同型半胱氨酸测定试剂盒(酶循环法)产品技术要求zhongshengbeikong
同型半胱氨酸测定试剂盒(酶循环法)产品技术要求ruizhengshanda
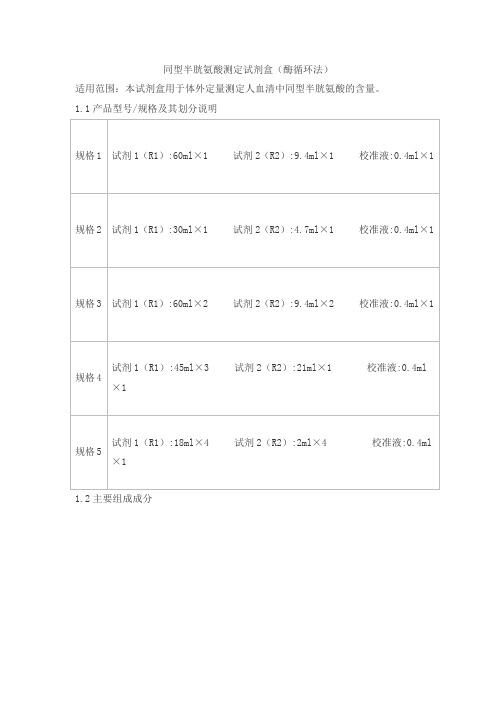
同型半胱氨酸测定试剂盒(酶循环法)适用范围:本试剂盒用于体外定量测定人血清中同型半胱氨酸的含量。
1.1产品型号/规格及其划分说明1.2主要组成成分2.1外观2.1.1 试剂1(R1)为无色或淡黄色液体,无混浊,无未溶解物;2.1.2 试剂2(R2)为无色或淡黄色液体,无混浊,无未溶解物;2.1.3 校准液应为无色澄清液体,无混浊,无未溶解物;2.1.4 试剂盒标签标识清晰,外包装完整无损。
2.2 净含量试剂1(R1)、试剂2(R2)和校准液的净含量不少于标示值。
2.3 试剂空白在主波长340nm、副波长405nm处(光径1cm),试剂空白吸光度A ≥1.0。
在主波长340nm、副波长405nm处(光径1cm),试剂空白吸光度变化率ΔA/min≤0.05。
2.4分析灵敏度测量1μmol/L的被测物时,吸光度变化率?A/min≥0.001。
2.5 线性范围在[3,45]μmol/L线性范围内,线性回归的相关系数r≥0.995。
在[3,10]μmol/L范围内,绝对偏差不超过±1μmol /L;在(10,45]μmol/L范围内,相对偏差不超过±10%。
2.6 精密度2.6.1 重复性重复测定(10±2)μmol/L的样品,变异系数CV≤5%;重复测定(20±4)μmol/L的样品,变异系数CV≤3%。
2.6.2 批间差相对极差≤10%。
2.7 准确度测定SRM1955,测定值与靶值的相对偏差不超过±15%。
2.8 稳定性原包装的HCY试剂盒在2℃~8℃避光保存,有效期为18个月。
试剂盒在规定的储存条件下保存至有效期满后,检测2.3、2.4、2.5、2.6.1、2.7项,结果应符合各项目的要求。
2.9 校准液溯源性按GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,试剂盒校准液溯源至NIST SRM1955。
同型半胱氨酸测定试剂盒(酶循环法)产品技术要求jiuqiang

同型半胱氨酸测定试剂盒(酶循环法)适用范围:用于体外定量测定人血清或血浆中的同型半胱氨酸含量。
1.1 包装规格1.2 主要组成成分主要组成成分见表2。
表2 主要组成成分注:不同批号的校准品、质控品赋值有差异。
2.1 外观试剂1、2、3均为无色澄清液体,目测不得有任何沉淀及絮状悬浮物;校准品为无色澄清液体,目测不得有任何沉淀及絮状悬浮物。
质控品为无色澄清液体,目测不得有任何沉淀及絮状悬浮物。
试剂盒标签标识清晰,外包装完整无损。
2.2 净含量试剂的净含量应不少于标称量。
2.3 试剂空白吸光度A340nm下测定空白吸光度应≥ 0.8000。
2.4 准确度用国际参考物质NIST SRM1955,对试剂盒进行测试,准确性偏差应不超过±15%。
2.5 分析灵敏度样本浓度为10.0 μmol/L时,其吸光度变化(ΔA)应≥ 0.0100。
2.6 线性区间线性区间在[1.5,50.0]μmoL/L,线性相关系数r应≥0.990,在[1.5,10.0]μmoL/L区间内测定的绝对偏差应不超过±1.0μmoL/L,在(10.0,50.0]μmoL/L范围内测定的相对偏差应不超过±10%。
2.7 测量精密度2.7.1重复性使用高、低不同浓度的血清样本或质控品重复测定10次,其测定值的变异系数(CV%)应不大于5%。
2.7.2批间差随机抽取三批试剂盒的批间相对极差(R)应不大于10%。
2.8 稳定性试剂盒在2℃~8℃密封避光保存,有效期为12个月。
取到效期后试剂盒进行检测,检测结果应符合2.1、2.3、2.4、2.5、2.6、2.7.1的要求。
2.9校准品溯源性按照GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,试剂盒校准品溯源至国际参考物质NIST SRM1955。
同型半胱氨酸测定试剂盒(循环酶法)产品技术要求深圳市希莱恒医用电子

1净含量同型半胱氨酸测定试剂盒(循环酶法)
性能指标
试剂盒内试剂净含量应不少于标示值。
2外观性状
2.1试剂盒各组分应齐全、完整,液体无渗漏;
2.2包装标签文字符号应清晰;
2.3试剂盒内各组份的外观性状:
(1)R1:无色或淡黄色澄清液体;
(2)R2:无色或淡黄色澄清液体。
3试剂空白
试剂初始吸光度 A 应不大于0.05。
4分析灵敏度
测试10.0umol/L 样本的吸光度变化率(ΔA/t)应不小于0.01。
5线性
线性范围:试剂盒线性范围为(3-50)umol/L。
a)线性相关系数∣r∣应≥0.995;
b)线性偏差不超过±10% 。
6精密度
6.1重复性
6.1.1重复测试(10.0±2.0 )umol/L 的样本,所得结果的变异系数(CV)应不大于5%。
6.1.2重复测试(20.0±4.0 )umol/L 的样本,所得结果的变异系数(CV)应不大于3%。
6.2批间差
测试(10.0±2.0 )umol/L 的样本,所得结果的批间相对极差(R)应不大于10%。
7准确度。
同型半胱氨酸检测试剂盒产品技术要求

同型半胱氨酸检测试剂盒产品技术要求同型半胱氨酸(Homocysteine, HCY)是一种重要的氨基酸,它在体内的代谢过程中,参与甲硫酸盐和硫酸葡萄糖胺的形成以及尿苯丙氨酸的代谢。
正常情况下,体内HCY的浓度较低,但如果HCY的产生量过高或清除速度减慢,就会导致HCY浓度升高,从而引发多种健康问题,如心血管疾病、新生儿缺陷、神经系统疾病等。
1.灵敏度:该检测试剂盒的灵敏度应足够高,能够准确测量HCY浓度的变化。
测量的线性范围应广泛,能够覆盖普通人群和高危人群的HCY浓度范围。
2.准确性:检测试剂盒应具有较高的准确性,能够在不同样本中精确测量HCY的浓度。
它应可靠地区分正常浓度和异常浓度,并提供准确的浓度结果。
3.精密度:检测试剂盒应具有较高的精密度,能够重复测量同一样本以获得一致的结果。
它应具有较低的内部和外部变异性,以确保可靠的实验重复性和结果比对性。
4.反应速度:检测试剂盒应能够在合理的时间内完成反应,并提供可靠的测量结果。
反应时间不宜过长,以节省实验时间。
5.操作简便性:检测试剂盒应具有操作简便的特点,使实验操作人员能够方便、快速地使用该试剂盒进行测量。
试剂盒应包含清晰明确的使用说明书,以便用户能够正确操作和解读结果。
6.安全性:检测试剂盒应符合安全性要求,不含有有害物质或重金属等对操作人员和环境有害的成分。
同时,应提供必要的标识和保护措施,以确保使用过程中的安全性。
7.长期稳定性:检测试剂盒应具有较长的稳定性,可以长期保存而不会失去活性。
试剂盒应提供有效期和储存条件等相关信息,以便用户能够合理储存和使用。
8.适用范围:检测试剂盒应适用于不同类型的样本,如血液、尿液等,以满足不同场景下HCY测量的需求。
总之,同型半胱氨酸检测试剂盒(酶法)的技术要求包括灵敏度、准确性、精密度、反应速度、操作简便性、安全性、长期稳定性和适用范围等方面,以确保该产品能够准确、可靠地测量HCY浓度,为相关疾病的诊断和治疗提供科学依据。
同型半胱氨酸测定试剂盒(循环酶法)产品技术要求senmeixikema

同型半胱氨酸测定试剂盒(循环酶法)适用范围:用于体外定量检测人血清中同型半胱氨酸的浓度。
1.1规格a) 试剂1:1×30ml,试剂2:1×4.7ml;b) 试剂1:2×30ml,试剂2:1×9ml;c) 试剂1:2×60ml,试剂2:2×9ml;d) 试剂1:1×60ml,试剂2:1×9ml;e) 试剂1:2×240ml,试剂2:2×36ml;f) 试剂1:2×20ml,试剂2:2×3ml;g) 试剂1:12×20ml,试剂2:12×3ml;h) 试剂1:2×30ml,试剂2:2×6ml;i) 试剂1:1×30ml,试剂2:1×6ml;j) 试剂1:2×30ml,试剂2:2×9ml;k) 试剂1:1×48ml,试剂2:1×13ml;l) 试剂1:1×40ml,试剂2:1×10ml。
1.2 组成试剂主要组分见表1:表1 试剂主要组分2.1 外观外包装完整无破损,标签清晰;试剂1应为无色至淡黄色溶液;试剂2应为淡黄色溶液。
2.2 净含量应不低于试剂瓶标示装量。
2.3 试剂空白2.3.1 试剂空白吸光度在340nm处测定试剂空白吸光度,应≥1.0;2.3.2 试剂空白吸光度变化率试剂空白吸光度变化率(△A/min)应≤0.05。
2.4 分析灵敏度测定浓度为40μmol/L的样品,吸光度变化率(△A/min)应不低于0.01。
2.5 线性2.5.1在(0,50]μmol/L范围内,线性回归的相关系数应不低于0.990;2.5.2测试浓度[20,50]μmol/L的样品,相对偏差应不超过±10%;测试浓度(0,20)μmol/L的样品,绝对偏差应不超过±2μmol/L。
同型半胱氨酸检测试剂盒(酶法)产品技术要求

医疗器械产品技术要求编号:同型半胱氨酸检测试剂盒(酶法)1.产品型号/规格及其划分说明序号规格1R1:2×50ml、R2:2×5ml、R3:2×9ml(2×250Tests)2R1:2×50ml、R2:1×10ml、R3:1×18ml3R1:1×50ml、R2:1×5ml、R3:1×9ml2.性能指标2.1外观试剂R1溶液应呈粉红色、无颗粒、无杂质;试剂R2溶液应呈黄色、无颗粒、无杂质;试剂R3溶液应呈淡黄色、无颗粒、无杂质。
2.2净含量试剂盒各试剂装量应不小于标示值。
2.3试剂空白吸光度应为≤0.20。
用蒸馏水作为样品加入试剂测试,试剂空白吸光度A660nm2.4分析灵敏度测试40μmol/L被测物时,吸光度差值(△A)应不小于0.02。
2.5线性范围在(0~40)μmol/L范围内,其线性相关系数r≥0.990;浓度≥6μmol/L时,相对偏差≤20%;浓度<6μmol/L时,绝对偏差≤1μmol/L。
2.6测量精密度2.6.1重复性用控制血清重复测试所得结果的重复性(变异系数,CV)应≤10.0%。
2.6.2批间差批间差应≤10.0%。
2.7准确度用参考物质进行测试,其相对偏差应≤20.0%。
3.检验方法仪器基本要求a)波长:660nm;温度:37℃±1℃。
b)全自动生化分析仪。
测试方法按说明书规定,因不同机型使用试剂最终浓度相同。
在此推荐以本公司BECKMAN或HITACHI全自动生化分析仪进行测试。
3.1外观和性状目测检查,试剂R1、R2、R3溶液性状应符合2.1的要求。
3.2净含量用通用量具进行测量,应符合2.2的要求。
3.3试剂空白吸光度用蒸馏水作为样品测试试剂(盒),在测试波长660nm下,记录测试启动时的吸光度(A1)和约5min(t)后的吸光度(A2),A2测试结果即为试剂空白吸光度测定值,应符合2.3的要求。
同型半胱氨酸(Hcy)测定试剂(盒)(酶循环法)产品技术要求新产业

医疗器械产品技术要求编号:
同型半胱氨酸(H cy)测定试剂(盒)(酶循环法)
2.性能指标
2.1外观
试剂应为清澈透明的液体,无沉淀、悬浮物和絮状物。
2.2净含量
试剂装量的装量应按表 2,液体装量的最大允许负偏差应为 5%。
表 2 净含量
2.3试剂空白吸光度
试剂(盒)以纯化水为空白在 37 ℃±1℃ 、340 nm 波长、1 cm 光径条件下,试剂空白吸光度应≥1.50。
2.4分析灵敏度
试剂(盒)测试 28 μmol/L的被测物时,吸光度变化(ΔA)应在-0.180~-0.120 的范围内。
2.5线性范围
试剂(盒)在(0~50) μmol/L范围内的分析性能应符合如下要求:
a)线性相关系数r≥0.990;
b)(0~10) μmol/L范围内,线性绝对偏差应在±1μmol/L以内;(10~50) μmol/L
范围内,线性相对偏差应在±10%以内。
2.6测量精密度
2.6.1重复性
用校准品重复测试所得结果的变异系数CV≤4%。
2.6.2批间差
试剂(盒)批间相对偏差R≤6%。
2.7准确度
校准品的相对偏差 B 在±10%以内。
2.8分析特异性
血红蛋白浓度在 150 mg/dL 内、抗坏血酸浓度在 30 mg/dL 内、胆红素浓度在 20 mg/dL 内,对试剂检测结果的偏差影响应在±10%以内。
同型半胱氨酸测定试剂盒(循环酶法)产品技术要求灵泽

肠内营养泵适用范围:可连续或间断向患者胃肠道输送肠内营养液,适用于需要肠内营养治疗的患者。
1.1 产品型号/规格:Link-20081.2划分说明:1.3 产品组成主机、电源适配器和1个加温器。
2.1正常工作条件:a) 环境温度范围:+10℃~+30℃b) 相对湿度范围:30%~75%c) 大气压范围:700hpa~1060hpad) 使用电源范围:网电源:输入:100V-240V 50-60Hz 内部电源: 4节可充电锂电池,DC8.4V2.2显示屏智能图标提示功能:显示屏具有以下智能图标提示功能2.2.1启动定时功能时,显示铃铛图标;2.2.2加温器与营养泵连接后,显示温度设置的数值;2.2.3当供电方式为网电源时,显示电线接头图标;当以蓄电池供电时,显示电池电量图标。
2.2.4营养泵正常运转输液时,显示水滴图标。
2.2.5营养泵正常运转输液时,显示报警音量图标。
2.3磁性识别系统启动功能只有与佰通系列一次性肠内营养供应管路(袋式泵管、针式泵管)配套使用时方能启动。
2.4 输液速度设定和显示功能输液速度设定范围: 0~399ml/h(步进1ml/h),误差应不超过±10%,输液速度能够显示。
2.5 输液量设定和显示功能输液量设定范围:0~2999ml(步进1ml),误差应不超过±10%,并可显示。
2.6 输液量累计显示功能输液累计总量为1~9999ml(显示最小单位1ml),输液量累积量误差应不超过±10%。
2.7加温器温度设置和显示功能加温器温度设置范围:35℃~40℃(步进1℃),误差为±3℃,设定温度可显示。
2.8时钟功能内置24小时时间设置,可设置和显示具体时间。
2.9 报警音量设置和显示功能报警音量设置范围:包括低、中、高三档,设定音量可显示。
2.10定时提醒功能定时设置范围:0.5 h~23.5 h(最小调节量0.5h),误差(±3%),当达到设定时长时,发出“滴”的一声,同时当前界面出现铃铛图标闪动,持续15s后消失。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
同型半胱氨酸测定试剂盒(酶循环法)
适用范围:本产品用于体外定量测定人血浆或血清中同型半胱氨酸的浓度。
1.1规格
液体双剂型
试剂1(R1):60mL×2,试剂2(R2):19mL×2,校准品(5个浓度):1mL ×5;
试剂1(R1):60mL×1,试剂2(R2):19mL×1,校准品(5个浓度):1mL ×5;
试剂1(R1):20mL×2,试剂2(R2):13mL×1,校准品(5个浓度):1mL ×5。
1.2规格划分说明
根据净含量划分规格。
1.3主要组成成分
试剂盒由试剂1(R1)液体、试剂2(R2)液体和校准品液体组成。
1.3.1 试剂1(R1)液体:
脱氢酶 10KU/L
NADH 0.4mmol/L
稳定剂
1.3.2 试剂2(R2)液体:
共价结合底物 0.1mmol/L
循环酶 3KU/L
稳定剂
1.3.3 校准品:人血清基质
同型半胱氨酸
校准品定值范围:0μmol/L~60μmol/L,5个浓度呈梯度增加(每批定值) 2.1 外观
试剂盒中各组件的外观应满足:
a) 试剂1(R1)应为浅黄色透明溶液,无混浊,无未溶解物,外包装完整无破损;
b)试剂2(R2)应为无色或浅黄色透明溶液,无混浊,无未溶解物,外包装完整无破损;
c)校准品应为浅黄色透明溶液,无混浊,无未溶解物,外包装完整无破损。
2.2 净含量
液体试剂净含量应不少于标示值。
2.3 试剂空白吸光度
在波长340nm(光径1cm)处,试剂空白吸光度(A)应≥0.800;试剂空白吸光度变化率(△A/min)≤0.015。
2.4 准确度
测定SRM1955,相对偏差应不超过±15%。
2.5 分析灵敏度
测试10µmol/L的Hcy时,吸光度变化率(△A/min)的绝对值应≥0.01。
2.6 重复性
重复测试高浓度样本,变异系数(CV)应≤3%。
重复测试低浓度样本,变异系数(CV)应≤5%。
2.7 批间差
测定同一样本,批间差(R)应≤8%。
2.8 线性范围
在[3,50]μmol/L范围内,线性相关系数(r)应≥0.995,线性相对偏差应不超过±10%。
2.9 试剂稳定性
原包装的试剂盒在2℃~8℃避光贮存,有效期为12个月。
试剂有效期满后3个月以内,试剂性能应符合2.1、2.3、2.4、2.5、2.6、2.8的要求。
2.10 校准品稳定性
原包装校准品在2℃~8℃避光贮存,有效期为12个月。
校准品有效期满后3个月内,用该校准品校准合格的试剂盒,准确度应符合2.4的要求。
2.11 校准品溯源性
校准品溯源性应符合GB/T 21415-2008的要求,并提供相关溯源过程、测定值不确定度等内容。
