可逆过程与可逆过程体积功
合集下载
14-可逆过程与可逆功解析

上一内容
下一内容 返回
回主目录
功与过程
上一内容
下一内容
回主目录
返回
功与过程
2.多次等外压压缩 第一步:用 p" 的压力将体系从 V2 压缩到V " ; 第二步:用 p' 的压力将体系从V " 压缩到V ' ; 第三步:用 p1 的压力将体系从 V ' 压缩到 V1 。
W p (V V2 )
pV K1
TV 1 K2
p1 T K3
式中, K1, K2 , K 3 均为常数, C p / CV 。
上一内容
下一内容
回主目录
返回
可逆体积功的计算
三、可逆体积功的计算 1、理想气体恒温可逆过程
V2 P W nRT ln nRT ln 1 V1 P2
We,3 p '(V 'V1 ) p "(V " V ') p2 (V2 V ")
所作的功等于3次作功的加和。
可见,外压差距越小,膨胀 次数越多,做的功也越多。
上一内容
下一内容
2006.1.1 回主目录
返回
2006.1.1
功与过程
上一内容
下一内容
2006.1.1 回主目录
2、理想气体绝热可逆过程
W U nCV ,m (T2 T1 )
上一内容
下一内容
回主目录
返回
绝热过程
绝热过程的功
在绝热过程中,体系与环境间无热的交换,但可 以有功的交换。根据热力学第一定律:
dU Q W
=W
(因为Q 0)
这时,若系统对外作功,热力学能下降,体系温
下一内容 返回
回主目录
功与过程
上一内容
下一内容
回主目录
返回
功与过程
2.多次等外压压缩 第一步:用 p" 的压力将体系从 V2 压缩到V " ; 第二步:用 p' 的压力将体系从V " 压缩到V ' ; 第三步:用 p1 的压力将体系从 V ' 压缩到 V1 。
W p (V V2 )
pV K1
TV 1 K2
p1 T K3
式中, K1, K2 , K 3 均为常数, C p / CV 。
上一内容
下一内容
回主目录
返回
可逆体积功的计算
三、可逆体积功的计算 1、理想气体恒温可逆过程
V2 P W nRT ln nRT ln 1 V1 P2
We,3 p '(V 'V1 ) p "(V " V ') p2 (V2 V ")
所作的功等于3次作功的加和。
可见,外压差距越小,膨胀 次数越多,做的功也越多。
上一内容
下一内容
2006.1.1 回主目录
返回
2006.1.1
功与过程
上一内容
下一内容
2006.1.1 回主目录
2、理想气体绝热可逆过程
W U nCV ,m (T2 T1 )
上一内容
下一内容
回主目录
返回
绝热过程
绝热过程的功
在绝热过程中,体系与环境间无热的交换,但可 以有功的交换。根据热力学第一定律:
dU Q W
=W
(因为Q 0)
这时,若系统对外作功,热力学能下降,体系温
2-9可逆过程与可逆体积功

2013-7-14
3
例1, 3mol理想气体于恒温298.15K条件下由始态 V1 = 20.0dm3 可逆膨胀到末态V2 = 50.0dm3 . 求始, 末态气体的压力p1 , p2 以及 膨胀过程的可逆功Wr .
n = 3 mol p1 = V1 = 20dm3 T1 = 298.15K 恒温可逆 n = 3 mol p2 = V2 = 50dm3 T2 = 298.15K
2. 可逆体积功(reversible volume work )
W
V2
V1
pd V
pamb p
(1). 理想气体恒温可逆过程
WT ,r pdV nRT dV V1 V1 V
V2 V2
WT ,r
V1 p2 nRTln nRTln V2 p1
nRT V p
2013-7-14
p2 Wr nRT ln p1
4
{ 3 8.314 298.15 ln(20.0 / 50.0 )}J 6814J
(2). 理想气体绝热可逆过程
Wa,r pdV
V2 V1
绝热与恒温的区别?
2013-7-14
5
①. 理想气体绝热可逆过程方程式
T2 T1 V1 V 2
②. 理想气体绝热可逆体积功 不论可逆与否, 绝热过程的功总可以用 W = U 来进行计算 , 这种方法更加简便.
Wa,r U nCV ,m (T2 T2 )
2013-7-14
7
例36 1 mol氧气由0℃, 106Pa,经过(1)绝热可逆膨胀;(2) 对抗恒定外压Psu= 105Pa绝热不可逆膨胀,使气体最后压力为 105Pa,求此两种情况的最后温度及系统对环境所作的功。 解(1)绝热可逆膨胀 绝热可逆膨胀 1molO2 p1 = 106Pa T1 = 273.15K
2.10可逆过程与可逆体积功

气体可逆膨胀压缩过程
以理想气体恒温膨胀压缩过程为例, 以理想气体恒温膨胀压缩过程为例,将盛 有一定量某理想气体的带活塞的气缸与恒温热 源接触, 源接触,以使平衡时系统的温度与热源的温度 相等。 相等。 系统始态为a压力为 末态为z压力为 压力为p 系统始态为 压力为pa;末态为 压力为 z, 压力为 pz=1/5pa 。
理想气体绝热可逆功
Wa,r = ∆U = ∫T nCV ,mdT = nCV ,m (T2 − T1 )
T2
1
T2根据绝热可逆过程方程式求得。 根据绝热可逆过程方程式求得。 或
Wa,r = ∫ − pamb dV = ∫ − pdV = ∫
V1 V1
V2
V2
V2
V1
p1V1γ − γ dV V
p1V1γ 1 1 = γ −1 − γ −1 V1 γ − 1 V2
3)绝热恒外压膨胀 : ∆U = W 绝热恒外压膨胀 绝热 nCV,m (T2 −T1) = -p2(V2 −V1) = -p2V2+p2V1
3 p2 n R(T2 −T ) = nRT1 − nRT2 1 2 p1 3 p2 T2 = 174.8K (T2 −T ) = T −T2 1 1 2 p1 ∆U= nCV,m(T2 −T1) = −5.40×103J
p1V1γ − γ dV V
• P95,39 解:设计变化途径如下: 设计变化途径如下:
n = 5mol T2 = 300K p2 = 50kPa V2
n = 5mol T1 = 300K p1 = 200kPa V1
Байду номын сангаас恒温 可逆
绝热 可逆
n = 5mol T3 p3 = 200kPa V3
§1.0-§1.3 热力学基本概念-热与功

兼有气体及液体双重特性; 超临界流体特性 体积质量接近液体; 粘度接近气体; 扩散系数比液体大约10倍。
表1.2 一些物质的临界参量
物 He H2 N2 O2 H2O CH4 C2 H 4 C6H6 C2H5 OH 质 Tc/K 5.26 33.3 126.2 154.4 647.4 190.7 283.1 562.6 516.3 pc/MPa 0.229 1.30 3.39 5.04 22.12 4.64 5.12 4.92 6.38 Vm,c/10-6m3·mol-1 58 65 90 74 56 99 124 260 167
相变化过程与饱和蒸气压 相变化过程:一定条件下聚集态的变化过程。
气体 (T,p) 汽化 液体 液化 凝固 熔化 (T,p) 固体(α) (T,p) 升华 凝华 晶型转化 (T,p) 固体(β)
饱和蒸气压:
在一定温度下,当液(或 固)体与其蒸汽达成液(或 固)汽两相平衡时,汽相的压 力称为该液(或固)体在该温 度下的饱和蒸气压。
焦耳实验
或: 整个系统(双球) dV=0
气体 真空 图1-1气体向真空膨胀 (自由膨胀)
(3) 对抗恒定外压过程
p1,V1 Psu p2,V2 Psu
T1
T1
膨胀过程的功:
W = − ∫V psu dV
V2
1
= −psu(V2 −V) 1
压缩过程的功:
p2,V2 Psu
T1p1,V1Psu NhomakorabeaT1
W = − ∫V psu dV
第一节 热力学基本概念
0.系统和环境
系统: 热力学研究的对象(微粒组成的宏观集合体)。 环境: 与系统通过物理界面(或假想的界面)相 隔开并与系统密切相关的周围部分。
表1.2 一些物质的临界参量
物 He H2 N2 O2 H2O CH4 C2 H 4 C6H6 C2H5 OH 质 Tc/K 5.26 33.3 126.2 154.4 647.4 190.7 283.1 562.6 516.3 pc/MPa 0.229 1.30 3.39 5.04 22.12 4.64 5.12 4.92 6.38 Vm,c/10-6m3·mol-1 58 65 90 74 56 99 124 260 167
相变化过程与饱和蒸气压 相变化过程:一定条件下聚集态的变化过程。
气体 (T,p) 汽化 液体 液化 凝固 熔化 (T,p) 固体(α) (T,p) 升华 凝华 晶型转化 (T,p) 固体(β)
饱和蒸气压:
在一定温度下,当液(或 固)体与其蒸汽达成液(或 固)汽两相平衡时,汽相的压 力称为该液(或固)体在该温 度下的饱和蒸气压。
焦耳实验
或: 整个系统(双球) dV=0
气体 真空 图1-1气体向真空膨胀 (自由膨胀)
(3) 对抗恒定外压过程
p1,V1 Psu p2,V2 Psu
T1
T1
膨胀过程的功:
W = − ∫V psu dV
V2
1
= −psu(V2 −V) 1
压缩过程的功:
p2,V2 Psu
T1p1,V1Psu NhomakorabeaT1
W = − ∫V psu dV
第一节 热力学基本概念
0.系统和环境
系统: 热力学研究的对象(微粒组成的宏观集合体)。 环境: 与系统通过物理界面(或假想的界面)相 隔开并与系统密切相关的周围部分。
第一章 热力学第一定律

1.2热力学基本概念
热和功
Closed system (t1)
Surroundings (t2)
热(heat):封闭体系与环境 之间因温差而传递的能量 > 0 吸热 规定:Q < 0 放热 功(work):封闭体系与环境之 间除热以外传递的其他一切能量 > 0 环境对体系做功 规定:W < 0 体系对环境做功
1、研究物质的宏观性质(
macroscopic properties )。
2、只需知道系统的起始状态和最终状态以及过程进
行的外界条件无需知道过程机理及物质结构。 3、研究的变量没有时间概念,不涉及速率问题。
局限性
不涉及微观结构(Microscopic)和反应 机制( Mechanism)。
Company Logo
摩尔气体常数:
8.314 J / K ·mol
对于多组分均相系统的状态函数还与其组 成成分有关,即 V = f (p,T,n1, n2 ,n3……)
Company Logo
注意:热力学定律并不能导出 具体系统的状态方程,它必须 由实验来确定。
Company Logo
1
50
100
1.2热力学基本概念 state B path 2
path 1 state A
始态至终态的一切变化——过程(process) 具体步骤 —— 途径(path)
Company Logo
1.2热力学基本概念
常见的变化过程有:
1.2热力学基本概念
状态函数具有下述特性:
1) 状态函数是状态的单值函数。 2)状态函数的改变量只取决于系统的始态和终态, 与变化的途径无关。 3)状态函数的微小变化,在数学上是全微分
2-10可逆过程和可逆体积功

•多次等外压膨胀
(3).外压比内压小一个无穷小的值
外压相当于一堆沙子,每次取一粒,这样的膨胀过程是 无限缓慢的,每一步都接近于平衡态。所作的功:
P终 p始
一粒粒取走砂粒 (剩余砂粒相当前述一 个重物)
(iii)
即 TV 1 常 : 数
结 pg状 方 有 合 态 程
:
pV 常 数
1
Tp
常 数
pV c
b、理想气体绝热可逆体积功
由 热 逆 程 绝 可 方 :
V2 V1
pV p1V1
W的定义式
Wr pdV p1V1
V2
V1
V dV
V2
V2
V2
(2)理想气体绝热可逆体积功
a、 理想气体绝热可逆过程方程式
d U δWr δ Qr 0 nRT 理想气体 nCV,m d T p d V dV V
对 热 逆 程 绝 可 过 ,
CV,m dT dV R T V
pg :C p,m CV, m R γ C p,m CV, m
W p (V V 1)
' '
p终 p始 p1 P1
p'' (V '' V ' )
p2 (V2 V '' )
(ii)
P始,V始 T
V1
1 P 1,V 1 T
p2 V2
2
P2
p终V3
3 P终,V终
P2,V2 T
可逆过程与可逆过程体积功
T2
= U
n CV ,mdT
T1
T2
= H
n C p,mdT
T1
7
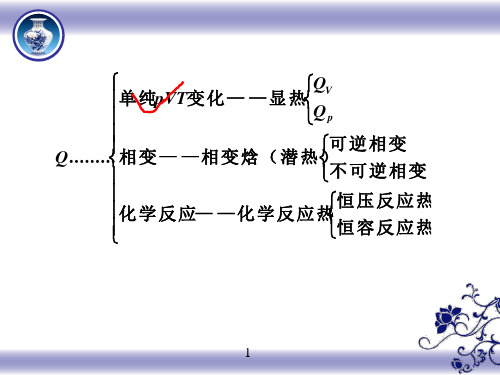
单
纯pVT变
化
—
—
显
热QQVp
Q......... 相
变
—
—
相
变
焓
(
潜
热
)可不
逆 可
相变 逆相
变
化
学
反
应—
—
化
学
反
应
热恒恒
压 容
反 反
应 应
热 热
8
§ 2.5 相变过程热的计算
1. 相及相变
(1)相的定义: 系统内性质完全相同且均匀的部分称为相。 (2)相变:物质从一相转移至另外一相,称为相变。 (3)常见相变:
ln
p2 p1
4. 理想气体绝热可逆过程
T2 T1
V2 V1
1
1 1
T2 T1
p2 p1
4 p1V1 p2V2
5. 绝热可逆过程体积功的计算
方法一:
Wr
pdV
V2 nRT dV V1 V
V2 p0V0
V V1
dV
p0V0
1 V2 V V1
dV p0V0
1
(V21 V11 )
Q Qp H 40.63kJ
28
(2) 100℃下向真空蒸发
H2O(l) T1 373.15K p1
p外0 H
H2O(g) T2 373.15K p2 101.325k Pa
H1
H2O(l) T 373.15K
H 2
p 101.325k Pa
第1章可逆过程

0kJ 18.24kJ 18.24kJ
Q U W
0 18.24kJ 18.24kJ
,
11
解法二:
因为
PV 1 1 nRT 1
3 3
202.65 pa 10 10 m PV 1 1 243.745K 所以 T1 1 1 nR 1mol 8.314 J K mol 3 3 2026.5 p 10 10 m PV a 同理 T2 2 2 2437.45K 1 1 nR 1mol 8.314 J K mol
V2
1
V2
V1
QP H n C P,m dT nCP,m T2 T1
T2
U n CV ,m dT nCV ,m T2 T1
T2 T1
T1
9
例2-2 1mol的理想气体H2(g)由202.65kPa、10dm3等容升温, 压力增大到2026.5kPa,再等压压缩至体积为1dm3。 求整个过程的 Q、W、U和H
1
V2
QV U n CV ,m dT nCV ,m T2 T1
T2 T1
H n C P,m dT nCP,m T2 T1
T2 T1
3.等压过程
W pe dV pdV p V2 V1 nRT2 T1 V
一、热力学可逆过程的特点
1.可逆过程进行时,系统状态变化的动力与阻力相差无限小, 所以在恒温条件下,系统可逆膨胀时对环境所作的功最大, 系统可逆压缩时从环境得到的功最小。 2.可逆过程进行时,系统与环境始终无限接近于平衡态;或 者说,可逆过程是由一系列连续的、渐变的平衡态所构成。 因此,可逆即意味着平衡。 3.若变化循原过程的逆向进行,系统和环境可同时恢复到原 态。同时复原后,系统与环境之间没有热和功的交换。 4.可逆过程变化无限缓慢,完成任一有限量变化所需时间无 限长。
Q U W
0 18.24kJ 18.24kJ
,
11
解法二:
因为
PV 1 1 nRT 1
3 3
202.65 pa 10 10 m PV 1 1 243.745K 所以 T1 1 1 nR 1mol 8.314 J K mol 3 3 2026.5 p 10 10 m PV a 同理 T2 2 2 2437.45K 1 1 nR 1mol 8.314 J K mol
V2
1
V2
V1
QP H n C P,m dT nCP,m T2 T1
T2
U n CV ,m dT nCV ,m T2 T1
T2 T1
T1
9
例2-2 1mol的理想气体H2(g)由202.65kPa、10dm3等容升温, 压力增大到2026.5kPa,再等压压缩至体积为1dm3。 求整个过程的 Q、W、U和H
1
V2
QV U n CV ,m dT nCV ,m T2 T1
T2 T1
H n C P,m dT nCP,m T2 T1
T2 T1
3.等压过程
W pe dV pdV p V2 V1 nRT2 T1 V
一、热力学可逆过程的特点
1.可逆过程进行时,系统状态变化的动力与阻力相差无限小, 所以在恒温条件下,系统可逆膨胀时对环境所作的功最大, 系统可逆压缩时从环境得到的功最小。 2.可逆过程进行时,系统与环境始终无限接近于平衡态;或 者说,可逆过程是由一系列连续的、渐变的平衡态所构成。 因此,可逆即意味着平衡。 3.若变化循原过程的逆向进行,系统和环境可同时恢复到原 态。同时复原后,系统与环境之间没有热和功的交换。 4.可逆过程变化无限缓慢,完成任一有限量变化所需时间无 限长。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
25
H 2O(g),2mol T1 283.15K p1 85kPa
H 1
H
H 2O(l),2mol T1 283.15K p1 85kPa
H 3
H 2O(g),2mol T2 373.15K p2 101.325kPa
T2
H2 T2 373.15K
QV n CV ,m dT
T1 T2
CV ,m
1 QV U m n dT T V
封闭系统,dV=0,W ’=0,单纯pVT变化 *对理想气体:W ’=0,单纯pVT变化 恒容过程 *对液体和固体: =
U n CV , m d T
T1
T2
非恒容过程
1. 相及相变
(1)相的定义: 系统内性质完全相同且均匀的部分称为相。 (2)相变:物质从一相转移至另外一相,称为相变。
(3)常见相变:
气相 晶型 转变 (trs)
固相
固相
熔化(fus) 凝固
9
液相
2. 相变分类
(1)可逆相变:在指定温度及该温度对应的平衡压力下所发 生的相变,叫可逆相变。 例:
H 2 O( l ) 100C 101.325kPa H 2 O( l ) 25C 3.167kPa
W =0
ΔU
ΔH
=0 =0 =0 =0 =0 =0
6
=0
=0
=0
=0
=0
H 2 O( l ) T1 298.15K
p1 3.167kPa
相变 过程
H 2 O( g ) T2 373.15K p2 101.325kPa
T2
U
T2
=
nC
V ,m
dT
H
T1
=
nC
p ,m
vap H m(T2 ) vap H m(T1 ) C p ,m(g) C p ,m(l)dT T1
T2
16
通式:
T2 T1
H m(T2 ) H m(T1 ) C p,mdT
由T1的相变焓计算T2的相变焓
C p ,m C p ,m() C p ,m()
n vap H m ( 25 C )
H
H 2O(g) T1 298.15K p1 3.167kPa
H 3
H 1 nT C p,m ( l )dT
T1
T2
nC p,m ( g )dT
H 2O(l) T2 373.15K p2 101.325kPa
nvap H m ( 100C )
H2
n H2O ( s ) T2=273.15K
Q = Qp= H = -291.43kJ H = U+ (pV) U H = -291.43kJ W= - p外V 0
24
(pV) = pV 0
例9 求2mol水蒸气于10℃、85kPa下凝结为液体水过 程的Q、W、 H 及U 。已知100℃、101.325kPa下 水的vapHm=40.63kJ· -1 mol
H 2 O( g ) 100C 101.325kPa H 2 O( g ) 25C 3.167kPa
可逆相变条件:
dp=0, dT=0 , p =f(T)
可逆相变的判断:
熔点、沸点、凝固点 液体在某温度下的饱和蒸气压 固体在某温度下的饱和蒸气压
10
(2)不可逆相变:指定温度,非平衡压力下所发生的相变叫 不可逆相变。 或者相变前后温度、压力改变。 例:
11
3. 相变焓(可逆相变焓)
(1)定义: 1mol纯物质发生可逆相变时与环境交换的热叫摩尔相变热, 也称为摩尔相变焓.
B
B
H m
根据可逆相变条件: dp=0,dT=0
Q Q p H n H m
12
(2)相变的标记法及摩尔相变焓之间的相互关系:
1
T2 p2 p T1 1
1
1
4
p1V1 p2V2
5. 绝热可逆过程体积功的计算
方法一:
V2 p V nRT dV 0 0 dV W r pd V V1 V V1 V V2 1 p0V0 p0V0 dV ( V21 V11 ) V1 V 1
忽略压力对相变焓的影响
17
例7:已知下列热力学数据:
100℃水的摩尔蒸发焓为40.63kJ· -1 , mol
C p ,m (H 2O, l) 5.59J mol 1K 1
C p ,m (H 2O, g) 33.795J mol 1 K 1
试求:水在25℃的摩尔蒸发焓。
H 3 nC p,m ( g )dT 2535.0J
T2
T1
H H 1 H 2 H 3 43.73 103 J
1 vap H m ( 25C ) H 43.76 103 J mol 1 n
20
5. 不可逆相变过程热的求解——设计过程
H 2 O( s ) H 2O(l() ) H 2O l 5 C 25CC 5 101.325kPa 101.325kPa 101.325kPa
H 22O(s))O(g ) H OH 2 (g 255110C C C 101..101kPa kPa 101325kPa 325.325
n H2O (s) T1 =253.15K H3
H2
n H2O ( s ) T2=273.15K
m n 55.56mol M
H1 nC p,m ( l )dT 83.687kJ
T1
T2
H 2 ns H m (0C ) n( ls H m ) 333.327kJ l
n H2O ( l ) T1 =253.15K H n H2O (s) T1 =253.15K
21
解:p=101.325kPa
n H2 O ( l ) T1 =253.15K
T2
1
H
n H2O (s) T1 =253.15K H3 nC p,m ( s )dT T
T1
2
H1 T nC p,m( l )dT n H2 O ( l ) T2 = 273.15 K H2
H 2O(l) T1 298.15K p1 3.167kPa
n vap H m ( 25 C )
H
H 2O(g) T1 298.15K p1 3.167kPa
18
试求:25℃ 水的摩尔蒸发焓。
H 2O(l) T1 298.15K p1 3.167kPa
T2
1
H 2O(l),2mol
p2 101.325kPa
H1 nC p,m ( g )dT .... J
T1
ΔU ΔH Δ pV ΔH pV g
H 2 n H m n( vap H m ) ... J
例:B物质,在T1,p1时有vapHm(T1)
在T2,p2时有vapHm(T2)
vapHm(T1) ~ vapHm(T2)的关系?
14
设计过程:
B(l), 1mol T2 , p2
Hm(l)
vapHm(T2)
B(g), 1mol T2 , p2
Hm(g)
B(l), 1mol T1 , p1
n H2O ( s ) T2 = 273.15 K ns H m ( 0C ) n( ls H m ) l
H H1 H 2 H 3
22
p=101.325kPa
n H2 O ( l ) T1 =253.15K
H1 n H2O ( l ) T2=273.15K
H
V2
方法二:
由绝热可逆过程方程求出终态温度T2,再求体积功.
ΔU n CV ,mdT n CV ,m (T2 T1 )
T1
T2
U Q W
Wr ΔU
Q0
5
常见pg单纯pVT变化过程: Q
恒容过程(dV= 0) 恒压过程(dp= 0) 恒温可逆过程 (dT= 0,可逆) 恒温不可逆过程 (dT= 0) 绝热可逆过程 ( Qr = 0) 绝热不可逆过程 ( Q = 0) 自由膨胀过程 (p环=0) 恒温自由膨胀过程 (p环=0)
平衡相变+pVT 变化 例8: 求压力 101.325 kPa 下,1 kg - 20 ℃的过冷水 凝固为同温同压的冰的过程的Q、W、ΔU、ΔH。
已知水的正常凝固点为 0 ℃ , 在此条件下冰的熔化焓为 5999.4 J · -1 , mol 过冷水的定压摩尔热容为 75.312 J · -1 · -1 mol K 冰的定压摩尔热容为 37.604 J · -1 · -1 。 mol K
Bs
Bl
ls H m fus H m s H m l
Bs
B g
gs H m sub H m sg H m
Bl
B g
gl H m vap H m lg H m
13
4. 相变焓与温度的关系
相变 H m f (T )
H 3 nC p,m ( s )dT 41.786kJ
T2 T1
H 291.43kJ
23
p=101.325kPa Q、W、ΔU、ΔH
n H2O ( l ) T1 =253.15K H1 n H2O ( l ) T2=273.15K
H
n H2O (s) T1 =253.15K H3
vapHm(T1)
B(g), 1mol T1 , p1
