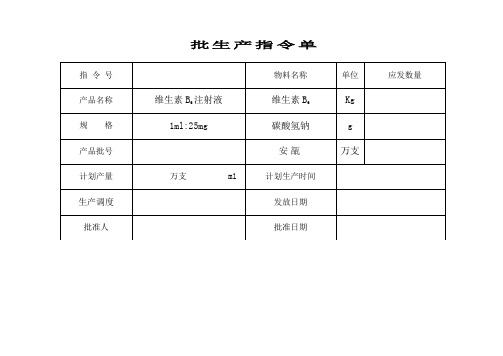
保健食品液体制剂生产记录
维生素B6注射液批生产记录20130122
2.记录操作区温度:18-26℃湿度:45%-65%压差≥10Pa
温Байду номын сангаас:℃湿度: %压差:Pa
3.配剂室无与本批生产无关的物料,设备清洁合格。
□符合要求□不符合要求
4.配剂所用容器具已清洁并在有效期内。
□符合要求□不符合要求
5.检查配剂用本批记录文件齐全。
□齐全□不齐全
6.本批生产的房间状态标志牌已换挂。
□已挂标识牌□未挂标识牌
2.滤前气泡点试验
按气泡点试验方法对0.45µm、0.22µm的滤芯做气泡点试验,要求如下:0.45µm压力:≥0.20Mpa
0.22µm压力:≥0.25Mpa并附打印记录
0.45µm:压力:Mpa
0.22µm:压力:Mpa
3.药液管道的配剂前清洗
配剂罐、药液管道及过滤系统的配剂前清洁按SOP-CLP 309进行操作。清洗时间为30分钟以上。
□ 已清洗清洗时间:-
□ 未清洗
4.配剂操作
1.配剂罐内加配剂量约90%的注射用水,水温室温(10~30℃)
加注射用水ml水温:℃
岗位:
QA:
2.将维生素B6投入注射用水中,搅拌3+1分钟。
□按要求操作□未按要求操作
3.补加注射用水至全量。
注射用水加至ml
4.用5%碳酸氢钠溶液40ml-45ml缓慢加入上述溶液中,搅拌循环5分钟后测PH值在2.8—3.3。
3.灌封室设备清洁合格。
□符合要求□不符合要求
4灌封所用器具已清洁并在有效期内。
□符合要求□不符合要求
5.灌注系统及管道已清洗/灭菌并在有效期内。
□符合要求□不符合要求
6.检查灌封用本批记录文件齐全。
小儿咳喘灵口服溶液批生产记录
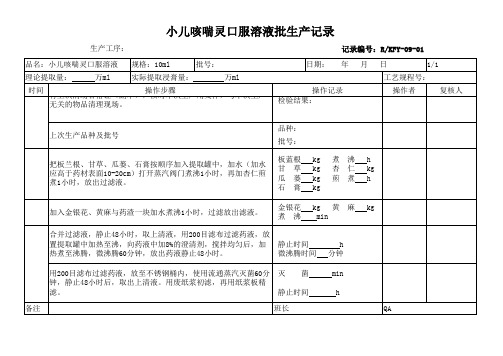
生产工序: 品名:小儿咳喘灵口服溶液 理论提取量: 时间 万ml 规格:10ml 实际提取浸膏量: 批号: 万ml 操作记录 检验结果: 日期: 记录编号:R/KFY-09-01 年 月 日 操作者 1/1 复核人
工艺规程号:
操作步骤 有上次清场合格证(副本),核对本次生产用文件,与本次生产 无关的物品清理现场。 上次生产品种及批号
品种: 批号: 板蓝根 甘 草 瓜 蒌 石 膏 金银花 煮 沸 kg kg kg kg 煮 杏 煎 沸 仁 煮 h kg h
把板兰根、甘草、瓜蒌、石膏按顺序加入提取罐中,加水(加水 应高于药材表面10-20cm)打开蒸汽阀门煮沸1小时,再加杏仁煎 煮1小时,放出过滤液。
加入金银花、黄麻与药渣一块加水煮沸1小时,过滤放出滤液。 合并过滤液,静止48小时,取上清液,用200目滤布过滤药液,放 置提取罐中加热至沸,向药液中加8%的澄清剂,搅拌均匀后,加 热煮至沸腾,微沸腾60分钟,放出药液静止48小时。 用200目滤布过滤药液,放至不锈钢桶内,使用流通蒸汽灭菌60分 钟,静止48小时后,取出上清液。用废纸浆初滤,再用纸浆板精 滤。 备注
kg 黄 min麻kg静止时间 微沸腾时间 灭 菌
h 分钟 min h QA
静止时间 班长
口服液包装生产记录模板

结果记录
操作人
复核人
QA现场监控员
开工前
的检查
1、应有有效的《清场合格证》
2、设备应完好
1、清场合格证: 符合规定( ) 符合规定()
2、捆扎机(编号:060201)符合规定( ) 符合规定()
允许生产□
签名:
领 料
据包装指令从库房领取各种外包装材料
并复核其批号、数量
物料编码
名称
物料批号
成品收率= a(盒)/理论产量×100%
成品收率范围:93%~98%
成品数(a)(件小盒)共计(小盒)
抽样数(小盒)
成品收率=(%)
a+本批残损数+b+d
物料平衡率=×100%
领料数(c)
物料平衡率应为100%
报废的印刷性包装材料应按《印刷性包装材料管理程序》1202·016进行处理
名称
本批使用数
(a)
**口服液包装生产记录
品名:**口服液
规格:10ml/支×60支/中盒×10中盒/件
设计依据:《**口服液工艺规程》1108·004
批号:
计划批量:60000支
生产时间:年月日:—年月日:
填写说明:①:“”由QA现场监控员填写,其他由操作工填写;②: 符合规定在()内打“√”,不符合规定打“×”。
工艺过程
报告书号
领料数(c)
B-010
标签
张
张
B-011
说明书
张
张
B-012
小盒
个
个
B-013
中盒
个
个
B-016
纸箱
个
个
包装
小容量注射剂生产记录
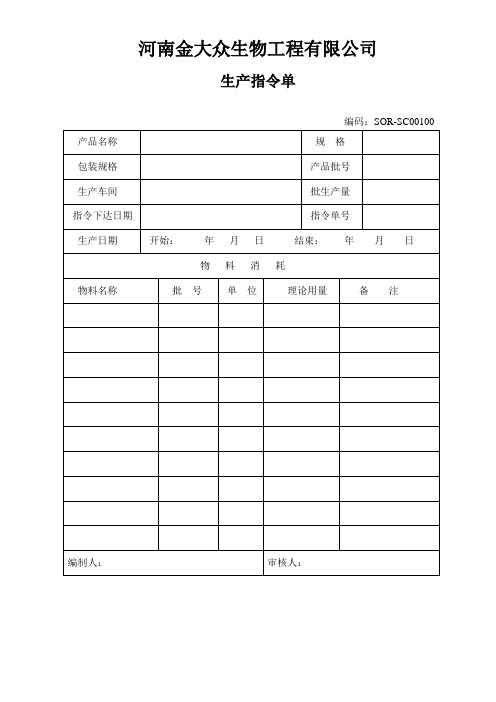
河南金大众生物工程有限公司生产指令单编码:SOR-SC00100原辅料领料单编码:SOR-SC00200包装指令单编号:SOR-SC01100包材领料单领料部门:年月日编码:SOR-SC01200河南金大众生物工程有限公司理瓶工序生产记录编号: SOR-SC03000操作人:复核人:河南金大众生物工程有限公司最终灭菌小容量注射剂洗瓶工序生产记录编号: SOR-SC03200操作人:复核人:瓶干燥灭菌工序生产记录编号: SOR-SC03300操作人:复核人:质监员:称量配料记录生产日期:年月日编号: SOR-SC00900组长:现场QA:河南金大众生物工程有限公司配液工序过滤器完整性测试记录编码:SOR-SC03400 年月日生产前检测□操作结束检测□出现可疑情况检测□操作人:复核人:河南金大众生物工程有限公司注射剂配液岗位生产记录编号: SOR-SC03500操作人:复核人: 质监员:配液工序过滤器完整性测试记录编码:SOR-SC03400 年月日生产前检测□操作结束检测□出现可疑情况检测□操作人:复核人:灌封岗位生产记录编号: SOR-SC03600操作人:复核人:灭菌工序生产记录编号: SOR-SC03800注:符合的在“□”打“√”。
组长:现场QA:灯检岗位生产记录编号: SOR-SC03900操作人:复核人:包装指令单指令单号:编号:SOR-SC01100包材领料单领料部门:年月日编码:SOR-SC01200包装工序生产记录物料销毁记录生产负责人:日期:河南金大众生物工程有限公司物料领用、退库记录产品名称:批号:规格:批量:编号:SOR-SC01900河南金大众生物工程有限公司成品寄库单河南金大众生物工程有限公司成品入库单河南金大众生物工程有限公司注射剂工艺查证记录查证人:河南金大众生物工程有限公司成品放行审核单编码:SOR-SC02400。
五子衍宗口服液批生产记录(100盒).

五子衍宗口服液批生产审核单
口服液准备岗位容器具处理及灭菌操作记录
五子衍宗口服液洗瓶岗位生产指令单
口服液洗瓶岗位操作记录
格式号:YL·Z02-02-002-01
口服液车间洗瓶岗位清洁记录
五子衍宗口服液配液、灌封指令单
五子衍宗口服液配液岗位操作记录
岗位负责人:工艺员:
五子衍宗口服液灌装岗位操作记录
口服液生产线中转岗位操作记录
中转岗半成品进、出记录
五子衍宗口服液灭菌岗位操作记录
五子衍宗口服液灯检岗位生产指令单
口服液车间一般生产区清洁记录
五子衍宗口服液包装岗位生产指令
五子衍宗口服液批包装记录
五子衍宗口服液批包装记录
岗位负责人:工艺员:
五子衍宗口服液批包装记录
岗位负责人:工艺员:
包装工包装产量明细
包装工包装产品明细。
小儿止咳糖浆剂批生产记录

陕西德福康制药有限公司批生产记录产品名称:产品规格:产品批号:审核批准放行日期:年月日生产设备部陕西德福康制药有限公司糖浆剂生产日汇总表QA:复核人:填表人:陕西德福康制药有限公司批生产指令单陕西德福康制药有限公司领料送料单配料称量记录称量工序清场记录陕西德福康制药有限公司称量工序清洁消毒记录浓配工序批生产记录浓配工序清场记录陕西德福康制药有限公司浓配工序清洁消毒记录稀配工序批生产记录稀配工序清场记录陕西德福康制药有限公司稀配工序清洁消毒记录理瓶工序记录理瓶工序清场记录陕西德福康制药有限公司理瓶工序清洁消毒记录洗瓶工序记录洗瓶工序清场记录陕西德福康制药有限公司洗瓶工序清洁消毒记录陕西德福康制药有限公司灌装工序记录陕西德福康制药有限公司灌装工序清场记录陕西德福康制药有限公司灌装工序清洁消毒记录陕西德福康制药有限公司封口工序清洁消毒记录封口工序检验记录封口检验工序清场记录陕西德福康制药有限公司封口检验工序清洁消毒记录灯检工序记录灯检工序清场记录陕西德福康制药有限公司灯检工序清洁消毒记录陕西德福康制药有限公司批包装指令单陕西德福康制药有限公司领料送料单贴签喷码工序生产记录贴签喷码工序清场记录陕西德福康制药有限公司贴签标码工序清洁消毒记录批装箱记录批装箱清场记录陕西德福康制药有限公司批装箱清洁消毒记录陕西德福康制药有限公司成品入库记录陕西德福康制药有限公司成品入库清场记录陕西德福康制药有限公司成品入库清洁消毒记录糖浆剂QA现场检查记录批生产记录审核单成品放行审核记录。
XXX版GMP口服液制剂全套批生产记录

XXX版GMP口服液制剂全套批生产记录产品名称:XXX版GMP口服液制剂生产批号:XXXXX生产日期:XXXX年XX月XX日一、原辅材料准备及检查1.原辅材料准备:(1)主要原料清单:原料名称供应商批号用量xxx xxx公司 xxx xxxxxx xxx公司 xxx xxx(2)辅料清单:辅料名称供应商批号用量xxx xxx公司 xxx xxxxxx xxx公司 xxx xxx2.原辅材料检查:(1)主要原料:按照相关要求进行外观、标识、包装、规格等检查,检查记录见附件1(2)辅料:按照相关要求进行外观、标识、包装、规格等检查,检查记录见附件2二、制剂生产过程1.准备制剂设备和容器:(1)根据工艺要求,准备好所需的制剂设备和容器,洗净并消毒。
2.准备生产用水:(1)检查生产用水的水质,并记录相关数据。
3.准备制剂溶剂:(1)按工艺要求,准备好制剂所需的溶剂。
4.配制制剂溶液:(1)按照工艺要求,将制剂原料逐一加入搅拌容器中,适当加热并搅拌至均匀。
5.过滤制剂溶液:(1)将配制好的制剂溶液通过过滤器过滤,去除悬浮物等杂质。
6.灭菌处理:(1)将过滤好的溶液进行灭菌处理,确保产品的微生物指标符合要求。
7.装瓶包装:(1)将灭菌好的制剂液体装入瓶中,按规定数量进行包装。
9.封瓶:10.封装包装:三、质量控制及分析1.进行质检样品的取样及标记。
2.根据质检样品的检验项目和方法,进行质检操作。
3.记录质检结果,并进行分析。
4.对合格的产品进行包装交接。
四、记录1.生产批次报告:记录生产过程中的设备、操作、环境等要点,检查合格项目等,附件32.温度记录:记录生产过程中的各个环节的温度,附件43.湿度记录:记录生产过程中的各个环节的湿度,附件54.净化度验证记录:记录净化设备的验证情况,附件65.灭菌验证记录:记录灭菌设备的验证情况,附件76.质量检查记录:记录质量检查的结果,附件8以上内容为生产批次记录的基本内容,详细操作和检验项目及方法需根据具体工艺和要求进行调整。
注射液生产记录

板蓝根注射液生产记录########药业有限公司原料:板蓝根岗位:提取、浓缩、醇沉投料量:kg批生产量:操作指导操作记录1.提取1.1.称取板蓝根加入适量水煎煮二次,第一次2小时,第二次1小时,合并煎液,滤过。
2.浓缩2.1.滤液浓缩至一定量。
3.醇沉3.1.加95%乙醇使药液含醇量达70%,搅匀,静置24小时。
3.2.药液滤过,滤液回收乙醇至一定量,冷藏。
投料日期:年月日时分板蓝根:kg第一煎:水加入量:ml提取时间:时分至时分第二煎:水加入量:ml提取时间:时分至时分合并煎液量:ml过滤时间:时分至时分操作人:复核人:浓缩时间:时分至时分浓缩时控温:︒C 真空度:Mpa得浸膏量:ml操作人:复核人:95%乙醇加入量:ml 药液乙醇度:静置时间:月日时分至月日时分操作人:复核人:过滤日期:板框压滤:时分至时分过滤人:药液体积:ml回收时间:时分至时分回收时控温:︒C 真空度:Mpa得浸膏量:ml冷藏时间:月日时分至月日时分操作人:复核人:岗位:氨沉、配制操作指导操作记录4.氨沉:4.1.药液滤过,滤液用氨试液调节PH为8.0~8.5,搅匀,冷藏48小时。
4.2.滤过,滤液加热除去氨。
4.3.加注射用水至一定量,冷藏。
氨沉日期:板框压滤:时分至时分加氨试液量:ml 药液PH值:冷藏时间:月日时分至月日时分操作人:复核人:过滤日期:板框压滤:时分至时分加热除氨:时分至时分操作人:复核人:加入注射用水后药液量:ml冷藏时间:月日时分至月日时分操作人:复核人:5.配制5.1.药液滤过,滤液用1%NaOH溶液调节PH为7.0~7.5,冷藏。
5.2.药液滤过,滤液加入甘露醇一定量。
5.3.用注射用水配药液至足量。
5.4.药液经药液经G6砂棒和0.8 m的微孔滤膜精滤后至接受瓶。
5.5.从接受瓶中接药液25ml进行澄明度检查,鞣质检查,合格后方可输送灌封岗位。
过滤日期:板框压滤:时分至时分原始PH值:加1%NaOH量:调PH值为:冷藏时间:月日时分至月日时分操作人:复核人:配制日期:板框压滤:时分至时分加入甘露醇:g配足后药液总量:ml操作人:复核人:精滤时间:时分至时分操作人:复核人:澄明度检查:检查结果:合格不合格检查人:2ml板蓝根注射液生产记录岗位:洗瓶、灌封日 期:操 作 指 导操 作 记 录洗瓶:洗瓶机新鲜蒸馏水压力(MPa )空气压力(Mpa )循环压力(Mpa )喷淋水压力(MPa )烘道温度(︒C )6.洗瓶:6.1.待灭菌隧道的温度升至250︒C ,将安瓿瓶置于超声波清洗槽中清洗。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
批生产指令
产品名称批号规格批量执行车间液体车间执行人编制依据金银花饮料生产工艺规程生产日期
生产配方物料代码物料名称
工艺配方量
(1000ml)
生产用量Y11
F03
F01
内包材B04 B05
备注:
下达人:下达日期:批准人:批准日期:
称量备料岗位生产记录
品名:规格:批号:批量:
编制依据
生产工艺规程2、称量备料岗位标准操作规程
生产指令操作记录
1.操作间有“已清洁”和“清场合格证”。
2.计量器具是否在有效期内。
是□否□是□否□
3.物料经缓冲间脱包清洁并做记录
4.核对待称量物料的品种、批号、数量是否一致
是□否□
称量备料单
物料名称编号备料量剩余量称量人:复核人:
5.清场:设备容器具是否已清洁并挂好相应状态牌,操作间有无遗留物。
已清洁是□否□遗留物有□无□清场人:
QA:日期:
6.现场监视监控记录监控记录:
QA:
配制岗位操作记录
生产日期:
品名:规格:批号:批量:
编制依据
1、生产工艺规程
2、配制岗位标准操作记录
生产指令操作结果
1.操作间有“清场合格证”,“已清洁”合格证。
2.核对物料的品名、批号、数量是否一致。
3.检查设备是否完好。
4.按生产工艺取规定量30-40%纯化水置夹层锅,加热至沸腾。
5.将配方中的金银花加入夹层锅进行煎煮提取(时间为30分钟)后进行过滤至贮罐中备用。
6.将、和贮罐中的料液放入调配罐中进行搅拌溶解,过滤后备用。
有□无□
是□否□
投料记录
:
::
□完好
□已煎煮提取
□已加热沸腾
□已溶解、搅拌均匀
□加全量
得溶液:操作人:复核人:
取样送检(中间产品报告单附后)□已取样
取样量: QA:
8.清场:设备容器具是否已清洁并挂好相应状态牌,操作间有无遗留物。
已清洁是□否□遗留物有□无□清场人:
QA:日期:
9.现场监视监控记录
监控记录:
QA:日期:
洗瓶(烘干)岗位操作记录
品名:规格:批号:批量:
编制依据
1、生产工艺规程
2、洗瓶(烘干)岗位标准操作记录
生产指令操作结果
1.检查操作间有无“已清洁”“清场合格证”
2.核对包材数量是否一致
3.检查设备是否完好
4. 10ml玻璃瓶、铝盖用自来水初洗,再用纯化水精洗。
5.将10ml玻璃瓶和铝盖放入烘箱内,干燥灭菌。
合格瓶数
收率=×100%
领用数量-剩余数量
收率范围≥95%
合格瓶数+剩余数量+废瓶数
平衡率= ×100%
领用数量
范围:≥98% 有□无□
是□否□
10ml玻璃瓶:
铝盖:
完好□
□已清洗
□已干燥、灭菌
合格玻璃瓶数:
不合格玻璃瓶数:
铝盖数:
收率=
是否符合规定:是□否□
平衡率=
有无偏差:有□无□
操作人:复核人:
6.清场:设备容器具是否已清洁并挂好相应状态牌,操作间有无遗留物。
已清洁是□否□遗留物有□无□清场人:
QA:日期:
7.现场监视监控记录监控记录:
QA:
灌装岗位操作记录
品名:规格:批号:批量:
编制依据
1、生产工艺规程
2、灌装岗位标准操作记录
生产指令操作结果
1.检查操作间有无“已清洁”“清场合格
证”、核对品名、批号是否相符。
2.检查设备是否完好。
3.核对包材名称、数量并做记录。
4.按灌装机标准操作规程操作。
5.调整装量经QA确认合格后开始后灌装。
6.在灌装过程中每20分钟测量一次装量,同时做好记录
7.理论灌装量= 领用料液数量×100﹪
每瓶灌装数量
合格瓶数
料液收率= ×100%
配制液÷标示量
收率范围95~99%
灌装瓶数×平均装量+废弃液+剩余液
平衡率= ×100%
总配制量
平衡率范围99±2% 是□否□
是□否□
10ml玻璃瓶:
铝盖:
待灌装料液: L
试灌装装量检测结果: QA:
灌装总数:瓶
灌装合格瓶数:瓶
收率=
是否符合规定:是□否□
平衡率=
有无偏差:有□无□
操作人:复核人:
8.清场:设备容器具是否已清洁并挂好相应状态牌,操作间有无遗留物。
已清洁是□否□遗留物有□无□清场人:
QA:日期:
9.现场监视监控记录监控记录:
QA:
附表:灌装装量检查表
品名批号
装量检查装量为250ml/支;每20分钟抽查一次,每次抽查4瓶编号
1 2 3 4 时间
:
:
:
:
:
:
:
:
:
:
:
:
:
:
:
:
:
:
:
:
:
:
:
:
结论
灭菌岗位操作记录
品名:规格:批号:批量:
编制依据
1、工艺规程
2、灭菌岗位标准操作规程
生产指令操作记录
1.检查操作间有无“已清洁”“清场合格
证”。
有□无□
2.复核灭菌物的品种、批号、数量应与传递卡一致。
是□否□领取瓶
3.按灭菌岗位标准操作程序操作。
灭菌温度115℃
压力:
灭菌时间30分钟
是□否□
灭菌记录
升
温
开始
时间
到达
时间
灭菌温度℃115℃
灭
菌
开始
时间
结束
时间
灭菌总数:瓶
破损:瓶
操作人:复核人:
4.清场:设备容器具是否已清洁并挂好相应状态牌,操作间有无遗留物。
已清洁是□否□遗留物有□无□清场人:
QA:日期:
5.现场监视监控记录
复核人:灯检岗位操作记录
品名:规格:批号:批量:
编制依据
1、生产工艺规程
2、灯检岗位标准操作规程
生产指令操作记录及结果
1.检查操作间有无“已清洁”和“清场合格
证”
有□无□
2.核对灯检的品种、批号、数量是否一致。
是□否□
数量瓶
3.按灯检标准操作规程灯检。
记录个人产量及不良品数:
合格数
合格率=×100%
领入数
范围≥96%
合格数+不良品数
平衡率=×100%
领用数
平衡率:98±2%
是□否□
操作人灯检产量不良品数
01
02
03
04
05
灯检总量:瓶
不合格品数:瓶
灯检合格率=
是否符合规定:是□否□
灯检平衡率=
有无偏差:有□无□
不合格品分类情况表:分类装量不合格异物松盖其它数量
4.取样送检(中间产品报告单附后)□符合
送检量: QA:
5.清场:设备容器具是否已清洁并挂好相应状态牌,操作间有无遗留物。
已清洁是□否□遗留物有□无□
清场人:
QA:日期:
6.现场监视监控记录监控记录:
QA:
批包装指令
产品名称批号
规格批量
执行车间液体车间执行人
编制依据金银花饮料(饮料)生产工艺规程生产日期
物料代码物料名称规定量
包
装
材
料
备注:
下达人:下达日期:
批准人:批准日期:
外包装岗位操作记录
品名:规格:批号:批量:
编制依据
1、工艺规程
2、包装岗位标准操作规程
生产指令操作记录
1.操作间有“已清洁”和“清场合格证”。
是□否□
2.核对待包装品与指令单是否一致; 是□否□
待包装品瓶
操作人:复核人:
3.领入包装材料品名、数量与指令单一致;
4.印字:将所领的标签、彩中盒、纸箱打上产品批号、生产日期、有效期,标签上打批号。
先试打印一个,复核,再请QA 检查合格后方可继续打印。
使用数+残损数+退库数
包装平衡= ×100%
领用数
平衡率:100%
物料使用记录
名称领用数使用数残损数退库数平衡(%)操作人:复核人:
5.包装过程:
装箱人代号打印。
按包装标准操作规程叠箱、垫板、装数、清点装箱数量,并复核。
封箱、打包、寄库、计算入库数。
如有零余,与其他批号合箱,并填写合箱记录;
两个批号为一合箱。
入库数+取样数+零头数
成品收率= ×100%
批生产量生产指令操作记录
生产日期:
产品批号:
保质期:
批号打印人:复核人:
合
箱
记
录
批号数量合箱人入库数量本批产品零头本批取样数量成品收率
6.清场:设备容器具是否已清洁并挂好相应状态牌,操作间有无遗留已清洁是□否□遗留物有□无□
百度文库- 让每个人平等地提升自我
物。
清场人:复核人:日期:7.现场监视监控记录监控记录
复核人:
11。
