有关强酸知识点
高一化学酸碱盐知识点总结

高一化学酸碱盐知识点总结化学酸碱盐分类酸:定义:电离时生成的阳离子全部(唯一)是H+的化合物分类:1. 按照在水溶液中是否能完全电离强酸:HCI HBr HI HNO3 H2SO4 HMnO4 HCI04(高氯酸)弱酸:HClO (次氯酸)HF CH3COOH H2SO3 H2S H3PO4 H2CO32. 根据一分子酸可电离出的氢离子的个数一元酸:HCI HBr HI HNO3 HMnO4 HCIO4 HCIO HFCH3COOH二元酸:H2SO4 H2SO3 H2S H2CO3三元酸:H3PO43. 根据酸根中是否含氧含氧酸:HNO3 H2SO4 HMnO4 HCI04 HCIO H2SO3 H3PO4CH3COOH H2CO3无氧酸:HCI HBr HI HF4. 根据水溶性可溶性酸:除硅酸外的其他酸,如:HCI H2SO4 HMnO4 CH3COOH 难溶性酸:H2SQ3 (硅酸)5. 根据挥发性难挥发性酸:H2SO4 H3PO4挥发性酸:HCI (浓)HBr HI HNO3 (浓)HF H2SO3 H2S CH3COOH H2CO36. 根据有机物与无机物分类标准有机酸:CH3COOH无机酸:HCI HBr HI HNO3 H2SO4 HMnO4 HCIO4 HCIOHF CH3COOH H2SO3 H2S H3PO4 H2CO37按照氧化性强弱氧化性酸:H2SO4 (浓)HMnO4 HCIO4 HCIO HNO3 (稀、浓)非氧化性酸:HCI HBr H2SO4 (稀)HF H3PO4 H2CO3弱酸电离:HCIO H CIOH 2CO3 H HCO 3分步电离:2HCO 3 H CO32性质:酸的通性:1.酸能与酸碱指示剂反应,酸能使紫色石蕊试剂变红2. 酸能与金属活动性顺序中位于氢之前的活泼金属反应,生成相应的盐和氢气H 2SO4 Zn ZnSO4 H 22HCl Fe FeCl2 H 23. 酸能与碱发生反应,生成相应的盐和水Ba(OH )2 H2SO4 BaSO4 2H 2O 2Al(OH)3 3H 2SO4 Al2(SO4)3 6H 2O4. 酸能与盐反应,生成新盐和新酸CaCO3 2HCl CaCl2 CO2 H 2OBa( NO3)2 H 2SO4 BaSO4 2HNO35. 酸能与碱性氧化物反应,生成相应的盐和水CaO 2HNO3 Ca( NO 3) 2 H 2OCuO H 2SO4 CuSO4 H 2O酸的有关反应规律1. 强酸制弱酸Na2CO3(aq)S0〈少)Na2SO3 CO2 H 2S CuSO4 CuS H 2SO42. 高沸点酸制低沸点酸微热NaCl (s) H2SO4(浓) NaHSO4 HCL强热NaNO3(s) H 2SO4(浓) NaHSO4 HNO33. 易溶酸制难溶酸HCl Na2Si3 H 2SiO3 2NaCl 碱:定义:电离时生成的阴离子全部(唯一)是0H-的化合物分类:1. 根据在水溶液中是否能完全电离强碱:NaOH KOH Ba(OH)2 Ca(OH)2 弱碱:NH3?H2O Fe(OH)2 Cu(OH)2 Mg(OH)2 Mn(OH)2 Zn(OH)2 Fe(OH)3 Al(OH) 32. 根据一分子碱最多电离出的氢氧根离子的个数一元碱:NaOH KOH NH3?H2O二元碱:Ba(OH)2 Ca(OH)2 Fe(OH)2 Cu(OH)2 Mg(OH)2 Mn(OH)2 Zn(OH)2三元碱:Fe(OH)3 Al(OH) 33.根据水溶性可溶性碱:NaOH KOH Ba(OH)2 Ca(OH)2难溶性碱:Fe(OH)2 Cu(OH)2 Mg(OH)2 Mn(OH)2 Zn(OH)2 Fe(OH)3 Al(OH)3强碱电离:KOH K OHBa(OH)2 Ba2 2OH弱碱电离:4 NH3?H2O NH4 H2OFe(OH)3 Fe5 3OH性质:碱的通性:1.碱能与酸碱指示剂反应,使紫石蕊试剂变蓝,使酚酞试剂变红2.碱能与酸发生中和反应,生成相应的盐和水NaOH HCl NaCl H 2OCu(OH)2 H 2SO4 CuSO4 H 2O碱的有关反映规律:1. 强碱制弱碱(较强碱制较弱碱)3NaOH FeCl3 Fe(OH )3 3NaCl2KOH ( NH 4 )SO4 K2SO4 NH3 H 20 3NH3?H20 AlCl3 Al(OH )3 3NH 4ClNaOH与H 3PO4(物质的量之比) 1:1)NaOH H3PO4 NaH 2PO4 H2O 2:1)2NaOHH3PO4 Na2HPO4 2H 20 3:1)3NaOH H 3PO4Na3PO4 3H 2O4 碱能与酸性氧化物反应,生成相应的盐和水Ca(OH )2 CO2 (少)CaC03 H 2O2NaOH S03(少) Na2SO4 H 2O5 碱能与盐反应,生成新盐和新碱2NaOH CuSO4 Na2SO4 Cu(OH)2 Ba(OH )2 CuSO4 BaSO4 Cu(OH)2盐:定义:由金属阳离子或铵根离子与酸根离子构成的化合物叫盐分类:1?根据水溶性分为易溶盐与难溶盐钠盐、钾盐、铵盐、硝盐均为易溶盐氯化物除AgCI,硫酸盐除BaSO4 PbSO4 CaSO4等一般易溶弱酸盐除钠盐、钾盐、铵盐一般难溶(CH3C00)Ca (CH3C00)Cu 等是可溶的(CH3C00)Pb是可溶但难电离的2. 根据多兀酸遇见中和反应的程度所得的产物分为正盐:NaCI Na3PO4 CuS04 CaC03酸式盐:NaHC03 NaHP04 NaH2P04 Ca(HC03)碱式盐:CU2(0H)2C03(碱式碳酸铜)Mg(OH)CI (碱式氯化镁)酸式盐电离: 2NaHC03 Na H C03碱式盐电离:Cu2(0H )2C03 2Cu320H C0;盐的通性:仁盐能与酸反应,生成相应的盐和水2. 盐能与碱反应,生成相应的盐和水3. 盐能与盐反应,生成新盐4. 盐能与金属发生置换反应盐的有关反应规律:1. 正盐+多元酸=酸式盐心C02 Ca(0H)2 CaC03 H20C02(多)Ca(0H)2 Ca(HC03)2 ' )CaC03 C02 H20 Ca(HC03)2氧化物3 酸式盐+碱=正盐+水+碱(或正盐)碳酸氢钠溶液中滴入少量氢氧化钙溶液:Ca(0H) 2+2NaH 2O3===CaCO3 J +Na2C0 3+2H20定义:只有两种元素组成的化合物,其中一种是氧元素分类:1. 按组成分:金属氧化物:FeO MnO2 ZnO CuO Fe2O3 Fe3O4 Al 2O3 HgO CaO非金属氧化物:CO2 CO SO2 SO3 P2O5 N2O5 CI2O7 Mn 2O7 SiO2 H2O2. 按性质分:酸性氧化物:CO2 CO SO2 SO3 P2O5 N2O5 CI2O7 Mn 2O7SiO2 H2O碱性氧化物:Na2O K2O BaO CaO CuO Fe2O3两性氧化物:BeO,AI 2O3,Ga2O3 (镓),ZnO,GeO 2,Sb2O3,Bi z O s,TQ2,ZrO 2不成盐氧化物:H2O NO CO N2O NO2 N2O4 TeO ClO 2 I2O4 特殊氧化物:H2O2 Na2O2 Fe3O4酸性氧化物:与碱反应只生成盐和水的氧化物(酸酐)酸性氧化物的通性:1. 与碱反应只生成盐和水CO2+NaOH=Na2CO3+H2O2. 与碱性氧化物反应只生成盐SiO2+CaO=CaSiO33. 部分酸性氧化物溶于水得到相应的酸Mn 2O7+H20=2H MnO4碱性氧化物:与酸反应只生成盐和水的氧化物碱性氧化物的通性:1. 与酸反应只生成盐和水Fe s O3+H2SO4=Fe2(SO4)3+3H2O2. 与酸性氧化物反应只生成盐Na2O+SO3=Na2SO43. 少数碱性氧化物溶于水得到相应的碱CaO+H2O=Ca(OH)2注:金属氧化物可能是碱性氧化物、两性氧化物、酸性氧化物或特殊氧化物非金属氧化物可能是酸性氧化物、不成盐氧化物、特殊氧化物氢氧化钙溶液中滴入少量碳酸氢钠溶液:Ca(0H) 2+NaH 203===CaC0 3 J +Na0H+H 20。
有关浓硫酸的知识点九年级

有关浓硫酸的知识点九年级浓硫酸的知识点九年级浓硫酸,是一种常见的无机酸,广泛应用于化学实验和工业生产中。
下面将为大家详细介绍有关浓硫酸的一些重要知识点。
1. 浓硫酸的化学性质浓硫酸(化学式:H2SO4)是无色、黏稠的液体,也被称为硫酸。
它是一种强酸,能与大部分金属反应产生氢气并生成相应的硫酸盐。
浓硫酸与水反应剧烈,产生大量热量,并伴随着冒烟、变色或甚至爆炸等现象。
因此,在操作浓硫酸时,需要特别小心,并戴上防护手套和护目镜。
2. 浓硫酸的物理性质浓硫酸的密度相对较高,约为1.83 g/cm³。
它的沸点为约338℃,在高温下会分解。
浓硫酸对许多有机物具有强烈的脱水性,能使有机物失水并发生脱水反应。
因此,使用浓硫酸时应避免与易燃或易爆物质接触。
3. 浓硫酸的用途浓硫酸在工业生产中有广泛应用。
它可以被用作脱水剂,用于制取许多无机盐和有机化合物。
此外,浓硫酸还被用于制造肥料、炸药、染料和合成纤维等。
在实验室中,浓硫酸常用于进行酸碱中和反应、酸解反应和酮类的制备等。
4. 浓硫酸的制备方法浓硫酸通常通过浓缩硫酸蒸馏的方法制备。
首先,将稀硫酸倒入一个蒸馏烧瓶中,并加热。
然后,通过冷却管冷凝并收集蒸馏出的浓硫酸。
需要注意的是,在制备和分装浓硫酸时,要使用专门的实验器材,并在通风橱中操作,确保操作安全。
5. 浓硫酸的危害性浓硫酸具有很强的腐蚀性,可以对皮肤、眼睛和呼吸系统造成严重损害。
因此,在使用浓硫酸时,必须佩戴防护设备,并遵循相关的操作规程和安全措施。
若不慎溅到皮肤或眼睛,应立即用大量清水冲洗,并寻求医疗帮助。
6. 浓硫酸的储存与安全注意事项浓硫酸应储存在防腐蚀性能良好的容器中,并存放在通风良好、干燥和避光的地方。
它应与易燃物、氧化剂和有机物分开存放,以避免发生意外事故。
在操作浓硫酸时,务必戴上防护手套、护目镜和工作服,并配备酸雾排风系统,确保操作环境的安全。
通过对浓硫酸的学习,我们了解了它的化学性质、物理性质、用途、制备方法以及安全注意事项。
高一化学酸碱盐知识点总结

高一化学酸碱盐知识点总结化学酸碱盐分类酸是一类化合物,其电离时所生成的唯一阳离子为H+。
1.根据在水溶液中是否能完全电离,酸可分为强酸和弱酸。
强酸包括HCl、HBr、HI、HNO3、H2SO4、HMnO4和HClO4(高氯酸),而弱酸则包括HClO(次氯酸)、HF、CH3COOH、H2SO3、H2S、H3PO4、H2CO3等。
2.根据一分子酸可电离出的氢离子的个数,酸可分为一元酸、二元酸和三元酸。
一元酸包括HCl、HBr、HI、HNO3、HMnO4、HClO4和HClO等,二元酸包括H2SO4、H2SO3、H2S、H2CO3等,而三元酸仅包括H3PO4.3.根据酸根中是否含氧,酸可分为含氧酸和无氧酸。
含氧酸包括HNO3、H2SO4、HMnO4、HClO4、HClO、H2SO3、H3PO4、CH3COOH、H2CO3等,而无氧酸仅包括HCl、HBr、HI、HF等。
4.根据水溶性,酸可分为可溶性酸和难溶性酸。
可溶性酸包括除硅酸外的其他酸,如HCl、H2SO4、HMnO4、CH3COOH等,而难溶性酸仅包括H2SiO3(硅酸)。
5.根据挥发性,酸可分为难挥发性酸和挥发性酸。
难挥发性酸包括H2SO4、H3PO4等,而挥发性酸包括HCl(浓)、HBr、HI、HNO3(浓)、HF、H2SO3、H2S、CH3COOH、H2CO3等。
6.根据有机物与无机物分类标准,酸可分为有机酸和无机酸。
有机酸仅包括CH3COOH,而无机酸包括HCl、HBr、HI、HNO3、H2SO4、HMnO4、HClO4、HClO、H2SO3、H2S、H3PO4、H2CO3等。
7.根据氧化性强弱,酸可分为氧化性酸和非氧化性酸。
氧化性酸包括H2SO4(浓)、HMnO4、HClO4、HClO、HNO3(稀、浓)等,而非氧化性酸包括HCl、HBr、H2SO4(稀)、HF、H3PO4、H2CO3等。
酸的通性包括:1.酸能与酸碱指示剂反应,酸能使紫色石蕊试剂变红;2.酸能与金属活动性顺序中位于氢之前的活泼金属反应,生成相应的盐和氢气;3.酸能与碱发生反应,生成相应的盐和水。
高考化学硝酸知识点

高考化学硝酸知识点高考化学硝酸知识点(一)概述1.硝酸是强酸,具有酸的通性;2.浓、稀硝酸都有强的氧化性,浓度越大,氧化性越强。
3.硝酸属于挥发性酸,浓度越大,挥发性越强(98%以上为发烟硝酸),4.硝酸不太稳定,光照或受热时会分解(长期放置时变黄色的原因?保存注意事项?棕色瓶冷暗处);5.硝酸有强烈的腐蚀性,不但腐蚀肌肤,也腐蚀橡胶等,6。
工业制硝酸用氨的催化氧化法(三步反应?)。
7.硝酸可与大多数金属反应,通常生成硝酸盐。
8.浓硝酸可氧化硫、磷、碳等非金属成高价的酸或相应的'氧化物,本身还原为二氧化氮。
9.硝酸(混以浓硫酸)与苯的硝化反应硝酸(混以浓硫酸)与甲苯的硝化反应(制TNT)10.硝酸与乙醇的酯化反应。
与甘油的酯化反应(二)硝酸与金属反应的“特殊性”及规律1.浓硝酸与铁、铝的钝化现象(原因及应用:钝化。
常温可以用铝罐车或铁罐车运硝酸)(表现了浓硝酸的什么性质?)2.浓、稀硝酸与活泼金属反应都不生成氢气(原因?)3.浓、稀硝酸能与铜、银等不活泼金属反应(表现了硝酸的什么性质?试管中粘附的铜或银用什么来洗?)4.与金属反应时硝酸的主要还原产物:(1)、与铜、银等不活泼金属反应,浓硝酸生成NO2,而稀硝酸生成NO(2)、与锌、镁等活泼金属反应,还原产物比较复杂,其价态随金属活泼性增强和酸的浓度降低而降低,最低可得NH4+。
(3)、浓、稀硝酸与金属反应中的作用:表现出——酸性、强氧化性(注意:定量计算中应用)5.稀硝酸与铁反应,如果硝酸过量,生成三价铁盐,如果铁过量,生成二价铁盐(在硝酸与铁的摩尔比的不同溶液中铁元素存在的形式不同)。
硝酸知识点总结

硝酸知识点总结一、硝酸的性质1.1 硝酸的化学性质硝酸是一种无色透明的液体,是一种强氧化剂,能与许多物质发生剧烈的化学反应。
硝酸可以与许多金属发生还原反应,生成相应的盐和一氧化氮或氧化氮等气体。
硝酸也是一种强酸,在水中完全离解,生成硝酸根离子和氢离子(H+)。
硝酸还能与有机物发生酯化反应,生成硝酸酯。
另外,硝酸还能与许多有机化合物发生硝化反应,生成硝基化合物,如硝基苯等。
1.2 硝酸的物理性质硝酸是一种无色透明的液体,呈强烈的腐蚀性气味,密度约为1.5~1.6g/cm3。
硝酸在常温下易挥发,易吸湿,在空气中会迅速与水蒸气混合,并生成对环境有害的氮氧化物。
1.3 硝酸的安全性硝酸是一种剧毒、腐蚀性极强的化合物,对皮肤、眼睛和呼吸道有严重腐蚀作用,对人体健康和环境都具有很大的危害。
因此,在使用硝酸时应严格遵守安全操作规程,做好个人防护工作,避免直接接触硝酸。
二、硝酸的用途2.1 工业生产硝酸是一种重要的化工原料,广泛用于生产硝化甘油、硝化纤维素等炸药,并应用于冶金、化肥、有机合成、橡胶及塑料工业等,是许多工业生产中不可缺少的重要原料。
2.2 农业生产硝酸作为一种氮肥,在农业生产中起到了非常重要的作用。
硝酸可以作为植物的氮源,促进作物的生长,提高作物的产量和质量。
2.3 科学研究硝酸在科学研究中也有广泛应用,例如硝酸可以用作化学分析试剂,还可以用于制备其他化学物质,如硝酸铅、硝酸银等。
三、硝酸的制备方法硝酸有多种制备方法,常见的制备方法包括硝酸铵的硝化法、硝酸钠的硝化法、硫酸硝化法、硝酸钾的硝化法等。
其中,硫酸硝化法是其中最为常用的方法:硫酸硝化法的反应方程式为:H2SO4 + HNO3→ H2SO4 + H2O + NO2 + 2O2硫酸和硝酸反应生成硝酸和二氧化氮,然后将二氧化氮在水中溶解,再经过脱色、蒸馏、冷却等步骤即可得到硝酸。
四、硝酸的安全注意事项4.1 防护措施在使用硝酸的过程中,应严格遵守操作规程,做好个人防护措施,包括戴防护眼镜和手套,避免直接接触硝酸。
高三化学酸的知识点

高三化学酸的知识点化学是我们日常生活中一个重要的科学领域,而酸是化学中的一个重要概念。
学习酸的知识点对于高三化学的学习至关重要。
本文将介绍高三化学中酸的相关知识点,帮助同学们更好地理解和掌握这一内容。
一、酸的定义酸是一类能够释放氢离子(H+)的化合物,其特征是具有酸味、具有腐蚀性、能与碱反应并中和。
在化学方程式中,酸一般以H表示。
二、常见的酸1. 盐酸(化学式:HCl):盐酸是一种无色、刺激性气味的液体。
它是一种强酸,能与碱快速反应,并生成盐和水。
盐酸广泛应用于实验室和工业生产中。
2. 硫酸(化学式:H2SO4):硫酸是一种无色、有强烈腐蚀性的液体。
它也是一种强酸,与碱反应生成盐和水。
硫酸被广泛应用于电池制造、肥料生产等领域。
3. 醋酸(化学式:CH3COOH):醋酸是一种酸味较弱的液体。
它是一种弱酸,与碱反应生成盐和水。
醋酸主要存在于醋中,被广泛应用于食品加工和制药工业。
三、酸的性质1. 腐蚀性:酸具有腐蚀性,能损坏物体表面的组织结构。
这是由于酸与物质反应产生的化学变化导致的。
2. 酸味:酸具有特殊的酸味,例如柠檬汁、醋等。
3. 中和作用:酸能与碱反应并中和,生成盐和水。
在酸与碱反应的化学方程式中,酸和碱的摩尔比例是1:1。
4. 指示剂:指示剂可以用来判断溶液是否为酸性,常见的指示剂有酚酞、甲基橙等。
四、常见的酸碱反应1. 酸与金属的反应:酸与金属反应产生相应的盐和氢气。
例如,盐酸与锌反应产生氯化锌和氢气的化学方程式为:2HCl + Zn → ZnCl2 + H2。
2. 酸与碳酸盐的反应:酸与碳酸盐反应产生相应的盐、水和二氧化碳。
例如,硫酸与碳酸钠反应产生硫酸钠、水和二氧化碳的化学方程式为:H2SO4 + Na2CO3 → Na2SO4 + H2O + CO2。
3. 酸与碱的反应:酸与碱反应能够中和产生盐和水。
例如,盐酸与氢氧化钠反应产生氯化钠和水的化学方程式为:HCl + NaOH → NaCl + H2O。
强酸、弱酸常见的七种判断方法
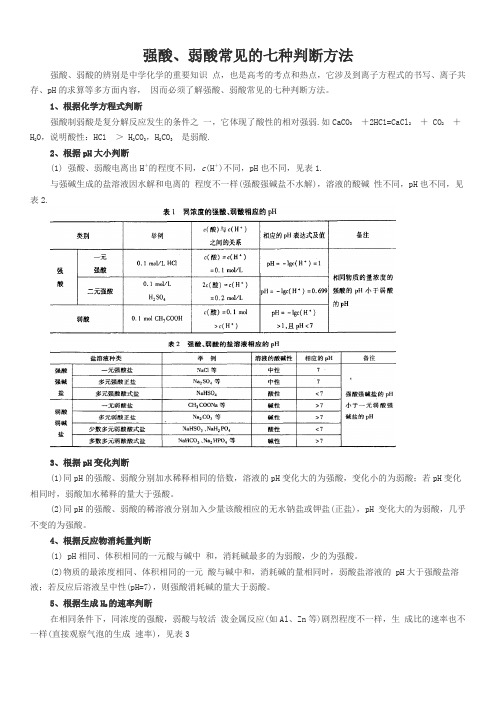
强酸、弱酸常见的七种判断方法强酸、弱酸的辨别是中学化学的重要知识点,也是高考的考点和热点,它涉及到离子方程式的书写、离子共存、pH的求算等多方面内容,因而必须了解强酸、弱酸常见的七种判断方法。
1、根据化学方程式判断强酸制弱酸是复分解反应发生的条件之一,它体现了酸性的相对强弱.如CaCO3+2HC l=CaCl2+ CO2+H2O,说明酸性:HC l> H2CO3,H2CO3是弱酸.2、根据pH大小判断(1) 强酸、弱酸电离出H+的程度不同,c(H+)不同,pH也不同,见表1.与强碱生成的盐溶液因水解和电离的程度不一样(强酸强碱盐不水解),溶液的酸碱性不同,pH也不同,见表2.3、根据pH变化判断(1)同pH的强酸、弱酸分别加水稀释相同的倍数,溶液的pH变化大的为强酸,变化小的为弱酸;若pH变化相同时,弱酸加水稀释的量大于强酸。
(2)同pH的强酸、弱酸的稀溶液分别加入少量该酸相应的无水钠盐或钾盐(正盐),pH 变化大的为弱酸,几乎不变的为强酸。
4、根据反应物消耗量判断(1) pH相同、体积相同的一元酸与碱中和,消耗碱最多的为弱酸,少的为强酸。
(2)物质的最浓度相同、体积相同的一元酸与碱中和,消耗碱的量相同时,弱酸盐溶液的 pH大于强酸盐溶液;若反应后溶液呈中性(pH=7),则强酸消耗碱的量大于弱酸。
5、根据生成H2的速率判断在相同条件下,同浓度的强酸,弱酸与较活泼金属反应(如Al、Zn等)剧烈程度不一样,生成比的速率也不一样(直接观察气泡的生成速率),见表36、根据导电性强弱判断同温度、同物质的量浓度强酸、弱酸溶液,电离出自由移动离子浓度不同(强酸是完全电离,弱酸是部分电离),溶液的导电性也不同,强酸溶液的导电性强于弱酸溶液(可以用电流计测出)。
7、根据中和热大小判断相同条件下,绝大多数弱酸电离时需要吸收大量的热量,因此与强碱中和释放出的热量 (又称中和热)小于强酸(可以用量热计测出)_ 如1 L0. 1 mol/L HC l与CH3COOH稀溶液与同浓度的NaOH溶液中和,测得HC l的中和热所放出的热量为57. 3 KJ/mol,CH3COOH的中和热所放出的热量为56.0 KJ/mol。
硫酸有关知识点总结

硫酸有关知识点总结第一部分:硫酸的物理性质硫酸在常温下为无色、无臭的油状液体,与水完全混合并产生放热反应。
硫酸的密度为1.84克/毫升,熔点为10.39摄氏度,沸点为337摄氏度。
硫酸具有很强的腐蚀性,可以与许多物质反应,包括有机物、金属和其他酸。
硫酸的溶解度随着温度的升高而增加,可以溶解许多物质,如硫酸铜、硫酸钾等。
第二部分:硫酸的化学性质硫酸是一种强酸,能够与水分解成氢离子和硫酸根离子。
它能够与碱中和生成盐和水。
硫酸也可以与金属发生反应,生成相应的硫酸盐和氢气。
另外,硫酸还能够与有机物发生反应,引起脱水或酯化反应。
硫酸的化学性质非常活泼,可以与众多物质发生反应,因此使用时需要非常小心。
第三部分:硫酸的应用硫酸在工业生产和实验室中有着广泛的应用。
其中,最主要的用途是作为化肥生产的原料,硫酸铵、硫酸钾等都是常见的化肥。
硫酸还用于金属加工、电池制造、纺织工业、制药等领域。
在实验室中,硫酸常用于调节酸碱度、制备某些化合物以及进行化学实验。
第四部分:硫酸的安全注意事项硫酸是一种具有很强腐蚀性的化学品,使用时需要非常小心。
在操作硫酸时,需要佩戴防护眼镜、手套和护目镜,避免直接接触皮肤和眼睛。
另外,使用硫酸的场所应保持通风良好,避免其蒸气对人体造成伤害。
对于硫酸的废弃物处理也需要格外小心,避免对环境造成污染。
综上所述,硫酸是一种具有重要作用的化学品,但同时也具有很强的危险性。
在生产和使用过程中,需要严格遵守相关的安全操作规程,以保障人员和环境的安全。
希望本文的介绍能够帮助读者更加了解硫酸,并正确地使用和处理它。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
强酸知识点
强酸是指具有很强酸性的化学物质,它在溶液中能够释放出大量的质子(H+),从而降低溶液的pH值。
强酸常见的有硫酸、盐酸和硝酸等。
本文将从以下几个方
面介绍强酸的知识点。
1.强酸的定义强酸的定义是指在水溶液中完全离解的酸,即酸分子能
够与水分子完全反应,释放出大量的质子。
强酸的离解程度比弱酸高,因此它们的酸性更强。
2.强酸的性质强酸具有以下几个常见的性质:
•酸味:强酸具有酸味,但由于强酸对人体有害,所以切勿尝试品尝。
•腐蚀性:强酸能够与许多物质发生剧烈的化学反应,因此具有很强的腐蚀性。
在操作强酸时,应注意安全措施,避免皮肤和眼睛接触强酸。
•导电性:由于强酸能够释放出大量的质子,所以它们在溶液中具有较高的电离度,能够导电。
3.强酸的常见种类目前常见的强酸主要有硫酸、盐酸和硝酸等。
•硫酸(H2SO4):硫酸是一种无色至淡黄色的液体,具有强烈的腐蚀性。
它广泛用于工业生产和实验室中,是一种重要的化工原料。
•盐酸(HCl):盐酸是一种无色至淡黄色的液体,具有刺激性气味。
它是一种常用的实验室试剂,也广泛应用于金属表面清洗等领域。
•硝酸(HNO3):硝酸是一种无色至黄色的液体,具有强烈的刺激性气味。
它在工业生产中广泛用于制造化肥和炸药等。
4.强酸的常见用途强酸在多个领域具有重要的应用价值。
•工业生产:强酸是许多化工过程中必不可少的原料,如硫酸被广泛应用于磷肥、冶金、纸浆和造纸等行业。
•实验室应用:强酸在实验室中用于分析、制备和反应等多个方面,如盐酸常用于酸碱中和实验和金属清洗实验。
•医疗领域:强酸在医疗领域中也有一定的应用,如盐酸可以用于消毒和杀菌。
•其他领域:强酸还被广泛应用于金属表面处理、电池制造和化学分析等领域。
总结:强酸是具有很强酸性的化学物质,它具有酸味、腐蚀性和导电性等特点。
常见的强酸有硫酸、盐酸和硝酸等,它们在工业生产、实验室和医疗领域中有广泛的应用。
在使用强酸时,要注意安全措施,避免对人体和环境造成伤害。
