烷烃的结构与性质
高中化学选必三 2-1 烷烃 基础知识

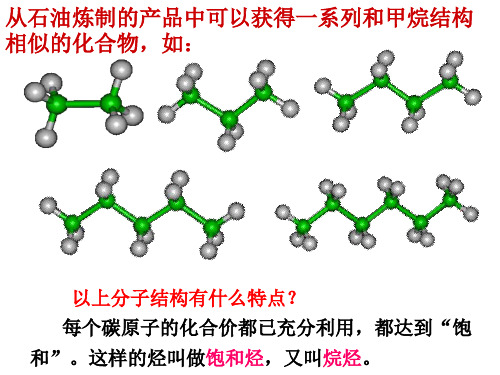
第一节 烷烃一、烷烃的结构与性质(一)定义:碳原子之间都以单键结合,剩余碳原子全部跟氢原子结合,使每个原子的化合价都达到“饱和”的链烃叫饱和链烃,或叫烷烃(二)通式:C n H 2n+2(n ≥1)(三)物理性质:1、随着碳原子数的增多,熔沸点依次升高,密度依次增大(密度小于水);C 1——C 4为气态(但新戊烷为气体),C 5——C 16为液态,C 17以上的为固态2、溶解性:不溶于水,易溶于有机溶剂。
液态烷烃都可做有机溶剂3、质量分数:随着碳原子数的增多,氢原子的质量分数逐渐减小,碳原子的质量分数逐渐增大,所以CH 4是氢原子质量分数最大的烷烃4、同分异构体的熔沸点:支链越多,熔沸点越低(四)结构特点:烷烃的结构与甲烷的相似,其分子中的碳原子都采取sp 3杂化,以伸向四面体4个顶点方向的sp 3杂化轨道与其他碳原子或氢原子结合,形成σ键。
烷烃分子中的共价键全部是单键。
既有极性键又有非极性键(甲烷除外)。
(五)烷烃的存在形式天然气、液化石油气、汽油、柴油、凡士林、石蜡等,它们的主要成分都是烷烃。
(六)代表物——甲烷1、物理性质:甲烷是一种无色、无臭的气体,在相同条件下,其密度比空气小,难溶于水2、化学性质:甲烷的化学性质比较稳定,常温下不能被酸性高锰酸钾溶液氧化,也不与强酸、强碱及溴的四氯化碳溶液反应。
甲烷的主要化学性质表现为能在空气中燃烧(可燃性)和能在光照下与氯气发生取代反应。
(1)氧化反应:CH 4+2O 2−−→−点燃CO 2+2H 2O (淡蓝色火焰) 使用前要验纯,防止爆炸(2)受热分解:CH 4−−→−高温C+2H 2(隔绝空气)(3)取代反应:CH 4+Cl 2−−→−光照CH 3Cl+HCl(七)化学性质:通常状况下,很稳定,不与强酸、强碱或酸性KMnO 4反应1、氧化反应(可燃性):C n H 2n+2+21n 3+O 2−−→−点燃nCO 2+(n+1)H 2O注:当碳含量少时,产生淡蓝色火焰,但随着碳原子数的增多,碳的质量分数逐渐增大,有黑烟产生2、取代反应:有机物分子里的某些原子或原子团被其他原子或原子团所替代的反应(1)烷烃取代反应的特点:①在光照条件下;②与纯卤素反应;③1mol 卤素单质只能取代1molH④连锁反应,有多种产物(卤代烃和卤化氢气体)(2)举例:CH 3CH 3+Cl 2−−→−光照CH 3CH 2Cl+HCl3、受热分解:烷烃在隔绝空气的条件下,加热或加催化剂可发生裂化或裂解通式:一分子烷烃催化剂△一分子烷烃+一分子烯烃举例:(七)同系物1、定义:结构相似,在分子组成上相差一个或若干个CH2原子团的化合物互称为同系物2、特点:(1)通式相同,结构相似,化学性质相似,属于同一类物质;(2)物理性质一般随碳原子数目的增多而呈规律性变化。
烷烃
相互关系 E F C A D B
白磷与红磷 正丁烷与异丁烷
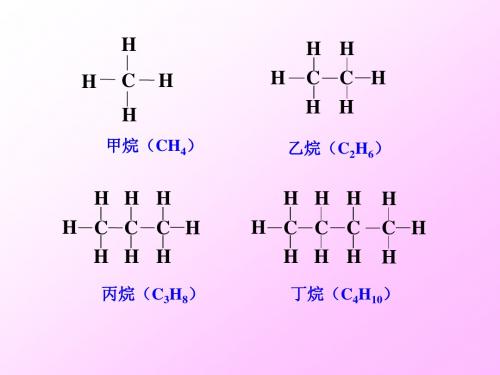
H H H C C H H H
H H H H C C C H H H H
丙烷( 丙烷(C3H8) 结构简式: 结构简式:CH3CH2CH3
乙烷( 乙烷(C2H6) 结构简式: 结构简式:CH3CH3 CH3—CH3
H H H H C C C 丁烷(C4H10) 结构简式: 结构简式:CH3CH2CH2CH3 或CH3(CH2)2CH3 CnH2n+2(n≥1) ) CnH2n(n≥3) )
(三)同系物
结构相似,在分子组成上相差一个或若干个 结构相似,在分子组成上相差一个或若干个CH2 原子团的物质 相差一个或若干个 互称同系物。 互称同系物。 同:通式同,组成元素同,同类物质 通式同,组成元素同, 原子团,(分子式不同) ,(分子式不同 异:组成上相差n个CH2原子团,(分子式不同) 组成上相差 个 式量相差: 式量相差:14n 电子数相差: 电子数相差:8n
同系物一定不是同分异构体; 同系物一定不是同分异构体;同分异构体一定不是同系物
练习:选择正确答案的序号, 练习:选择正确答案的序号, 填入下表空格中 A.同位素 B.同分异构体 . . C.同系物 D.同素异形体 . . E.同一物质 F.同类物质 . . 物质名称 氯仿与三氯甲烷 一氯甲烷与四氯化碳 乙烷与新戊烷
气态, (1)状态:常温常压下的烷烃, C1~C4,气态, )状态:常温常压下的烷烃, C5~C16,液态, 液态, C17及以上,固态。 及以上,固态。 (2)密度: 液态时密度均小于1g/cm3(均比水轻)。 )密度: 液态时密度均小于 均比水轻)。 (3)溶解性:均难溶于水,易溶于有机溶剂。 )溶解性:均难溶于水,易溶于有机溶剂。
烷烃的结构与性质课件(共24张PPT)人教版选择性必修3

(4)分解反应:隔绝空气,1000℃以上
知识精讲
(1)甲烷的稳定性
常温下,甲烷与强氧化剂、强酸、强碱反应探究
操作指南 打开输液袋下方开关,缓慢挤压输液袋
KMnO4溶液
溶液颜色变 化情况
滴加酚酞的NaOH溶液 滴加石蕊的H2SO4溶液
结论
通常情况下,CH4的化学性质比较—— 与强氧化剂、强酸、强碱—————
H
单键、σ键、sp3杂化、正四面体结构
知识精讲
根据烷烃的分子结构,
写出相应的结构简式和分 子式,分析他们在组成和 名称 结构上的相似点。
结构简式
分子 式
碳原子 分子中共价
的杂化 键的类型
方式
甲烷
CH4
CH4
sp3
σ键
乙烷
CH3CH3
C2H6
sp3
σ键
甲烷 乙烷
丙烷
丙烷
CH3CH2CH3
C3H8 sp3
σ键
丁烷 CH3CH2CH2CH3 C4H10 sp3
σ键
丁烷
戊烷 CH3CH2CH2CH2CH3 C5H12 sp3
σ键
戊烷
知识精讲
➢烷烃的结构特点 (1)烷烃的结构与甲烷相似 (2)其分子中的碳原子都采取sp3杂化,以伸向四面体四个顶点方向 的sp3杂化轨道与其他碳原子或氢原子结合,形成σ键。 (3)烷烃分子中的共价键全部是单键,单键可以旋转。
一氯乙烷 CH3CH2Cl
1种
二氯乙烷 CH3CHCl2 CH2ClCH2Cl
2种
三氯乙烷 CH3CCl3
CH2ClCHCl2
2种
四氯乙烷 CH2ClCCl3 CHCl2CHCl2
2种
烷烃

⑷若有几个等长碳链时,要选含有最多 取代基的碳链作主链。 ⑸若在主链的两端等距离处有取代基且 多于两个时,要使第三个取代基的位次 较小,依此类推。
第三节 烷烃的化学性质
一、稳定性 二、卤代反应及反应机制 反应机理就是研究反应是如何发生、如何 发展、如何结束的。 烷烃卤代反应的反应机理是游离基链锁反 应(free radical chain reaction)。
⑵主链编号:从靠近取代基的一端, 用阿拉伯数字依次为主链编号。
⑶取代基处理:将取代基的编号和名称放在 母体前面,中间用半字线连接。 相同的取代基合并,取代基数目用中文小写 数字表示,取代基的位次需一一标出,中间 用逗号隔开。 不同的取代基在母体前面的排列依据基团的 “次序规则”进行比较后按“较优基团后列 出”原则列出。
本章要点:
1.烷烃的结构特点:
碳原子都是SP3杂化,所有的键都是σ键, σ键的特点。
2.碳原子的种类:
伯、仲、叔、季(1°级、2°级、3°级、4°级)碳原子。
3.烷烃的同分异构现象:
碳链异构和构象异构;构象异构的概念、定义、乙烷的两种典型构象、丁烷 的四种典型构象的Newman投影式、稳定性比较。
第二节 烷烃的命名法
一、普通命名法
正、异、新; 伯、仲、叔、季碳原子。 举例说明。
二、系统命名法
常见的基团名称: RCH3CH3CH2甲基 methyl 乙基 ethyl
烷基 Alkyl
正丙基 propyl
CH3CH2CH2-
(CH3)2CH异丙基 isopropyl
烷烃的结构和性质课件

02
CHAPTER
烷烃的物理性质
总结词
烷烃的熔点随着碳原子数的增加而升高。
详细描述
烷烃的熔点范围在-50℃至+50℃之间。随着碳原子数的增加,烷烃的分子质量增大,分子间的相互作用力增强,熔点逐渐升高。例如,甲烷的熔点为-182℃,而二十烷的熔点为+3℃,两者相差很大。
烷烃的沸点随着碳原子数的增加而升高。
防治方法
06
CHAPTER
学习烷烃的意义和方法
烷烃是典型的有机化合物,学习其结构和性质有助于理解有机化学的基本概念和原理。
无论是学生还是职业人士,掌握烷烃的知识都是应对化学考试和满足职业需求的重要一环。
应对考试和职业需求
掌握有机化学基础知识
理解结构特点
掌握物理性质
理解化学性质
运用多媒体资源
01
异构化反应是烷烃在催化剂作用下,发生结构变化,生成异构体。
异构化反应包括异构化、重排等反应类型。
烷基化反应是烷烃在催化剂作用下,与其它有机化合物发生加成反应,生成新的烷烃。
烷基化反应可以用来生产高辛烷值的汽油、柴油等燃料。
04
CHAPTER
烷烃的合成与分解
利用烯烃与氢气的加成反应来合成烷烃。
02
03
04
学习烷烃的结构特点,包括碳原子之间的键和构型,是理解其性质的基础。
熟悉烷烃的物理性质,如沸点、熔点、密度等,有助于对其进行鉴别和分类。
烷烃的主要化学性质包括取代反应、氧化反应和裂解反应等,需要深入理解并掌握。
利用多媒体资源,如网络课程、教学视频等,可以更直观地了解烷烃的结构和性质。
THANKS
烷烃在氧化反应中主要发生燃烧和生炭反应。
烷烃
4—甲基—3—乙基
⑦写名称
取代基在前,“某烷”在后,将两者名写在一起
6 7 8 CH3 CH2 —CH2 —CH3 | | 例: CH3—CH—CH2—CH2—CH—CH2—CH3 |2 1 3 4 5| CH3 CH3
2,2,5—三甲基—5—乙基辛烷
练习:用系统命名法命名下列有机物
CH3—CH2—CH2 | CH2 戊烷 | CH3 CH3 |2 1 5 4 3 CH3—CH2—CH—CH—CH3 | CH3
同分异构现象和同分异构体
[讨论]下面是正丁烷和异丁烷的组成和某些物质性质,试分析有 何异同并探讨其原因。 名 称 分子式 C4H10 相对分子质量 熔 58 点 沸 点 相对密度 0.5788 正丁烷 -138.4 -0.5
CH 3—CH—CH— CH2 —CH 3 2 CH 3 CH 3CHCH2CH 2CH 3
CH 3 或者: CH 3CH(CH3 )CH2CH 2CH 3
它们对应的结构简式:
乙烷: H H | | H-C-C-H | | H H 丙烷: H H H | | | H-C-C-C-H | | | H H H
CH3CHCH3 CH3
3烷烃的名称:
碳原子数 分子式 名称
1 CH4
2 C 2H 6
3 4 5 C3H8 C4H10 C5H12
甲烷 乙烷
丙 烷 丁烷
戊烷
6 7 8 9 10 碳原子数 分子式 C6H14 C7H16 C8H18 C9H20 C10H22 名称
己 烷 庚 烷 辛烷 壬烷 癸 烷
碳原子数大于十时,以汉字数字代表称某烷,
①找起点 主链中离支链最近端作为起点 先简单取代基 再繁取代基 ②编序号 用阿拉伯数字给主链碳原子编号 以确定支链的位置
第二章 烷烃

㈠ 稳定性 • C-C键和C-H键均很牢固 键和C • C-H键的极性小,C和H都很难被极化 键的极性小, 都很难被极化 • 在常温下,与强酸、强碱、强氧化剂、强还原剂 在常温下,与强酸、强碱、强氧化剂、 都不发生反应 ㈡ 燃烧 燃烧产物为CO 并放出大量的热, 燃烧产物为CO2和H2O,并放出大量的热,因 此烷烃成为可作为重要的能源. 此烷烃成为可作为重要的能源.
CH3 H + Cl Cl CH3 Cl + H Cl
kJ/mol 435
243
351
431
∆H = (435+243) -(351+431) = -104kJ/mol 3.卤代反应机制 卤代反应机制 反应机制又称反应历程, 反应机制又称反应历程,是化学反应所经 反应历程 具体途径. 具体途径. 历的
扭转张力 非稳定构象具有恢复成稳 定构象的力量;
2、正丁烷的构象 、
正丁烷的构象比较乙烷要较为复杂一些。 正丁烷的构象比较乙烷要较为复杂一些。 正丁烷的极端典型构象有四种: 正丁烷的极端典型构象有四种:
全重叠式 邻位交叉 部分重叠式 对位交叉式
(1)正丁烷的构象势能关系图
沿C2-C3键轴旋转 的转动能垒 22.6 kJ·mol-1
CH3
CH2 CH2 CH2 CH3 正戊烷或戊烷(n (n-Pentane) 正戊烷或戊烷(n
CH3 C CH3
CH3
CH2
CH CH3
CH3
CH3
异戊烷(iso 异戊烷(iso- Pentane) (iso
CH3 新戊烷(neo (neo新戊烷(neo Pentane)
㈡系统命名法
⒈ 烷基的命名 烃分子中去掉一个氢原子, 烃分子中去掉一个氢原子,所剩下的部分叫做烃基 一价烷基的通式为C 脂肪烃基常用 R-表示 一价烷基的通式为 nH2n+1- -表示,一价烷基的通式为 常见烷基的结构和名称 CH3- 甲基 C2H5-乙基 CH3CH2CH2- (正)丙基
烷烃ppt

C、属于同系物的是_①__、___③__和__⑤___或__②__、__③__和__⑤__
① CH3—CH2—CH2
② CH3—CH—CH3
CH3 ③ CH3—CH2—CH3
⑤CH3—CH2—CH—CH3
④ CH3 CH3
CH3 CH—CH3
⑥ CH3—CH—CH3
CH3
CH2
CH3
三、烷烃的命名—— 根据碳原子数命名
| H
省略C—H键
CH3—CH—CH2—CH2—CH3
把同一C上的H合并
CH3
省略横线上C—C键 CH2 CHCH2CH2CH3 CH3
或者: CH3 CH(CH 3)CH2 CH2 CH3
乙烷: H H ||
H-C-C-H || HH
CH3CH3
丁烷: H H H H ||||
H-C-C-C-C-H |||| HHHH
例如:CH 3CH 3 Cl2 光照 会产生9种产物。
思考:烷烃的同系物存在物性递变、化性相似的 情况,那么其它同系物在物性和化性上有 何特点?为什么?
同系物的物理性质递变,化学性质相似
判断:
CH3
CH3-CH2-CH2-CH3 与 CH3-CH-CH3是同种物质吗?
分子式:C4H10
CH2
C、CH3-CH=CH3
CH2
CH2
练习:
2.下列对同系物的叙述中不正确的是( ) A、同系物的化学性质相似 B、同系物必为同一类物质 C、同系物的组成元素不一定相同 D、同系物最简式不一定相同 E、同系物的相对分子质量相差为14的整数倍
3、烷烃的化学性质
➢对比甲烷,预测其它烷烃有何化学性质?
C4H10
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
烷烃的结构与性质
烷烃是一类基本有机化合物,由碳和氢原子构成。
它们的分子由碳
原子构成的链或环连接而成,具有特定的结构和性质。
本文将探讨烷
烃的结构以及与其相关的性质。
一、直链烷烃
直链烷烃是最简单的烷烃类别,分子由一条直线状的碳链构成。
举
个例子,正丁烷(CH3-CH2-CH2-CH3)是一种直链烷烃,其分子中包含
四个碳原子。
直链烷烃的化学式可用CnH2n+2表示,其中n代表烷烃
分子中碳原子的数量。
直链烷烃的物理性质包括沸点、熔点和密度等。
随着碳原子数量的
增加,直链烷烃的沸点和熔点逐渐增加。
这是因为随着分子量的增加,分子间的范德华力也增强,使得分子间相互作用加强,需要更高的温
度来克服这种相互作用。
此外,随着分子量的增加,直链烷烃的密度
也逐渐增加。
二、支链烷烃
支链烷烃的分子由一条或多条侧链连接到主链上,与直链烷烃相比,支链烷烃具有更多的碳原子连接方式。
举个例子,2-甲基丁烷(CH3-
CH(CH3)-CH2-CH3)是一种支链烷烃,其中有一个甲基基团连接在主链上。
支链烷烃与直链烷烃在物理性质上有所不同。
由于支链的存在,支
链烷烃分子具有更大的隔离度,分子间相互作用减少,从而导致其沸
点和熔点相对较低。
支链烷烃的密度也较低,因为支链的存在减少了分子的紧密排列。
三、环烷烃
环烷烃是由碳原子构成的环连接而成的分子结构。
与直链烷烃和支链烷烃相比,环烷烃的分子形状呈环状,因此具有特殊的性质。
环烷烃的一个例子是环己烷(C6H12),其中六个碳原子形成一个环状结构。
环烷烃的性质与其分子结构有密切关系。
由于环状结构的存在,环烷烃分子内部有较大的张力,导致其相对不稳定。
此外,由于环烷烃中碳原子的取向限制,它们往往比相应的直链烷烃熔点和沸点更高。
环烷烃还表现出一些特殊的化学反应,如环开裂和环化等。
总结起来,烷烃是一类碳和氢原子构成的有机化合物,根据其分子结构和性质,可以分为直链烷烃、支链烷烃和环烷烃。
直链烷烃由一条直线状的碳链构成,而支链烷烃则具有侧链连接到主链上的结构。
环烷烃则由碳原子构成的环连接而成。
这些不同的结构使得烷烃具有不同的物理和化学性质,例如沸点、熔点和密度等。
了解烷烃的结构与性质对于理解其在化学和工业领域的应用具有重要意义。
