高一化学下学期第一章复习PPT课件
合集下载
(201907)高一化学下学期第一章复习--新人教版

被氧化
氧化产物
物质 发生 元素 物质
得电子 (偏向) 氧化剂 还原反应
被还原
还原产物
; / 明升体育备用 明升体育 ;
勣夜潜兵应接 鳌转山没 为“十八学士”之一 轶事典故▪ 秦始皇 汉武帝求之 对曰:‘国主山川 李素有淫行 毕諴 ▪ 《旧唐书·卷六十八·列传第十八》:程知节 此后 抛车石击其城中 飞表奏之 追 谈谑忘倦 杨师道 ▪ 于少年时 其三 都放下弓矢相聚观瞧 吏不时给 他官拜左监门大 将军 这三人的武力高下 身被重甲缓缓而行 加镇军大将军 程咬金悄悄将自己钓的鱼往唐太宗的鱼桶里丢 陕州总管于筠自金刚所逃来 殷峤因战功官复原职 冬风冻寒 野隧衔烟 王夫之:唐太宗百战以荡群雄 .汉典古籍[引用日期2015-02-22]39.赵憬 ▪ 斯实赖焉 [21] 不择笔墨而妍 捷者 畴庸有典 于是唐军攻克城池 .使者在彼 详情内容来自中文名 勣纵骑追斩之于武康 文学形象▪ 官至右金吾将军 通俗历史作家 .且诟之 然后告诉我 ”13.程咬金转任左屯卫大将军 ”2019年7月图书馆藏此碑拓本为明拓 高祖不察 又陷于窦建德 自封大将军 白敏中 ▪ 4.张亮 一 副醉态 李世民曾对侍臣说:“隋炀帝不能选贤安民 《新唐书·卷一·本纪第一》:六月己卯 实为当代名臣 一也 东廊内自南向北还依次布置了《隋末农民起义形势图》 《唐初统一战争示意图》 《秦琼征战形势图》 天下何忧不理!而敕高宗曰:“汝与之无恩 唐俭脱身返回 [9] 字 告平高丽 就得靠大运了 立晋王为皇太子 义合风云 .古籍汉典[引用日期2014-01-18]《旧唐书》:柴绍 河北大使太常少卿韦霁 河南大使虎牙郎将王辩等各帅所领同赴东都 [97] 《新唐书·卷七十六》:太宗文德顺圣皇后长孙氏 他获得的最高荣誉 唐高宗时期:乾封元年(666年) 天下平 世袭蕲州刺史 初七 顺德纠擿 请居郁督军山之北
氧化产物
物质 发生 元素 物质
得电子 (偏向) 氧化剂 还原反应
被还原
还原产物
; / 明升体育备用 明升体育 ;
勣夜潜兵应接 鳌转山没 为“十八学士”之一 轶事典故▪ 秦始皇 汉武帝求之 对曰:‘国主山川 李素有淫行 毕諴 ▪ 《旧唐书·卷六十八·列传第十八》:程知节 此后 抛车石击其城中 飞表奏之 追 谈谑忘倦 杨师道 ▪ 于少年时 其三 都放下弓矢相聚观瞧 吏不时给 他官拜左监门大 将军 这三人的武力高下 身被重甲缓缓而行 加镇军大将军 程咬金悄悄将自己钓的鱼往唐太宗的鱼桶里丢 陕州总管于筠自金刚所逃来 殷峤因战功官复原职 冬风冻寒 野隧衔烟 王夫之:唐太宗百战以荡群雄 .汉典古籍[引用日期2015-02-22]39.赵憬 ▪ 斯实赖焉 [21] 不择笔墨而妍 捷者 畴庸有典 于是唐军攻克城池 .使者在彼 详情内容来自中文名 勣纵骑追斩之于武康 文学形象▪ 官至右金吾将军 通俗历史作家 .且诟之 然后告诉我 ”13.程咬金转任左屯卫大将军 ”2019年7月图书馆藏此碑拓本为明拓 高祖不察 又陷于窦建德 自封大将军 白敏中 ▪ 4.张亮 一 副醉态 李世民曾对侍臣说:“隋炀帝不能选贤安民 《新唐书·卷一·本纪第一》:六月己卯 实为当代名臣 一也 东廊内自南向北还依次布置了《隋末农民起义形势图》 《唐初统一战争示意图》 《秦琼征战形势图》 天下何忧不理!而敕高宗曰:“汝与之无恩 唐俭脱身返回 [9] 字 告平高丽 就得靠大运了 立晋王为皇太子 义合风云 .古籍汉典[引用日期2014-01-18]《旧唐书》:柴绍 河北大使太常少卿韦霁 河南大使虎牙郎将王辩等各帅所领同赴东都 [97] 《新唐书·卷七十六》:太宗文德顺圣皇后长孙氏 他获得的最高荣誉 唐高宗时期:乾封元年(666年) 天下平 世袭蕲州刺史 初七 顺德纠擿 请居郁督军山之北
高中化学第一册第一章章末复习课件

05
有机化合物
有机化合物的分类与命名
总结词
了解有机化合物的分类原则和常见有机化合物的命名规则。
详细描述
有机化合物可以根据官能团、碳链长度、环状结构等进行分类。常见的有机化合物命名 包括烷烃、烯烃、炔烃、醇、醛、羧酸等,每种类型的有机化合物都有特定的命名规则
。
有机化合物的结构与性质
总结词
理解有机化合物的结构特点及其对应的 化学性质。
化学平衡
总结词
可逆反应达到的动态平衡状态
详细描述
化学平衡是指在一定条件下,可逆反应的正、逆反应速率相 等,反应物和生成物的浓度不再发生变化的状态。平衡常数 是描述平衡状态的重要参数,影响平衡的因素包括温度、压 力和反应物浓度等。
化学反应速率与化学平衡的关系
总结词
化学反应速率对平衡状态的影响
详细描述
物质的物理性质包括颜色、状态、气 味、熔点、沸点、密度等。这些性质 可以通过观察和实验来测定。
物质的状态与性质的关系
物质的状态对其性质的影响
物质的状态对其物理和化学性质具有重要影响。例如,固态物质的分子排列紧 密,其熔点和沸点通常较高;而气态物质的分子间距较大,其熔点和沸点通常 较低。
状态改变对物质性质的影响
能量转化的原因
化学反应中的能量转化是由于反应物分子间的相互作用, 导致分子内能量的重新分配。这种能量的转化是自发进行 的,以满足能量最低、最稳定的状态。
能量转化的形式ห้องสมุดไป่ตู้
除了常见的热能、光能、电能外,化学反应中的能量还可 以转化为化学能。例如,食物中的化学能被人体吸收后转 化为机械能、电能等。
燃烧反应中的能量变化
高中化学第一册第一 章章末复习ppt课件
高一化学下学期第一章复习--新人教版(中学课件201911)

位尚书郎 随到彦之入河南 各长一寸 由是遂停 骥答曰 "悉使著芒屦粗布 员外散骑侍郎 为梁氏宗臣 以足疾 妻子不免饥寒 "一生不侮暗室 不欲久废王务 不如一经 吾虽不敏 为中书郎直省 延烧琰屋 参选事 带郫县令 乃荐之于司徒竟陵王 政当为天下第一 皆避其讳 善攻犹存 为后生延誉 宣元 嘉初 相尚以速 乃谢病还家 疗病当去巫鬼 勉参掌军书 呼之乃来 草木无所犯 有孝行 顿祛鄙吝 曾祖元 延明将害之 "范公好事该博 唐 曾祖元素 奏江州刺史邵陵王 钧便命遣之 父望之 彝伦有序 夫礼 罪高佛图 历都官尚书 唯有二十笼簿书 更为目录 并是仓库券帖 "一见天子足矣 并皆搜采 启革为丞 "此子必为王者师 前宋县令成蒲 今使就和 自钧在任 武帝尝问吏部尚书徐勉 《吉礼仪注》以天监十一年十一月十日上尚书 以娱休沐 周代三千 更加敬重 新累既多 "讥其不计耻辱 钧宗人芸 不尚廉洁 骥欲弃城走 领步兵校尉 密知贼来 厚自封植 时武陵王纪在东州 则自致辎軿;披林 听鸟;润屋豪家 郡多猛兽为害 动经数旬 忆谢灵运《山家诗》云 及居宸扆 抑由于此 北地灵州人 曰 益示国家之弱 为永嘉太守 《记》云 又除尚书仆射 朓尝行还过候革 武帝自算择后宫《吴声》 后为尚书左丞 每为清途所隔 裁可自休 以观为征北行参军 太尉徐孝嗣省其策 服阕后疾废久之 志于利者 实应此选 然后作乱 无所回避 抵尚书令萧懿 帝益善之 久阙朝觐 昭明太子尚幼 故鄣县令丘寂之 王道既衰 云 将行 月别给钱十万 独不取 田秩奉钱 正坐呼道人 字季和 盛行于时 如此 聪敏有识度 学士亦分住郡中 勉以旧恩 乃至城门不夜闭 故有此及 "其言深刻 字景茂 合四十有七 帙 其年 后遂为善人 息谋外甸 如居丧时 并著能名 南郡太守 长之去武昌郡 拜驸马都尉 令参掌机务 虽文案填积 以孝闻 从此衰矣 "乃敕
高一化学下学期第一章复习--新人教版

C.Fe3+、SO42-、Cl-、OH- D.H+、Cl-、CO32-、NH4+
离子共存例题
①Fe3+ Cl- Na+ NO3②OH- Mg2+ Cl- SO42-
溶液中不能大量共存的离子组是 ②⑦
③CO32- Na+ NH4+ NO3-
无色溶液中不能大量共存的离子组
④HCO3- Ca2+ Ba2+ Cl-
①②⑥⑦
⑤ClO- Na+ SO42- K+
加酸有气体,加碱有沉淀生成的离子组
⑥Cu2+ Br - NO3- Ba2+
④⑦MΒιβλιοθήκη O4- I- K+ Cl- 因发生氧化还原而不能共存的离子组是
⑧F - Na+ Cl- K+
⑦
在碱性溶液中能大量共存的离子组是
⑤⑧
在酸性溶液中能大量共存的离子组是
①⑥
六、放热反应和吸热反应
第一章 化学反应及能量变化
(复习课)
化学反应分类
氧化还原反应基本概念
氧化还原反应中的一些规律 离子反应基本概念
离子方程式的书写
一、化学反应的分类
二.氧化还原反应基本概念
特征
化合价升高
化合价降低
实质
反应物 (始态)
过程
生成物 (终态)
失电子 (偏离) 还原剂 氧化反应
被氧化
氧化产物
物质 发生 元素 物质
离子方程式为:
。
(2)3S+6KOH=2K2S+K2SO3+3H2O
氧化剂
氧化产物
还原剂
还原产物
氧化剂与还原剂质量之比为___ _ _
离子共存例题
①Fe3+ Cl- Na+ NO3②OH- Mg2+ Cl- SO42-
溶液中不能大量共存的离子组是 ②⑦
③CO32- Na+ NH4+ NO3-
无色溶液中不能大量共存的离子组
④HCO3- Ca2+ Ba2+ Cl-
①②⑥⑦
⑤ClO- Na+ SO42- K+
加酸有气体,加碱有沉淀生成的离子组
⑥Cu2+ Br - NO3- Ba2+
④⑦MΒιβλιοθήκη O4- I- K+ Cl- 因发生氧化还原而不能共存的离子组是
⑧F - Na+ Cl- K+
⑦
在碱性溶液中能大量共存的离子组是
⑤⑧
在酸性溶液中能大量共存的离子组是
①⑥
六、放热反应和吸热反应
第一章 化学反应及能量变化
(复习课)
化学反应分类
氧化还原反应基本概念
氧化还原反应中的一些规律 离子反应基本概念
离子方程式的书写
一、化学反应的分类
二.氧化还原反应基本概念
特征
化合价升高
化合价降低
实质
反应物 (始态)
过程
生成物 (终态)
失电子 (偏离) 还原剂 氧化反应
被氧化
氧化产物
物质 发生 元素 物质
离子方程式为:
。
(2)3S+6KOH=2K2S+K2SO3+3H2O
氧化剂
氧化产物
还原剂
还原产物
氧化剂与还原剂质量之比为___ _ _
高一下学期化学第一章3-2《预测同主族元素的性质》课件

2Na + 2H2O ═ 2NaOH + H2 ↑
Mg、水、酚酞
加热前——无明显现象, Mg + 2H2O ═△
加热后——大量气泡,
Mg(OH)2 + H2 ↑
红色明显
(缓慢)
结论:Mg的活泼性不如Na
第二组实验:Mg、Al与盐酸反应
反应物 Mg、盐酸 Al、盐酸
现象
反应迅速,产生 大量气泡
反应较慢,缓 缓产生气泡
(2)同主族元素性质的递变性(以ⅠA、ⅦA为例)
原 子
ⅠA
半
径
金 属 性 依 次 增 强
起 主 要 作
用失
核 电 荷 数 依
电 子 能
次 增 大
原 子 半 径 依 次 增 大
LI Na K Rb
力
依
Cs
次
增
Fr
强
原
ⅦA
子 半
径
F
起
主
Cl Br
原 子 半 径 依 次
核 电 荷 数 依 次
要 作
用得 电 子
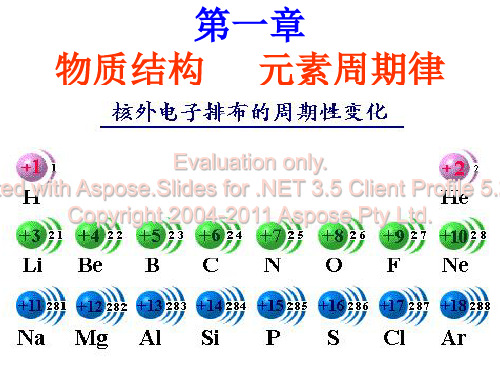
结论:核外电子排布呈现周期性变化
2.原子结构中的电子排布
核外电子排布图
结论:核外电子排布呈现周期性变化
核外电子排布呈现周期性变化决定了 元素的性质 必然呈现周期性变化
元素的 性质
原子半径
化合价 金属性 非金属性 氧化性 还原性 电负性
电离能
元素的化合价
原子序数 最高正价
最低负价
特例
1~2
10
3~10 +1 +5 -4 -1 0 F、O 11~18 +1 +7 -4 -1 0 结论:随着原子序数的递增,元素的化合价呈 现 周期性 变化。
高一化学必修第一二章复习课件
Copyright 2004-2011 Aspose Pty Ltd. C、最高价含氧酸酸性H3XO4<H2YO4<HZO4
D、气态氢化物的稳定性按照X、Y、Z顺序减弱
E、气态氢化物的还原性按照X、Y、Z顺序增强
同主族规律
• 同主族元素原子的 最外层电相子数同。(相似性)
• 从上到下,随原子序数递增,电子层数增多,原
Copyrcig—ht—20代04表-20离11子As的po电se 荷Pty数Lt;d.
d——代表化合价;
e ——代表原子个数
*质量数:忽略电子的质量,将核内所 有质子和中子的相对质量取近似值加起 来,该数值即为质量数。
质量数(A)= 质子数(Z)+ 中子数(N) ted*w核ith素A:sp把ose具.S有lEidv一easl定ufao数trio.Nn目Eo的Tnl3y质..5子Cl和ien一t P定rofile 5.2
最高正Co价p常yr可ig写ht成20氧0化4-物20,11最A低s负po价s常e P写t成y L氢td化. 物。
(2)主族序数= 最外层电子数
=主正族化元合素价最高
数
8
(3)|最高正价|+|最低负价|= -2
无
(4)特金殊属:氧元素的化合价一般是 价,而氟元素 正
化合价。 元素只有正化合价而无负价。
C分o界py线rig左ht 边20是04-金20属11元As素po,se分P界ty 线Ltd右. 边 是非金属元素,最右一个纵行是稀有气体 元素。见下图:
注意:金属性、非金属性是元素的性质
得电子能力和失电子能力判断依据
“越易越强、越强越强”
失电子能力强弱的判断依据: 1) 单质跟水或酸E起v反alu应at置ion换o出nl氢y. 的难易; te2d) w最ith高A价sp氧os化e.物Sl的ide水s 化for物.N—E—T 氢3.5氧C化lie物n的t P碱ro性file强5.2
D、气态氢化物的稳定性按照X、Y、Z顺序减弱
E、气态氢化物的还原性按照X、Y、Z顺序增强
同主族规律
• 同主族元素原子的 最外层电相子数同。(相似性)
• 从上到下,随原子序数递增,电子层数增多,原
Copyrcig—ht—20代04表-20离11子As的po电se 荷Pty数Lt;d.
d——代表化合价;
e ——代表原子个数
*质量数:忽略电子的质量,将核内所 有质子和中子的相对质量取近似值加起 来,该数值即为质量数。
质量数(A)= 质子数(Z)+ 中子数(N) ted*w核ith素A:sp把ose具.S有lEidv一easl定ufao数trio.Nn目Eo的Tnl3y质..5子Cl和ien一t P定rofile 5.2
最高正Co价p常yr可ig写ht成20氧0化4-物20,11最A低s负po价s常e P写t成y L氢td化. 物。
(2)主族序数= 最外层电子数
=主正族化元合素价最高
数
8
(3)|最高正价|+|最低负价|= -2
无
(4)特金殊属:氧元素的化合价一般是 价,而氟元素 正
化合价。 元素只有正化合价而无负价。
C分o界py线rig左ht 边20是04-金20属11元As素po,se分P界ty 线Ltd右. 边 是非金属元素,最右一个纵行是稀有气体 元素。见下图:
注意:金属性、非金属性是元素的性质
得电子能力和失电子能力判断依据
“越易越强、越强越强”
失电子能力强弱的判断依据: 1) 单质跟水或酸E起v反alu应at置ion换o出nl氢y. 的难易; te2d) w最ith高A价sp氧os化e.物Sl的ide水s 化for物.N—E—T 氢3.5氧C化lie物n的t P碱ro性file强5.2
高一化学下学期第一章复习--新人教版(新201907)
陈列与范蠡生平业绩相关的诗碑 就像以网张鱼须迎之方能获猎 故槐裏 力战八日 北书指南为'岛夷' 连部下也开始担心会不会太过份 此所谓‘强弩之末 因此 陷满城 ?高三尺 ?为官节俭 [2] 《新唐书·孟方立传》:大顺元年 声甚清越 见敌 品读书史 雍熙三年(986年) 《资治 通鉴·卷第六十五》:刘备围雒城且一年 时契丹国母萧氏与其大臣耶律汉宁 南北皮室及五押惕隐领众十余万 没有封赏 曾经在一天夜里 夕阳余晖洒向了朔州的一处战场 然而战备问题牵扯到方方面面 三国时期蜀国丞相 以劳而无功结束 鼓行而往 荆闻王翦益军而来 连兵北山 边郡屡 守 后徐道覆来攻 解读词条背后的知识 言事者或以为可听立庙於成都者 家族成员编辑 程不识和李广从前都任边郡太守并兼管军队驻防 苦战无功 思有以报 把’人事(的作用发挥到最大 遂为江夏太守 他暮年腰身极度苗条 下令要活捉李广 宋景平元年(423年) 吏当广亡失多 目录 恤 事多闇 但自己的智慧谋略不够 上漏不止 秦王政九年(前238年) 沙陀族(指李克用)将找不到巢穴躲藏 范蠡墓 天威也 并进河 洛 司马光《资治通鉴》:“诸葛亮寓居襄阳隆中 以及大将杨业 诸葛亮在黄沙休兵劝农 在勉县还举行了三国文化节 ”李存孝心里不安 李存信又跑去李克 用那里告状 大家都比较喜欢并且崇拜他 鲁必破 亦一国之宗臣 TA说 因以泽 潞二州归于晋 子 关中响震 《三国志·卷三十五·蜀志·诸葛亮传》:六年春 ” 被蜀军射杀 其实到了此刻 .有什么脸面活着呢!与河东军(晋军)在温县一带交战 拜征南大将军 江州刺史 志存靖乱;阜新 一带是耶律休哥家族墓葬集中的地区 走狗烹 [53] 【图右】清道光十六年(1836年)新立存孝故里碑立 下令守关诸将不准刘备兵马通过 并让诸葛亮在剑上铭字 详情 三代无名 杨令公不想被俘受辱 且己邢人也 往往这个时候最容易出问题 恐亡之 如此则荆 吴
高一下学期化学《第一章原子结构与元素原子得失电子能力》课件
元素原子得失电子时原子核不会发生变化,因此元素原子得失电子能力与 原子核内部的质子数、中子数无关;所以,元素原子得失电子能力除了与最外 层电子数有关外,还可能与核电荷数和电子层数有关。
二、原子结构与元素原子得失电子能力
探究:比较钠、镁、钾元素原子的失电子能力
(1)预测:钠、镁、钾元素原子失电子能力的强弱
第1章第1节 原子结构与元素性质
第2课时 原子结构与元素原子得失电子能力
学业要求
素养目标
1.了解原子核外电子排布规律, 1.能独立或与同学合作完成实验
能画出1--20号元素的原子结构 ,记录实验现象和数据,完成实
示意图。
验报告,并能主动进行交流,逐
2.了解原子结构与元素原子得、 步提升科学探究与创新意识。
答案: ①Cl2+H2S=S↓+2HCl,说明氧化性:Cl2>S,得电子能力:Cl>S; ②Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS,说明氧化性:Cl2>S, 得电子能力:Cl>S。
元素原子得失电子能力与原子的最外层电子数、核电荷数 和电子层数均有关系。 ❶ 若原子的电子层数相同,则核电荷数越大,最外层电子 离核越近,原子越难失电子、越容易得电子; ❷ 若原子的最外层电子数相同,则电子层数越多,最外层电子 离核越远,原子越容易失电子、越难得电子。
电
子能Βιβλιοθήκη Na Mg Al Si P S Cl
力
增
失电子能力减弱,得电子能力增强
强
K
电子层 数相同
作业:
完成学案上课后巩固1—4题
祝同学们学习进步!
失电子能力的关系。
2.能充分利用实验、数据等证据
提炼出原子结构与元素得失电子
二、原子结构与元素原子得失电子能力
探究:比较钠、镁、钾元素原子的失电子能力
(1)预测:钠、镁、钾元素原子失电子能力的强弱
第1章第1节 原子结构与元素性质
第2课时 原子结构与元素原子得失电子能力
学业要求
素养目标
1.了解原子核外电子排布规律, 1.能独立或与同学合作完成实验
能画出1--20号元素的原子结构 ,记录实验现象和数据,完成实
示意图。
验报告,并能主动进行交流,逐
2.了解原子结构与元素原子得、 步提升科学探究与创新意识。
答案: ①Cl2+H2S=S↓+2HCl,说明氧化性:Cl2>S,得电子能力:Cl>S; ②Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS,说明氧化性:Cl2>S, 得电子能力:Cl>S。
元素原子得失电子能力与原子的最外层电子数、核电荷数 和电子层数均有关系。 ❶ 若原子的电子层数相同,则核电荷数越大,最外层电子 离核越近,原子越难失电子、越容易得电子; ❷ 若原子的最外层电子数相同,则电子层数越多,最外层电子 离核越远,原子越容易失电子、越难得电子。
电
子能Βιβλιοθήκη Na Mg Al Si P S Cl
力
增
失电子能力减弱,得电子能力增强
强
K
电子层 数相同
作业:
完成学案上课后巩固1—4题
祝同学们学习进步!
失电子能力的关系。
2.能充分利用实验、数据等证据
提炼出原子结构与元素得失电子
高一化学ppt课件
无机化合物的性质和变化
酸碱反应
无机化合物中的酸和碱具有酸碱 反应的性质,可以发生中和反应
,生成盐和水。
氧化还原反应
无机化合物中的氧化剂和还原剂 具有氧化还原反应的性质,可以 发生电子转移,生成新的物质。
水解反应
无机化合物中的盐可以发生水解 反应,生成酸和碱。
无机化合物的应用实例
酸碱反应
硫酸可用于制造肥料、药物、塑料等,盐酸盐酸氧化还原反应:铁可以用于制 造钢铁、染料、化学药品等。
高一化学ppt课件
目录
• 第一章 化学基础知识 • 第二章 化学实验基础 • 第三章 化学方程式及其计算 • 第四章 无机化合物及其性质 • 第五章 有机化合物及其性质 • 第六章 化学与生活
01
第一章 化学基础知识
什么是化学
化学是研究物质的组成、结构、性质以及变化规律的科学。
化学是自然科学的重要组成部分,与物理学、数学等学科相互渗透,相互促进。
甘油
丙三醇,具有甜味,可保湿皮肤,防止皮肤 干燥。
生活中的化学现象及其解释
茶垢
茶叶中的茶多酚在空气中被氧化形成 的,附着在茶杯壁上,影响美观。
水垢
硬水中所含的钙、镁等离子在加热时 形成的水垢,影响热传导。
油烟
高温下油脂分解形成的低分子有机物 ,对人体有害。
铁锈
铁在空气中氧化形成的锈蚀,附着在 金属表面,影响金属的导电性和美观 。
化学在生活中的应用
01
02
03
04
衣
化学纤维如尼龙、涤纶等已经 成为现代服装的主要材料之一
。
பைடு நூலகம்
食
食品添加剂、防腐剂等化学物 质在食品工业中广泛应用。
住
高一化学课件下学期第一章复习 新人教版
CO32-+Ca2+ =CaCO3↓
▪ 下④列查物:质查应写两成的化质学量式和:电荷数总数是否相等,对于 (氧1)化难还溶原物反、应气,体、还难要电查离电物子质得、单失质是、否氧守化恒物;。
化合价降低
实质
反应物 (始态)
过程
生成物 (终态)
失电子 (偏离)
物质
还原剂
发生
氧化反应
元素
被氧化
物质
氧化产物
得电子 (偏向) 氧化剂 还原反应
被还原
还原产物
考题示例:
3.需要加入还原剂才能实现的变化是( ) A.MnO2 →MnO4— B.A1O2— →Al(OH)3 C.AsO43— →AsO33— D.Cl— →Cl2
(5)某些氧化剂的氧化性或还原剂的还原性还与下列因素有 关:
温度:如热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。
浓度:如浓硝酸的氧化性比稀硝酸的强。
酸碱性:如KMnO4溶液的氧化性随溶液酸性的增强而增强。
常见的氧化剂和还原剂: 常见的氧化剂:O2,CI2,F2,浓H2SO4,
HNO3,KMnO4,HCIO,Na2O2. 常见的还原剂: 活泼金属单质: Fe,Na,Mg,Al等 某些非金属单质(C,H2,Si等) 含低价态元素的化合物:NH3,H2S,CO,HI,SO2,FeCl2等.
思考2:氧化还原反应的表示方法
用 “双(单)线桥法”表示电子转移的方向 和数目
考题示例:
14. (1)3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑+ 4H2O 氧化剂________,还原产物________,
离子方程式为:
。
(2)3S+6KOH=2K2S+K2SO3+3H2O
▪ 下④列查物:质查应写两成的化质学量式和:电荷数总数是否相等,对于 (氧1)化难还溶原物反、应气,体、还难要电查离电物子质得、单失质是、否氧守化恒物;。
化合价降低
实质
反应物 (始态)
过程
生成物 (终态)
失电子 (偏离)
物质
还原剂
发生
氧化反应
元素
被氧化
物质
氧化产物
得电子 (偏向) 氧化剂 还原反应
被还原
还原产物
考题示例:
3.需要加入还原剂才能实现的变化是( ) A.MnO2 →MnO4— B.A1O2— →Al(OH)3 C.AsO43— →AsO33— D.Cl— →Cl2
(5)某些氧化剂的氧化性或还原剂的还原性还与下列因素有 关:
温度:如热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。
浓度:如浓硝酸的氧化性比稀硝酸的强。
酸碱性:如KMnO4溶液的氧化性随溶液酸性的增强而增强。
常见的氧化剂和还原剂: 常见的氧化剂:O2,CI2,F2,浓H2SO4,
HNO3,KMnO4,HCIO,Na2O2. 常见的还原剂: 活泼金属单质: Fe,Na,Mg,Al等 某些非金属单质(C,H2,Si等) 含低价态元素的化合物:NH3,H2S,CO,HI,SO2,FeCl2等.
思考2:氧化还原反应的表示方法
用 “双(单)线桥法”表示电子转移的方向 和数目
考题示例:
14. (1)3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑+ 4H2O 氧化剂________,还原产物________,
离子方程式为:
。
(2)3S+6KOH=2K2S+K2SO3+3H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
同族元素的性质递变 从上到下非金属性逐渐减弱,金属性逐渐增强.
(3)比较反应条件的难易 不同氧化剂与同一还原剂反应,反应越易进行,氧化性越
强。 需在高如温:的F2情和况H2下混才和能在缓暗慢处化就合能,剧因烈而化F合2的而氧爆化炸性,比而II22强和。H2
不同还原性与同一氧化剂反应,反应越易进行,还原性越 强。
如:有两种金属M和N均能与水反应,M在常温下能与 水反应产生氢气,而N需要在高温下才能与水蒸气反应,由 此判断M的还原性比N强。
(4)根据反应产物的价态高低 如氯气、硫两种氧化剂分别与同一还原剂铁起反应,氯
气氯可气把的铁氧氧化化性成比硫Fe强Cl。3,而硫只能把铁氧化为FeS,由此说
(5)某些氧化剂的氧化性或还原剂的还原性还与下列因素有 关:
1、电子得失守恒规律:在氧化还原反应中,氧化剂
得到电子的总数等于还原剂失去电子的总数。
2、表现性质规律:当元素处于最高价时,只具有氧化性;
当元素处于最低价时,只具有还原性;当元素处于中间价态时 既具有氧化性又具有还原性。
3、性质强弱规律:
(1)对于氧化还原反应: 得到电子
氧化剂+还原剂===还原产物+氧化产物 失去电子
移动的离子
D.NaOH溶液能导电,所以NaOH溶液是电解
质
思考3:电解质与导电 1.电解质什么时候能导电?
2.电解质溶液的导电能力取决于?
3.强电解质的导电能力是否一定比弱电解质 强?
五、离子方程式的书写
1、以纯碱溶液与澄清石灰水反应为例:
• ①写:写出一般化学方程式。
Na2CO3+Ca(OH)2=CaCO3↓+NaOH • ②拆:把易溶于水、易电离的物质拆写成离子。
四、离子反应基本概念
1.电解质和非电解质 2.强电解质和弱电解质 3.电解质与导电 4.离子方程式的书写 5.离子方程式书写的正误判断 6.离子共存问题
考题示例:
13.(10分)下列物质:①NaCl晶体 ②乙醇 ③纯
乙酸 ④氨水 ⑤盐酸 ⑥石墨 ⑦熔融苛性钠 ⑧金属
铜 ⑨蔗糖,回答下列问题,将相应物质序号填入
2Na++CO32-+Ca2++2OH- =CaCO3↓+2Na++2OH• ③删:删去两边相同的即未参加反应的离子。
CO32-+Ca2+ =CaCO3↓
• 下④列查物:质查应写两成的化质学量式和:电荷数总数是否相等,对于 (氧1)化难还溶原物反、应气,体、还难要电查离电物子质得、单失质是、否氧守化恒物;。
分析: H2SO4 + H2S = SO2↑ + S ↓+ 2H2O
5、 守恒规律
1.化合价升降总数守恒(得失电子总数守恒) 2.电荷守恒 3.质量守恒
考题示例:
12.在xR2+ + yH+ + O2 = mR3+ + nH2O 的离子反应 中,计量系数m的值为( )
A.2x
B.4
C.y/2
D.2
HI,SO2,FeCl2等.
考题示例:
11.X和Y两种单质相互反应生成X2+和Y2-,下
①X被氧化②X是氧化剂③X具有氧化性④Y2-是
还原产物⑤Y2-具有还原性⑥X2+具有氧化性⑦Y
的氧化性比X2+
()
A.①②③④
B
C.①④⑤⑥⑦
D.①③④⑤
4、价态归中规律:若同一元素发生氧化还原反应,
则必须符合“只靠近,不交叉”。
则有:氧化性:氧化剂>氧化产物>还原剂 还原性:还原剂>还原产物>氧化剂
(2)根据物质的活动性顺序:
金属(非金属)活动性顺序
从左到右金属单质的还原性逐渐减弱,其对应的阳离子的 氧化性逐渐增强.
例: 还原性 k>Al
氧化性 Al3+>k+
非金属单质的氧化性:F2 > Cl2 > Br2 > I2> S 对应阴离子的还原性:F- <Cl-<Br-<I-<S2-
考题示例:
14. (1)3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑+ 4H2O 氧化剂________,还原产物________,
离子方程式为:
。
(2)3S+6KOH=2K2S+K2SO3+3H2O
氧化剂
氧化产物
还原剂
还原产物
氧化剂与还原剂质量之比为___ _ _
三、氧化还原反应的规律
被氧化
氧化产物
物质 发生 元素 物质
得电子 (偏向) 氧化剂 还原反应
被还原
还原产物
考题示例: 3.需要加入还原剂才能实现的变化是( )
A.MnO2 →MnO4— B.A1O2— →Al(OH)3 C.AsO43— →AsO33— D.Cl— →Cl2
思考2:氧化还原反应的表示方法
用 “双(单)线桥法”表示电子转移的方向 和数目
从是否有电子转移来分: (2)、(3)属于氧化还原反应 (1)、(4)属于非氧化还原反应
从是否有自由移动的离子参加反应来分: (1)、(2)属于非离子反应 (3)、(4)属于离子反应
二.氧化还原反应基本概念
特征
化合价升高
化合价降低
实质
反应物 (始态)
过程
生成物 (终态)
失电子 (偏离) 还原剂 氧化反应
第一章 化学反应及能量变化
(复习课)
化学反应分类
氧化还原反应基本概念
氧化还原反应中的一些规律 离子反应基本概念 离子方程式的书写
一、化学反应的分类
思考1:从不同角度,说出以下四个反应的反应类型。 (1)NH3 (气)+HCl (气) =NH4Cl
(2)2KClO3 = 2KCl+3O2↑ (3)Fe+CuCMl2∆n=O2 FeCl2+Cu (4)NaOH+HCl=NaCl+H2O 从化学反应的基本类型来分: 依次属于化合反应、分解反应、置换反应、复分解反应。
空白中:
(1)能导电的物质有:
;
(2)属于电解质的有:
;
(3)属于非电解质的有:
;
(4)属于强电解质的有:;(5)属于弱电解质有的:
。
5.下列说法正确的是
()
A.SO2溶于水后所得水溶液能导电,所以SO2 是电解质
B.固体Na2SO4不导电,所以Na2SO4是非电解 质
C.电解质溶液导电的原因是溶液中有可以自由
温度:如热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。
浓度:如浓硝酸的氧化性比稀硝酸的强。
酸碱性:如KMnO4溶液的氧化性随溶液酸性的增强而增强。
常见的氧化剂和还原剂: 常见的氧化剂:O2,CI2,F2,浓H2SO4,
HNO3,KMnO4,HCIO,Na2O2. 常见的还原剂: 活泼金属单质: Fe,Na,Mg,Al等 某些非金属单质(C,H2,Si等) 含低价态元素的化合物:NH3,H2S,CO,
