地下水—碘化物的测定—淀粉分光光度法
分光光度法测定盐水中微量碘

分光光度法测定盐水中微量碘黄静静;郭礼波【摘要】用分光光度法测量了盐水中微量碘浓度.通过控制反应时间和酸度,令分析结果稳定准确.【期刊名称】《氯碱工业》【年(卷),期】2016(052)011【总页数】3页(P35-37)【关键词】盐水;碘;分光光度法;测定【作者】黄静静;郭礼波【作者单位】四川大学化工学院,四川成都610064;四川大学化工学院,四川成都610064【正文语种】中文【中图分类】TQ506.6【分析与测试】在离子膜法烧碱生产过程中,为保护离子膜,必须严格控制进电解槽的二次盐水的质量。
这其中碘含量是一个重要的指标。
盐水中的碘离子在电解槽环境中会被氧化成高碘酸根,并与Na+、Ba2+、Ca2+、Mg2+等离子(即使其浓度极低)生成不溶的高碘酸盐化合物,在膜中沉积下来,随着时间的迁移对膜造成不可逆的损害,降低电流效率,最终缩短膜的使用寿命,造成巨大的经济损失。
因此,必须控制I-的质量分数在1×10-6以下。
在相关的国家和行业标准中,尚未规定盐水中I-的测定方法。
本文中研究了采用分光光度法对盐水中微量碘进行测定的具体步骤和条件,通过酸度和反应时间的控制,建立了简便的操作程序,结果稳定可靠。
1.1 方法原理过量溴水使盐水中的I-氧化形成用甲酸钠除去过量的溴,加入过量碘化钾还原生成;析出的单质碘与淀粉形成蓝色吸附物,在一定的条件下其吸光度与盐水中的碘含量成正比。
据此,通过标准曲线方程进行定量计算[1],反应方程式如下:1.2 试剂及材料(1)乙酸钠溶液:pH值为4.6。
(2)磷酸。
(3)甲酸钠溶液:质量浓度为100 g/L。
(3)碘化钾溶液:质量浓度为50 g/L。
(4)饱和溴水:在市售质量分数为3%的溴水中加入少量溴素(可在瓶底见到深色溴素),保存在深色玻璃瓶中。
(5)淀粉指示剂溶液:质量浓度为5 g/L。
(6)碘标准储备溶液:ρ(I-)= 1 mg/mL。
制备方法:将基准碘酸钾置于(110±2)℃的烘箱内干燥2 h至质量恒定,准确称取0.843 2 g,溶解于水后移至500 mL容量瓶中,定容,摇匀。
一种快速检测地下水中碘离子的方法
一种快速检测地下中碘离子的方法
黄威罗明标
(东华理工大学,江西南昌330013)
摘要:本文建立了紫外分光光度法方便快捷的测定地下水中微量碘离子,碘离子浓 度范围于2 -22(JLg/mL时,波长在226nm处,吸光度与浓度呈现出良好的线性关系,相关 系数为0.9991,检出限为1.43 x 10-V^mL,分析方法的相对标准偏差(RSD)在0. 487 ~ 0.976%之间,加标回收率在96. 1 - 103. 6%之间。共存的K\Na\Mg2\Ca2\Cr , SO/-对测定无影响;共存的co32-干扰很大,可加酸除去。因此该方法可用于地下水水 中微量碘离子的测定。
关键词:碘分光光度法
中国有12个省市存在高碘地下水⑴。碘离子是 不可降解的,并且倾向于通过食物链积聚在人和动物
的甲状腺中。长期饮用高碘水(>150!xg/mL)将对人 体造成危害。碘的测定方法有光度法、容量法、电化学 法、高效液相色谱法、离子色谱法等多种⑷,在微量碘 的测定方法中,应用最广的是光度法中的碘-淀粉法。 碘-淀粉法操作十分繁琐,需将「氧化成io3 -后再加 入I'还原成12,再加入可溶性淀粉做显色剂⑶。电化 学、滴定法灵敏度较低。离子色谱法方便简洁快速,灵 敏度高但测试费用昂贵,不利于多样品分析测试⑷O 因此,方便快捷廉价的测定地下水中的碘含量具有重 要意义。
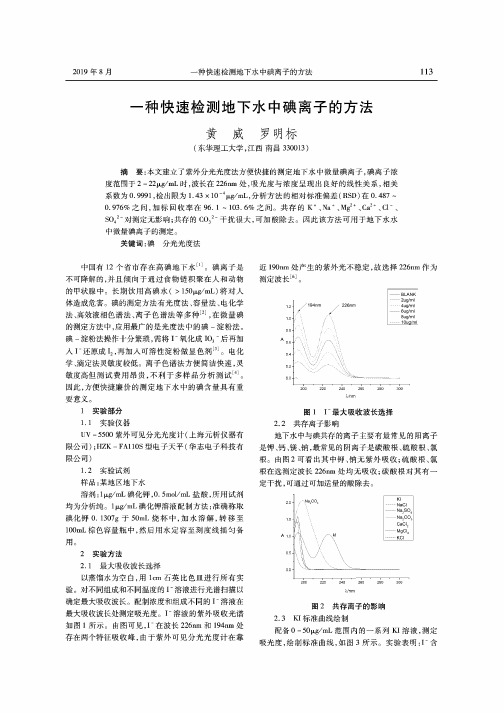
3.2回收率实验 回收率实验是在测定试样某组分含量的基础上, 加入已知量(标准样值)的该组分。再次测定其组分含 量。由回收率实验所得数据可以计算出回收率⑸。取
地下水过滤后稀释一定倍数,在226nm处测定吸光度。 表2紫外分光光度法测定碘离子加标回收率
样品
测量值 (|xg/mL)
平均值 (|Xg/mL)
水质碘化物的测定分光光度法

水质碘化物的测定分光光度法
碘化物是水中溶解的碘元素,是污染水体的重要指标,碘化物的浓度超标会影响水体的生态环境,因此碘化物的测定是评价水质的一个重要指标。
碘化物的测定主要通过分光光度法。
分光光度法是将溶液中的碘化物吸收到一定量的紫外光中,根据吸收光谱的不同波长的紫外线,测量其有效吸收率确定碘化物含量,进而推算出碘化物的浓度。
首先,选择溶液样本,将样品加入分光光度仪中,调节分光光度仪的参数,对样品进行分光光度测量。
将样品的吸收光谱的不同波长的吸收率和标准曲线进行比较,确定碘化物在样品中的浓度。
其次,在分光光度测量中,应注意样品的准备,样品的准备应该符合分光光度仪的要求,如果样品太稀或太浓,则可能会影响测量结果的准确性。
此外,在使用分光光度仪测量碘化物时,应尽量选择具备良好的稳定性和可靠性的仪器。
如果仪器的稳定性和可靠性不足,则可能会对测量结果产生较大的影响。
最后,应注意校正分光光度仪的参数,分光光度仪的参数在使用前应进行校正,以确保测量结果的准确性。
总之,碘化物的测定主要通过分光光度法,在进行分光光度测量时,需要注意仪器的稳定性和可靠性,样品的准备,以及校正分光光度仪的参数,这样才能得出准确的测量结果,做出相应的污染防治措施。
催化分光光度法测定地下水中痕量碘

催化分光光度法测定地下水中痕量碘[摘要]:在酸性介质中,碘离子与4.4-四甲基二氨基苯甲烷(四碱)和氯胺T氧化反应中的催化作用,生成有色的络和物,以有色络和物的最大吸收值计算结果。
本法最低检测浓度为0.1μg/L,0.08μg标准溶液相对标准偏差1.78%,样品的加标回收率为96.2%-105%。
本方法操作简单快速,检出限低,灵敏度高,精密度和准确度好。
[关键词]:催化分光光度法;地下水;碘目前,测定碘的方法很多,有催化还原分光光度法,但分析方法不易掌握,淀粉比色法,在方法检出限和精密度等方面,不能满足痕碘量的分析要求。
地下水中碘的含量一般很微,该法具有操作简单快速,检出限低,灵敏度高,经过对珠江三角洲地下水污染调查和广州城市地质调查地下水测试近千个水样的检测结果证明,分析结果稳定,值得推广应用。
1.实验部分1.1仪器S22pc型分光度计(上海棱光技术有限公司)1.2主要试剂1.2.1碘标准溶液称取105℃烘干1h的KI(高纯试剂)0.0131g于250mL烧杯中,加水溶解后,移入1000mL容量瓶中,用水稀释至刻度,摇匀。
此溶液含碘10μg/mL。
分取上述溶液10mL于100mL容量瓶,用水稀释至刻度,摇匀。
此溶液含碘1.0μg/mL。
分取上述溶液10mL于100mL容量瓶,用水稀释至刻度,摇匀。
此溶液含碘0.1μg/mL。
用时配制。
1.2.2碳酸钠溶液36g/L称取36g无水碳酸钠于250mL烧杯中,加水溶解后,稀释至1000mL,混匀,置塑料瓶中保存。
1.2.3醋酸溶液8%80mL冰醋酸w(HAc)=99.9%,用水稀释至1000mL混匀。
1.2.44.4-四甲基二氨基苯甲烷(四碱)溶液0.1g/L称取0.1g四碱于250mL烧杯中,加1mL冰醋酸,完全溶解后,用水稀释至1000mL,若溶液混浊需过滤后使用。
1.2.5氯胺T溶液1.0g/L称取0.2g 氯胺T于200mL烧杯中,加水溶解后,用水稀释至200mL,装入棕色磨口塞的玻璃瓶中,摇匀。
分光光度计 总淀粉测定方法

分光光度计总淀粉测定方法
分光光度计在总淀粉的测定中起到了关键作用。
以下是基于分光光度计的总淀粉测定方法:
原理:淀粉颗粒与碘反应可生成深蓝色的络合物,在波长660nm 处具有最大光吸收峰。
根据生成络合物颜色的深浅,用分光光度计测定吸光度值,对照标准曲线,可以计算出淀粉的含量。
材料:马铃薯、香蕉、苹果、葡萄等。
仪器及试剂:
仪器:刻度试管(25mL)、电子天平、容量瓶(100mL)、漏斗、滤纸、试管、电炉、刻度吸管(或移液器)、水浴锅、分光光度计、记号笔。
试剂:0.5%碘液。
步骤:
取不少于20g去壳种子磨粉,磨至95%的粉样通过0.25mm筛。
称取1g粉样,精确到1mg,放入20ml刻度试管中。
加入5ml 0.33mol/L盐酸溶液,振荡混匀后,继续加入5ml
0.33mol/L盐酸溶液。
将试管置于沸水中煮沸10min。
取出冷却后,加入0.5ml 30%(m/V)硫酸锌溶液,振荡混匀,释出蛋白质。
加入0.5ml15%(w/v)亚铁氰化钾溶液,振荡混匀(如有泡沫加几滴95%乙醇)。
定容至20ml刻度处,摇匀后过滤。
在20~25℃环境中,用空白液调整旋光仪的零点,测定样品液的旋光度。
注意事项:
盐酸的浓度必须控制在0.31~0.33mol/L内。
蛋白质含量高的作物应适当增加硫酸锌溶液的用量。
淀粉的比旋度因不同作物略有差异。
结果计算:通过分光光度计测得吸光度值后,可以对照标准曲线计算出淀粉的含量。
请注意,此方法仅供参考,具体操作请根据实际情况和实验室条件进行调整。
实验九 分光光度法测定海带中碘含量

实验九分光光度法测定海带中碘含量本实验采用分光光度法测定海带中碘含量。
利用碘对淀粉溶液的显色反应,在一定波长下测定淀粉-碘复合物的吸光度,计算海带中碘的含量。
实验原理:1.分光光度法分光光度法是一种测量物质含量(浓度)的方法,它通过测量吸收或透过样品之后光线的变化来得到样品中特定物质含量的信息。
分光光度法的基本关系式是比尔定律,即:A=εbc,其中,A为吸光度,ε为摩尔吸光系数,b为光程,c为浓度。
2.碘对淀粉的显色反应淀粉对碘有极强的亲合力,碘加入淀粉溶液后,可以形成淀粉-碘复合物,导致溶液变为深蓝色或蓝紫色。
淀粉-碘复合物在一定波长下有吸收特性,可以应用于分光光度法测定碘的含量。
实验步骤:1.制备标准曲线(1)准备5个量筒,分别注入0.0 mL、0.2 mL、0.4 mL、0.6 mL、0.8 mL 10-3 mol/L 碘酸钾溶液。
(2)将每个量筒逐个加入去离子水至10 mL,搅拌均匀。
(4)在吸收波长610 nm下测定各个比色皿的吸光度。
(5)根据标准曲线计算样品中碘的含量。
2.测定样品(1)取少量海带,粉碎均匀。
(2)称取0.5 g 海带粉末,加入烧杯中,加入50 mL 1% 碳酸钠溶液,搅拌均匀。
(3)置于热板上煮沸,加热30 min,待凉。
(4)从烧杯中取出1 mL 溶液,加入试管中,加入1 mL 10% 硫酸,用急促手振法煮沸15 s,待凉。
(5)加入20 mL 去离子水,转移于100 mL 容量瓶中,用去离子水补足容量。
(6)取2 mL 溶液,加入比色皿中。
(7)按上述方法测定其吸光度,计算海带中碘的含量。
实验记录:测定碘酸钾溶液的吸光度,记录如下表:|稀释倍数|试剂量(mL)|比色皿体积(mL)|吸光度(D.O.)||-|-|-|-||0|0.0|2.0|0||1|0.2|2.0|0.236||2|0.4|2.0|0.472||3|0.6|2.0|0.711||4|0.8|2.0|0.942|利用上表制作标准曲线,计算出样品海带中碘的含量,结果如下表:海带溶液中的碘含量=样品吸光度×系数其中系数为:每1 mL 浓度为6.32 μg/mL 碘的标准溶液对应的吸光度为0.236。
地下水和土壤中不同形态碘的分离测定
2009年8月A ugust 2009岩 矿 测 试ROCK AND M I N ERA L ANALY SIS V o.l 28,N o .4337~341收稿日期:2009 01 20;修订日期:2009 05 03基金项目:国土资源地质大调查 中国农业生态地球化学评价体系研究与成果集成项目资助(1212010610918)作者简介:李洪伟(1982),男,山东夏津人,硕士研究生,应用化学专业。
E m ai:l bjl h w 2007@ 。
通讯作者:刘晓端(1951),女,北京市人,研究员,主要从事环境地球化学研究。
E m a i :l liux iaoduan @si na .com 。
文章编号:02545357(2009)04033705地下水和土壤中不同形态碘的分离测定李洪伟1,刘晓端2*,李保山1(1.北京化工大学化工资源有效利用国家重点实验室,北京 100029;2.国家地质实验测试中心,北京 100037)摘要:实验选用717强碱型阴离子树脂吸附溶液中的碘离子和碘酸根,用30g /L 氯化钠溶液和2.0mo l/L 硝酸钠溶液先后从树脂上洗脱碘酸根和碘离子,达到不同形态碘分离的目的。
洗脱液用碘-淀粉比色法测定碘的含量。
方法已用于我国高碘地区地下水和土壤样品中不同形态碘的分析。
关键词:碘形态;717强碱型阴离子树脂;碘-淀粉比色法;地下水;土壤中图分类号:O613.44;O657.75文献标识码:ASeparation and Deter m i nation of D iffere nt Iodi ne Species in Groundwater and Soil Sa mplesLIH ong w ei 1,LIU X iao duan 2*,LI B ao shan1(1.Stat e Key Labor at o ry of Che m i c al Resource Engi n eeri n g ,Beiji n g Uni v ersity ofC hem i c alTechnol o gy ,Beiji n g 100029,Chi n a ;2.Nati o nal Resear ch Center for Geoanal y sis ,Beiji n g 100037,C hi n a)Abst ract :I n this study ,iod i d e and iodate in sa m p les w ere adso r bed i n exchange co l u m n conta i n i n g 717strong base an i o n exchange resin .Then iodate and iod i d e are effective ly eluted by 30g /L sod i u m chloride so l u tion and 2.0m o l/L sodium nitrate solution and collected separate l y .Iodi d e and iodate in the eluates are then deter m i n ed w it h i o dine starch co l o ri m etr y .The m ethod provides the advantages of h i g h precisi o n ,si m p le operation and has been app li e d to the de ter m inati o n o f different i o dine species in g r oundw ater and soil sa m ples fro m h i g h iod i n e areas i n Ch i n a .K ey w ords :i o di n e speciation ;717str ong base an i o n exchange resin ;iod i n e starch co l o ri m etry ;ground w ater ;so il 碘是具有重要生物效应的微量元素之一,与人体健康息息相关。
东营市地下水碘化物的空间分布特征及影响分析
东营市地下水碘化物的空间分布特征及影响分析韩术鑫;张冲;栾玲玉;王利红;赵长盛;李剑【摘要】为研究东营市地下水碘化物的空间分布特征以及对环境和饮用水安全的影响,对域内的山前平原区和黄泛平原区分别布设了48个和47个调查点位.结果表明:东营市地下水碘化物质量浓度均值达到(0.247±0.263) mg/L,其环境质量呈现由南向北逐步恶化的变化趋势,超过90%的国土面积处于地下水环境质量标准Ⅳ类.山前平原区南部是东营市唯一具备可饮用地下水的区域,域内以适碘地区为主,缺碘地区和高碘地区分别位于区域东南部和第二次海侵古海岸线附近.总体上,可饮用地下水处于中等缺碘水平,海(成)水入侵已成为影响可饮用地下水适碘地区范围的关键因素,需引起高度关注.地下水所处的环境地质概况、海(成)水入侵和大气降水是影响碘化物空间分布的重要因素.【期刊名称】《中国环境监测》【年(卷),期】2018(034)005【总页数】7页(P68-74)【关键词】碘化物;地下水;空间分布;影响分析【作者】韩术鑫;张冲;栾玲玉;王利红;赵长盛;李剑【作者单位】山东省分析测试中心,山东济南250014;山东省分析测试中心,山东济南250014;山东省分析测试中心,山东济南250014;山东省分析测试中心,山东济南250014;山东省分析测试中心,山东济南250014;山东省分析测试中心,山东济南250014【正文语种】中文【中图分类】X832;R123碘是一种人体所需的重要微量元素,通过参与甲状腺激素的合成,调节新陈代谢及生长发育过程。
研究发现,碘的缺乏或过量均对机体的正常代谢产生负面效应,因此如何科学合理地摄取碘是当前亟待解决的关键问题[1-2]。
除了食物,饮水是日常生活中人们获取碘的重要途径,世界卫生组织推荐的成人每日饮用水适碘量为80~150 μg/L[3]。
我国很多地区取地下水作为饮用水,但地下水碘含量分布极不均匀,山区或丘陵地区缺碘严重,而华北和华中等地的黄泛平原区、山西晋中盆地和大同盆地等区域存在成片状的高碘地下水[4-5]。
分光光度法测定纸品中淀粉含量
分光光度法测定纸品中淀粉含量徐嵘;谢堂堂;陈桂强;章雅玲;周振宇【摘要】A spectrupholometric method was established to determine the content of starch in paper. Starch was extracted by hot water, then the extract was reacted with iodine to form a blue-green colored complex, the absorbance of solution was measured at peak value of wavelength. This method has a good precision and rather high recovery.The detection limil is 0. 02% .%对纸品(含淀粉)进行热水抽提,利用淀粉遇到碘生成蓝色络合物的特性,测定其在最大吸收波长处的吸光度,从而建立了一种快速测定纸品中淀粉含量的方法.该方法精密度好,工作曲线相关性好,检出限0.02%.【期刊名称】《中国造纸》【年(卷),期】2012(031)002【总页数】4页(P19-22)【关键词】纸品;淀粉含量测定;分光光度法【作者】徐嵘;谢堂堂;陈桂强;章雅玲;周振宇【作者单位】深圳出入境检验检疫局,广东深圳,518045;深圳出入境检验检疫局,广东深圳,518045;深圳出入境检验检疫局,广东深圳,518045;深圳出入境检验检疫局,广东深圳,518045;浙江凯恩特种材料股份有限公司,浙江遂昌,323300【正文语种】中文【中图分类】TS77淀粉作为助剂被广泛应用到造纸工业中,湿部添加用于提高填料、细小纤维的留着和改善纸的干强度;表面施胶、颜料涂布和加工纸中用于增稠和黏合作用[1]。
由于阳离子淀粉价格便宜,使用方便,因此,各类改性淀粉的研制及应用,尤其是作为纸张增强剂的应用,引起了国内外的普遍关注。
农业地质样品中碘的分析方法
农业地质样品中碘的分析方法吴俊;张明杰;李剑超【摘要】综述了容量法、分光光度法、电感耦合等离子体质谱法(ICP-MS)、离子色谱法(IC)、离子选择电极法(ISE)、X-射线荧光光谱法(XRF)、中子活化分析(NAA)等不同的碘测定方法,并展望了该分析测试领域的前景.%We discussed various strategies for analysis of iodine,such as volumetricmethod,spectrophotometry,inductively coupled plasma mass spectrometry(ICP-MS),ion chromatography(IC),ion selective electrode method(ISE),X-ray fluorescence spectrometry(XRF),neutron activation analysis (NAA),and so on.Furthermore,the promising development of the detection of iodine was demonstrated.【期刊名称】《安徽农业科学》【年(卷),期】2017(045)020【总页数】7页(P20-26)【关键词】碘;分光光度法;电感耦合等离子体质谱法;电化学分析法;色谱分析法【作者】吴俊;张明杰;李剑超【作者单位】湖北省地质实验测试中心,湖北武汉 430034;湖北省地质实验测试中心,湖北武汉 430034;湖北省地质局第六地质大队,湖北孝感 432100【正文语种】中文【中图分类】S159.2碘对人来说,作用很重要,一旦人体碘量不足,就会发生一系列的病态,也就是所谓的“碘缺乏病”。
然而,过量的碘也会导致危害,可使隐性甲状腺免疫疾病转变为显性疾病,长期碘过量摄取,也会导致严重的疾病。
因此,找到合适的方法,确定农业或地质样品中碘的含量范围,至关重要。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
FHZDZDXS0072 地下水碘化物的测定淀粉分光光度法
F-HZ-DZ-DXS-0072
地下水—碘化物的测定—淀粉分光光度法
1 范围
本方法适用于地下水中碘离子的测定。
最小检测量为0.5μg,若取20mL水样测定,最低检测浓度为2.5μg /L。
测定范围:25μg/ L~500μg /L。
2 原理
在磷酸介质中,加入溴水可以将溶液中存在的碘离子定量地氧化为碘酸根离子。
反应生成的碘酸根离子与碘化钾作用生成碘,碘再与淀粉作用生成蓝色化合物,借以进行比色或光度测定。
过量的溴用甲酸钠破坏。
过剩的甲酸钠,在酸性介质中经煮沸可以除去。
3 试剂
除非另有说明,本方法所用试剂均为分析纯,水为二次去离子水。
3.1 饱和溴水:在少量蒸馏水中滴加液态溴(Br2),直到溶液上层出现橙色溴的蒸气,于磨口瓶中保存(用时现配)。
3.2 磷酸溶液(1+2)。
3.3 甲酸钠溶液(HCOONa,200g/L)。
3.4 碘化钾溶液(KI,10g/L)。
3.6 碘离子标准溶液
3.6.1 碘离子标准贮备溶液,0.20 mg/mL:称取0.2616g碘化钾(KI,99.99%)溶于少量蒸馏水中,移入1000mL容量瓶中,用蒸馏水稀释至刻度,摇匀。
此溶液1.00mL含0.20mg碘离子。
3.6.2 碘离子标准溶液,1.00μg /mL:吸取5.00mL碘离子标准贮备溶液(0.20mg/mL)于1000mL 容量瓶中,用蒸馏水中稀释至刻度,摇匀。
此溶液1.00mL含1.00μg碘离子。
3.7 淀粉溶液(5g/L):称取0.5g可溶性淀粉,加100mL蒸馏水,加热搅拌,直至溶液清亮透明。
4 仪器设备
分光光度计。
5 试样制备
5.1 取澄清原水样进行测定。
试样量20mL。
6 操作步骤
6.1 水样分析
取20.0mL水样于100mL烧杯中,加入6滴磷酸溶液(1+2),加10滴饱和溴水,放在电热板上,加热至恰沸腾时取下,趁热加入10滴甲酸钠溶液(200g/L),搅拌,此时溶液中溴的颜色应完全褪去。
再将溶液沸腾以破坏过剩的甲酸钠。
取下烧杯,放入冷水槽中冷却。
将溶液
移入25mL 比色管中,用蒸馏水稀释至刻度。
向比色管中加入1.0mL 碘化钾溶液(10g/L ),加1.0mL 淀粉溶液(5g/L ),盖塞,摇匀。
放置5min 后比色。
或于分光光度计上于波长570nm 处,以试剂空白作参比,用3cm 吸收皿,测量其吸光度。
取20.0mL 蒸馏水代替水样,按水样分析操作步骤6.1进行。
6.3 标准曲线的绘制
移取0、0.50、1.00、2.00、4.00、6.00、8.00、10.0μg 碘离子标准溶液于一系列100mL 烧杯中,加蒸馏水稀释至20mL ,以下按水样分析操作步骤6.1进行。
以碘离子质量为横坐标,吸光度值为纵坐标,绘制标准曲线。
7 结果计算
7.1 按公式(1)计算水样中碘离子的含量
−I ρ=V
m m 0−…………………………(1) 式(1)中:
−
I ρ——水样中碘离子的质量浓度,mg/L; m ——从标准曲线上查得的试样溶液中碘离子质量,μg ;
m 0——从标准曲线上查得的空白溶液中的碘离子的质量,μg ;
W ——取水样体积,mL 。
8 精密度和准确度
同一实验室,10次测定含0.1mg/L 碘的地下水,其相对标准偏差为2.79%。
在该水样中加入1.0μg 碘标准溶液,回收率为95%~98%。
9 参考文献
[1] 中华人民共和国地质矿产行业标准.DZ/T0064.56-93,地下水质检验方法.淀粉比色法测定
碘化物[S].北京:中国标准出版社.1996,160-161.
[2] 岩石矿物分析编写小组.岩石矿物分析.第二版[M].北京:地质出版社.1974,887.
[3] 地下水标准检验方法[J].地质实验室.1988,4(增刊):121-122.。
