第四章 热力学基本关系式及应用
第四章 热力学基本关系式及应用.

第四章 热力学函数之间的关系及其应用
4.1几个函数的定义式 4.2函数间关系的图示式
4.4对应系数关系式 4.5Maxwell关系式 4.6热力学关系式的记忆
4.7热力学关系式的应用
4.3Gibbs公式
4.3.1 Gibbs基本公式 4.3.2 偏摩尔量 4.3.3 化学势 4.3.4 广义Gibbs公式 4.3.5 化学势统一判据 4.3.6 一级相变与二级相变
22
4.3.2 偏摩尔量
3、定义式关系
多组分可变体系中的热力学公式与组成恒定的体系具有完全相同
的形式,所不同的只是用容量性质的偏摩尔量代替相应的摩尔量而已。
H B U B pVB
FB U B TS B
GB B H B TSB U B pVB TSB FB pVB dUB TdSB pdVB
16
4.3.2 偏摩尔量
(5)一般情况ZB≠Z*m,B,但纯物质的偏摩尔量就是其摩 尔量,即Z*B=Z*m,B; (6)在极稀溶液中:ZA≈Zm,*A
(7)偏摩尔量可正、可负。如向稀的硫酸镁水溶液中
继续加入硫酸镁时,溶液体积缩小,此时硫酸镁的 偏摩尔体积为负值。 (8)偏摩尔量是1molB对整体热力学性质的贡献量, 而不应该理解为它在混合体系中所具有的量。
8
dG SdT Vdp
推导:
G H TS dG dH TdS SdT
dH TdS Vdp
所以,
dG SdT Vdp
4.3.1 Gibbs公式-基本公式
吉布斯基本公式:
9
(1)dU TdS pdV (2)dH TdS Vdp
吉布斯基本公式的适用条件:
热力学函数的基本关系式

dU = TdS- pdV
(1-108)
dH = TdS + Vdp
(1-109)
dA = -SdT- pdV
(1-110)
dG = -SdT + Vdp
(1-111)
式(1-108),(1-109),(1-110),(1-111)称为热力学基本方程
dU = TdS- pdV dH = TdS + Vdp dA = -SdT- pdV dG = -SdT + Vdp
常用的是式(1-120)及式(1-121),这两等式右边的变化率是可以由 实验直接测定的,而左边则不能。可用等式右边的变化率代替左
4.热力学状态方程
由dU=TdS-pdV
定温下, dUT=TdST-pdVT
等式两边除以dVT 即
dUT T dST p
dVT
dVT
由麦克斯韦方程 于是
U T S p V T V T S p V T T V
式(1-116)及 (1-117)叫吉布斯 - 亥姆霍茨方程。
(1-117)
G-H方程常用的形式为:
即
(G / T )
T p
H T2
加△
(1-116)
Gibbs自由能随压力的变化
因
(эG/эP)T,n=V
(э△G/эP)T,n=△V 此即G---V关系式
只要知道△V--p关系式,在定温下P1的△G1就可求算出P2的△G2。
在定压下从T1到 T2积分得: (△G)2/ T2- (△G)1/ T1=- =∫T1 T2 △H/T2dT 若知△H--T关系以及T1时的△G1就可求算T2时的△G2 而: △H= △H T0+∫ T0 T △CpdT △H T0是T0时的焓变。
热力学函数基本关系式

V S ( ) p d p T
S V d p
p
从状态方程求得 ,V 与 p 的关系,就可求 ( S )T 或 S 。
上一内容
下一内容 回主目录 返回
2018/11/23
Maxwell 关系式的应用
物化课件
例如,对理想气体
pV nRT,
( S p )T
常用的特征变量为:
G(T , p)
U (S,V )
上一内容
下一内容
A(T ,V ) H (S, p)
回主目录
S(H, p)
返回
2018/11/23
特性函数
物化课件
例如,从特性函数G及其特征变量T,p,求H,U, A,S等函数的表达式。 G(T , p) dG SdT Vdp G 导出: V ( G ) T S ( ) p p T
V =C p dT [V T ( ) p ]dp T
V H C p dT [V T ( ) p ]dp T
知道气体状态方程,求出( V ) p 值,就可计算 H值。
T
上一内容
下一内容 回主目录 返回
2018/11/23
Maxwell 关系式的应用
等温对p求偏微分 ( H )T T ( S )T V
( S )T 不易测定,据Maxwell关系式 p
(
所以
H V ( )T V T ( ) p p T
只要知道气体的状态方程,就可求得 ( H )T p 值,即等温时焓随压力的变化值。
上一内容
下一内容 回主目录 返回
dA SdT pdV
(
(4) dG SdT Vdp
利用该关系式可将实验可测偏微商来代替那些不易直 接测定的偏微商。
热力学基础中的热力学关系与偏导数

热力学基础中的热力学关系与偏导数热力学是研究能量转化和能量传递规律的一门学科,它是理解和描述自然界中许多现象和过程的基础。
在热力学中,我们经常面对各种热力学关系和偏导数的计算,这些关系和计算方法对于热力学分析和应用具有重要意义。
一、热力学基本关系式在热力学中,存在着几个基本的热力学关系式,它们是从热力学基本定律出发推导得到的。
这些关系式包括了内能、焓、熵、体积和温度之间的关系。
1. 内能和焓的关系:根据热力学基本定律,系统的内能变化等于传递给系统的热量与系统对外界做功之和。
即ΔU = Q - W。
通过对焓的定义H = U + PV,可以得到焓的变化与系统的热量和外界做功之间的关系,即ΔH = Q。
2. 熵和热量的关系:根据热力学第二定律,任何孤立系统的熵都不会减少。
对于可逆过程,熵的变化等于传递给系统的热量除以系统的温度,即ΔS = Q/T。
这个关系式揭示了熵与热量和温度之间的关系。
3. 温度和焓的关系:根据热力学基本定律和热容的定义,对于恒容过程,热容Cv等于系统的内能对温度的偏导数,即Cv = (∂U/∂T)v。
对于恒压过程,热容Cp等于焓对温度的偏导数,即Cp = (∂H/∂T)p。
这两个关系式揭示了温度与内能和焓之间的关系。
二、热力学关系的应用热力学关系的应用范围广泛,涉及到能量转化、功的计算、热力学循环等方面。
1. 热力学循环:热力学循环是指在各种设备和系统中完成能量转化的循环过程。
通过运用热力学关系,我们可以计算热力学循环中的功、热量和效率等参数,从而优化系统设计和提高能源利用效率。
2. 非平衡态热力学:非平衡态热力学是研究热力学系统远离平衡态时的行为和规律的分支学科。
通过热力学关系的应用,我们可以对非平衡态过程进行定量的描述和分析,揭示系统的演化路径和性质。
三、热力学关系的计算方法对于热力学关系的计算,我们经常使用偏导数来描述系统的性质和变化。
偏导数是多元函数在某一点上对某个变量的变化率。
热力学函数间的关系

计算结果说明,在给定条件下,298K时,合成氨反应可 以进行;而在1000K时,反应不能自发进行
再见!
H
U
TS
G
TS F
H U pV pV U H pV
G H TS F pV pV F U TS G pV
T1
T
T2 T1
H T2
dT
(1) 若温度变化范围不大,△H可近似为不随温度变化的常数
G T
T 2
G T
T 1
H
1 T2
1 T1
四、G与温度的关系—吉布斯-亥姆霍兹公式
25℃,反应 2SO3(g) 2SO2(g) O2(g)
rGm (298K) 1.400 10 5 J mol1 r Hm 1.966 105 J mol1
H T2
吉布斯-亥姆赫兹公式
G T
T
H T2
P
四、G与温度的关系—吉布斯-亥姆霍兹公式
吉布斯-亥姆赫兹方程式
Байду номын сангаас
G T
T
H T2
P
(微分形式)
应用:在等压下若已知反应在T1的rGm(T1),则可求得该反 应在T2时的rGm(T2)。
积分形式
T2 d ( G )
M 和N也是 x,y 的函数
二阶导数
M
2Z
( y )x xy ,
N
2Z
( x )y xy
所以
M N ( y )x ( x )y
三、Maxwell 关系式
热力学函数是状态函数,数学上具有全微分性质,将上述
关系式用到四个基本公式中, 就得到Maxwell关系式:
6.热力学基本关系式
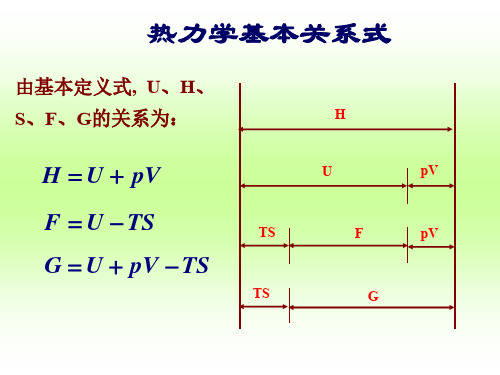
G U pV TS
dG S dT V d p
U、H、F、G这些热力学函数之间的关系实质是勒让德变换 勒让德变换实际上是在我们得到了一个不变量后,要得到它的对偶自变量下的 不变量的一个重要的变换。
热力学四个基本关系式(Gibbs关系式)如下:
d U T d S p dV
S p V T T V
(1)
U p V T T p T V
得证
几个重要的偏导关系式
1.与S有关的
S p V T T V
S V T p p T
d H T d S V d p
(1)
(2) (3)
d F S d T p dV dG S dT V d p
(4)
条件: 简单封闭系统,只作体积功。
• 基本关系式实质上是 U 、 H 、 F 和 G 的数学全 微分展开式。 • 简单的封闭系统, 状态只需两个独立变量即可 决定, 这两个变量可以任意选取. • 从四个关系式的微分变量可知, 对不同的状态 函数, 在作全微分展开时, 选取的独立变量是 不一样的:
例: 试证明:
U p V T T p T V
解:有基本热力学关系式
d U T d S p dV
在等温条件下,求内能对体积的偏微商:
U S V T V p T T
由麦克斯韦关系式: 代入(1)式得:
Wf 0
Qr T d S
将上式代入内能的全微分:
W p dV
d U T d S p dV
(1)
热力学函数的基本关系式

⑵等温等压相变△G 对于等温等压的可逆相变,直接可得(△G)T,P=0.对于非等温 等压的非可逆相变或同温同压下两个相态的△G,可以通过设计可 逆过程进行计算,也可根据G---P关系公式求算。
1.8 热力学函数的基本关系式
H
U、H、S、A、G 、 p、V、T H =U+pV,A =U-TS,G =H-TS 1. 热力学基本方程
U
pV
TS A pV
TS
G
δWr ′=0时,则δWr=-pdV,于是
一微小可逆过程
dU=δQr+δWr,
dS δ Qr T
δWr ′ =0时,则δWr=-pdV,于是
=8586Jmol-1 故△G= △G1+ △G2 + △G3=8584Jmol-1 依Gibbs自由能减少原理,298K,1atm水不能经等温等压过程转变 为同温 同压的水蒸气,但其逆过程则是可以的。因此在298K, 1atm下液态水是稳定态。
⒊应用Gibbs--helmholtz方程求△G 将 G--H方程:{э(△G/T)/эT}P=- △H/T2
△S=0,△T=0,△H=0,
△G=0
⑵理气在等温等压的Gibbs自由能改变 △G = △H-T △S (△H=0) △S=-R∑nilnXi △G= RT∑nilnXi 其中ni为组分i的量,Xi为理想混合气中
为组分I的摩尔数。
⒌非等温等压两态的△G 若体系的两态温度,压力都不相等,根据G的定义:
化工热力学第四章

St ,Vt ,ni
dni
0
H t ni
St , p,ni
U t ni
St ,Vt ,ni
❖ 2)意义: ❖ 化学势体现了不同条件下热力学性
质随构成旳变化,可用以描述相平衡。
❖ §4-3 相平衡准则及相律
❖ 1 相平衡准则 相平衡准则能够由均相敞开系统旳 热力学关系来推导。
V RT p
ay12 by22 2cy1 y2
dV dy1 2ay1 2by2 2cy1 2cy2
dV V 1 V (1 y1 ) dy1
RT p
ay12 by22 2cy1 y2
(1 y1 )(2ay1 2by2 2cy1 2cy2 )
RT p
a( y12
dni dni( ) dni( ) 0 dni( ) dni( ) (i 1, 2, , N )
dUt T ( )dSt( ) T ( )dSt( )
p( )dVt( ) p( )dVt( )
N
i( )dni( ) i( )dni( ) i
T ( ) T ( ) dSt( ) p( ) p( ) dVt( )
M1
M
(1
x1 )
dM dx1
dM M 2 M x1 dx1
二元混合物旳偏摩尔性质和摩尔性质图示
T,p一定
dM x1 d x1 M
M1
1
x1
d d
M x1
M1
M
M2
M M ( x1 )
M2
0
x1
1
❖ 对于N元系统,各组分旳偏摩尔性质与 摩尔性质之间旳关系是:
N M
Mi
M
j1
xj
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H HB n B T , p ,nc F FB n B T , p ,nc
13
4.3.2 偏摩尔量 2、物理意义
Z ZB n B T , p ,nc
(1)偏摩尔量ZB是在T,p以及除nB外所有其他组分的 物质的量保持不变的条件下,任意广度性质Z随nB的 变化率。
dU TdS pdV
所以,
dH TdS Vdp
4.3.1 Gibbs公式-基本公式 (3)
7
dF SdT pdV
F U TS dF dU TdS SdT
推导:
所以,
dU TdS pdV dF SdT pdV
4.3.1 Gibbs公式-基本公式 (4)
11
4.3.2 偏摩尔量
1Байду номын сангаас定义:
Z ZB n B T , p ,nc
ZB—偏摩尔量
脚注T,p表示T,p恒定,nC表示除组分B以外,其余
所有组分(以C代表)均保持恒定不变。
Z Z dp Z B dn B 则: dZ dT T p ,nB p T ,nB
17
4.3.2 偏摩尔量
二、 偏摩尔量之间的某些关系式
1、 偏摩尔量的集合公式
Z Z dZ dp Z B dn B dT T p ,nB B p T ,nB
恒温恒压下,
dZ Z B dnB
B
偏摩尔量的集合公式。
考虑A、B组成的二元系(恒温恒压):
23
4.3.2 偏摩尔量
三、 偏摩尔量的测量
1、斜率法: 2、解析法:
Z m Z m Z A Z m xB Z ( 1 x ) m A x x B T ,P A T ,P Z m Z m Z B Z m ( 1 xB ) Z x m A x x B T ,P A T ,P
4.1几个函数的定义式
dG -SdT VdP G S T P G V P T
3
例如:从G( T,P )求出S、V、U、H、F
G H G TS G T T P G G U H - PV G - T P T P P T G F G PV G P P T
的质量摩尔浓度m的关系如下:
V=(1.0014+0.01662m+1.77×10-3m3/2+1.2×10-4m2)dm3。 试计算1mol· kg-1的NaCl溶液中NaCl和H2O的偏摩尔体积。
习题3 xCd mix H m Cd Sn合金在500 。 C(773 K)时的摩尔混合焓数据 如下: 0 0 0.1 1247 .6 0.3 0.5 0.7 0.9 1.0 0
1
第四章 热力学函数之间的关系及其应用
4.1几个函数的定义式 4.2函数间关系的图示式
4.4对应系数关系式 4.5Maxwell关系式 4.6热力学关系式的记忆
4.7热力学关系式的应用
4.3Gibbs公式
4.3.1 Gibbs基本公式 4.3.2 偏摩尔量 4.3.3 化学势 4.3.4 广义Gibbs公式 4.3.5 化学势统一判据 4.3.6 一级相变与二级相变
ZA
Z nB Z B nA
3、截距法:
24
4.3.2 偏摩尔量
习题1: 293.15K时,质量分数为60%的甲醇水溶液的密度是 0.8946kg· dm3,在此溶液中水的偏摩尔体积为1.68×10-2dm3· mol-1。
求甲醇的偏摩尔体积。
参考答案
习题2: 在298.15K,含水1kg的NaCl水溶液的体积V与NaCl
2729 .6 3347 .2 2596 .2 1052 .3
试用作图法求出xCd 0.6的Sn Cd合金中Cd和Sn的偏摩尔混合焓。
(3)dF SdT pdV (4)dG SdT Vdp
(1)组成不变的封闭系统(双变量系统)无有效功的可逆、不 可逆过程均可适用。因为对双变量系统而言,上面四个式子的
微分是全微分,与路径无关,可逆不可逆一样。
(2)组成可变的封闭系统无有效功的可逆过程,如复杂物理 变化(相变)、化学变化必须要求可逆。
5
(1) dU
TdS pdV
W pdV
推导:可逆不作非体积功时,
Q TdS
所以, dU
代入热力学第一定律:dU
Q W
TdS pdV
4.3.1 Gibbs公式-基本公式 ( 2)
6
dH TdS Vdp
H U pV
推导:
dH dU pdV Vdp
22
4.3.2 偏摩尔量
3、定义式关系
多组分可变体系中的热力学公式与组成恒定的体系具有完全相同
的形式,所不同的只是用容量性质的偏摩尔量代替相应的摩尔量而已。
H B U B pVB
FB U B TS B
GB B H B TSB U B pVB TSB FB pVB dUB TdSB pdVB
4.1几个函数的定义式
2
八大状态参数:T、P、V、S、U、H、F、G。 其中:T、P为强度性质,其余参数为容量性质。
H U pV G F pV F U TS G H TS
我们也称U,H,F,G 等热力学函数为特性函数,可以用一个特
性函数和其特征变量求得所有其它热力学函数,从而可以把一个热力 学体系的平衡性质完全确定下来。
15
4.3.2 偏摩尔量
3、几点说明: (1)只有体系某组分才具有偏摩尔量,对溶液整体而言无
所谓偏摩尔量的概念;
(2)只有体系的广度性质才有偏摩尔量(质量和物质的量 除外); (3)注意右下角标的条件:等温等压; (4)偏摩尔量本身是强度性质,任何偏摩尔量都是T、p、
组成的函数,用k+1个变量描述,即ZB=f(T,P,xB„);
14
4.3.2 偏摩尔量
(2)也可理解为:在定温、定压下,向大量的某一定组 成的混合物或溶液中加入单位物质的量的B时引起的体系 的广度性质Z的改变量,例如∶向太平洋中加入1molNaCl。 或在等温等压下向有限量的体系中加入dnBmol的物
质B所引起的体系容量性质Z的微变量dZ与dnB之比。
总之,其核心是保持溶液的浓度不变。
dZ Z AdnA Z B dnB
Z nA Z A nB Z B
4.3.2 偏摩尔量
推广到多元系(恒温恒 压)Z
B B B
18
恒温恒压时:V U
n V
B
B B BHB
n Z Z x Z G n G n u
m B B
B
B
B
B B
B
B
n U
B B
B
H
二元溶液中 溶质和溶剂关系
Z m Z m Z A Z m xB Z ( 1 x ) m A x x B T ,P A T ,P Z m Z m Z B Z m ( 1 xB ) Z m xA xB T ,P x A T ,P
标压下,将液体Pb过冷至590K凝固,因为恒温恒压,根
据dG=-SdT+VdP,该过程的G=0 ( )
10
4.3.2 偏摩尔量
一、偏摩尔量的定义
对于多组分体系(溶液)而言,设Z代表V,U,H, S,F,G这些广度性质,则: Z=f (T,p,n1,n2,……) 其全微分则为:
Z Z dZ dT dp T p ,nB p T ,nB Z Z dn1 dnB n n 1 T , p ,n2 ,n3 ,...nc ,... B T , p ,nc
B
Gibbs-Duhem公式为一很重要关系. 它反映了各偏
摩尔量间相互联系、相互消长的制约关系, 在讨论溶液 问题时非常重要。
21
4.3.2 偏摩尔量
二元溶液中溶质和溶剂的G-D关系表现形式:
xAdZA xB dZB 0
Z A Z B xA x B x x A T ,P B T ,P ( 推导见教材P65 ~ 66 )
根据集合公式 :Z nB Z B
B
dZ n1dZ1 Z1dn1 n2 dZ 2 Z 2 dn2 nk dZ k Z k dnk
已知在等温、等压下某均相体系任一容量性质的全微分为:
dZ Z1dn1 Z 2 dn2 Z k dnk
16
4.3.2 偏摩尔量
(5)一般情况ZB≠Z*m,B,但纯物质的偏摩尔量就是其摩 尔量,即Z*B=Z*m,B; (6)在极稀溶液中:ZA≈Zm,*A
(7)偏摩尔量可正、可负。如向稀的硫酸镁水溶液中
继续加入硫酸镁时,溶液体积缩小,此时硫酸镁的 偏摩尔体积为负值。 (8)偏摩尔量是1molB对整体热力学性质的贡献量, 而不应该理解为它在混合体系中所具有的量。
两式相比较,得: n1dZ1 n2 dZ 2 nk dZ k Gibbs-Duhem公式
n dZ
B B
B
0
20
4.3.2 偏摩尔量
将上式除以:n
n
B
B
Gibbs-Duhem公式
x1dZ1 x2 dZ 2 xk dZ k xB dZ B 0
