二组分相图
物理化学课件二组分相图相图资料

压力-组成图(p-xB图) 温度-组成图(T- xB图) 杠杆规则 二组分真实液态混合物的气-液平衡相图
1
将吉布斯相律应用于二组分系统 ( C = 2 )
f = 2-+2=4-
min=1,fmax=3 最多3个独立变量(T, p, x)
指定温度,则有压力-组成图 ; 指定压力,则有温度-组成图 .
10
• 甲苯(A) - 苯(B)系统在 p = 101.325 Pa下 沸点与两相组成的关系
沸点 t / ℃ 液相组成 xB(L) 气相组成 xB(G)
110.62
0
0
108.75
0.042
0.089
104.87
0.132
0.257
103.00
0.183
0.384
101.52
0.219
0.395
97.76
• 露点: 气相降温至开始 凝结的温度.
• 区分系统点与相点,会 读系统总组成与相组 成.
沸点-组成图
12
苯和甲苯的 压力-组成图 和 温度-组成图 的对比:
• 整体形状基本类似
• 点、线、 面的相对高低位置均颠倒!
13
杠杆规则
p
当系统在 M 点以 L, G 两相平衡时, 对B组分作物料衡算:
t 一定 l (A+B)
若pB* > p > pA*, 则 yB > xB, yA < xA. 可知:
饱和蒸气压不同的两种液体形成理想液态混合物成气-液平 衡时, 两相的组成并不相同, 易挥发组分在气相中的相对 含量大于它在液相中的相对含量.
气-液平衡时蒸气总压p与气相组成yB的关系:
结合式 p = pA* + (pB* - pA* ) xB 和式 yB = pB*xB /p 可得
chapt 5- 汇总(单组份,二组分相图).

平面图
§5.5 二组分液体完全互溶的气-液平衡相图
1. 理想溶液的 p-x图
绘制相图——蒸馏法:
(以79.6℃下甲苯和苯二组分
p x 相图为例)
定温下,测定不同比例的 C6H5CH3-C6H6混合物的 蒸气总压p、液相组成yB 及气相组成xB。
140
对应 t — 临界溶解温度 120
S'' K
p =常数 单相混溶区
② lα(A+B) —— 共轭溶液 lβ(A+B) 互比量(杠杆规则)
100
MS
S'
N
③ 分析系统变化情况:
定温下向水中加异丁醇 ? 系统由S′点升温?
由O点升温?
80 C
60 0
lα(A+B) + lβ(A+B) O
0.2 0.4 0.6
成为 xB=0.1。将 7 mol B 和 3 mol A 气体混合,在 101.325 kPa 下
冷却到 65C 产生第一滴液体,其组成为 xB=0.9,继续定压封闭 冷却到 55C 时剩下最后一个气泡,其组成为 yB=0.6。
(1)画出此二组分系统在 101.325kPa 下的沸点一组成图,
并标出各相区;
当该盐(不挥发)的稀水溶液, 降温,
在零度以下某个温度,析出纯冰: ΔTf = kf mB
不同温度下(NH4)2SO4在水中的溶解度
温度 t / ℃ 液相组成 w[(NH4)2SO4]
固相
0
0
冰
-5.45
0.167
冰
-11
0.286
冰
-18
金属二组分相图
0 268.6 4 232.2 8 204.1 12 179 16 182.2 20 177.9
表3、校正后的50%Pb数据 0.5 1 1.5 2 2.5 263.1 257.5 252.2 247.7 243.7 4.5 5 5.5 6 6.5 228.5 225 221.3 217.9 214.4 8.5 9 9.5 10 10.5 200.7 197.2 194 190.6 187.2 12.5 13 13.5 14 14.5 180.2 181.7 182.2 182.4 182.4 16.5 17 17.5 18 18.5 182.1 181.9 181.6 180.9 180.3 20.5 21 21.5 22 22.5 177.1 176.1 174 169.8 165 图6、校正后的50%Pb的冷却曲线
图5、校正后的10%Pb的冷却曲线
5
10
15
20
25
时间/min 温度/℃ 时间/min 温度/℃ 时间/min 温度/℃ 时间/min 温度/℃ 时间/min 温度/℃ 时间/min 温度/℃
270 260 250 240 230 220 210 200 190 180 170 160 150 0
2.5 233.4 6.5 204.5 10.5 213.6 14.5 204.9 18.5 187.7 22.5 175.1
3 229.8 7 204.8 11 212.8 15 202.9 19 185.3 23 169.9
3.5 226 7.23.5 164.8
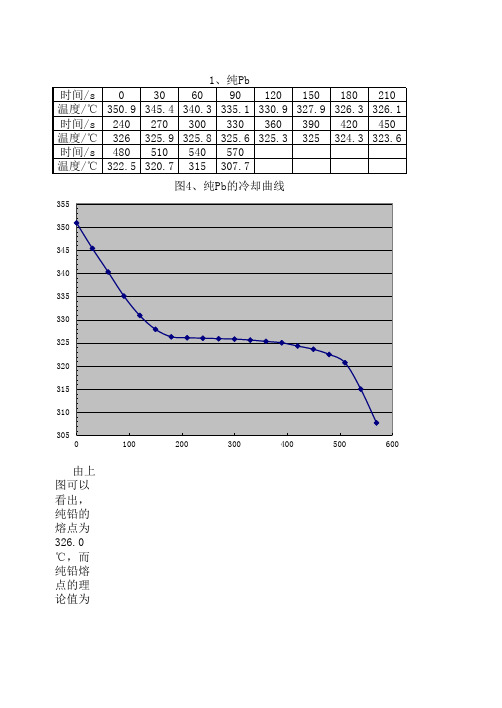
1、纯Pb 时间/s 0 30 60 90 120 150 180 210 温度/℃ 350.9 345.4 340.3 335.1 330.9 327.9 326.3 326.1 时间/s 240 270 300 330 360 390 420 450 温度/℃ 326 325.9 325.8 325.6 325.3 325 324.3 323.6 时间/s 480 510 540 570 温度/℃ 322.5 320.7 315 307.7 图4、纯Pb的冷却曲线
chapt 5- 汇总(单组份,二组分相图)

§5.5 二组分液体完全互溶的气-液平衡相图 1. 理想溶液的 p-x图
绘制相图——蒸馏法:
(以79.6℃下甲苯和苯二组分 p x 相图为例)
定温下,测定不同比例的 C6H5CH3-C6H6混合物的 蒸气总压p、液相组成yB 及气相组成xB。
平衡相组成 :
100 p/kPa 80 60 液相线是直线 40
练习:
p / 10 5 Pa A 220 固 e 液 d a 0.00611 C' O B 0.01 374.2 t/℃ 气 c b C
系统点 (强度状态)
f =C-φ+2
f ′=C-φ+1
① 定温下,由a点缓慢降压: H2O(l)→液气平衡→H2O(g) f '=1, f '=0, f '=1 ② 定压下,由b点缓慢降温: H2O(g) , f '=1 →气液平衡, f '=0 →H2O(l) , f '=1 →液固平衡,f '=0 →H2O(s) , f '=1
练习:
正常沸点
1. A ,B 二组分在液态完全互溶,已知液体 B 在 80C 下蒸气 压力为 101.325 kPa,气化焓为 30.76 kJ·mol-1。组分 A 的正常沸 点比组分 B 的正常沸点高 10 C。在 101.325kPa 下将 8 mol A 和 2 mol B 混合加热到 60 C 产生第一个气泡,其组成为 yB=0.4,继 续在 101.325 kPa 下恒压封闭加热到 70C,剩下最后一滴液其组 成为 xB=0.1。将 7 mol B 和 3 mol A 气体混合,在 101.325 kPa 下 冷却到 65C 产生第一滴液体,其组成为 xB=0.9,继续定压封闭 冷却到 55C 时剩下最后一个气泡,其组成为 yB=0.6。 (1)画出此二组分系统在 101.325kPa 下的沸点一组成图, 并标出各相区; p=101.325kPa
二组分相图的原理和应用

二组分相图的原理和应用一、二组分相图的概念二组分相图是指由两种化学组分组成的体系在不同温度和组成条件下所呈现的各种相的分布情况。
它是材料科学和冶金学领域中的重要研究对象,可以帮助我们理解物质在不同条件下的相变行为。
二、二组分相图的原理二组分相图的构建基于以下原理:1.相平衡:在平衡状态下,相图中各个相的组成、结构和比例都是固定的。
相图的绘制需要通过实验数据以及热力学理论来确定各相的存在范围。
2.相变:相图中的相变线表示了不同相之间的过渡区域。
这些相变可以是固态到液态的熔化过渡,也可以是固态到固态的晶体相变。
3.相图的标定:为了绘制相图,需要通过实验测量得到不同温度下的物质组成和相变点。
这些实验数据被用来确定相图中各个区域的边界。
4.相规律:相图中的各个区域代表了不同的相组合和相变行为。
通过对相规律的研究,可以了解物质的结构和性质。
三、二组分相图的应用二组分相图在实际应用中具有以下重要作用:1.材料设计:二组分相图可以帮助工程师和科学家设计新材料,通过研究不同相的存在范围和相变行为,可以选择最合适的材料组合和制备条件。
2.材料改性:相图可以指导材料改性的研究,通过改变材料的组成和处理条件,可以实现材料性能的调控和优化。
3.相变控制:通过研究相图,可以了解不同相之间的相变动力学和热力学特性,从而控制相变过程的速度和温度范围。
4.性能预测:二组分相图可以帮助预测材料的物理和化学性能,通过分析不同相的结构、组成和相变行为,可以预测材料的导电性、热导性、机械性能等重要性能参数。
四、二组分相图的应用案例以下是一些二组分相图应用的案例:1.合金设计:通过研究合金的相图,可以确定最佳合金组合、热处理条件以及制备方法,以满足特定的性能要求。
例如,在钢铁工业中,通过研究铁-碳相图,可以设计出不同类型的钢材,如低碳钢、高碳钢和不锈钢等。
2.电子材料:在电子行业中,通过研究半导体材料的相图,可以优化半导体器件的性能。
例如,硅的相图对于晶体管和集成电路的设计和制备非常重要。
物理化学课件二组分相图相图解读

2
压力-组成图(p~ xB图)
设组分A和B形成理想液态混合物(见图). 气-液平衡时蒸气总压p与液相组成xB的关系: 在温度T下两相平衡时, 由拉乌尔定律
* * xB pA pA xA , pB pB
T一定
g p y A yB pA pB xA xB l
•理想液态混合物的 气 - 液平衡
A和B均满足 pB = p*B xB
t 一定 p
p
l (A+B) M
* B
nGxG + nLxL = (nG + nL) xM 得
L 总 nG n n B B B
L
G
nL xG xM MG 推导 nG xM xL LM
B 既是系统点又是相点
A
xL xM xG nL nM nG
xB
7
• 实际混合物中苯(B)和甲苯(A)双液系的性质接近理想 混合物, 在79.7 ℃下实测 压力-组成 数据如下:
液相组成 xB 0 0.1161 0.2271 0.3383 0.4532 0.5451 0.6344 0.7327 0.8243 0.9189 0.9565 1.000
8
相点
系统点
液相线
• 点, 线, 区的含义 及各状态下自由 度数; • 会读系统总组成 g p 与相组成 ; yA yB pA pB 气相线 xA xB 相点 l
T一定
结线 •理想液态混合物的 气 - 液平衡
蒸气压组成相图 A和B均满足 pB = p*B xB
9
2. 温度-组成图(T~ xB图)
在恒压下表示二组分系统气-液平衡时的温度和
组成的关系. 根据实验数据可以作出T~x图(包括气相线和液 相线). 例如:苯~甲苯的T~x图如下:
二组分凝聚系统相图.

T
' c
等压
c'
两相
T/K
453
413
373
Tc
c
0.2 0.4 0.6
单相
0.8 1.0
0
水
质量分数 水-烟碱的溶解度图
烟碱
6.4 二组分凝聚系统相图 一、二组分固态完全不互溶系统液固平衡相图
1. 热分析法
基本原理:二组分系统 C=2,指定压力不变,
f * = C +1 -F =3 -F
F = 1
f f 1 ** f f 2
*
相点 表示某个相状态(如相态、组成、温度等)的 点称为相点。 物系点 相图中表示系统总状态的点称为物系点。在T-x 图上,物系点可以沿着与温度坐标平行的垂线上、 下移动;在水盐相图上,随着含水量的变化,物系 点可沿着与组成坐标平行的直线左右移动。
单相区,物系点与相点重合;两相区中,只有 物系点,它对应的两个相的组成由对应的相点表示
B
3. 全部变为固体Bi后
f * C 1 Φ 1
t /s
温度又可以下降 纯Cd步冷曲线与之相同
Cd-Bi二元相图的绘制
w(Cd) 0.2
的步冷曲线
b
T /K
f* 2
C
D
f * 1
1. 加热到b点,Bi-Cd全部熔化 Φ 1 f * 2 1 Φ 2 温度可以下降,组成也可变 2. 冷至C点,固体Bi开始析出 Φ 2 f * 2 1 Φ 1 温度可以下降 3.D点固体Bi、Cd同时析出
Φ 3
f* 0 温度不能改变 f * 1 4.熔液消失,Bi和Cd共存
f 2 1 Φ 0
*
2.10 二组分系统相图

点以前就分解了;或者由于沸点较高,
不能或不易用通常的蒸馏方法来提纯。
根据上述不互溶双液体系的性质,可
采用水蒸汽蒸馏方法来提纯它们。
53 /57
在水蒸汽蒸溜时,让水蒸汽以汽泡的形式通 过有机液体冒出,这样可起到搅拌作用,以 使体系的蒸气相和两个液体相达成平衡。 在蒸馏过程中馏出物的两种液体的重量比例
所以蒸气组成曲线 v 在溶液组成曲线 l
的右上方(如图)
22 /57
• 在曲线 v 以上为 单相气相区域, • 在此区域中只有 气体存在;
f = C +1 = 2 1 + 1 = 2
有 T,xB 两个自由度;
23 /57
• 在曲线 l 以下为
单相液相区域,
• 在此区域中只有
溶液相存在;
溶液浓度在D和B之
间时,则B在气相中 的浓度大于B在溶液 中的浓度;
19 /57
在D点时,溶液组成
和蒸气相组成相同。
应当指出,上述蒸气
压 -组成图均 为 固 定
了另一变量 温度, 即温度一定的情况下 作出的。
改变温度,也能得到类似的图形。
20 /57
§2.9.2 完全互溶双液体系的沸 点-组成图
移动。
•当溶液全部蒸发完时,温度上升到 t3, 此时最后剩下的一滴溶液的组成为 c。
31 /57
• 应当注意,这
是描述溶液在
一带有活塞的
密闭容器中不
断蒸发过程;
•在整个蒸发过程中蒸气相始终与溶液相 达成平衡。
32 /57
溶液与纯组分沸
点的不同:
纯组分的沸点是恒定的,即由开始沸腾
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
0.8
1.0 K(B)
图3-29 Na(A) - K(B)熔点-组成图
t/℃
* tA
100 50 0 H F J
b
b
•
P E0.2 0.4 Na2K (C)
0.6 xB
0.8
1.0 K(B)
图3-29 Na(A) - K(B)熔点-组成图
2. 溶解度法绘制相图-水-盐系统
固(液)态完全不互溶的温度-组成图
yB t/℃ 80 l(A+B)
•
l (A+B)+sB
t
* B
0.0
0.2
0.4
0.6
0.8
1.0
t/℃ * tA 100
80
60
40 *
69.9
•
p=101325Pa
g(A+B)
g(A+B)
l(A)
tA
•s(A)+l(A+B) 20 •E s(A)+s(B) C
•C 60
s(C)+l
• • 638
•
1.0 Si(B)
• 500
l+s(A) E2 s(A)+s(C) 0.2
0.0 Mg(A)
0.4 (C)
0.6 wB
0.8
图3-28 Mg(A)-Si(B) 熔点-组成图
(2)形成不相合熔点化合物 (熔体与固相组成不同)
t/℃
* tA
100 50 0 H s(A) + s(C)
0.0 Ge(A)
图3-30 Ge(A) - Si(B)系统的熔点-组成图
图a 液态完全互溶沸点-组成图
固(液)态部分互溶的温度-组成图
350 t/℃ 300
* tB
•
t/℃ 120 100
p1=常数 g(A+B)
* tB
E l (A+B)
D
D
80 l (A+B) 60
150
• 0.0
F 0.2 0.4 xB 0.6
解: (1)从图中可知,当系统冷却时,首先析出 A(s),冷至近三相线时,在B (s)还未析出之前, 得到A(s)最多,根据杠杆规则可知 mA (s) / m (总) = q2 E / aE mA (s) = 180 g (0.600.40 ) / (0.60 ) = 60 g m (l) = (1800.60 ) g = 120 g 所以冷却至三相线,最多可得 60 g 的纯A(s);
NE线:盐的溶解
度曲线
水平线 CED— 三相平衡线
- 40
0.0 0.2 H2O(A)
图 3-24 H2O(A)-(NH4)2SO4系统的固、液平衡相图
s(A)+s(B)+lE (A+B)
160 t/℃
120
80
N (Tb)
l(A+B)
l (A+B)+s (B) L l(A+B)+s(A) wE=0.384 C E s(A)+s(B) 0.4 wB 0.6
线:液相线、固相线,三相共存线 面:稳定相态,自由度数 2、了解系统的某些情况,能想象出相图的样子
如:A、B混合物构成理想液态混合物,其p -x 图、 t-x图的样子
金属形成稳定化合物AB3、A2B3,固体A、B、A2B3、 AB3彼此不互熔,液体互溶,t-x图的样子
3、 由气液t-x图绘制p -x图
(2)三相平衡时,若低共熔混合物的量只剩 60 g 时,说明 有 60 g 混合物已转变为纯 A(s)和 B(s)的质量分别为 mA ( s )和 mB ( s ),由杠杆规则可知 mA ( s )/ mB ( s ) = bE / Ea m’A ( s ) = ( 1.00 – 0.60 ) / ( 0.60 0 ) m’B ( s ) =2 / 3 m’B (s) m’A ( s )+ m’B ( s ) = 60g 由上式可得 m’A ( s ) = 24 g , m’B ( s ) =36 g ,mA ( s ) = ( 60+24 ) g = 84 g 所以,若低共熔混合物的质量为 60g 时,与其平衡的固体 A 为 84g 固体 B 为 36g 。
exp νB μB (T ) / RT B
ΔrGm (T ) νB μB (T ) B
r G (T ) RT ln K (T )
m
化学反应标准平衡常数与计量方程的关系:
N2+3H2=2NH3 (1)
r G (T ) RT ln K (T )
有肢解复杂相图的能力
画图
强调:能用热分析数据绘制相图
画状态变化过程的步冷曲线
用图: 分离、提纯 分析状态变化情况
例1
如图所示,在101.325 kPa 下,A,B 二组分液态完全 互溶,固态完全不互溶, 其低共熔混合物wB= 0.60 今 有180 g,wB= 0.40 的溶液, 试回答: (1)冷却时,最多可得 多少克纯A(s)? (2)在三相平衡时,若 低共熔混合液的质量为60 g ,与其平衡的固体A及B各 为多少克?
例2
A和B形成相合熔点化合物AB:A,B,AB 在 固态时完全不互溶;A,AB,B 的熔点分别为 200C,300C,400C,A与AB及AB与B形成 的两个低共熔点分别为150C,xB,E1=0.2 和 250C,xB,E2=0.8。 (1)画出以上述系统的熔点-组成(t-xB)图 (2)画出以下两条步冷曲线:xB=0.1的系统从 200 C冷却到100 C,及xB=0.5的系统从400 C冷却到200C; (3)8 mol B和12 mol A 混合物冷却到无限接 近150 C时,系统是哪几相平衡?
GE1 H
相态及成分 l (Mg+Ag) s(Mg)+l(Mg+Ag) S1(Mg+Ag) l(Mg+Ag)+s2(Mg+Ag)
CQI
线:s(Mg)+lE ,1(Mg+Ag) , s(Mg m Ag n) 三相平衡 f ’ = 0 线: l (Mg+Ag) ,s(Mg m Ag n) , s1(Mg +Ag) 三相平衡 线: s1(Mg +Ag) , lE , 2(Mg+Ag) , s2 (Mg +Ag) 三相平
表 3-5 不同温度下(NH4)2SO4在水中的溶解度
温度 t / ℃ 0 -5.45 -11 -18 -19.05 0 10 30 50 70 90 108.90(沸点) 液相组成 w[(NH4)2SO4] 0 0.167 0.286 0.375 0.384 0.411 0.422 0.438 0.458 0.479 0.498 0.518 固相 冰 冰 冰 冰 冰+ (NH4)2SO4 (NH4)2SO4 (NH4)2SO4 (NH4)2SO4 (NH4)2SO4 (NH4)2SO4 (NH4)2SO4 (NH4)2SO4
(1) 水- 盐系统相图
160 t/℃ 120 80 40 0 L l(A+B)+s(A) wE=0.384 C E s(A)+s(B) 0.4 wB 0.6 D 0.8 1.0 (NH4)2SO4(B) l(A+B) N (Tb)
点: N
E点:最低共熔点 LE线:水的凝固点
下降曲线
l (A+B)+s (B)
0.96 G 0.8
•1.0
0.0
•
F
0.2 0.4 wB 0.6
G
Sn(A)
Pb(B) H2O(A)
0.8 1.0 n-C4H9OH(B)
•
图3-31 Sn(A) - Pb(B)熔点-组成图
图b 液态部分互溶沸点-组成图
l (A+B)
• E 200 C • •
250 t A 232
*
•
•C
g
l
g
•
l
(2) 具有转变温度的熔点—组成图
t/℃ 2000 1600 1200 961 800
* tA
l(A+B)
* tB
E l+ s(A+B)
C
l+s(A+B)
D s(A+B)+ s(A+B) s (A+B)
s(A+B)
F 0.2 0.4
G 0.6 0.8 1.0
0.0
Ag(A)
wB
Pt(B)
图3-32 Ag(A) – Pt (B)系统熔点-组成图
二组分形成化合物系统的相图
根据生成化合物的稳定性: (1)形成相合熔点化合物 (2)形成不相合熔点化合物
(1) 形成相合熔点化合物
t/℃
1500
a
l(A+B)
* tB
1430
s(C)+l A
1000 650
* tA
l+s(B)
E1 s(C)+s(B)
例2
已知在大气压下,MgAg 系统的温度组成图如 右图。 (1)列表说明I,II, III,IV 相区存在的相态 及成分;(2)分析水平 线上的相平衡状态并指明 ´=?(3)绘出P 点冷却 到室温的步冷曲线,并在 曲线的转折点处及各线段 部位的系统的相态及成分 的变化情况。
解:(1) 相区 Ⅰ Ⅱ Ⅲ Ⅳ (2)
40
•E
l(A)+l(B)
g(A+B)
•D •
* tB
l
D
0.0 0.2 H2O(A) 0.4 xB 0.6 0.8 1.0 C6H6(B)
