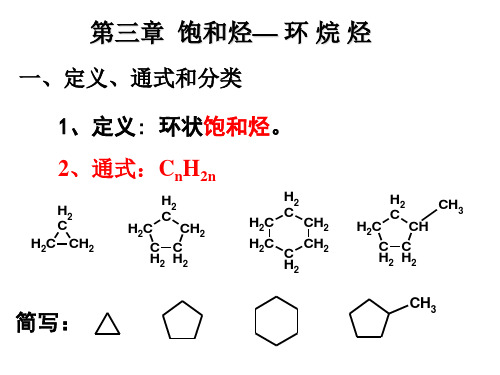
第三章 环烷烃
合集下载
3环烷烃

环已烷及其衍生物的构象
平面结构中相邻碳形成全重叠式构象 键角为120
环己烷的椅式构象
(1) 环己烷椅式构象的画法
H 1 H H 2 H H
H
3 H H 4 H H
H 5 H 6
4 CH2 CH2 1
H H 2 3 H
H 6 H H
5
H
H
环已烷的六个碳原子都保持正常键角109°28′
a键
e键
a键转变成e键,e键转变成a键; 环上原子或基团的空间关系保持。
H3C
有二个不同取代基的环己烷衍生物
CH3 (CH3)2CH CH(CH3)2 CH3
两个规则
带有相同基团的多取代环己烷,那末在两个构象异 构体之间,总是有较多取代基取e键向位的构象为优势构 象。
带有不同基团的多取代环己烷,其优势构象总是体积 较大的基团取e键的向位。
8 7 6 5
9 10
1 2 3 4
(95%)
(5%)
4
3 5 H H 6
2 1
CH3与C3-H、C5-H有相互排斥 力,这称为1,3-二直立键作用。
CH3
(2)二取代环己烷的构象
1,2-二甲基环己烷
CH3 CH3 CH3
CH3
CH3
CH3 CH3
CH3
1,2-二甲基环己烷的平面表示法
CH3 CH3
CH3 CH3
CH3
CH3 CH3
Br
离子型 机理
+
Br2
Br
(3) 加HX:
室 温
+
HBr
CH3 CH2 CH2 Br
CH3
CH CH2 CH2
+
第三章 环烷烃

• Angles would be 120, if planar. • The chair conformer has 109.5 bond angles and
all hydrogens are staggered (交叉的)。 • No angle strain and no torsional strain.
讨论: 甲基环己烷分子中甲基处于e键稳定还是 处于a键稳定?
equtorial (down)
CH 3
CH3 axial (down)
*请画出叔丁基环己烷的优势构象。
构象翻转
1,3-Diaxial Interactions 1,3-二直立键
=>
Disubstituted Cyclohexanes
3
3'
环戊基环己烷 cyclopentylcyclohexane
1,1’- 联环丙基(烷) 1,1’-Bicyclopropyl 1,1’-Bicyclopropane
定义:两个或两个以上的环系各以一个碳原子用单键或 双键直接相连而成的化合物称为集合环烷烃。
第二节 单环烷烃的分类和同分异构
单环烷烃的通式:CnH2n
eg.
Br2
+HBr
CH3 (CH3)2CCHCH2Br
Br CH3
(CH3)2CCHCH3
Br
3.3 环的张力
1.拜尔张力学说(A.von Baeyer, strain theory) 环丙烷的结构
2.环烷烃的燃烧热(P45 表3.2) 3.张力能
环
产 生 张
非键相互作用(Enb):非键合的两原子或原子团距 离小于其范氏半径之和(强烈排斥)
二取代环己烷
Bulky Groups
all hydrogens are staggered (交叉的)。 • No angle strain and no torsional strain.
讨论: 甲基环己烷分子中甲基处于e键稳定还是 处于a键稳定?
equtorial (down)
CH 3
CH3 axial (down)
*请画出叔丁基环己烷的优势构象。
构象翻转
1,3-Diaxial Interactions 1,3-二直立键
=>
Disubstituted Cyclohexanes
3
3'
环戊基环己烷 cyclopentylcyclohexane
1,1’- 联环丙基(烷) 1,1’-Bicyclopropyl 1,1’-Bicyclopropane
定义:两个或两个以上的环系各以一个碳原子用单键或 双键直接相连而成的化合物称为集合环烷烃。
第二节 单环烷烃的分类和同分异构
单环烷烃的通式:CnH2n
eg.
Br2
+HBr
CH3 (CH3)2CCHCH2Br
Br CH3
(CH3)2CCHCH3
Br
3.3 环的张力
1.拜尔张力学说(A.von Baeyer, strain theory) 环丙烷的结构
2.环烷烃的燃烧热(P45 表3.2) 3.张力能
环
产 生 张
非键相互作用(Enb):非键合的两原子或原子团距 离小于其范氏半径之和(强烈排斥)
二取代环己烷
Bulky Groups
第三章 环烷烃

第三章 环烷烃 (Cycloalkane)
1
主要内容
单环与双环的命名 小环化合物的化学性质 脂肪环的构象与稳定性因素 环己烷及其取代物的优势构象
2
§3.1 环烷烃的分类及命名
1. 环烷烃的分类
按环的大小
小环 (三元环、四元环) 常见环 (五元环、六元环) 中环 (七元环~十二元环) 大环 (十二元环以上)环烷烃
向外扩张了-5º16' 16
24º14'
9º44'
0º44'
环烷烃分子中键角与正四面体键角差值
-5º36'
角张力(angle strain):环的角度与sp3轨道夹角差别引起的张力
环的稳定性: 三元环 < 四元环 < 五元环 化学反应活性:三元环 > 四元环 > 五元环
——角张力学说的合理性 对于中等环和大环化合物,角张力学说的结论与实验 事实不符。
10
§3.2 单环脂环烃的性质
1. 自由基取代反应 : 环烷烃与烷烃相似
Br
300℃ + Br2
+ HBr
2. 加成反应
小环化合物的特殊性质-----易开环加成
11
(1) 加氢
H2 / Ni, 40oC
CH3CH2CH3
H2 / Ni, 100oC
CH3CH2CH2CH3
H2 / Pt, 300oC CH3CH2CH2CH2CH3
§3.4 脂环烃的构象
1. 环丙烷的构象
桥头碳
10 2
1
9
3
8
6
4
7
5
十氢萘
桥头间的碳原子数
(用"."隔开)
1
主要内容
单环与双环的命名 小环化合物的化学性质 脂肪环的构象与稳定性因素 环己烷及其取代物的优势构象
2
§3.1 环烷烃的分类及命名
1. 环烷烃的分类
按环的大小
小环 (三元环、四元环) 常见环 (五元环、六元环) 中环 (七元环~十二元环) 大环 (十二元环以上)环烷烃
向外扩张了-5º16' 16
24º14'
9º44'
0º44'
环烷烃分子中键角与正四面体键角差值
-5º36'
角张力(angle strain):环的角度与sp3轨道夹角差别引起的张力
环的稳定性: 三元环 < 四元环 < 五元环 化学反应活性:三元环 > 四元环 > 五元环
——角张力学说的合理性 对于中等环和大环化合物,角张力学说的结论与实验 事实不符。
10
§3.2 单环脂环烃的性质
1. 自由基取代反应 : 环烷烃与烷烃相似
Br
300℃ + Br2
+ HBr
2. 加成反应
小环化合物的特殊性质-----易开环加成
11
(1) 加氢
H2 / Ni, 40oC
CH3CH2CH3
H2 / Ni, 100oC
CH3CH2CH2CH3
H2 / Pt, 300oC CH3CH2CH2CH2CH3
§3.4 脂环烃的构象
1. 环丙烷的构象
桥头碳
10 2
1
9
3
8
6
4
7
5
十氢萘
桥头间的碳原子数
(用"."隔开)
第3 环烷烃

第三章 环烷烃
第三章 环烷烃
• 环烷烃是环状的烷烃。环烷烃分子中碳原子相互以单键联结成闭合碳 环,其余的价全部与氢原子连接。 • 要将链状烷烃变为环状,需将链端两个碳原子上的氢原子去掉,因此 单环烷烃的通式为CnH2n。 • 多环烷烃中每成一个环,氢原子将减少两个,所以双环烷烃的通式为 CnH2n-2。 • 可想而知,环烷烃和烷烃的大多数性质相似。 • 许多有机化合物具有环状结构。
§3.4 环烷烃的稳定性和张力
环的稳定性 与环的大小 有关
环丙烷最不 稳定,环丁 烷次之,环 戊烷比较稳 定,环己烷 以上的大环 都稳定
环稳 定性
环大小
(Aldolf von Baeyer)
1885年拜尔
张力 学说
张力学说假定成环碳原子处于同一平面,并形成等边多 边形:
109.5° 49.5° 60° 109.5° 19.5° 90° 108° 1.5° 109.5°
环戊烷
甲基环丁烷
乙基环丙烷
1, 1-二甲基环丙烷 1, 2-二甲基环丙烷
1, 2-二甲基环丙烷还有顺( cis-,两个取代基在环平面同侧)、反 (trans-,取代基在环平面两侧)异构;反式-1, 2-二甲基环丙烷又有对 映异构。
顺式 bp37℃
反式 bp29℃
顺、反异 构
镜面
对映异构
顺反异构和对映异构都属于立体异构。 顺、反异构属于立体异构中的构型异构,两个顺反异构体之间要相互变 化,必须打开共价键才行,而这在常况下是不可能的。因此,二者是具有 不同物理性质的异构体。
CH3
CH3
CH3
1, 3-二甲基环戊烷
CH3
CH2CH3
反-1-甲基-4-异丙基环己烷
1,4-二甲基-1-乙基环己烷
第三章 环烷烃
• 环烷烃是环状的烷烃。环烷烃分子中碳原子相互以单键联结成闭合碳 环,其余的价全部与氢原子连接。 • 要将链状烷烃变为环状,需将链端两个碳原子上的氢原子去掉,因此 单环烷烃的通式为CnH2n。 • 多环烷烃中每成一个环,氢原子将减少两个,所以双环烷烃的通式为 CnH2n-2。 • 可想而知,环烷烃和烷烃的大多数性质相似。 • 许多有机化合物具有环状结构。
§3.4 环烷烃的稳定性和张力
环的稳定性 与环的大小 有关
环丙烷最不 稳定,环丁 烷次之,环 戊烷比较稳 定,环己烷 以上的大环 都稳定
环稳 定性
环大小
(Aldolf von Baeyer)
1885年拜尔
张力 学说
张力学说假定成环碳原子处于同一平面,并形成等边多 边形:
109.5° 49.5° 60° 109.5° 19.5° 90° 108° 1.5° 109.5°
环戊烷
甲基环丁烷
乙基环丙烷
1, 1-二甲基环丙烷 1, 2-二甲基环丙烷
1, 2-二甲基环丙烷还有顺( cis-,两个取代基在环平面同侧)、反 (trans-,取代基在环平面两侧)异构;反式-1, 2-二甲基环丙烷又有对 映异构。
顺式 bp37℃
反式 bp29℃
顺、反异 构
镜面
对映异构
顺反异构和对映异构都属于立体异构。 顺、反异构属于立体异构中的构型异构,两个顺反异构体之间要相互变 化,必须打开共价键才行,而这在常况下是不可能的。因此,二者是具有 不同物理性质的异构体。
CH3
CH3
CH3
1, 3-二甲基环戊烷
CH3
CH2CH3
反-1-甲基-4-异丙基环己烷
1,4-二甲基-1-乙基环己烷
第三章 环烷烃
如何鉴别: 如何鉴别:
CH3-CH=CH2 CH3-CH2-CH3
褪褪 Br2/H2O
褪褪 KMnO4
×
褪褪
×
在强烈条件下,环烷烃也能被氧化。 在强烈条件下,环烷烃也能被氧化。 如:
OH
O
+ O2 (air)
环烷酸钴 140~180℃ ℃ 1-2.5MPa
+
氧化
HOOC
COOH
工业生产己二酸 锦纶-66单体 单体) (锦纶-66单体)
总之: 总之: 三元环的稳定性最小,最易开环; 三元环的稳定性最小,最易开环; 四元环的稳定性次之;也易开环; 四元环的稳定性次之;也易开环; 五元、六元环等,较稳定,不易开环。 五元、六元环等,较稳定,不易开环。 作业 : P73 二(4、5、6) 、 、 )
Ni + H2 200
+ 开环 加
Pt H2 300
CH3-CH2-CH2-CH2-CH3
(2)加成卤素 ) +
常温 Br2 CCl4
Br-CH2-CH2-CH2-Br
+ Br2
CCl4
Br-CH2-CH2-CH2-CH2-Br
棕红色褪去,用以鉴定环丙烷及环丁烷 鉴定环丙烷及环丁烷。 使Br2/CCl4棕红色褪去,用以鉴定环丙烷及环丁烷。
(3)加成卤化氢 )
+ HBr
CH3
CH3CH2CH2Br
+
HBr
CH3CHCH2CH3 Br
带有取代基的小环烷烃加成HX或 带有取代基的小环烷烃加成HX或Br2时,环 HX 的断裂是在取代基最多与最少的两个环碳原子 的断裂是在取代基最多与最少的两个环碳原子 加到含H多的碳上。( P67有错误 。(书 有错误!) 之间, 之间,且H加到含H多的碳上。(书P67有错误!)
第3章 环烷烃

第20页
24。44′
60。
109。28′
90。 (109。28′-90。)/ 2 = 9。44′ 108。 (109。28′-108。)/ 2 = 0。44′
24。44′
120。 ( 120。-109。28′)/ 2 = 5。16′
(109。28′-60。)/ 2 = 24。44′
成功之处:能解释大多数实验事实. 不成功之处:对五员环及六员环的推测不对. 不成功原因:把分子都看成平面,实际上除三员环外,其 它环的碳原子都不在一个平面内.
H
H
在船型构象中,有的C-H键处于重叠式。
H
H H
45
HH 3 H
HH H
6
1
HH
2
H
1
H H
6 5
CCHH22 4
2
3
H H
HH H H
第31页
3.环己烷的α键与e键
α键—竖键(或直立键) e 键—横键(或平伏键)
ee
a 5a
ae6
a e
e
ae
4
3a 2
a
1
a a
a a
a
e e
e
ee e
● 10 4__10 6 秒/次 转环
③母体:按成环碳原子总数称为 “某烷”.
第8页
7
CH1 2CH3 2 CH3
8 CHCH3 3 CH2
6
5
4
2,8-二甲基-1-乙基- 二环[3.2.1] 辛烷
定编号: 编号从一个桥头碳开始,沿最长桥到另一
桥头碳,再沿次长桥回到起始桥头碳,最后是最 短桥的碳原子.
写取代基:
将取代基位次和名称放在“二环”之前即可.
24。44′
60。
109。28′
90。 (109。28′-90。)/ 2 = 9。44′ 108。 (109。28′-108。)/ 2 = 0。44′
24。44′
120。 ( 120。-109。28′)/ 2 = 5。16′
(109。28′-60。)/ 2 = 24。44′
成功之处:能解释大多数实验事实. 不成功之处:对五员环及六员环的推测不对. 不成功原因:把分子都看成平面,实际上除三员环外,其 它环的碳原子都不在一个平面内.
H
H
在船型构象中,有的C-H键处于重叠式。
H
H H
45
HH 3 H
HH H
6
1
HH
2
H
1
H H
6 5
CCHH22 4
2
3
H H
HH H H
第31页
3.环己烷的α键与e键
α键—竖键(或直立键) e 键—横键(或平伏键)
ee
a 5a
ae6
a e
e
ae
4
3a 2
a
1
a a
a a
a
e e
e
ee e
● 10 4__10 6 秒/次 转环
③母体:按成环碳原子总数称为 “某烷”.
第8页
7
CH1 2CH3 2 CH3
8 CHCH3 3 CH2
6
5
4
2,8-二甲基-1-乙基- 二环[3.2.1] 辛烷
定编号: 编号从一个桥头碳开始,沿最长桥到另一
桥头碳,再沿次长桥回到起始桥头碳,最后是最 短桥的碳原子.
写取代基:
将取代基位次和名称放在“二环”之前即可.
第三章环烷烃
H (1 2 0 p m ) H CH3 CH3
(2 0 0 p m )
CH3
取代基的体积越大,e键的比例越高
C(CH
3)3
~100%
2) 二取代环己烷的构象
CH3 E=10.4 kJ/mol CH3 CH3 CH3
试比较顺式和反式 1,4-二甲基环己烷的稳定性。
H3 C CH3
CH3 a CH3 a
1-甲基螺[3.4]辛烷
2.编号从连接螺碳的小环的碳开始; 3.将编号和取代基名称写在螺字前.
2.桥环烃
两个环共用两个或两个以上碳原子的多环烃。两 个碳原子之间的距离叫桥,桥的交点为桥头碳。
二环[1.1.0]丁烷 bicyclo[1.1.0]butane
CH
3
二环[2.2.1]庚烷 bicyclo[2.2.1]heptane
四元环
60°
9 °44′
0 ° 44′ -5 °16 ′
五元环 六元环
109° 8′ 2
解释了小环化合物的性质,大环化合物的出现否 定了该学说。因六元环以上的环烷烃的碳原子能以正 常的键角成键,因此稳定性很高。
2.张力因素
引起分子不稳定的因素
范德华张力 非键原子之间的距离较近时引起的排斥作用。 角张力 键张力 扭转张力
信封式
4.环己烷及其衍生物的构象 (1) 环己烷的构象 极端构象: A)椅式构象 透视式
H 2 H H 1 H H 250pm H 3 H H 5 H H 4 H H
椅式
船式 纽曼投影式
H
H
H
H H
6 1
H H H
2 5
H H
4
H
6
交叉型
3
(2 0 0 p m )
CH3
取代基的体积越大,e键的比例越高
C(CH
3)3
~100%
2) 二取代环己烷的构象
CH3 E=10.4 kJ/mol CH3 CH3 CH3
试比较顺式和反式 1,4-二甲基环己烷的稳定性。
H3 C CH3
CH3 a CH3 a
1-甲基螺[3.4]辛烷
2.编号从连接螺碳的小环的碳开始; 3.将编号和取代基名称写在螺字前.
2.桥环烃
两个环共用两个或两个以上碳原子的多环烃。两 个碳原子之间的距离叫桥,桥的交点为桥头碳。
二环[1.1.0]丁烷 bicyclo[1.1.0]butane
CH
3
二环[2.2.1]庚烷 bicyclo[2.2.1]heptane
四元环
60°
9 °44′
0 ° 44′ -5 °16 ′
五元环 六元环
109° 8′ 2
解释了小环化合物的性质,大环化合物的出现否 定了该学说。因六元环以上的环烷烃的碳原子能以正 常的键角成键,因此稳定性很高。
2.张力因素
引起分子不稳定的因素
范德华张力 非键原子之间的距离较近时引起的排斥作用。 角张力 键张力 扭转张力
信封式
4.环己烷及其衍生物的构象 (1) 环己烷的构象 极端构象: A)椅式构象 透视式
H 2 H H 1 H H 250pm H 3 H H 5 H H 4 H H
椅式
船式 纽曼投影式
H
H
H
H H
6 1
H H H
2 5
H H
4
H
6
交叉型
3
环烷烃
Monosubstituted Cyclohexanes
• The two conformers of a monosubstituted cyclohexane are not equal in energy • The equatorial conformer of methyl cyclohexane is more stable than the axial by 7.6 kJ/mol
Conformations of Cyclobutane
• Cyclobutane has less angle strain than cyclopropane but more torsional strain because of its larger number of ring hydrogens • Cyclobutane is slightly bent out of plane - one carbon atom is about 25°above
six axial bonds perpendicular to the ring
6 个键是直立键,a键
six equatorial bonds near the plane of the ring
6 个键是平伏键, e键
Drawing the Axial and Equatorial Hydrogens
Conformational Mobility of Cyclohexane
• Chair conformations readily interconvert, resulting in the exchange of axial and equatorial positions by a ring-flip
第三章 环烷烃
CH3CH2CH2CH3
CH3CH2CH2CH2CH3
Pt C,常压 3000C,常压
3.3 环烷烃的化学性质
• 亲电加成反应: 亲电加成反应:
环丙烷在室温下可以和卤素、氢卤酸等试剂起亲电加 环丙烷在室温下可以和卤素、 成反应,生成开链化合物。 成反应,生成开链化合物。
FeCl3
+ Cl2
ClCH2CH2CH2Cl
+ Br2
Br
3.3 环烷烃的化学性质
CH3 + HBr
CH3CHCH2CH3 Br
CH3 CH3 CH3
CH3CH3
+ HBr
CH3
C Br
CH
CH3
3.3 环烷烃的化学性质
结论: 结论: 1)环丙烷活性最大,不稳定,易发生开环加成(H2 环丙烷活性最大,不稳定,易发生开环加成( (
); 、X2、HX); 、 (2)其他环烷烃性质与开链烷烃相似,发生X2的自由基 其他环烷烃性质与开链烷烃相似,发生X 取代反应; 取代反应; (3)环丙烷衍生物开环位置:取代最多的C与取代最少 环丙烷衍生物开环位置:取代最多的C 之间; 加成位置:符合马氏规则。 的C之间; 加成位置:符合马氏规则。 加成到含H较多的C上 加成到含H 马氏规则:H加成到含H较多的 上,X加成到含H较少的C上。 加成到含 较少的C
3.1.1 脂环烃的分类
根据环的个数:单环烃,多环烃。 根据环的个数:单环烃,多环烃。 个数 在多环体系中:两个环共用一个碳原子的为螺环烃, 在多环体系中:两个环共用一个碳原子的为螺环烃,两 个环共用两个以上碳原子的为桥环烃。 个环共用两个以上碳原子的为桥环烃。 螺环烃
桥环烃
为了书写方便,环烃常用键线式表示。 为了书写方便,环烃常用键线式表示。
CH3CH2CH2CH2CH3
Pt C,常压 3000C,常压
3.3 环烷烃的化学性质
• 亲电加成反应: 亲电加成反应:
环丙烷在室温下可以和卤素、氢卤酸等试剂起亲电加 环丙烷在室温下可以和卤素、 成反应,生成开链化合物。 成反应,生成开链化合物。
FeCl3
+ Cl2
ClCH2CH2CH2Cl
+ Br2
Br
3.3 环烷烃的化学性质
CH3 + HBr
CH3CHCH2CH3 Br
CH3 CH3 CH3
CH3CH3
+ HBr
CH3
C Br
CH
CH3
3.3 环烷烃的化学性质
结论: 结论: 1)环丙烷活性最大,不稳定,易发生开环加成(H2 环丙烷活性最大,不稳定,易发生开环加成( (
); 、X2、HX); 、 (2)其他环烷烃性质与开链烷烃相似,发生X2的自由基 其他环烷烃性质与开链烷烃相似,发生X 取代反应; 取代反应; (3)环丙烷衍生物开环位置:取代最多的C与取代最少 环丙烷衍生物开环位置:取代最多的C 之间; 加成位置:符合马氏规则。 的C之间; 加成位置:符合马氏规则。 加成到含H较多的C上 加成到含H 马氏规则:H加成到含H较多的 上,X加成到含H较少的C上。 加成到含 较少的C
3.1.1 脂环烃的分类
根据环的个数:单环烃,多环烃。 根据环的个数:单环烃,多环烃。 个数 在多环体系中:两个环共用一个碳原子的为螺环烃, 在多环体系中:两个环共用一个碳原子的为螺环烃,两 个环共用两个以上碳原子的为桥环烃。 个环共用两个以上碳原子的为桥环烃。 螺环烃
桥环烃
为了书写方便,环烃常用键线式表示。 为了书写方便,环烃常用键线式表示。
有机化学课件 第三章 环烷烃
螺[3.4]辛烷
(c)螺环上的编号:从连接螺原子(不含)上的一个碳开始,先
编较小的环,然后经过螺原子再编大环。有取代基是在遵循
编号原则的基础上,使取代基位置号码加和数最小为原则. 例3:
5-甲基螺[2.4]庚烷
2 3
1
6 5
7 8
螺[4. 5]癸烷 spiro[4. 5]decane
4
10
9
除螺C外的碳原子数 (用"."隔开)
6-甲基二环[3.2.2]壬烷
1,7-二甲基二环[3.2.2]壬烷
桥头碳原子
10 9 8 7 1 2 3 4 5
桥头间的碳原子数 (用"."隔开) 环的数目 二环[4. 4. 0]癸烷 bicyclo[4. 4. 0]decane 组成桥环的 碳原子总数
6
十氢萘
桥 头 碳:几个环共用的碳原子,
环的数目:断裂二根C—C键可成链状烷烃为二环;断裂三根C—C 键可成链状烷烃为三环
实 例 四
H3C H
CH3 H
带有二个或二 个以上取代基 时,分子有对 称性,构型用 顺、反表示(
顺-1,2-二甲基环丙烷 cis-1,2-dimethylcyclopropane
英文用 “cis”
和“trans”表 示)。
二、双环化合物的命名
其中两个碳环共用一个碳原子的叫螺环化合物. 共用两个或以上碳原子的叫桥环化合物.
当碳原子的键角偏离109°28′时,便会产生一种恢复正 常键角的力量。这种力就称为张力。键角偏离正常键角越多, 张力就越大。 109°28′内角
偏转角度=
2 4
9o44’
N=3 偏转角度
24o44’
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
a.命名与开链烃相似:以不饱和碳环为母体,侧链为取代基。 b.碳环上的编号顺序:应是不饱和键所在的位置号码最小。 c.对于只有一个不饱和键的环烯(或炔)烃,双键或叁键位置可不标。
环戊烯
环辛炔
1,3-环己二烯
带有侧链的环烯烃命名:
a. 若只有一个不饱和碳上有侧链,该不饱和碳编号为1; b. 若两个不饱和碳都有侧链或都没有侧链,则碳原子编号顺序除双 键所在位置号码最小外,还要同时以侧链位置号码的加和数为最 小。
第三章 环烃
第一节 脂环烃
脂环族化合物:结构上具有环状碳骨架,性质与开链化合物相似的
一类化合物。脂环烃:只有C、H两种元素组成的脂环化合物。
一、脂环烃的分类
1、按碳环数分:单环脂环烃;二环脂环烃和多环脂环烃等
CH3
十氢化萘
降冰片烷
螺[2,4]庚烷
立方烷
棱烷
蓝烷
金刚烷
2、按成环碳原子数分:三元环、四元环、五元环脂环烃等
环己烷不是平面结构,较为稳定的构象 为折叠的船型构象和椅型构象。
1
(Ⅰ)
6 1
2
3 5 3 2 5
4
(Ⅱ)
6
4
Ⅰ
Ⅱ
在(Ⅰ)和(Ⅱ)中,C2、C3 、C5 、C6都在一个平面内,但在(Ⅱ)
中,C1和C4在平面的同一侧,这种构象叫船式构象;而在(Ⅰ)
中,C1和C4在平面的上下两侧,这种构象叫椅式构象
HH3C 3C
11
1 C1-C2 1 C1-C2
C5-C4 6 C5-C4 6 C1-C2 C1-C2 C5-C4 C5-C4
4
HH HH3C 2 3C HH HH
2
H H
6 6 44 55
1 1
H H H H
H H H H
22
CH3 CH3
11
3 3
H
4
5 5
H H
3 3
H H
6 6
H H
H
CH3与C3为对位交叉 CH3与C3为对位交叉 优势构象, 优势构象, 室温时占95% 室温时占95%
CH 与C3为邻位交叉 CH33与C3为邻位交叉
(有排斥力) (有排斥力)
同一平面 上的比较
两种椅型构象是两种不同结构的分子。
甲基连在a键上的构象具有较高的能量,比较不稳定。
平衡体系中e键甲基环己烷占95%, a键的占5%。
叔丁基环己烷的构象
H H H C
C
H C
H H H H H H H
C
(H3C)3C
CH3CH2CH2CH3
+ H2
CH3CH2CH2CH2CH3
(2) 加卤素或卤化氢
+ Br2
C C l4
BrCH2CH2CH2Br
+ HBr
H 2O
CH3CH2CH2Br
环丙烷的烷基衍生物与HX加成,环的破裂发生在含H 最多和最少的两个碳原子之间,且符合马氏规律.
CH3—CH—CH2 + HBr CH2 CH3CHCH2CH3 Br
透视式
纽曼投影式
每个碳上与氢原子相连的两个键,一个垂直于平面,这个键
叫直立键,以a表示;另一个键则大致与平面平行,叫做平
伏键,以e表示。六个a键六个e键;
椅式构象中的两种类型C-H键
H
3
H
5
H
2 6
H
1
C H H C
H : a键 (axial bond) 竖键, 直键, 直立键 H : e键 (equatorial bond) 横键, 平键, 平伏键
3
H
相邻C-H 处于 邻位交叉式构象
H
3. 环戊烷的结构
不是平面结构,因C-H键的重叠,有较大扭转张力。
实际构象:折叠环的形式--“信封式”构象。
分子张力不大,因此环戊烷的化学性质比较稳定。
4. 环己烷的结构
120
o
如果环己烷的 6 个碳原子在同一平面上: • 将有角张力(偏离109.5o) • 将有扭转张力(C-H重叠)
H C H H C C C H C C H H
H C
满足碳四价
H H
C C C H
C C
H H
苯的结构参数
H C H C
120o
H C
120o
C H
C H
C
键长完全平均化,六个 C—C键 相等(0.140nm),烷烃C—C单 键(0.154nm),烯烃的C=C双键 H 108pm (0.133nm)。单键和双键的平均 值(0.144nm)。
C-C键的形成
交盖较好
键轨道的交盖
交盖较差
这样的键与一般的键不 一样,它的电子云没有轨道 轴对称,而是分布在一条曲 线上,故常称弯曲键。
内角60°
弯曲键比一般的 键弱,并且具有较高的能量。
这种因键角偏离正常键角而引起的张力叫角张力。
2.环丁烷的结构
内角90°
四个碳原子不在一个平面上。
140pm
平面型分子
凯库勒式的缺陷
(1)按凯库勒式:苯分子中有交替的碳碳单键和双键, 而单键和双键的键长是不等的。苯应该是一个不 规则的六边形结构。实际上:苯分子中碳碳键的键 长完全相等,均为0.140nm。即比一般的碳碳单键 短,比一般的碳碳双键长一些。 (2)化学性质 没有体现芳香性 所以, 凯库勒式并不能代表苯分子的真实结构.
H H
4
H H H H
H H 3 H H
5 4 2
H
1 6
H H
H
椅式构象中C-H键的顺反关系
H
3
H
5
H
2 6
H
1
相邻碳上的a键和e键为顺式
H
H
4
H H
两个相邻的a键(或e键)为反式
H H H H
构象的翻转 通过C-C键的不断扭动,一种椅型翻转为另一种椅型
为 a键
为e键
椅型构象的翻转 两种椅型构象是等同的分子.
环烷烃的命名(与烷烃相似):
(A)以碳环作为母体, 环上侧链作为取代基命名; (B)环状母体的名称是在同碳直链烷烃的名称前加一“环”字。 (C) 取代基较多时,命名时应把取代基的位置标出。 (D) 环上碳原子编号,以取代基所在位置的号码最小为原则。 例1: CH
3 1 ቤተ መጻሕፍቲ ባይዱ 4 2 3
CH3
1,2-二甲基环戊烷
CH3
CH=CH2
苯
甲苯
苯乙烯
b 多环芳烃——分子中有两个或以上的苯环
联苯
萘(nai)
蒽(en)
二、苯环的结构
凯库勒结构式
苯的分子式: (C6H6) (1)苯比较稳定,只有在加压和催化剂作用下才发 生加氢反应:
C6H6 + 3H2
Ni
压力
苯不易发生加成,不易氧化,但容易发生取代反应。
(2)苯加氢生成环己烷,苯的一元取代物只有一种 ,说明 苯环上的六个碳原子和六个氢原子的地位是等同的。 (3)1865年凯库勒提出苯的结构是一个对称的六碳环, 每个碳原子上都连有一个氢原子。
四碳环不易开环,在常温下与卤素,卤化氢不反应。
3. 氧化反应:
在常温下,环烷烃与一般氧化剂(KMnO4,O3) 不反应;
思考: 如何鉴别丁烷、甲基环丙烷、1-丁烯和1-丁炔 ?
四、环烷烃的结构 烷烃是sp3杂化,键角109.5°,环烷烃的碳也是sp3 杂化,但键角不一定一样。 1.环丙烷的结构
。 109.5 。 60 。 24 44'
室温: 100%
有非常大的1. 3-竖键作用
取代基在e键上的构象较稳定.
若有多个取代基,往往是 e 键取代基最多的构象最稳定。 若环上有不同取代基,则体积大的取代基连在 e键上的构象最稳定。 例1: 1,2-二甲基环己烷,顺式如下:
同一平面上的比较. 在同侧为顺, a,e 在异侧为反,a,a;e,e.
立体模型
[小结] 苯分子结构的认识: (1)苯分子是正六边形,碳和氢均处于同一平面。 (2)C-C键长平均化,为0.140nm。 (3)碳均为sp2杂化,六个碳具有同样的电子云密度。 未参与杂化的P轨道形成了一个大π键。 (4) 电子云均匀地分布在苯环的上下,具有相当大的 离域作用,从而使它们能量比在三个孤立的键要 低得多。 苯的氢化热(208.5 KJ· -1)比环己烯氢化热的三 mol 倍低得多( 3×119.3-208.5 = 149.4 KJ· -1), mol 这149.4KJ· -1即为苯的共轭能。 mol
折叠式构象 环丁烷中的键
环丁烷的构象
H
3
2
H HH
1
若为平面型分子 有角张力和扭转张力
H H
4
3
2 1
HH
HH
4
90o
H
C4-C3
H
C1-C2
88o
H H
H H
相邻C-H 处于 重叠式构象
H
稳定构象 角张力稍增 加, 扭转张 力明显减小
H H H
3
2
H
4 1
H H
C1-C2
4
2
H H
1
H
H2C H2C
图2 胆酸
第二节 芳香烃
一.芳烃的定义和分类 1.芳香烃是具有“芳香性”的碳氢化合物,是芳香族 化合物的母体。
芳香性(Aromaticity)的概念 (1)C/H的比例高。 (2)具有平面和接近平面的环状结构。
(3)键长接近平均化。
(4)化学性质稳定,易发生亲电取代而不易发生加成、氧化
2.芳烃分类: (1)苯型芳烃和非苯芳烃 (2)按环的数目分 a 单环芳烃——分子中只含有一个苯环
环戊烯
环辛炔
1,3-环己二烯
带有侧链的环烯烃命名:
a. 若只有一个不饱和碳上有侧链,该不饱和碳编号为1; b. 若两个不饱和碳都有侧链或都没有侧链,则碳原子编号顺序除双 键所在位置号码最小外,还要同时以侧链位置号码的加和数为最 小。
第三章 环烃
第一节 脂环烃
脂环族化合物:结构上具有环状碳骨架,性质与开链化合物相似的
一类化合物。脂环烃:只有C、H两种元素组成的脂环化合物。
一、脂环烃的分类
1、按碳环数分:单环脂环烃;二环脂环烃和多环脂环烃等
CH3
十氢化萘
降冰片烷
螺[2,4]庚烷
立方烷
棱烷
蓝烷
金刚烷
2、按成环碳原子数分:三元环、四元环、五元环脂环烃等
环己烷不是平面结构,较为稳定的构象 为折叠的船型构象和椅型构象。
1
(Ⅰ)
6 1
2
3 5 3 2 5
4
(Ⅱ)
6
4
Ⅰ
Ⅱ
在(Ⅰ)和(Ⅱ)中,C2、C3 、C5 、C6都在一个平面内,但在(Ⅱ)
中,C1和C4在平面的同一侧,这种构象叫船式构象;而在(Ⅰ)
中,C1和C4在平面的上下两侧,这种构象叫椅式构象
HH3C 3C
11
1 C1-C2 1 C1-C2
C5-C4 6 C5-C4 6 C1-C2 C1-C2 C5-C4 C5-C4
4
HH HH3C 2 3C HH HH
2
H H
6 6 44 55
1 1
H H H H
H H H H
22
CH3 CH3
11
3 3
H
4
5 5
H H
3 3
H H
6 6
H H
H
CH3与C3为对位交叉 CH3与C3为对位交叉 优势构象, 优势构象, 室温时占95% 室温时占95%
CH 与C3为邻位交叉 CH33与C3为邻位交叉
(有排斥力) (有排斥力)
同一平面 上的比较
两种椅型构象是两种不同结构的分子。
甲基连在a键上的构象具有较高的能量,比较不稳定。
平衡体系中e键甲基环己烷占95%, a键的占5%。
叔丁基环己烷的构象
H H H C
C
H C
H H H H H H H
C
(H3C)3C
CH3CH2CH2CH3
+ H2
CH3CH2CH2CH2CH3
(2) 加卤素或卤化氢
+ Br2
C C l4
BrCH2CH2CH2Br
+ HBr
H 2O
CH3CH2CH2Br
环丙烷的烷基衍生物与HX加成,环的破裂发生在含H 最多和最少的两个碳原子之间,且符合马氏规律.
CH3—CH—CH2 + HBr CH2 CH3CHCH2CH3 Br
透视式
纽曼投影式
每个碳上与氢原子相连的两个键,一个垂直于平面,这个键
叫直立键,以a表示;另一个键则大致与平面平行,叫做平
伏键,以e表示。六个a键六个e键;
椅式构象中的两种类型C-H键
H
3
H
5
H
2 6
H
1
C H H C
H : a键 (axial bond) 竖键, 直键, 直立键 H : e键 (equatorial bond) 横键, 平键, 平伏键
3
H
相邻C-H 处于 邻位交叉式构象
H
3. 环戊烷的结构
不是平面结构,因C-H键的重叠,有较大扭转张力。
实际构象:折叠环的形式--“信封式”构象。
分子张力不大,因此环戊烷的化学性质比较稳定。
4. 环己烷的结构
120
o
如果环己烷的 6 个碳原子在同一平面上: • 将有角张力(偏离109.5o) • 将有扭转张力(C-H重叠)
H C H H C C C H C C H H
H C
满足碳四价
H H
C C C H
C C
H H
苯的结构参数
H C H C
120o
H C
120o
C H
C H
C
键长完全平均化,六个 C—C键 相等(0.140nm),烷烃C—C单 键(0.154nm),烯烃的C=C双键 H 108pm (0.133nm)。单键和双键的平均 值(0.144nm)。
C-C键的形成
交盖较好
键轨道的交盖
交盖较差
这样的键与一般的键不 一样,它的电子云没有轨道 轴对称,而是分布在一条曲 线上,故常称弯曲键。
内角60°
弯曲键比一般的 键弱,并且具有较高的能量。
这种因键角偏离正常键角而引起的张力叫角张力。
2.环丁烷的结构
内角90°
四个碳原子不在一个平面上。
140pm
平面型分子
凯库勒式的缺陷
(1)按凯库勒式:苯分子中有交替的碳碳单键和双键, 而单键和双键的键长是不等的。苯应该是一个不 规则的六边形结构。实际上:苯分子中碳碳键的键 长完全相等,均为0.140nm。即比一般的碳碳单键 短,比一般的碳碳双键长一些。 (2)化学性质 没有体现芳香性 所以, 凯库勒式并不能代表苯分子的真实结构.
H H
4
H H H H
H H 3 H H
5 4 2
H
1 6
H H
H
椅式构象中C-H键的顺反关系
H
3
H
5
H
2 6
H
1
相邻碳上的a键和e键为顺式
H
H
4
H H
两个相邻的a键(或e键)为反式
H H H H
构象的翻转 通过C-C键的不断扭动,一种椅型翻转为另一种椅型
为 a键
为e键
椅型构象的翻转 两种椅型构象是等同的分子.
环烷烃的命名(与烷烃相似):
(A)以碳环作为母体, 环上侧链作为取代基命名; (B)环状母体的名称是在同碳直链烷烃的名称前加一“环”字。 (C) 取代基较多时,命名时应把取代基的位置标出。 (D) 环上碳原子编号,以取代基所在位置的号码最小为原则。 例1: CH
3 1 ቤተ መጻሕፍቲ ባይዱ 4 2 3
CH3
1,2-二甲基环戊烷
CH3
CH=CH2
苯
甲苯
苯乙烯
b 多环芳烃——分子中有两个或以上的苯环
联苯
萘(nai)
蒽(en)
二、苯环的结构
凯库勒结构式
苯的分子式: (C6H6) (1)苯比较稳定,只有在加压和催化剂作用下才发 生加氢反应:
C6H6 + 3H2
Ni
压力
苯不易发生加成,不易氧化,但容易发生取代反应。
(2)苯加氢生成环己烷,苯的一元取代物只有一种 ,说明 苯环上的六个碳原子和六个氢原子的地位是等同的。 (3)1865年凯库勒提出苯的结构是一个对称的六碳环, 每个碳原子上都连有一个氢原子。
四碳环不易开环,在常温下与卤素,卤化氢不反应。
3. 氧化反应:
在常温下,环烷烃与一般氧化剂(KMnO4,O3) 不反应;
思考: 如何鉴别丁烷、甲基环丙烷、1-丁烯和1-丁炔 ?
四、环烷烃的结构 烷烃是sp3杂化,键角109.5°,环烷烃的碳也是sp3 杂化,但键角不一定一样。 1.环丙烷的结构
。 109.5 。 60 。 24 44'
室温: 100%
有非常大的1. 3-竖键作用
取代基在e键上的构象较稳定.
若有多个取代基,往往是 e 键取代基最多的构象最稳定。 若环上有不同取代基,则体积大的取代基连在 e键上的构象最稳定。 例1: 1,2-二甲基环己烷,顺式如下:
同一平面上的比较. 在同侧为顺, a,e 在异侧为反,a,a;e,e.
立体模型
[小结] 苯分子结构的认识: (1)苯分子是正六边形,碳和氢均处于同一平面。 (2)C-C键长平均化,为0.140nm。 (3)碳均为sp2杂化,六个碳具有同样的电子云密度。 未参与杂化的P轨道形成了一个大π键。 (4) 电子云均匀地分布在苯环的上下,具有相当大的 离域作用,从而使它们能量比在三个孤立的键要 低得多。 苯的氢化热(208.5 KJ· -1)比环己烯氢化热的三 mol 倍低得多( 3×119.3-208.5 = 149.4 KJ· -1), mol 这149.4KJ· -1即为苯的共轭能。 mol
折叠式构象 环丁烷中的键
环丁烷的构象
H
3
2
H HH
1
若为平面型分子 有角张力和扭转张力
H H
4
3
2 1
HH
HH
4
90o
H
C4-C3
H
C1-C2
88o
H H
H H
相邻C-H 处于 重叠式构象
H
稳定构象 角张力稍增 加, 扭转张 力明显减小
H H H
3
2
H
4 1
H H
C1-C2
4
2
H H
1
H
H2C H2C
图2 胆酸
第二节 芳香烃
一.芳烃的定义和分类 1.芳香烃是具有“芳香性”的碳氢化合物,是芳香族 化合物的母体。
芳香性(Aromaticity)的概念 (1)C/H的比例高。 (2)具有平面和接近平面的环状结构。
(3)键长接近平均化。
(4)化学性质稳定,易发生亲电取代而不易发生加成、氧化
2.芳烃分类: (1)苯型芳烃和非苯芳烃 (2)按环的数目分 a 单环芳烃——分子中只含有一个苯环
