总胆红素(TBIL) 钒酸盐氧化法
钒酸盐氧化法和亚硝酸钠氧化法测定血清总胆红素的方法比较

钒酸盐氧化法和亚硝酸钠氧化法测定血清总胆红素的方法比较【摘要】目的:对钒酸盐氧化法和亚硝酸钠氧化法测定血清总胆红素进行方法比较。
方法:采用两种方法测定血清总胆红素值,进行比较,同时对两种方法的重复性试验、线性试验、干扰试验以及回收试验进行分析总结。
结果:两种方法有很好的相关性,钒酸盐氧化法和亚硝酸钠氧化法测定总胆红素(TB)批内变异系数分别为低值2.8%、2.0%,高值1.8%、1.3%;批间变异系数低值分别为2.8%、2.5%,高值分别为1.8%、1.4%;平均回收率分别为105%、102%;线性分别达到434.3 μmol/L、500.0 μmol/L;较轻微的溶血、脂浊、维生素C对两种方法测定TB无明显干扰。
结论:亚硝酸钠氧化法与钒酸盐氧化法相比具有较好的重复性和回收率,但对溶血、脂浊、维生素C的抗干扰能力不及钒酸盐氧化法。
【关键词】血清总胆红素;钒酸盐氧化法;亚硝酸钠氧化法1 材料与仪器1.1 试剂:钒酸盐氧化法TB(批号0106113)由四川迈克科技有限责任公司提供,亚硝酸钠氧化法TB(批号R113DGC)由上海蓝怡科技有限公司提供,胆红素标准TB浓度为157 μmol/L(批号R201HGC)由上海蓝怡公司提供。
脂肪乳注射液(C14~24)为华瑞制药有限公司生产,批号为051109001。
维生素C为西南药业有限公司生产,批号为060105002。
1.2 仪器:日立公司生产的H7060全自动生化仪,希森美康公司生产的SF-3000血细胞分析仪。
2 方法与结果2.1 两种方法测定参数:严格按照试剂说明书设定,采用两点终点法检测。
2.2 重复性实验:(1)批内重复性实验:取两份不同病人血清标本混合,分别用钒酸盐氧化法和亚硝酸钠氧化法测定TB,连续重复测定20次,计算变异系数(CV)。
(2)批间重复性实验:取两份不同病人血清标本混合,分装保存后分别用两种方法测定TB,1天测1次,连续测定20天,计算CV。
总胆红素(TBIL)测定试剂盒(钒酸盐氧化法)产品技术要求赛诺普
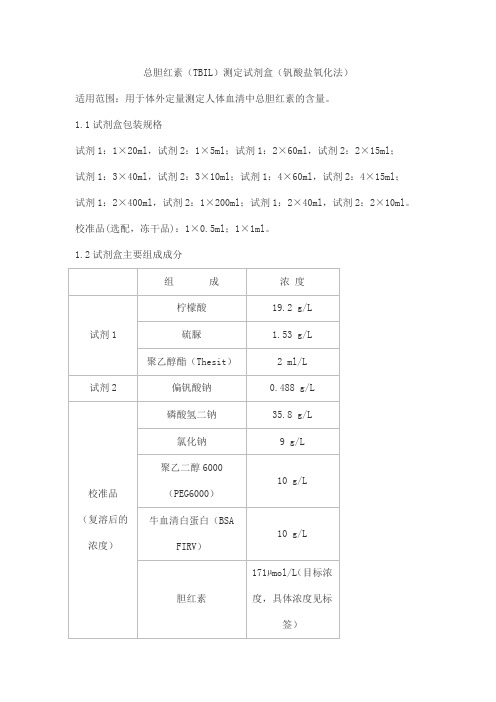
总胆红素(TBIL)测定试剂盒(钒酸盐氧化法)适用范围:用于体外定量测定人体血清中总胆红素的含量。
1.1试剂盒包装规格试剂1:1×20ml,试剂2:1×5ml;试剂1:2×60ml,试剂2:2×15ml;试剂1:3×40ml,试剂2:3×10ml;试剂1:4×60ml,试剂2:4×15ml;试剂1:2×400ml,试剂2:1×200ml;试剂1:2×40ml,试剂2:2×10ml。
校准品(选配,冻干品):1×0.5ml;1×1ml。
1.2试剂盒主要组成成分2.1 外观试剂1:无色澄清液体;试剂2:无色至浅黄绿色澄清液体。
校准品:冻干品,复溶后为黄色至黄褐色液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 试剂空白吸光度在37℃、450 nm波长、1cm光径条件下,试剂空白吸光度应不大于0.05。
2.4 分析灵敏度测定浓度为100µmol/L样本时,吸光度变化值(ΔA)应在(0.1,0.3)范围内。
2.5 线性范围在(2.0,680)µmol/L线性范围内,线性相关系数r应不小于0.995。
在[150,680)µmol/L范围内的线性相对偏差应不大于±10%;在(2.0,150)µmol/L范围内的线性绝对偏差不大于±15µmol/L。
2.6 重复性重复测试两份高低浓度的样本,所得结果的变异系数(CV%)应不大于5%。
2.7 批间差不同批号试剂测试同一份样本,测定结果的批间相对极差应不大于6%。
2.8 准确度相对偏差:相对偏差应不超过±10%。
2.9瓶间差(均一性)校准品的瓶间变异系数(CV%)应不大于5%。
2.10含水量(冻干品)校准品的水分含量不大于8%。
2.11 校准品溯源性依据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,校准品溯源至NIST生产的有证参考物质(SRM 916)。
钒酸盐氧化法与干化学法测定总胆红素的方法学比较

/3卷
表 ! 干化学法测定血清"浆#胆红素预期 偏 倚 和 相 对 偏 倚 的 估 计 "$ #
组别
隐形黄疸 中度黄疸 重度黄疸
钒酸盐法 干化学法 预期偏倚 相对偏倚
"%&’()*# "%&’()*# "%&’()*#
"$ #
!+,-
!.,/.
0,1.
-,23
/2/
/2-,22
/,22
/,0+
!+-
份 8分 别 用 两 种 方 法 进 行 总 胆 红 素 的 测 定 8共 测 定 *A8应 用 2>22软 件 对 所 测 数 据 进 行 统 计 <结 果 ;以 钒 酸 法 为 对 比 方 法
9B:8对干化学法9C:进行评估8两者测定总胆红素的回归方程为 CD!E))FBG )EHIF8相 关 系 数 J(D )E???<总 胆 红 素
%
#% 均值
%
%
%
%
%";’;
%";JJ;
注L3!G-3$G分 别 代 表 方 法 >O方 法 =每 次 测 定 的 差 值L3!GH-3$GH 分别代表分别代表两种方法每次测定的差值的相对偏差 7&8
图 ! 均值数点图 图 $ 差值偏倚散点图
U &#U
/期
邬 寿 贞 等 O脂 肪 组 织 层 内 乳 腺 癌 一 例
! 材料和方法
!E! 材料 !E!E! 仪器 51-+,5%H!H)+ 全 自 动 生 化 分 析 仪 9日 本 日 立 公 司 生 产 :Q#~}$$?*)干 式 全 自 动 生 化 分 析 仪 9美 国 强 生 公 司 生 产 :< !E!E( 试 剂 钒 酸 盐 试 剂 及 标 准 品 由 上 海 科 华@东 菱 公 司 提 供8批号 分 别 为 ())!((!和 ())()F)IQ干 化 学 法 试 剂 及 标 准 品 由美国 #~}$$&公司提供8批号分别为 K!FK**和 )I?(< !E!EK 质 控 品 钒 酸 法 质 控 品 由 美 国 R+’0zB 公 司 提 供 =/#%和=/#(高低浓度质控品8批号分别为(")’, 和!I!6/N KQ干 化 学 质 控 品 由 美 国 强 生 公 司 提 供8批 号 分 别 为 7(FI*和 R(FIH的 高 低 浓 度 两 种 质 控 品 <
血清总胆红素测定标准操作规程

血清总胆红素测定标准操作规程1检验原理:(钒酸盐法)pH 值接近3时,在钒酸盐和表面活性剂的作用下,胆红素被氧化成胆绿素。
此时,胆红素特有的黄色减少,在波长450nm 处通过测定钒酸作用前后的吸光度的差可以求得样品中总胆红素的浓度。
胆红素−−−−−→−表面活性剂钒酸盐/胆绿素 2.试剂主要组成成分3.样本要求 新鲜无溶血血清、勿使用肝素抗凝血浆。
22~25℃保存8小时,2~8℃保48小时,-20℃保存7天,样本不可反复冻融!4.检验方法:仪器法(详见DF-603/DI-600标准操作规程)5.参考范围:6检验结果的解释6.1样本含量超出线性范围时,建议用0.9%(W/V )的氯化钠溶液稀释样本。
通常稀释2倍,当样本浓度较大时提高稀释倍数。
6.2单位换算:mg/dL=umol/L ×0.05857检验方法的局限性7.1结果的准确性依赖于仪器的校正和测定温度、时间的控制。
7.2若试剂浑浊或以水空白在450nm 处吸光度大于0.500时不能使用。
8.产品性能指标8.1线性范围:在给定的样本/试剂比例和条件下测定时,本世纪线性范围可达0-300umol/L 。
8.2试剂空白吸光度:在450nm 处,光径1cm 时,空白吸光度A ≤0.500,△A 空白/分钟≤0.002.8.3准确度:相对偏差≤10%。
8.4精密度8.4.1批内精密度CV≤3%8.4.2批间精密度:R≤10%8.5分析灵敏度:在给定的样本/试剂比例和条件下测定时,1umol/L的总胆红素对应的△A不低于1.5×3108.6干扰试验无明显干扰:添加干扰物后的测定值与初始测定值的相对偏差处于±10%以内。
8.7方法比较:本试剂盒与商品化试剂盒测定40个样本测定结果相关性如下:y=0.997x+1.051;r=0.997。
9.临床意义:胆红素是红细胞正常或非正常降解后在内皮系统形成的有机复合物,检测胆红素有利于监测肝脏疾病以及发现溶血性贫血以及评估黄疸的程度。
总胆红素测定试剂盒钒酸盐氧化法重点标准化操作专题规程TBvSOP

总胆红素测定试剂盒(钒酸盐氧化法)原则化操作规程1 目旳规范实验室操作,保证检查工作顺利有效进行特制定此规程。
2 授权操作人经培训且考核通过旳实验室检查人员。
3 合用范畴本试剂合用于体外定量检测人血清或血浆中旳总胆红素旳浓度。
4 检查措施本试剂盒采用钒酸盐氧化法测定总胆红素旳浓度。
5 检查原理pH值接近3时,在钒酸盐、加速剂和表面活性剂旳作用下,总胆红素被氧化成胆绿素,胆红素在450nm处旳特异性吸光度下降。
通过测定钒酸盐氧化前后吸光度旳变化,即可计算出样品中总胆红素旳含量。
6 检查标本规定6.1标本类型: 使用新鲜血清样本,不要使用溶血及乳糜血样本。
6.2原则运送:室温条件下运送。
7 试剂及配套品7.1试剂来源长春迪瑞医疗科技股份有限公司总胆红素试剂盒(钒酸盐氧化法)7.2试剂构成7.3试剂旳稳定性与贮存:7.3.1试剂在2˚C ~8˚C条件下,干燥、避光、密封贮存,有效期12个月。
7.3.2开封后在2~8℃可稳定30天。
8 实验仪器及性能指标8.1 实验仪器迪瑞CS系列全自动生化分析仪8.2试剂性能指标8.2.1试剂空白:试剂空白吸光度A≤0.0508.2.2分析敏捷度:测试1μmol/L被测物时,吸光度变化△A<-0.0002。
8.2.3线性范畴: 0~684.0μmol/L,线性有关系数r值≥0.9900;线性范畴在0~187.0μmol/L时,绝对偏差应不超过±28.05μmol/L;线性范畴在187.0~684.0μmol/L时,相对偏差应不超过±15%。
8.2.4精确度:相对偏差应在±10%。
8.2.5精密度:反复性:CV≤5.0%批间差: R≤6.0%9 校准9.1校准品来源长春迪瑞医疗科技股份有限公司生产旳临床化学校准血清9.2校准品旳构成:人血清9.4校准品使用注意事项9.4.1 若该复溶血清受细菌污染,将会减少许多成分旳稳定性。
9.4.2 不同批号旳校准血清不能交叉使用,由于批号于批号之间旳赋值不同。
总胆红素操作程序

总胆红素操作程序1.目的规范总胆红素(TBIL)检测试验,确保检测结果准确性和重复性。
2.范围本操作规程适用于生化室工作人员、实习人员、进修人员的操作前培训。
3.术语4.测定原理4.1测定方法:钒酸盐法4.2 测定原理:在特定条件下(PH3.0),血清中胆红素与钒酸反应,生成胆绿素,其在450nm 处吸光度的下降与血清中总胆红素含量成正比。
5.标本5.1标本种类:新鲜无溶血血清。
5.2标本采集见生化标本采集程序。
6.试剂6.1试剂来源:和光试剂。
6.1.1组成包装规格:R1 540ml×4 R2 135ml×46.1.2试剂准备试剂为液体双试剂,无需配制,开瓶即可使用。
6.1.3试剂稳定性原装试剂在2~8℃避光保存,稳定期12个月。
试剂开瓶载机2~8℃稳定30天。
新打开试剂不宜与已用过的试剂混合在一起,否则易造成试剂稳定性下降。
7.仪器参数设定AU2700参数设定:和光试剂仪器参数设置具体参见试剂厂家提供的相关仪器的检测参数。
8.校准8.校准:具体参见临床生化校准程序8.1 校准条件:8.1.1仪器光路系统经过光路保养或更换光源等重要部件后。
8.1.2仪器经过大保养后。
8.1.3挪动仪器的安装地点。
8.1.4更换试剂批号。
8.1.5室内质控失控。
8.2 AU2700和光试剂系统的校准:8.2.1 准备:和光配套胆红素校准物.8.2.2 保存和稳定性:原校准品在2~8℃保存至有效期,1ml蒸馏水复溶,复溶后在2~8℃可保存7天。
8.2.3保存位置:低温冰箱-20℃。
8.2.4操作步骤:蓝色样本架的1号位置放蒸馏水;黄色样本架的9号位置放和光配套胆红素定标液→仪器主画面[USER] →[Calibration] →[选择校准项目]→[START]→[YES]。
9.室内质控及失控纠正:见临床生化室内质控程序9.1质控物来源:柏乐液体质控(批号:45612/45613)。
9.2质控物储存条件及准备:-15~-20℃保存至有效期,从低温冰箱取出后室温平衡30分钟。
血清总胆红素测定标准操作规程

血清总胆红素测定标准操作规程1.检测目的用于定量测定人体血清或血浆中总胆红素的含量2.检测原理钒酸氧化法:在PH3.0左右的缓冲液中,钒酸钠氧化总胆红素为胆绿素,使反应液的黄色减少。
测定胆红素氧化前后吸光度的差,可以计算出样品中总胆红素的浓度。
3.适用范围血清,或用肝素抗凝的血浆4.试剂及仪器1.试剂品:迈瑞公司生产的TBiL试剂盒,各组分如下:2.校准品由迈瑞公司提供的校准液,在更换试剂批号或出现质控漂移;仪器进行保养;仪器重要零件更换后进行校准。
3.仪器迈瑞BS-800型号仪器5.操作装载试剂—→进行校准—→进行质控—→输入标本检测项目—→加载标本—→标本测定—→结果复核—→报告6.注意事项1. 不能测试严重溶血、脂浊、黄疸的标本, 血浆标本可用肝素抗凝,待测样品室温不超过24小时,可于2℃-8℃保存72小时,胸腹水经抗凝取上清液。
2. 不能使用过期的试剂,2℃-8℃保存。
3. 定标液应冰冻保存。
7. 结果计算 c =ΧC O式中:c ——测定总胆红素浓度,umol/L ;A 测定——标本管吸光度;A 标准——标准管吸光度;C O ——校准血清总胆红素浓度,umol/L ;8. 操作性能1 精密度:批内CV ≤ 5.0%,批间CV ≤ 6.0%。
2 准确度:以参考方法定值的血清作为校准品时,本法测定结果与参考方法基本一致。
3 线性范围:2~684 umol/L9. 参考值5.1~19 umol /L(0.3~1.1mg/dL)10. 临床意义胆红素是老化的血红细胞中血红蛋白的代谢产物,血液中总胆红素和直接胆红素的含量测定有利于肝病和黄疸疾病的诊断。
总胆红素增高主要见于各类黄疸肝炎,胆道堵塞,新生儿黄疸。
总胆红素减低见于孕妇,部分冠心病。
11.安全防护A 测定A 标准1.对任何一份标本(包括质控品、标准品及检测试剂等)都应视其为具有传染性,操作人员在工作时应戴乳胶手套、穿工作服。
2.一旦发生标本容器划破手或身体、液体溅进眼睛等粘膜处,应立即用大量的水冲洗,同时向上级医师或科领导报告,必要时施以丙种球蛋白预防。
总胆红素 (钒酸盐氧化法)试剂盒标准操作程序.

总胆红素(钒酸盐氧化法)试剂盒标准操作程序1.摘要本试剂盒供医疗机构用于体外定量测定人血清样本中总接胆红素的含量。
2.适用范围程序适用于AU5811自动生化分析仪检测血清样本中总接胆红素的含量。
3.职责使用AU5811自动生化分析仪进行测定总接胆红素浓度的工作人员要严格按照本SOP程序进行,室负责人监督管理;本SOP的改动,可由任一使用本SOP的工作人员提出,并报经生化室负责人、科主任签字批准生效。
4.检测方法上海科华生物工程股份有限公司生产的总接胆红素(钒酸盐氧化法)试剂盒采用的是钒酸盐氧化法。
5.原理pH3.0左右,在起加速剂作用的表面活性剂的条件下,能够增进未结合胆红素的溶解度,样本中的总胆红素被钒酸盐氧化成胆绿素。
与此同时,胆红素特有的黄色也随之消失。
所以通过测定胆红素氧化前后吸光度的变化,就可以计算出样本中的总胆红素的浓度。
−−→胆红素钒酸盐−胆绿素6.仪器AU5811自动生化分析仪7.试剂7.1试剂来源:上海科华生物工程股份有限公司提供7.2试剂瓶内主要成分:R1:枸橼酸盐缓冲液(pH2.6)、表面活性剂;R2:磷酸盐缓冲液、偏钒酸盐7.3试剂稳定性:试剂于2℃-8℃避光保存,有效期为一年8.标准品和质量控制8.1校准程序:使用科华公司的校准品对自动分析仪进行校准。
按照公司标准品使用要求,并以9g/L氯化钠溶液或去离子水为空白,经校准测定,仪器自动对标准品通过合适的数学模型绘制校准曲线。
8.2质控品:罗氏公司提供的生化复合定值质控血清作为室内质控品。
每日在测定前做一次质控加试剂后做一次质控。
该质控品为干粉包装,在2-8℃冰箱可稳定到失效期,使用前用5ml去离子水复溶,待质控物充分溶解(大约30分钟)后使用。
8.3质控数据管理:按程序对检验后的质控后结果进行转换,及时质控数据进行分析处理,如出现失控值,应及时分析失控原因,并填写好相关失控记录。
8.4质控判断规则:按《Westgard多规则质控方法测定标准操作程序》8.5室间质评:分别参加河北省室间质评,对回报的室间质评结果按《室间质量评价程序》进行处理。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
目录
1. 检测原理
2. 标本采集与处理
2.1 受检者的准备
2.2 静脉采血
2.3 抗凝剂
2.4 标本处理
3. 试剂
3.1 试剂
3.2 校准血清
3.3 试剂与校准血清的稳定性
4. 仪器
5. 操作
6. 计算
7. 操作性能
7.1 精密度
7.2 准确度
7.3 灵敏度
7.4 可报告范围
7.5 特异性
7.6 干扰
8. 参考值
9. 临床意义
附录A: 参数
1. 检测原理
钒酸盐测定钒酸盐作用前后吸光度差异,可求得样品中的直接胆红素的浓度。
胆红素————胆绿素
pH 3.0
2. 标本采集与处理
2.1 受检者的准备:
病人空腹12h,不饮酒24h后采集血样。
体检对象抽血前应有两周的的正常状况记录。
注意有无应用影响测试项目的药物。
此外,对于体检者,采血的季节都应做相关记录,因为样本中各项目的含量有季节性变动,为了前后比较应在每年同一季节检验。
应嘱体检对象在抽血前24小时内不做剧烈运动。
2.2 静脉采血:
除非是卧床的病人,一般在采血时取坐位。
体位影响水分在血管内外的分布,会影响测试项目的浓度。
在采血前至少应静坐5分钟,一般从肘静脉取血,使用止血带的时间不超过1分钟,穿刺成功后立即松开止血带。
2.3 抗凝剂:
血浆多主张用EDTANa2(1mg/mL)抗凝。
2.4 标本处理:
血标本室温放置30min~45min后离心分离血清或血浆,在两小时内检测完毕;如两小时内不能检测完毕,将离心分离血清或血浆置洁净试管加盖2-8℃保存。
3.试剂
3.1 试剂:
本科使用湖南永和阳光科技有限责任公司TBIL试剂盒,为液体双试剂,各组分如下:
3.2 校准血清:
使用湖南永和阳光科技有限责任公司提供的40项校准血清。
校准频次:
空白定标:每日需做试剂空白定标。
全点定标:试剂换批号使用时或质控结果超过规定的2SD范围,需要全点定标。
3.3 试剂与校准血清的稳定性:
原包装试剂储存在2-8℃至标签所示失效日期。
试剂开瓶后,在仪器中至少可保存30天。
试剂储存在18-22℃稳定28天,试剂应避免污染。
试剂R1、R2颜色为无色,当试剂变色,按照试剂失效处理。
多项校准血清在2-8℃储存至标签所示失效日期,复溶后-20℃保存,可稳定一个月,只可冻融一次,避免反复冻融。
参见校准血清说明书。
4.仪器
KONELAB 30型号仪器。
性能:波长450nm,仪器测定吸光度的灵敏度应达到0.001ABS以上。
5.操作
样品为血清或肝素/EDTA抗凝血浆。
本法为终点法。
参数见后附,附录A。
试剂参数设置、定标操作以及样本检测常规操作,见仪器操作规程。
6.计算
ΔA测定
C = ————×C0
ΔA标准
式中:c——测定总胆红素浓度,μmol/L;
ΔA测定——标本管吸光度;
ΔA标准——标准管吸光度;
C O——校准血清中总胆红素浓度,μmol/L;
7.操作性能
7.1 精密度:
批内CV< 0.67%,批间CV<2.97%。
7.2 准确度:
检测结果的相对不准确度≤±10%。
7.3 灵敏度:
总胆红素浓度为:90μmol/L时,显色吸光度A450nm为0.272~0.332。
7.4 可报告范围:
血清与试剂用量之比为1:25时,测定上限为680μmol /L。
7.5 特异性:
测量值在给定值的90%-110%范围内。
7.6 干扰:
内源性干扰物溶血、脂血、黄疸对测试结果无明显影响。
8.参考值
2.0~20.4μmol /L。
9.临床意义
胆红素是老化的血红细胞中血红蛋白的代谢产物,血液中总胆红素和直接胆红素的含量测定有利于肝病和黄疸病的诊断。
附录A: 参数。
