分析化学考试题复习资料剖析
《分析化学》复习题及答案解析

《分析化学》复习题及答案解析一、选择题1.根据标准化法,我国标准分为四级,下面不属于这四级的是(D)。
A、国家标准B、行业标准C、企业标准D、卫生标准2.下列标准代号属于国家商业部颁布的推荐性标准是( B )。
A、SH/TB、SB/TC、QB/TD、DB/T3.下列属于重量分析法的是( D )。
A、凯氏定氮法测食品中粗蛋白的含量B、密度瓶测酒精的比重C、斐林试剂法测食品中还原糖的含量D、索氏抽提法测食品中粗脂肪的含量重量分析法主要有沉淀法(被测组分形成难溶化合物沉淀)、气化法(通过加热或用其他方法使样品中某种挥发性组分逸出)、电解法(电解原理,使金属离子在电极上析出)4.一化学试剂瓶的标签为红色,其英文字母的缩写为( B )。
A、GRB、ARC、CPD、LR5.一化学试剂瓶的标签为绿色,其英文字母的缩写为( A )。
A、GRB、ARC、CPD、LR6.滴定管的最小刻度为( A )。
A、0.1mlB、0.01mlC、1mlD、0.02ml7.用于配制标准溶液的试剂的水最低要求为( C )。
A、一级水B、二级水C、三级水D、四级水8.下列溶液中需要避光保存的是( B )。
A、氢氧化钾B、碘化钾C、氯化钾D、硫酸钾9.贮存易燃易爆,强氧化性物质时,最高温度不能高于( C )。
A、20℃B、10℃C、30℃D、0℃10.配制0.2mol/L 的H2SO4溶液,应选用( A )量取浓酸。
A、量筒B、容量瓶C、酸式滴定管D、移液管11.由组批或货批中所抽取的样品称之( B )。
A、采样B、检样C、原始样品D、平均样品12.把许多份检样综合在一起的样品称为( C )。
A、检验样品B、平均样品C、原始样品D、仲裁样品13.可用“四分法”制备平均样品的是( A )。
A、稻谷B、蜂蜜C、鲜乳D、苹果14.对样品进行理化检验时,采集样品必须有( B )。
A、随机性B、代表性C、典型性D、适时性15.湿法消化常用的消化剂是( C )。
分析化学考试复习题及答案

分析化学考试复习题及答案分析化学考试复习题:第一部分:误差及分析数据处理一.填空:√1.用丁二酮肟总量法测定Ni的含量,得到下列结果:10.48%、10.37%、10.43%、10.40% 10.47%已求得单次测定结果的平均偏差为0.036% 则相对平均偏差为();标准偏差为();相对标准偏差为()。
√2.滴定管的读数常有±0.01mL的误差,在完成一次测定时的绝对误差可能为()mL;常量分析的相对误差一般要求应≤0.1%,为此,滴定时消耗标准溶液的体积必须控制在( ) mL以上。
√3.定量分析中,影响测定结果精密度的是()误差。
√5.0.908001有()位有效数字,0.024有()位有效数字二.选择:√1.下列有关偶然误差的论述中不正确的是(A)偶然误差具有随机性(B)偶然误差具有单向性(C)偶然误差在分析中是无法避免的(D)偶然误差的数值大小、正负出现的机会是均等的√4.如果要求分析结果达到0.1%的准确度,使用灵敏度为0.1mg的天平称取试样时,至少应称取(A)0.1g (B)0.2g (C)0.05g (D)0.5g三.判断:√1.下面有关有效数字的说法是否正确(A)有效数字中每一位数字都是准确的(B)有效数字中的末位数字是估计值,不是测定结果(C)有效数字的位数多少,反映了测量值相对误差的大小(D)有效数字的位数与采用的单位有关√2.下面有关误差的叙述是否正确(A)准确度高,一定要求精密度高(B)系统误差呈正态分布(C)精密度高,准确度一定高(D)分析工作中,要求分析误差为零√3.判断下列说法是否正确(A)偏差是指测定值与真实值之差(B)随机误差影响测定结果的精密度(C)在分析数据中,所有的“0”均为有效数字(D)方法误差属于系统误差四.回答问题:√1.指出在下列情况下,都会引起哪种误差?如果是系统误差,应该采用什么方法避免?(1)读取滴定体积时,最后一位数字估计不准(2)试剂中含有微量的被测组分(3)滴定时不慎从锥形瓶中溅出一滴溶液(4)重量分析中,沉淀溶解损失√3.指出下列操作的绝对误差和相对误差(1)用台秤称出10.6g固体试样(2)用分析天平称得坩埚重为14.0857g第二部分滴定分析一.填空:√1.称取纯K2Cr2O7 5.8836g,配制成1000mL溶液,则此溶液的C(K2Cr2O7)为()mol L-1,C(1/6K2Cr2O7)为(),T(Fe/K2Cr2O7)为()g/ mL,T(Fe2O3/K2Cr2O7)为()g /mL,T(Fe3O4/K2Cr2O7)为()g /mL。
2024年6月份考试 1238分析化学期末复习题

1238 分析化学复习题1、银量法中,以铁铵矾作指示剂,用NH4SCN为标准溶液滴定溶液中的Ag+,称为()法。
A、莫尔B、佛尔哈德C、碘D、法扬斯答案: B2、各次测定值与平均值之差称为()。
A、误差B、公差C、相对偏差D、偏差答案: D3、配制1mol ·L-1 NaOH溶液500ml,应称取()g固体NaOH。
A、 2B、 5C、10D、 20答案: D4、将2.4374修约为四位有效数字是()。
A、 2.437B、 2.438C、 2.43D、 2.436答案: A5、从1L1mol ·L-1的NaOH溶液中取出100mL,取出的溶液中NaOH的物质的量浓度是多少 mol ·L-1? ()A、 0.5B、 1C、 1.5D、 2答案: BA、称量瓶B、容量瓶C、锥形瓶D、安瓿答案: A7、进行有危险性的工作应()。
A、穿戴工作服B、戴手套C、有第二者陪伴D、自己独立完成答案: C8、在进行容量仪器的矫正时所用的标准温度是()℃。
A、 15B、 20C、18D、 19答案: B9、滴定管在记录读数时,小数点后应保留()位。
A、 1B、 2C、 3D、 4答案: B10、下面不宜加热的仪器是()。
A、试管B、坩埚C、蒸发皿D、移液管答案: D11、现需要配制0.1000mol/L KCl溶液,下列仪器中最合适的量器是()。
A、容量瓶B、量筒C、刻度烧杯D、酸式滴定管答案: AA、眼睛看着滴定管中液面下降的位置B、眼睛注视滴定管流速C、眼睛注视滴定管是否漏液D、眼睛注视被滴定溶液颜色的变化答案: D13、放出移液管中的溶液时,当液面下降至管尖后,应等待()以上。
A、 5sB、10sC、15sD、 20s答案: C14、制作馒头时,需加入面碱(主要含碳酸钠),如果面碱放多了,蒸出的馒头会发黄,且口感不好。
为除去过多的面碱,做馒头时可加入适量的()。
A、食醋B、食盐C、料酒D、味精答案: A15、下列关于浓硫酸的描述错误的是()。
【精品】分析化学复习题.doc

第一章、绪论1.分析化学的主要任务是什么?在国民经济建设中有何作用?2.从学习和牛活实践中举出一列说明分析化学所起的作用?3.分析化学分类的依据是什么?如何分类?4.“分析化学”和“化学分析”在概念上有什么不同?5.进行分析化学有哪些步骤?6.分析工作应具备什么样的素质,才能胜任好本职工作?7.要学好分析化学,你有什么打算?■>定量分析中的误差及结果处理一、选择题1.下列叙述不正确的是()A.误差是医院真实值为标准的,偏差是以平均值为标准的。
实际工作获得的所谓“误差”, 实质上仍是偏差B.对某项测定来说,它的系统误差大小是可以测量的C.对偶然谋差來说,大小相近的正误差和负谋差出现的机会是均等的D.某测定的精密度愈好,则该测定的准确度愈好2.在滴定分析中,出现的下列情况,那种导致系统误差()A.试样未经充分混匀B.滴定管的读数读错C.滴定吋有滴液溅出D.袪码未经校准3.分析测定中的偶然误差,就统计规律来讲,其()A.数值固定不变B.止误差出现的概率大于负误差C.大误差出现的概率小,小无误差出现的概率大D.数值相等的正、负误差出现的概率均等4.分析测定中出现的下列情况,何种属于偶然-误差()A.滴定时所加的试剂中含有微量的被测物质B.某分析人员儿次读数读取同一滴定管的数值不一致C.某分析人员读取滴定管读数时总是偏高或偏低D.滴定时发现有少量的溶液溅出5.可川下列哪种方法减少分析测定中的偶然误差()A.进行对照试验B.进行空白试验C.进行仪器校准D.增加平行试验的次数6.有计算器算的2.236X101124一 1.036X0. 2000的结果为12.004471,按有效数值运算规则应将结果修约为()A. 12B.2. 0C. 12. 007.下列数据屮有效数字是四位的是()A. 0. 025B. 0. 0234C. 10. 030 &下列数据中包含两位有效位的是()A. PH二6. 5B. -5.3C. 10.09. PH=10. 20,有效数字的位数是()A.四位B.三位C.两位D. 12. 004 D. 40. 02 % D. 0. 02 D.不确定10.在秤量样品吋试样会吸收微量的水分,这属于() A.系统误差 B.偶然误差 C.过失误差 D.没有误差11・读取滴定管读数时,最后一位估计不准,这是() A.系统误差B.偶然误差C.过失误差D.没有误差12. 有四位同学测定同一试样,最后报告测定结果的平均偏差如下,其中正确的是() A. 0. 1285% B. 0. 1 %C. 0. 128%D. 0. 12850%13. 测得某水泥熟料屮的S03的含量,秤取试样量为2. 2g 下列的那份报告是合理的 ( ) A. 2. 085%B. 2.08%C. 2. 09 %D. 2. 1 %14分析硅酸盐样品中的SiO 》的含量,称取样品的质量为2.4650s 下曲的那份报告是合理 的() A. 62. 37% B. 62.3%C. 62.4%15.用25ml 的移液管移取的溶液的体积应记录为(A. 25mlB. 25. 0mlC. 25. 00ml16.下列表述不正确的是()A. 偏差是测定值与真实值之差B. 平均偏差常用來表示一组测定数据的精密度C. 平均偏差表示精密度的缺点是缩小了大误差的影响D. 平均偏差表示精密度的优点是比较简单的 17.下列衣述止确的是()A. 标准偏差能较好的反映测定数据的精密度B. 标准偏差表示单次测定的结果的相对偏差C. 变异系数即为相对平均偏差 I ).标准偏差又称变异系数1&某学牛测定铜合金中铜含量,得到以下数据:62.54% , 62.46% , 62. 50% , 62.48% , 62.52%。
大学生分析化学复习资料

第一章绪论一.选择题1.试样用量为0.1 ~ 10 mg的分析称为--------- ( )(A) 常量分析(B) 半微量分析(C) 微量分析(D) 痕量分析2.试液体积在1 ~ 10 mL的分析称为--------------( )(A) 常量分析(B) 半微量分析(C) 微量分析(D) 痕量分析3.准确移取1.0 mg/mL铜的标准溶液2.50 mL,于容量瓶中稀释至500 mL, 则稀释后的溶液含铜(μg/mL)为-----------------------------------------( )(A) 0.5 (B) 2.5 (C) 5.0 (D) 254.每100 mL人体血浆中,平均含K+18.0mg和Cl-365 mg。
已知M(K+)= 39.1 g/mol, M(Cl-) =35.5 g/mol。
血浆的密度为1.0 g/mL。
则血浆中K+和Cl-的浓度为----------( )(A) 1.80 ×10-1和3.65 mol/L (B) 7.04×10-3和1.30×10-1 mol/L(C) 4.60×10-3和1.03×10-1 mol/L (D) 4.60×10-6和1.03×10-4 mol/L5.海水平均含1.08×103 μg/gNa+和270 μg/gSO42-, 海水平均密度为1.02g/mL。
已知A r(Na)=23.0, M r(SO42-)=96.1,则海水中pNa和pSO4分别为-------( )(A) 1.32 和2.54 (B) 2.96 和3.56 (C) 1.34 和2.56 (D) 4.32 和5.546.以下试剂能作为基准物的是----------( )(A) 分析纯CaO (B) 分析纯SnCl2·2H2O (C) 光谱纯三氧化二铁(D) 99.99%金属铜7.用邻苯二甲酸氢钾为基准物标定0.1 mol/L NaOH溶液,每份基准物的称取量宜为[M r(KHC8H8O4)=204.2] ---------------- ( )(A) 0.2 g左右(B) 0.2 g ~ 0.4 g (C) 0.4 g ~ 0.8 g (D) 0.8 g ~ 1.6 g8.在滴定分析中所用标准溶液浓度不宜过大,其原因是-----------------( )(A) 过量半滴造成误差大(B) 造成终点与化学计量点差值大,终点误差大(C)造成试样与标液的浪费(D) (A)、(C)兼有之(A) 0.16 (B) 0.32 (C) 0.08 (D) 0.649.今欲测定某含Fe、Cr、Si、Ni、Mn、Al等的矿样中的Cr和Ni, 用Na2O2熔融, 应采用的坩埚是------------------------------( )(A) 铂坩埚(B) 银坩埚(C) 铁坩埚(D) 石英坩埚10. 用HCl + HF分解试样宜选的坩埚是-----------------( )(A) 银坩埚(B) 瓷坩埚(C) 铂坩埚(D) 石英坩埚11.用NaOH熔融分解试样宜选的坩埚是---------------------( )(A) 铂坩埚(B) 瓷坩埚(C) 银坩埚(D) 石英坩埚12.今欲测定含Fe、Cr、Si、Ni、Mn、Al等的矿样中的Cr和Ni, 用Na2O2作熔剂, 熔融后以水提取熔块, 溶液的成分是---------------------( )(A) FeO33-、CrO42-、SiO32-、MnO4-和Ni2+(B) CrO42-、SiO32-、Ni2+、MnO4-和AlO2-(C) Cr2O72-、SiO32-、MnO4-和AlO2-(D) CrO42-、SiO32-、MnO4-和AlO2-13.欲以K2Cr2O7法测定赤铁矿中Fe2O3的含量,溶解试样一般宜用的溶剂( )(A) HCl (B) H2SO4(C) HNO3(D) HClO414.以下物质必须采用间接法配制标准溶液的是---------------( )(A) K2Cr2O7(B) Na2S2O3(C) Zn (D) H2C2O4·2H2O15.以下标准溶液可以用直接法配制的是-------------( )(A) KMnO4(B) NaOH (C) K2Cr2O7(D) FeSO416.配制以下标准溶液必须用间接法配制的是-----------------( )(A) NaCl (B) Na2C2O4(C) NaOH (D) Na2CO317.1:2 H2SO4溶液的物质的量浓度为--------------------( )(A) 6mol/L (B) 12mol/L (C) 24mol/L (D) 18mol/L二.填空题1.常量分析与半微量分析划分界限是:被测物质量分数高于________%为常量分析; 称取试样质量高于________g为常量分析。
《分析化学》期末考试复习题及参考答案
分析化学复习题(课程代码 252402)一、填空题1、定量分析的过程通常包括_______________________________________________;定量分析的精密量器是指_____________________________________________。
2、配位滴定法中常见的滴定方式包括_______________________________________。
3、0.02000 mol·L-1的K2Cr2O7标准溶液(Mr=294.18)对Fe 2O3(M r=159.67)的滴定度为_____________________________________________________;已知试样中As2S3(M r =246.0)的质量分数为0.2000,则换算成BaSO4(M r =233.39)的质量分数为____________________________。
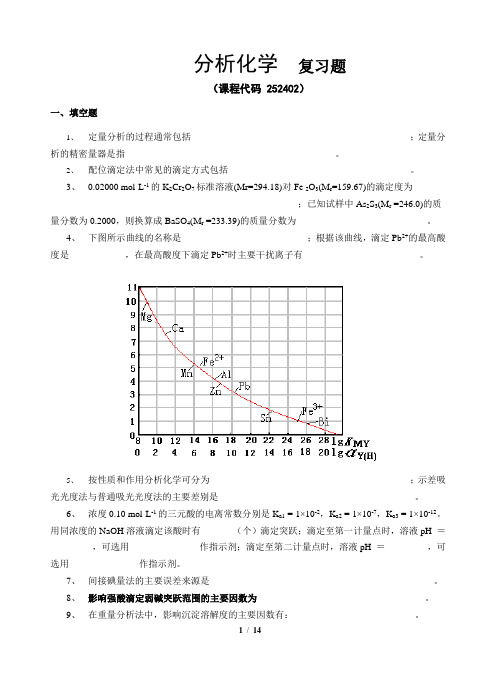
4、下图所示曲线的名称是___________________________;根据该曲线,滴定Pb2+的最高酸度是____________,在最高酸度下滴定Pb2+时主要干扰离子有_________________________。
5、按性质和作用分析化学可分为___________________________________________;示差吸光光度法与普通吸光光度法的主要差别是__________________________________________。
6、浓度0.10 mol·L-1的三元酸的电离常数分别是K a1 = 1×10-2,K a2 = 1×10-7,K a3 = 1×10-12。
用同浓度的NaOH溶液滴定该酸时有_______(个)滴定突跃;滴定至第一计量点时,溶液pH =_________,可选用_______________作指示剂;滴定至第二计量点时,溶液pH =_________,可选用_______________作指示剂。
(完整版)分析化学考试题库有答案

分析化学题库第一、二章绪论、误差一、判断题:1.按照测定原理,分析化学常分为化学分析和仪器分析两大类。
( √) 2.分析化学的任务包括定性分析、定量分析、结构分析和形态分析。
(×)3.用高锰酸钾法测定双氧水中过氧化氢的含量是属于滴定分析。
( √) 4.偶然误差是定量分析中误差的主要来源,它影响分析结果的精密度。
( √) 5.只要是可疑值(或逸出值)一定要舍去。
(×)6.被分析的物质称为样品,与样品发生化学反应的物质称为试剂,以化学反应为基础的分析方法称为化学分析法。
( √)7、偏差是测量值与平均值之差。
(×)8、绝对误差是测量值与真实值之差。
( √)9、增加平行测定次数,可以减少系统误差。
(×)10、当偶然误差消除后,分析结果的精密度越高,准确度越高。
(×)11、在滴定分析中,测定结果的精密度越高,其准确度也越高。
(×)12、相对平均偏差、样本标准偏差、总体标准偏差都可用来表示测定值的分散程度。
(×)13.增加测定次数可以提高分析结果的准确度。
(×)14.用20ml移液管移取NaOH溶液,体积数记为20ml。
(×)15.按照测定原理,分析化学常分为化学分析和仪器分析两大类。
( √) 16.用酸碱滴定法测定醋酸的含量,属于化学分析。
( √)17.化学分析是分析化学的基础,仪器分析是分析化学发展的方向。
( √)18.在一定称量范围内,被称样品的质量越大,称量的相对误差就越小。
( √) 19.滴定管的初读数必须是“0.00ml”。
(×)20.测定0.8ml 样品溶液的含量,属于常量分析。
(×)21.测定值与真实值相接近的程度称为准确度。
( √)二、填空题1.配制用的蒸馏水中含有少量被测组分,此情况属于系统误差。
2.用50ml移液管移取NaOH溶液,体积数记为50.00 ml。
3.称量太慢,使试样吸湿,此情况属于系统误差。
分析化学期末考试复习题及参考答案-高起本

《分析化学》复习题一、填空题1、滴定管一次读数误差为±0.01 mL ,若滴定相对误差不大于±0.1%, 则滴定剂用量至少应为mL ,最好使体积在 mL 左右,以减小相对误差。
2、某学生分析氯化物中氯的含量,重复测定四次,结果如下:52.68%,53.17%,52.73%,52.67%。
用Q 检验法判断数据53.17%在置信度为90%时是否应当舍弃(已知Q 0.90,4=0.76),舍弃商Q 等于 ,结论是 (填舍弃或保留)。
3、莫尔法与佛尔哈德法的指示剂分别为 、 。
4、光度法测定某物质,若有干扰,应根据 和 原则选择波长。
5、NaOH 滴定HCl 时,浓度增大10倍,则滴定曲线突跃范围增大 个pH单位。
6、在一定条件下用Ce(SO 4)2标准溶液滴定相同浓度的Fe 2+溶液,已知)Ce /Ce (34++O 'ϕ=1.44V ,)Fe /Fe (23++O 'ϕ=0.68V , 则化学计量点时溶液电势为 V 。
7、在分光光度法中,以 为纵坐标,以 为横坐标,可得光吸收曲线。
浓度不同的同种溶液,其最大吸收波长 ,相应的吸光度大小 。
8、电位分析中,电位保持恒定的电极称为 电极,常用的有 电极和 电极。
9、高效液相色谱分析中,如果样品组分的分配比范围很宽,宜采用措施;在气相色谱分析中,如果样品组分的沸点范围很宽,宜采用措施,这些操作的目的都是为了改善分离效果。
10、在原子吸收法中,火焰原子化器与石墨炉原子化器相比较,后者测定的灵敏度更。
11、EDTA滴定中,介质pH越低,则αY(H)值越_ __,O'K越_ __,滴定的pM 突跃越_ __。
(填“大”、“小”)12、用普通吸光光度法测得标准溶液c1的透光率为20%,待测溶液透光率为12%,若以示差法测定,以标准溶液c1作参比,则待测溶液透光率为_ __,相当于将仪器标尺扩大_ __倍。
13、用KMnO4滴定H2C2O4溶液,第一滴KMnO4滴入后紫色褪去很慢,而随着滴定的进行反应越来越快,这是由于反应生成的有作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
黑龙江科技学院考试试题第1套课程名称:分析化学课程编号:适用专业(班级):化工11级1-2班共4页命题人:教研室主任:第1页一、填空题(每空1分,共15分)1.滴加的标准溶液与待测组分恰好反应完全的这一点,称为化学计量点。
在待测溶液中加入指示剂,当指示剂变色时停止滴定,这一点称为滴定终点。
2.沉淀形式是指被测物与沉淀剂反应生成的沉淀物质,称量形式是指沉淀经过烘干或灼烧后能够进行称量的物质。
3.判断下图所示滴定曲线类型,并选择一适当的指示剂。
(见下图、表)曲线的类型为强碱滴定弱酸_,宜选用酚酞_为指示剂。
p H 指示剂变色范围p H苯胺黄 1. 3 — 3. 2甲基橙 3. 1 — 4. 410 甲基红 4 .4 — 6. 2酚酞8. 0 — 10.08 硝胺11.0 — 12. 364250 100 150 200 标准溶液加入量%4、44H24水溶液的质子条件式[3]+[]+[42-]+2[43-]=[]+[H34]。
5.某三元酸的电离常数分别是1 = 1×10-2,2 = 1×10-6,3 = 1×10-12。
用标准溶液滴定时有2个滴定突跃。
滴定至第一计量点时,溶液=_4_,可选用_甲基橙_作指示剂。
6.根据有效数字计算规则计算:1.683 + 37.42×7.33÷21.4-0.056 = 14.4 。
7.测得某溶液值为2.007,该值具有_3位有效数字8.对于某金属离子M与的络合物,其'()先随溶液增大而增大这是由于的酸效应减小,而后又减小;这是由于金属离子水解效应增大_。
9.常见的氧化还原滴定法主要有高锰酸钾法,重铬酸钾法,碘量法。
二、选择题(每题10分,共10分)1.下列反应中滴定曲线对称的反应是(A )。
A.4+ + 2+ = 3+ + 3+B.2 3+ + 2+ = 2 2+ + 4+C.I2 +2 S2O32- =2+ S4O62- D.4- + 52+ + 8 = 2+ + 53+ + 4H2O 2.在滴定分析测定中,属偶然误差的是(D )A.试样未经充分混匀B.滴定时有液滴溅出C.砝码生锈D.滴定管最后一位估读不准确3.下列各项叙述中不是滴定分析对化学反应要求的是( D )。
A.反应必须有确定的化学计量关系B.反应必须完全C.反应速度要快D.反应物的摩尔质量要大4.用4法滴定2+时,的氧化被加快,这种情况称( C )A.催化反应B.自动催化反应C.诱导效应D.副反应5.只考虑酸度影响,下列叙述正确的是(A )A.酸度越大,酸效应系数越大B.酸度越小,酸效应系数越大C.酸效应系数越大,络合物的稳定性越高D.酸效应系数越大,滴定突跃越大6.下列叙述中,哪个不是重量分析对称量形式的要求( C )。
A. 称量形式必须有确定的化学组成B. 称量形式必须稳定C. 称量形式的颗粒要大D. 称量形式的摩尔质量要大7.关于准确度与精密度关系的四种表述中正确的是( A )(1) 精密度是保证准确度的必要条件(2) 高的精密度一定能保证高的准确度(3) 精密度差,所测结果不可靠,再衡量准确度没有意义(4) 只要准确度高,不必考虑精密度A.1,3 B.2,4 C.1,4 D.2,38.分析纯的下列试剂不可以当基准物质的是(C )A.3 B.硼砂C.4·7H2O D.邻苯二甲酸氢钾9.用0.1的溶液滴定同浓度的3H2O(=1.80×10-5)时,适宜的指示剂为(C )。
A.甲基橙(3.4) B.溴甲酚兰(4.1)C.甲基红(5.0) D.酚酞(9.1)10.用K22O7法测2+,加入H34的主要目的是(D )A.同3+形成稳定的无色化合物,减少黄色对终点的干扰B.减小32+的电极电位数值,增大突跃范围C.提高酸度,使滴定趋于完全D.A和B三、简答题(共4题,25分)1.为什么标准溶液能直接滴定醋酸,而不能直接滴定硼酸?试加以说明。
(4分)答:因为醋酸的为4.74,满足≥10-8的准确滴定条件,故可用标准溶液直接滴定;硼酸的为9.24,不满足≥10-8的准确滴定条件,故不可用标准溶液直接滴定。
2.什么是金属指示剂的封闭和僵化?如何避免?(7分)答:如果指示剂与金属离子形成更稳定的配合物而不能被置换,则虽加入过量的也达不到终点,这种现象称为指示剂的封闭。
想避免这种现象,可以加入适当的配位剂来掩蔽能封闭指示剂的离子。
指示剂与金属离子形成的配合物如果是胶体或沉淀,在滴定时指示剂与的置换作用将因进行缓慢而使终点拖长,这种现象称为指示剂的僵化。
想避免这种现象,可以加入有机溶剂或将溶液加热,以增大有关物质的溶解度及加快反应速率,接近终点时要缓慢滴定,剧烈振摇。
3. 哪些因素影响氧化还原滴定的突跃范围的大小?如何确定化学计量点时的电极电位?(8分)答:(1) 对于反应 n 21 + n 12 = n 2 1 + n 1 2 化学计量点前0.1%:2/Red Ox Red Ox 22/Red Ox 059.03' c c lg 059.0'22222n n ⨯+=+=θθϕϕϕ 化学计量点后0.1%:1/Red Ox Red Ox 11/Red Ox 059.03' c c lg 059.0'11111n n ⨯-=+=θθϕϕϕ 所以凡能影响两条件电极电位的因素(如滴定时的介质)都将影响滴定突跃范围,此外与n 1, n 2有关,但与滴定剂及被测溶液的浓度无关。
(2) 对于可逆对称氧化还原反应:212211sp ''n n n n ++=θθϕϕϕ , 与氧化剂和还原剂的浓度无关;对可逆不对称氧化还原反应n 21 + n 12 = a n 2 1 + b n 1 2111221212211sp ]a[Red ]b[Ox lg 059.0''--a b n n n n n n ++++=θθϕϕϕ 与氧化剂和还原剂的浓度有关,对有 参加的氧化还原反应,还与[]有关。
4.什么是共沉淀和后沉淀?发生的原因是什么?对重量分析有什么不良影响?(6分)答:当一种难溶物质从溶液中沉淀析出时,溶液中的某些可溶性杂质会被沉淀带下来而混杂于沉淀中,这种现象为共沉淀,其产生的原因是表面吸附、形成混晶、吸留和包藏等。
后沉淀是由于沉淀速度的差异,而在已形成的沉淀上形成第二种不溶性物质,这种情况大多数发生在特定组分形成稳定的过饱和溶液中。
无论是共沉淀还是后沉淀,它们都会在沉淀中引入杂质,对重量分析产生误差。
四、计算题(共5题,50分)1.测定试样中P 2O 5质量分数(%),数据如下:8.44,8.32,8.45,8.52,8.69,8.38 .用Q 检验法对可疑数据决定取舍,求平均值、平均偏差d 、标准偏差s 和置信度选90%及99%的平均值的置信范围。
(13分)解:将测定值由小到大排列 8.32,8.38,8.44,8.45,8.52,8.69.可疑值为(1) 用Q 值检验法Q 计算 11x x x x n n n ---32.869.852.869.8--0.46查表2-4,6时, Q 0.90=0.56 Q 计算<Q 表故8.69%应予保留。
两种判断方法所得结论一致。
(2) )(6)38.869.852.845.832.844.8+++++=x 8.47% )609.022.005.002.015.003.0(+++++=d 0.09% %16)09.0()22.0()05.0()02.0()15.0()03.0(222222-+++++0.13%(3) 查表2-2,置信度为90%,6时,2.015因此 μ=(8.47±613.0015.2⨯)=(8.47±0.11)% 同理,对于置信度为99%,可得μ=(8.47±613.0032.4⨯)(8.47±0.21)% 2.某弱酸的9.21,现有其共轭碱溶液20.00 浓度为0.1000 ·1,当用0.1000·1溶液滴定时,化学计量点的为多少?化学计量点附近的滴定突跃为多少?应选用何种指示剂指示终点?解:计量点时 + → +c ()=0.05000·1 10510050000.021.9〉=-a K c c·0.05000×10-9.21﹥10[]621.91055.510050000.0--+⨯=⨯=H5.26计量点前剩余0.1﹪时 c()=51000.598.1900.201000.002.0-⨯=+⨯ c()= 050.098.1900.201000.098.19=+⨯ []7521.91016.61000.5050.010---+⨯=⨯⨯=H 6.21 计量点后,过量0.02 []51000.502.2000.201000.002.0-+⨯=+⨯=H4.30滴定突跃为6.21-4.30,选甲基红为指示剂。
3.称取0.1005g 纯3溶解后,用容量瓶配成100溶液。
吸取25,在﹥12时,用钙指示剂指示终点,用标准溶液滴定,用去24.90。
试计算:(1)溶液的浓度;(2)每毫升溶液相当于多少克和2O 3。
(9分)答案:(1)c()330.25000.2510-⨯⨯V M m CaCO 30..10000.251090.241.1001005.0-⨯⨯⨯=0.01008·1 (2)()××10-3=0.01008×81.04×10-3=0.008204g ·1 2O321()×M 2O3×10-3=21×0.01008×159.7×10-3=0.008048 g ·14.计算 = 10.0, 3= 0.1 1 2的溶液中电对的条件电极电位(忽略离子强度的影响)。
已知锌氨配离子的各级累积稳定常数为:β1 =2.27, β2 =4.61, β3 =7.01, β4 = 9.067;4+的离解常数为 =10-9.25。
(13分)答案:2+ + 2 = (ϕθ = -0.763 V )++=2lg 2059.0'Zn Zn ααϕϕθθ ()[][][]()[]++++++==++223322223Zn NH Zn ZnNH Zn Zn C Zn Zn NH α[][][]434232311NH NH NH βββ++++=而()[][][][][][]071.034334101113=+=+=+=+++H Ka NH NH NH NH NH H NH α又α3(H) = 3/ [3] 则[3]= 0.1/10 0.071 = 10-0.93()()()()37.540.939.0630.937.0120.934.610.932.27NH Zn 0110101010101010101α32=⋅+⋅+⋅+⋅+=∴----+ V 920.0101lg 2059.0763.037.5'-=+-=θϕ5.称取含有和的试样0.5776g, 用重量法测定, 得到二者的银盐沉淀为0.4403g ;另取同样质量的试样,用沉淀滴定法滴定,消耗0.1074·L -1 325.25溶液。
