高中化学常见吸热反应与放热反应
人教版高中化学必修2课件 吸热反应和放热反应

吸热反应和放热反应
常见的吸热反应 多数分解反应、盐类的水解反应、金属的冶炼(铝热除 外)、分子拆成原子等。 C+CO2 C+H2O(g) N2+O2
高温
2CO CO+H2 2NO BaCl2+2NH3↑+10H2O
高温 放电
Ba(OH)2· 8H2O+2NH4Cl
吸热反应和放热反应
1.反应热与焓变 反应热:在化学反应过程中,当反应物和生成物具
吸热反应和放热反应 观察下列示意图:
从键能上看:ΔH=E(反应物)总键能-E(生成物)总键能
吸热反应和放热反应
问题解决1
N2和H2在一定条件下可发生如下反应:
N2(g)+3H2(g)
收的能量分别为:
2NH3(g) ,已知断裂下列化学键需要吸
N≡N akJ· mol-1 、H-H bkJ· mol-1 、N-H ckJ· mol-1 根据有关数据估算上述反应的△H,其中正确的是( C )
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为
Cu(s) + 2H (aq) +H2O2(l)==Cu2 (aq) +2 H2O(l)△H=−319.68kJ/mol
+
+
吸热反应和放热反应
知识点——吸热反应和
放热反应
吸热反应和放热反应
常见的放热反应
燃烧、酸碱中和、活泼金属与水或酸反应、铝热反应、
多数化合反应、原子结合为分子等
2NO2
2SO2+O2
N2O4
催化剂
△H <0
△H <0
∆
2SO3
高中化学常见的吸热和放热反应

高中化学常见的吸热和放热反应引言在化学中,反应过程可以分为吸热反应和放热反应两种类型。
吸热反应指的是在反应过程中吸收了热量,使周围环境温度下降;而放热反应则是指在反应过程中释放了热量,使周围环境温度升高。
本文将详细介绍高中化学中常见的吸热和放热反应,并对其原理进行解析。
吸热反应1. 溶解盐类当溶解一些盐类时,会出现明显的吸热现象。
这是因为溶解盐类需要克服晶格能,而晶格能是由于正负离子之间相互作用力所导致的。
当溶解盐类时,需要提供足够的能量来克服这种相互作用力,从而导致周围环境温度下降。
2. 酸碱中和反应酸碱中和反应也是一种常见的吸热反应。
在酸碱中和过程中,氢离子(H+)与氢氧根离子(OH-)结合形成水分子,同时释放出大量的热能。
这种反应可以用以下化学方程式表示:H+ + OH- → H2O + 热能由于放出的热能被周围环境吸收,所以酸碱中和反应会导致周围环境温度下降。
3. 蒸发过程蒸发是一种吸热过程。
当液体蒸发时,分子从液态转变为气态,需要克服分子间的相互作用力。
这个过程需要吸收大量的热量来提供所需的能量,从而导致周围环境温度下降。
4. 化学反应一些化学反应也是吸热反应,例如氧化铵和水剧烈反应产生氨气和氢气。
这个反应会吸收大量的热能,并且伴随着剧烈的放烟火花现象。
类似地,其他一些化学反应也可能是吸热反应。
放热反应1. 燃烧反应燃烧是一种常见的放热反应。
在有机物与氧气发生完全燃烧时,会释放出大量的热能。
这是因为燃烧反应是一种高度放热的氧化反应,其化学方程式可以表示为:燃料+ O2 → CO2 + H2O + 热能由于放出的热能被周围环境吸收,所以燃烧反应会导致周围环境温度升高。
2. 中和反应除了酸碱中和反应中的吸热现象外,还有一些中和反应是放热的。
例如,在硫酸与氢氧化钠溶液中进行中和反应时,释放出大量的热能。
这种反应可以用以下化学方程式表示:H2SO4 + 2NaOH → Na2SO4 + 2H2O + 热能由于释放出的热能被周围环境吸收,所以中和反应会导致周围环境温度升高。
常见的吸放热反应吸热反应

常见的吸放热反应吸热反应放热反应:①活泼金属置换水或酸中氢的反应,如:2Na+2H2O=2N aOH+H2↑2Al+6HCl=2AlCl3+3H2↑ ②酸碱中和反应。
如:NaOH+HCl=NaCl+H2O2KOH+H2SO4=K2SO4+2H2O ③含碳燃料燃烧的反应,如:2CO+O2=2CO2 CH3CH2OH+3O2=2CO2+3H2O ④易爆物质的爆炸反应。
⑤多数的化合反应,如:Na2O+H2O=2NaOH CaO+H2O=Ca(OH)2 ⑥一些物质的溶解,如浓硫酸的稀释、氢氧化钠的溶解、氧化钙的溶解等。
吸热反应:①几个常见的反应,如:2NH4Cl(s)+Ba(OH)2·8H2O(s)=BaCl2+2NH3↑+10H2O C+H2O(g)=CO+H2 ②多数的分解反应,如:CaCO3=Ca O+CO2↑ CuSO4·5H2O=CuSO4+5H2O ③一些物质的溶解,如硝酸铵溶解等。
常见的放热反应:1.一切燃烧,以及部分氧化(如氨气氧化)2.中和、沉淀(不全是)3.多数化和,如SO3+H2O,NH3+HCl(但H2+I2,合成NH3吸热)4.特别剧烈的反应,如电石和水常见的吸热反应:1.高温下碳还原金属氧化物2.电离,水解3.多数化和,如KClO3,KMnO4,CaCO34.必须持续加热的反应,如石油裂化常见的放热反应:所有的燃烧反应(O2,Cl2中进行)酸碱中和反应金属与酸H+(H2O)铝热反应合成氨硫酸工业(接触室)2SO2+O2=(可逆)2SO3硝酸工业制NO 4NH3+502=4NO+6H2O常见的吸热溶解吸热NH4NO3Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3+10H2O大多数的分解反应C+H2O=CO+HC(制水煤气法)C+CO2=2CO(制煤气)N2+O2=2NO1、高温下碳或H2还原金属氧化物,如:C + 2CuO=高温=2Cu+ CO2↑2Fe2O3+3C=高温=4Fe+ 3CO2↑Fe3O4+2C=高温=3Fe + 2CO2↑CuO + H2 =△=Cu + H2OFe2O3+3H2=△=2Fe+3H2OFe3O4+4H2=△=3Fe+4H2OWO3+3H2=△=W +3H2OMoO3+3H2=△=Mo +3H2O2、电离反应3、盐类的水解4、CO2+C=高温=2CO C+H2O(气)=高温=CO+H25、CuO +CO=△=Cu + CO2↑6、氢氧化钡晶体与氯化铵晶体的反应。
2023年高中化学反应原理知识点

高中化学反应原理知识点化学反应与能量考点1:吸热反应与放热反应1、吸热反应与放热反应的区别特别注意:反应是吸热还是放热与反应的条件没有必然的联系,而决定于反应物和生成物具有的总能量(或焓)的相对大小。
2、常见的放热反应①一切燃烧反应;②活泼金属与酸或水的反应;③酸碱中和反应;④铝热反应;⑤大多数化合反应(但有些化合反应是吸热反应,如:N2+O2=2NO,CO2+C=2CO等均为吸热反应)。
3、常见的吸热反应①Ba(OH)2·8H2O与NH4Cl反应;②大多数分解反应是吸热反应③等也是吸热反应;④水解反应考点2:反应热计算的依据1.根据热化学方程式计算反应热与反应物各物质的物质的量成正比。
2.根据反应物和生成物的总能量计算ΔH=E生成物-E反应物。
3.根据键能计算ΔH=反应物的键能总和-生成物的键能总和。
4.根据盖斯定律计算化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与反应的途径无关。
即如果一个反应可以分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的。
温馨提示:①盖斯定律的主要用途是用已知反应的反应热来推知相关反应的反应热。
②热化学方程式之间的“+”“-”等数学运算,对应ΔH也进行“+”“-”等数学计算。
5.根据物质燃烧放热数值计算:Q(放)=n(可燃物)×|ΔH|。
二化学反应速率与化学平衡考点1:化学反应速率1、化学反应速率的表示方法___________。
化学反应速率通常用单位时间内反应物浓度和生成物浓度的变化来表示。
表达式:___________ 。
其常用的单位是__________ 、或__________ 。
2、影响化学反应速率的因素1)内因(主要因素)反应物本身的性质。
2)外因(其他条件不变,只改变一个条件)3、理论解释——有效碰撞理论(1)活化分子、活化能、有效碰撞①活化分子:能够发生有效碰撞的分子。
②活化能:如图图中:E1为正反应的活化能,使用催化剂时的活化能为E3,反应热为E1-E2。
高中化学最基础考点系列考点吸热反应与放热反应新人教选修

考点2 吸热反应与放热反应【考点定位】本考点考查常见的放热反应与吸热反应的判断,了解化学变化过程中能量变化的原因,属最基础考点,特别注意能量变化与反应条件无关。
【精确解读】1.吸热反应的概念:化学键角度:新化学键的形成所释放的能量小于破坏旧化学键所吸收的能量;能量守恒角度:反应物的总能量小于生成物的总能量的化学反应;2.常见的吸热反应或部分物质的溶解过程:大部分分解反应,NH4Cl固体与Ba(OH)2•8H2O固体的反应,炭与二氧化碳反应生成一氧化碳,炭与水蒸气的反应,一些物质的溶解(如硝酸铵的溶解),弱电解质的电离,水解反应等。
3.放热反应的概念:化学键角度:新化学键的形成所释放的能量大于破坏旧化学键所吸收的能量;能量守恒角度:反应物的总能量大于生成物的总能量的化学反应;4.常见的放热反应:①燃烧反应;②中和反应;③物质的缓慢氧化;④金属与水或酸反应;⑤部分化合反应;5.吸热反应和放热反应的能量变化图如图所示:注意:①反应放热还是吸热主要取决于反应物和生成物所具有的总能量的相对大小;②不是需要加热的反应都是吸热反应,燃烧大多数要点燃,都是放热反应.吸热反应就是在化学变化中,需要不断吸收大量热量的反应.不是需要使用催化剂的反应都是吸热反应。
【精细剖析】1.根据反应物的总能量和生成物的总能量的相对大小来判断:若反应物的总能量>生成物的总能量,则反应为放热反应,若反应物的总能量<生成物的总能量,则反应为吸热反应;2.化学反应的实质是旧键的断裂和新键的形成过程,而断键过程需要吸收能量,键形成过程需要放出热量,放热反应有些也需要一定条件,如2SO2+O2⇌2SO3为放热反应,需要在高温下才能发生;特别注意:放热反应或吸热反应与反应条件无直接关系;不是需要加热的反应都是吸热反应,燃烧大多数要点燃,都是放热反应.吸热反应就是在化学变化中,需要不断吸收大量热量的反应.不是需要使用催化剂的反应都是吸热反应。
【典例剖析】由N2O和NO反应生成N2和NO2的能量变化如图所示.下列说法错误的是( )A.使用催化剂可以降低过渡态的能量B.反应物能量之和大于生成物能量之和C.N2O(g)+NO(g)→N2(g)+NO2(g)+139kJD.反应物的键能总和大于生成物的键能总和【答案】D【变式训练】在常温常压下,烯烃与氢气混合并不起反应,甚至在高温时反应也很慢.但在适当的催化剂存在下与氢气反应生成烷,一般认为加氢反应是在催化剂表面进行.反应过程的示意图如下:下列说法中正确的是( )A.乙烯和H2生成乙烷的反应是吸热反应B.加入催化剂,可减小反应的热效应C.催化剂能改变平衡转化率,不能改变化学反应的平衡常数D.催化加氢过程中金属氢化物的一个氢原子和双键碳原子先结合,得到中间体【答案】D【实战演练】1.参照反应Br+H2→HBr+H的能量对反应历程的示意图,下列叙述中正确的是( )A.该反应为可逆反应B.加入催化剂,可提高HBr的产率C.反应物总能量低于生成物总能量D.反应物总键能低于生成物总键能【答案】C【解析】A.根据图象分析反应物的总能量小于生成物的总能量,可知为吸热反应,无法判断是否为可逆反应,故A错误;B.催化剂只改变反应速率,不改变平衡移动,所以加入催化剂,不可提高HBr的产率,故B错误;C.根据图象可知反应物的总能量小于生成物的总能量,故C正确;D.根据图象分析反应物的总能量小于生成物的总能量,可知为吸热反应,所以反应物总键能大于生成物总键能,故D错误;故答案为C。
常见的放热反应和吸热反应

常见的放热反应和吸热反应⑴常见的放热反应①燃烧反应。
如C、CO、C2H5OH等到的燃烧②酸碱中和反应。
如2KOH+H2SO4=K2SO4+2H2O③活泼金属与水或酸的反应。
如2Al+6HCl=2AlCl3+3H2↑④多数化合反应。
如Na2O+H2O =2NaOH,SO3+H2O=H2SO4⑵常见的吸热反应①多数分解反应,如CaCO3 CaO+CO2↑②铵盐与碱的反应,如:2NH4Cl(s)+Ba(OH)2·8H2O (s)=BaCl2+2NH3↑+10H2O③C(s)+H2O(g) CO+H2④CO2+C 2CO测定反应热Q= - C(T2 -T1)=- C0m(T2-T1)中和反应的反应热:酸碱中和反应所放出的热量中和热:在稀溶液中,酸和碱发生中和反应生成1mol水时的放出的热量中和热数值大小与反应物量多少无关焓:物质本身所具有的能量用焓来表示符号:H焓变△H=H 生成物-H反应物∆H<0时,为放热反应∆H>0时,为吸热反应影响焓及焓变大小的因素1、不同物质,H不同,△H也不同2、同一物质,物质的量越大,H也越大,△H也越大3、同一物质,H(气)> H(液)> H(固)焓变与反应热的不同:△H大小要看符号,Q的大小不看符号书写热化学方程式,注意以下几点:(1)热化学方程式要标明物质的状态:固体—s,液体—l,气体—g;水溶液中的溶质用aq表示(2) △H后要注明反应的温度,对于298K时进行的反应可以不注明温度;(3) △H单位是J·mol-1或KJ ·mol-1(4)若方程式中各物质系数加倍,则△H数值也加倍,若反应逆向进行,则符号也要变盖斯定律对于一个化学反应,无论是一步完成还是分几步完成,其反应焓变都是一样的,这一规律称为盖斯定律。
电解池与原电池有哪些异同(续)装置 原电池 电解池电子离子 流向电子流向: 负极 →导线→正极 离子流向: 阳离子→正极 阴离子→负极电子流向: 电源负极→电解池阴极电解池阳极→电源正极 离子流向: 阴离子→阳极 阳离子→阴极电解池与原电池①两电极接直流电源 ②电解质溶液 ③形成闭合回路①活泼性不同的两电极 ②电解质溶液③形成闭合回路形成条件 将电能转变成化学能的装置 将化学能转变成电能的装置 定义装置 实例电解池原电池装置电解池与原电池有哪些异同(续)电镀①电极: 阳极——镀层金属 阴极——待镀金属制品 ②电镀液:含有镀层金属离子的电解质溶液。
常见的放热反应和吸热反应

常见的放热反应和吸热反应
(1)常见的放热反应:
①所有的燃烧反应;
②大多数的化合反应(注:CO2+C2CO为吸热反应);
③酸碱中和反应;
④金属与酸或水的反应;
⑤缓慢的氧化反应;
⑥其他:
CaCO3+2HCl=CaCl2+CO2↑+H2O;
CaO+H2O=Ca(OH)2;
2Na2O2+2H2O=4NaOH+O2↑;
2Na2O2+2CO2=2Na2CO3+O2;
3Al+ Fe2O33Fe+Al2O3(铝热反应)
(2)常见的吸热反应:
①大多数的分解反应;
②以下几个反应是吸热反应:
Ba(OH)2·8H2O+2NH4Cl==2NH3↑+BaCl2+10H2O;
CO2+C2CO;
C+H2O(g)CO+H2;
3Fe+4H2O(g)Fe3O4+4H2
要点诠释:
(1)常见的热效应如浓硫酸溶于水、NaOH溶于水、CaO溶于水,虽伴随着能量的放出,但并不是放热反应;铵盐溶于水虽需要吸收能量,也不是吸热反应。
(2)对于可逆反应,若正反应为放热反应,则逆反应必为吸热反应。
高一化学第六章化学反应与能量知识点和题总结
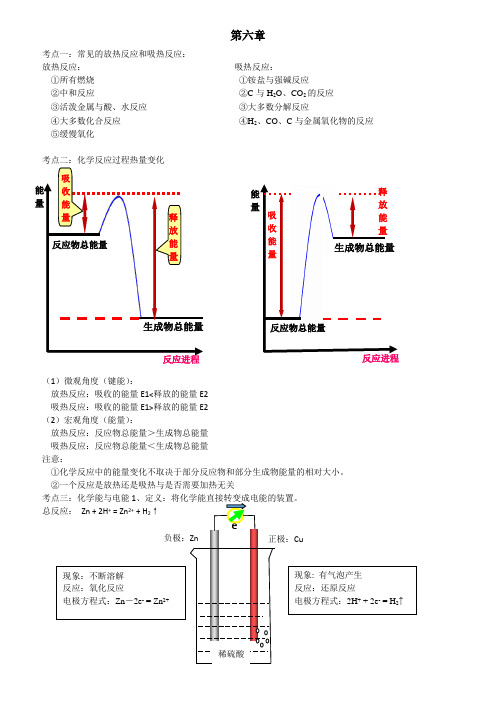
第六章考点一:常见的放热反应和吸热反应:放热反应: 吸热反应:①所有燃烧 ①铵盐与强碱反应②中和反应 ②C 与H 2O 、CO 2的反应 ③活泼金属与酸、水反应 ③大多数分解反应④大多数化合反应 ④H 2、CO 、C 与金属氧化物的反应 ⑤缓慢氧化考点二:化学反应过程热量变化(1)微观角度(键能):放热反应:吸收的能量E1<释放的能量E2 吸热反应:吸收的能量E1>释放的能量E2 (2)宏观角度(能量):放热反应:反应物总能量>生成物总能量 吸热反应:反应物总能量<生成物总能量 注意:①化学反应中的能量变化不取决于部分反应物和部分生成物能量的相对大小。
②一个反应是放热还是吸热与是否需要加热无关总反应: Zn + 2H + = Zn 2+ + H 2↑e - 反应物总能量生成物总能量 能量 反应进程 吸收能量 能量释放能量反应进程反应物总能量生成物总能量吸收能量释放能量稀硫酸负极:Zn 正极:Cu 现象:不断溶解 反应:氧化反应 电极方程式:Zn -2e - = Zn 2+ 现象: 有气泡产生 反应:还原反应 电极方程式:2H + + 2e - = H 2↑外电路:电子由负极经导线流向正极内电路:阳离子→正极;阴离子→负极2.形成原电池的条件(两极一液一回路):①两个活泼性不同的电极(金属与金属或金属与碳棒)②电解质溶液③形成闭合回路,自发进行的氧化还原反应3.氢氧燃料电池:(1)酸性燃料电池:负极:2H2-4e-= 4H+ 正极:O2 +4e- + 4H+= 2H2O(2)碱性燃料电池:负极:2H2 + 4OH- - 4e- = 4H2O 正极:O2 + 2H2O + 4e- = 4OH-总反应:2H2 + O2 =2H2O4.甲烷燃料电池:(电解质为KOH)负极:CH4+10OH--8e-=CO32-+7H2O 正极:2O2+4H2O+8e-=8OH-总反应:CH4+2O2+2KOH=K2CO3+3H2O练习:1.下列关于能量变化的说法,正确的是()A.等质量的红磷和白磷完全燃烧生成P2O5(s)放出的热量相同B.2Na+2H2O===2NaOH+H2,该反应生成物的总能量高于反应物的总能量C.放热反应中,反应物的总能量大于生成物的总能量D.有化学键断裂的是吸热过程,并且一定发生了化学变化2.下列反应既属于氧化还原反应,又是放热反应的是()A.铝与盐酸反应B.NaOH和HCl反应C.Ba(OH)2·8H2O与NH4Cl的反应D.CaCO3受热分解为CaO和CO23.下列变化过程,属于放热反应的是:()①NaOH固体溶于水②炸药爆炸③食物因氧化而腐败④铝热反应⑤酸碱中和反应⑥煅烧石灰石制生石灰⑦盐酸溶液中插入打磨过的铝片A.②③④⑤⑦B.①②④⑤C.②③④⑤D.①②③⑥⑦4.已知拆开1mol H–H键,1mol N≡N键分别需要吸收的能量为436kJ 、946kJ;形成1mol N–H键,会放出能量391kJ,在反应N2 + 3H22NH3中,每生成2mol NH3,()A.放出92 kJ热量B.吸收92 kJ热量C.放出209kJ热量D.吸收209kJ热量5.反应M+Z→Q(ΔH>0)分两步进行:①M+Z→X(ΔH<0),②X→Q(ΔH>0)。
