手性席夫碱的合成
席夫碱缩合反应

席夫碱缩合反应席夫碱缩合反应是一种有机合成反应,常用于构建碳-碳键的方法之一。
在这篇文章中,我将对席夫碱缩合反应进行深入探讨,包括该反应的机理、条件、应用和局限性。
一、席夫碱缩合反应的机理席夫碱缩合反应是通过在酮或醛化合物与含活泼甲基的化合物(如甲醛、丙酮等)反应过程中生成亲核碱与活泼甲基化合物中的羰基进行缩合来实现的。
该反应机理如下所示:1. 亲核加成:亲核碱进攻羰基碳上的电子,形成一个中间体。
2. 消除:中间体发生消除反应,生成一种称为席夫碱的中间产物。
3. 脱水:通过脱水反应,席夫碱中间产物失去一个水分子,生成最终的缩合产物。
二、席夫碱缩合反应的条件席夫碱缩合反应需要满足以下条件:1. 亲核碱:常用的亲核碱包括胺、硬脂酸钠等。
2. 活泼甲基化合物:活泼甲基化合物是席夫碱缩合反应中重要的组成部分,常见的活泼甲基化合物有甲醛、丙酮、乙酮等。
3. 溶剂:反应中常用的溶剂包括甲醇、乙醇、二甲基亚砜等。
4. 酸催化:为了促使席夫碱缩合反应进行,常需要在反应过程中加入酸性催化剂,如盐酸、硫酸等。
三、席夫碱缩合反应的应用席夫碱缩合反应在有机合成中具有广泛的应用价值,可以用于构建碳-碳键的扩大分子结构的范围。
以下是席夫碱缩合反应的几个应用领域:1. 药物合成:席夫碱缩合反应可用于药物合成的关键步骤,如合成抗生素、抗肿瘤药物等。
2. 天然产物合成:很多具有生物活性的天然产物分子中含有席夫碱结构,席夫碱缩合反应可以用于天然产物的全合成。
3. 功能材料合成:席夫碱缩合反应在合成有机光电材料和涂料方面具有潜在应用,可以用于构建材料的分子结构和功能性。
四、席夫碱缩合反应的局限性尽管席夫碱缩合反应具有广泛的应用,但也存在一些局限性:1. 可能产生副反应:在席夫碱缩合反应中,一些羰基化合物可能会与亲核碱发生其他副反应,导致反应不完全或产物不纯。
2. 手性产物选择性不高:在一些情况下,席夫碱缩合反应对手性产物选择性不高,导致产物的外消旋。
氨基酸与水杨醛合成一种手性希夫碱

手性希夫碱的实验合成及理论分析【摘要】在乙醇溶液和常温条件下,直接缩合水杨醛和氨基乙酸合成了一种手性希夫碱对它进行了抽滤提纯并计算了及其产率,用了显微熔点测定仪测定熔点。
【关键词】氨基酸水杨醛手性希夫碱1前言希夫碱是指由含有醛基和氨基的两类物质通过缩水形成含亚胺基(-CH=N-)或甲亚胺基(-RC=N-)的一类有机化合物, 它的基本结构中含有(>C=N-), 是H.Schiff在1864年首先发现的。
其杂化轨道上的氮原子上的孤对电子使得希夫碱配体具有极大的灵活性和良好的配位能力, 因而希夫碱金属配合物的研究一直受到广泛的重视。
由于氨基酸Schiff碱合成相对容易, 能够选择多种胺类及带有羰基的不同醛和酮进行反应, 其特点是能够灵活地选择反应物,改变取代基给予体原子本性及其位置,可合成许多链状、环合且性能、结构不同的配体。
自从六十年代末人们发现过渡金属希夫碱配合物具有生物活性以来,这个领域的研究逐渐活跃起来。
希夫碱不仅可以和过渡元素形成配合物,和镧系、锕系及部分主族金属元素也能形成稳定的配合物,此外还有如Zr、Mo、Ru、Ir等贵金属。
这些配合物在分析化学、立体化学、电化学、光谱学、分子自组装、超分子化学、生物化学模型系统、催化、材料、核化学化工等学科领域均具有重要意义。
近年来,对手性希夫碱配合物的研究日趋广泛,它的金属配位化合物在生物医药方面由于某些希夫碱具有特殊的生理活性,越来越引起医药界的重视。
据报道,氨基酸类、缩氨脲类、缩胺类、杂环类、腙类希夫碱及其应用的配合物具有抑菌、杀菌、抗肿瘤、抗病毒等独特药用效果;催化方面希夫碱及其配合物在催化领域的应用也很广泛,概括而言,希夫碱做催化剂主要是应用于聚合反应,不对称催化环丙烷化反应以及烯烃催化氧化方面和电催化领域。
分析化学方面许多希夫碱用来检测、鉴别金属离子,并可借助色谱分析、荧光分析、光度分析等手段达到对某些离子的定量分析;腐蚀方面长期以来,许多金属及其合金在工业、军事、民用等各个领域得到了广泛的应用,但是该金属及其合金在大气中、海水中很不稳定,因此研究寻找有效的缓蚀剂,引起了众多科学家的重视。
希夫碱的合成方法

希夫碱(Schiff-base)简介:希夫碱(Schiff-base)是德国化学家Hugo Schiff 在1879年发现的,并以自己的名字命名的;希夫碱(Schiff-base)是指含有甲亚胺(-HC=N-)或者亚胺特性基团(-RC=N-)的一类有机化合物,因此也称亚胺或亚胺取代物,通常希夫碱主要是由胺和活性羰基缩合形成碳氮双键(>C=N-)化合物[1]。
希夫碱是一类非常重要的有机化合物,其种类繁多,按配体结构分:单希夫碱、双希夫碱、大环希夫碱;按缩合物质不同分:缩胺类希夫碱、缩酮类希夫碱等。
希夫碱的早期研究为缩胺类,后来发展为缩酮类、缩胺类、缩氨基脲类、胍类、氨基酸类及氨基酸酯类等。
根据希夫碱的结构的特征,能灵活地选择各种羰基化合物和不同的胺类反应,改变连接的取代基,变化给予体原子的位置,可以得到从单齿到多齿,链状到环状,对称到不对称等种类繁多、结构复杂的希夫碱。
希夫碱的合成方法根据希夫碱的结构的特征,其合成相对容易,能灵活地选择各种羰基化合物和不同的胺类反应,改变连接的取代基,变化给予体原子的位置,可以得到从单齿到多齿,链状到环状,对称到不对称等种类繁多、结构复杂的希夫碱[2]。
希夫碱的合成是一种缩合反应,涉及加成、重排、消去等过程,反应物立体结构及电子效应起着重要的作用。
a.直接合成法或称“现场合成法”(insitu synthesis)氨基氮上的孤对电子进攻羰基碳,羰基的碳氧双键中的一个电子给氧原子,形成一个碳四中间体。
原来碳原子上的双键变成两个单键,一个单键连接氧负原子,另一个单键连在-NH2R3基团上。
随后氧负原子结合氢变成羟基,-NH2R3失去氢,成为-NHR3,接着羟基和-NHR3中的氢结合脱去一分子水,形成含碳氢双键的亚胺,及希夫碱。
其合成通式及缩合反应机理如下[3]:R1C R2O+H2NR1C2ONHRHR1CR2OHNHR2R1CR2NR3过渡态b.模板合成法(template synthesis)当反应物活性低或产物不稳定不能得到预期的Schiff碱时,可将金属离子作为模板试剂加入到拨基化合物中与二胺反应,则可能形成含金属离子的schiff碱配合物,也可以用其他金属离子取代此金属,例如重斓系对成环数小的14元环是有利的模板试剂,而对18元环不利;轻斓系对形成18元环或开环衍生物却是良好的模板试剂。
席夫碱的合成PPT精选文档

.
8
质谱分析:
席夫碱配体结构较为简单,可以得到准确的分子 式和分子量,通过比对配体,配合物和聚合物三 者的图谱可以判断是否生成了配合物或聚合物。
.
7
• 紫外光谱:如果席夫碱的配体中含有苯环、双键 等对紫外光吸收明显的基团时,可以得到一系列 的吸收谱带。
• X−射线衍射
若得到单晶产物并经过初步测试判断为所期望的席 夫碱配合物或配位聚合物,则可进一步作X−射线 单晶衍射分析,得出完整的晶体结构和晶体学数 据。
席夫碱化合物的合成
• 席夫碱是是含有亚胺或甲亚胺特性基团 (C══N)的一类有机化合物,通常席夫碱 由胺和有活性羰基的化合物(醛、酮等)缩 合而成,改变连接的取代基及其位置,变化 给电子基团的位置,可以开拓出许多从链状 到环合,从单齿到多齿、结构多变、性能迥 异的席夫碱配体。席夫碱不仅可以和过渡金 属形成配合物,还可以和镧系、锕系及部分 主族金属元素形成稳定的配合物。
.
3
• 单席夫碱
由单胺类和单羰基类化合物缩合而成,经 常作为阴离子型二齿配体和中性的单齿配体。
.
4
• 双席夫碱
由一分子的二胺类和两分子的羰基化合物缩合所 得,常用的二胺有邻苯二胺,乙二胺,丙二胺, 当R5,R6为羟基时,便得到了缩乙二胺(Salen)
.5ຫໍສະໝຸດ • 大环席夫碱由芳香二醛(苯,吡啶,呋喃,噻吩等)或二酮
化合物与一系列多胺缩合得到,形成含有不饱和官 能团的席夫碱的杂原子大环化合物。
.
6
• 结构表征:
元素分析:
通过元素分析测定产物的C、H、N含量,推测配体 的分子式和分子量,用元素分析仪来测定。
红外光谱:
席夫碱的C══N具有明显而特殊的红外吸收,可 作为合成配体的初步判断依据,通过红外光谱吸 收峰的位置、吸收峰的数目及其强度可以确定产 品所含的官能团,进一步分析产物的组成。
手性β-内酰胺的合成合成 讲义
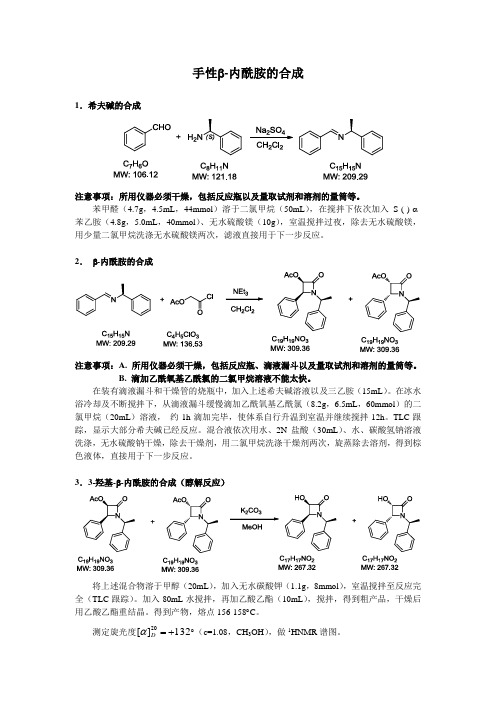
手性β-内酰胺的合成1.希夫碱的合成注意事项:所用仪器必须干燥,包括反应瓶以及量取试剂和溶剂的量筒等。
苯甲醛(4.7g ,4.5mL ,44mmol )溶于二氯甲烷(50mL ),在搅拌下依次加入S-(-)-α-苯乙胺(4.8g ,5.0mL ,40mmol )、无水硫酸镁(10g ),室温搅拌过夜,除去无水硫酸镁,用少量二氯甲烷洗涤无水硫酸镁两次,滤液直接用于下一步反应。
2. β-内酰胺的合成注意事项:A. 所用仪器必须干燥,包括反应瓶、滴液漏斗以及量取试剂和溶剂的量筒等。
B. 滴加乙酰氧基乙酰氯的二氯甲烷溶液不能太快。
在装有滴液漏斗和干燥管的烧瓶中,加入上述希夫碱溶液以及三乙胺(15mL )。
在冰水浴冷却及不断搅拌下,从滴液漏斗缓慢滴加乙酰氧基乙酰氯(8.2g ,6.5mL ,60mmol )的二氯甲烷(20mL )溶液, 约1h 滴加完毕,使体系自行升温到室温并继续搅拌12h 。
TLC 跟踪,显示大部分希夫碱已经反应。
混合液依次用水、2N 盐酸(30mL )、水、碳酸氢钠溶液洗涤,无水硫酸钠干燥,除去干燥剂,用二氯甲烷洗涤干燥剂两次,旋蒸除去溶剂,得到棕色液体,直接用于下一步反应。
3.3-羟基-β-内酰胺的合成(醇解反应)将上述混合物溶于甲醇(20mL ),加入无水碳酸钾(1.1g ,8mmol ),室温搅拌至反应完全(TLC 跟踪)。
加入80mL 水搅拌,再加乙酸乙酯(10mL ),搅拌,得到粗产品,干燥后用乙酸乙酯重结晶。
得到产物,熔点156-158︒C 。
测定旋光度132][20+=D α︒(c=1.08,CH 3OH ),做1HNMR 谱图。
乙酰氧基乙酰氯Acetoxyacetyl chloride分子式: C4H5ClO3密度: 1.270分子量:136.53 折射率: 1.4271沸点:55°/12mm敏感性: Moisture Sensitive 闪点:71°(160°F)CAS:三乙胺Triethylamine分子式: (CH3CH2)3N 闪点:-11°(12°F)分子量:101.19 密度:0.7255熔点:-115°折射率: 1.4005沸点:89-90°CAS:苯甲醛Benzaldehyde CAS:100-52-7分子式: C7H6O 闪点:62°(143°F)分子量:106.12 密度: 1.047熔点:-26°折射率: 1.5450沸点:178-179°敏感性: Air Sensitive(S)-(-)-1-苯基乙胺(S)-(-)-1-Phenylethylamine CAS:2627-86-3分子式: C8H11N 闪点:71°(159°F)分子量:121.18 密度:0.948熔点:-10°折射率: 1.5260沸点:187°敏感性: Air Sensitive。
席夫碱的合成 ppt课件

通过元素分析测定产物的C、H、N含量,推测配体 的分子式和分子量,用元素分析仪来测定。
红外光谱:
席夫碱的C══N具有明显而特殊的红外吸收,可 作为合成配体的初步判断依据,通过红外光谱吸 收峰的位置、吸收峰的数目及其强度可以确定产 品所含的官能团,进一步分析产物的组成。
质谱分析:
精品资料
• 你怎么称呼老师?
• 如果老师最后没有总结一节课的重点的难点,你 是否会认为老师的教学方法需要改进?
• 你所经历的课堂,是讲座式还是讨论式? • 教师的教鞭
• “不怕太阳晒,也不怕那风雨狂,只怕先生骂我 笨,没有学问无颜见爹娘 ……”
• “太阳当空照,花儿对我笑,小鸟说早早早……”
• 分类 按齿数分类:单齿,二齿,多齿 按结构分类:单席夫碱,多席夫碱,大环席夫碱 按对称性来划分:对称席夫碱,不对称席夫碱
• 单席夫碱
由单胺类和单羰基类化合物缩合而成,经 常作为阴离子型二齿配体和中性的单齿配体。
• 双席夫碱
由一分子的二胺类和两分子的羰基化合物缩合所 得,常用的二胺有邻苯二胺,乙二胺,丙二胺, 当R5,R6为羟基时,便得到了缩乙二胺(Salen)
• 大环席夫碱
由芳香二醛(苯,吡啶,呋喃,噻吩等)或二酮 化合物与一系列多胺缩合得到,形成含有不饱和官 能团的席夫碱的杂原子大环化合物。
席夫碱配体结构较为简单,可以得到准确的分子 式和分子量,通过比对配体,配合物和聚合物三 者的图谱可以判断是否生成了配合物或聚合物。
席夫碱的合成席夫碱化合物的合成?席夫碱是是含有亚胺或甲亚胺特性基团cn的一类有机化合物通常席夫碱由胺和有活性羰基的化合物醛酮等缩合而成改变连接的取代基及其位置变化给电子基团的位置可以开拓出许多从链状到环合从单齿到多齿结构多变性能迥异的席夫碱配体
一对手性Salen型席夫碱对映体的合成、结构与生物活性

一对手性Salen型席夫碱对映体的合成、结构与生物活性郝洪庆;李鑫;孙静【摘要】采取分步反应法以1R,2R-环己二胺(或1S,2S-环己二胺)与2-羟基萘甲醛和水杨酸苯酯反应,合成了一对手性Salen型席夫碱对映体:1R-(2-羟基苯甲酰亚胺)-2R-(2-羟基萘甲亚胺)环己烷(1a)和1S-(2-羟基苯甲酰亚胺)-2S-(2-羟基萘甲亚胺)环己烷(1b),对其进行了单晶结构、圆二色光谱、元素分析、红外光谱表征及生物活性实验.单晶结构与圆二色光谱分析表明1a和1b互为对映体:生物活性实验显示1a具有一定的抑菌活性.【期刊名称】《无机化学学报》【年(卷),期】2013(029)006【总页数】5页(P1222-1226)【关键词】手性;对映体;圆二色;生物活性【作者】郝洪庆;李鑫;孙静【作者单位】嘉应学院化学与环境学院,梅州 514015;嘉应学院化学与环境学院,梅州 514015;广东医学院药学院,东莞 523808【正文语种】中文【中图分类】O641.40 引言手性化合物在不对称催化、功能材料、液晶等领域具有重要应用[1-6]。
由于席夫碱化合物在结构上的多样性、可调控性[14-17],以及席夫碱及其配合物具有的抑菌、抗癌、抗病毒、杀霉等生物活性[7-8],手性席夫碱化合物的合成及其化学生物学和医药开发 [9-13]等研究一直倍受关注。
目前报道的Salen 型手性席夫碱通常呈对称结构,它们多是由1 个几何结构上左右对称的手性二胺(如1, 2-环己二胺、1, 2-二苯基乙二胺等) 上的2个氨基与2 个相同的有机基团缩合而得。
以上述手性二胺的2 个氨基与2 个不同基团反应合成结构上左右不对称的手性席夫碱难度较大,相关报道较少。
据文献报道,二胺与羰基化合物缩合制备三齿或四齿非对称席夫碱的方法主要有条件控制分步反应法与金属模板法。
前者是指严格控制反应条件,如反应温度、时间、溶剂或反应物物质的量之比和浓度等先得到中间产物,进一步制备二胺与2 个不同羰基缩合的席夫碱;金属模板法则是将金属离子作为模板剂,利用金属离子对N 原子的较强亲合力,特别适合于促使小分子有机物定向缩合成较大分子的有机配体并形成配合物,除去配合物中的金属离子后,最终得到席夫碱配体[18-20]。
手性希夫碱的合成及其催化不对称硅氢插入反应的研究

乙酸 甲酯 与 硅 氢 化 合 物 的 不 对 称 硅 氢 插 入 反应 , 考 察 了 不 同 的金 属 铜 配 合 物 和 希 夫 碱 对 反 应 的 影 响 , 探 讨 了 手 性希夫碱/ 金 属 配 合物 催 化 体 系 对 不 同硅 氢 底 物 的 适 应 性 . 当 采 用 希 夫 碱 4与 C u ( C H C N) P F 的 催 化 体 系 催
收 稿 日期 : 2 0 1 3 - 0 9 ~ 1 8
基金项 目: 国 家 自然 科 学基 金 项 目 ( 2 1 1 7 3 0 6 4 ; 5 1 2 0 3 0 3 7 ) . 通信作者 : 杨科芳( 1 9 7 9 一) , 女, 助理研究员 , 博士, 主要 从 事 有 机 催 化 合 成 化 学 与新 型 高 分 子 催 化 材 料 的研 究 . E — ma i l : k f y a n g @h z n u
与含 氨基 的化合物 ( 通 常是伯 胺) 缩 合制得 _ 1 ] . 1 8 6 4年 , Hu g o S c h i f f 首 次合 成 了希 夫碱口 ] , 并 因此而 得 名.
希 夫碱 能够 与多种 金属 的不 同价态 稳定存 在 , 而且可 以有效 地催 化 有机 反应 的进 行. 因此 , 化 学 家们 设 计 合 成 了许 多 具有高 效催 化活 性 的希 夫碱 _ 2 ] , 并应 用于有 机合 成反 应尤其 是不 对称有 机合 成反 应 中 ] . 1 9 8 8
Vo l | 1 2 No . 6
NO V .2 O1 3
d o i :i 0 . 3 9 6 9 / j . i s s n . 1 6 7 4 — 2 3 2 X. 2 0 1 3 . 0 6 . 0 0 2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
手性席夫碱的合成
摘要:手性席夫碱是近年来关注较多且在不对称催化反应中具有很大发潜力的优秀配体或催化剂。
此实验是以水杨醛,(1R,2R)-1,2-二苯基乙二胺经反应生成手性席夫碱。
并对其进行了熔点测定,红外光谱表征。
关键字:手性席夫碱合成
1前言
手性是自然界的基本属性[1]。
分子的手性识别在生命活动中起着极为重要的作用,例如在药理上,当手性药物的消旋体进入生物体内与酶或细胞表面的受体部位相互作用时,由于手性识别和匹配的严格要求,两个对映体以不同的途径被吸收、活化或降解,即外消旋药物对映体的生物活性、毒性、代谢途径存在差异,造成了不同对映体在生物体内的差别[2]。
席夫碱类化合物因其独特的光、电磁等物理材料性能,良好的配位化学性能及独特的抗菌、抗癌、除草等生理活性,引起了人们广泛、系统、深入的理论与应用研究[3-5]。
经过一个半世纪的发展,席夫碱化学已从单席夫碱经双席夫碱发展到不对称双席夫碱。
近年来,手性席夫碱作为催化剂配体化合物被广泛用于不对称有机合成中,所以我们进行手性席夫碱的合成,并对其进行表征。
2实验部分
2.1仪器与药品
X-4数字显示显微熔点测定仪(北京泰克仪器公司);红外光谱仪:(Alutar 307型);旋转蒸发器:(PE-52A)。
水杨醛(分析纯,市售) ,(1R,2R)-1,2-二苯基乙二胺(分析纯,市售)。
2.2实验步骤
用分析天平称取0.1084克(1R,2R)-1,2-二苯基乙二胺加到圆底烧瓶中,然后用适量甲醇溶解,完全溶解后加入0.1ml水杨醛在常温搅拌下反应2小时,得到淡黄色溶液。
对反应后的溶液进行薄层色谱分析。
减压蒸去甲醇析出晶体,加无水乙醇并加热使其溶解,冷却静置17h析出淡黄色晶体,抽滤并用无水乙醇洗涤两次,然后置于烘箱干燥,称量得0.1810克产品。
最后进行熔点测定,红外光谱的分析。
3结果与讨论
以水杨醛,(1R,2R)-1,2-二苯基乙二胺为原料,甲醇为溶剂合成席夫碱的路线如下:
2CHO OH +
2H 2O
OH +(1R ,2R )-1,2-diphenylethane-1,2-diamine
2,2'-((1R ,2R )-1,2-diphenylethane-1,2-diyl)bis(azan-1-yl-1-ylidene)bis(methan-1-yl-1-ylidene)diphenol
此反应比较容易进行,在甲醇溶剂中,无需加热即可完成,且产率比较高。
需要指出的是:在制备双水杨醛缩(1R,2R)-1,2-二苯基乙二胺席夫碱过程中,一定要保证水杨醛稍过量,以避免生成不易分离的单缩合副产物。
产品席夫碱的红外光谱表征,见图1。
图1. 双水杨醛缩(1R,2R)-1,2-二苯基乙二胺席夫碱的红外光谱图
由图1可知席夫碱的特征吸收峰(C=N )为1627.32cm-1,说明席夫碱生成了。
4结论
此次实验我们制得了产品双水杨醛缩(1R,2R)-1,2-二苯基乙二胺席夫碱0.1810克,且产率高达84.28%,测得的熔程为160-161℃,然后对产品进行了光谱分析。
参考文献:
[1] 林国强,李月明,陈耀全,等.手性合成——不对称反应及其应用[M].2版.北京:科学出版社,2005.
[2] 尤启东,林国强主编.手逻药勿二研穷与应毋[M].北京:化学工业出版社,2004,3一237
[3] 游效曾,孟庆金,韩万书.配位化学进展[M].北京:高等教育出版社,2000.
[4] 刘晓岚,刘永红,石尧成,等.席夫碱在有机合成中的应用研究[J].有机化学,2002,22(7):482-488.
[5] 李德江,孙碧海,李斌.双席夫碱的合成与表征[J].合成化学,2003,11(1):4-6.。
