第1章 高选择性有机合成试剂
现代有机合成试剂

现代有机合成试剂现代有机合成试剂是指用于有机合成反应中的化学试剂,它们能够促进反应、加速反应速率、提高产率和选择性。
现代有机合成试剂是有机化学领域中不可或缺的一部分,为有机合成化学提供了广泛的选择和灵活性。
一、常见的现代有机合成试剂1. Lewis 酸催化剂:Lewis 酸催化剂可以促进许多重要的有机反应,如 Friedel-Crafts 反应、Michael 反应、Diels-Alder 反应等。
常用的Lewis 酸催化剂包括 AlCl3、BF3·Et2O、TiCl4 等。
2. 催化氧化剂:催化氧化剂可以加速氧气或其他氧源与底物之间的反应,例如 Baeyer-Villiger 氧化反应和 epoxidation 反应等。
常用的催化氧化剂包括 mCPBA、TPAP 等。
3. 还原剂:还原剂可以将底物还原为较低价态,并在许多重要的有机反应中起到关键作用。
常用的还原剂包括 LiAlH4、NaBH4 等。
4. 氮杂环类试剂:这些试剂可以用于许多重要的有机反应,例如Mannich 反应、Strecker 反应、Gabriel 合成等。
常用的氮杂环类试剂包括 pyridine、imidazole 等。
5. 脱水剂:脱水剂可以将底物中的水分去除,以促进反应。
常用的脱水剂包括 P2O5、SOCl2 等。
二、现代有机合成试剂的应用1. Friedel-Crafts 反应:该反应是一种重要的芳香族化学反应,可用于合成苯乙酮和其他芳香族化合物。
Lewis 酸催化剂 AlCl3 是这种反应中最常见的催化剂。
2. Diels-Alder 反应:该反应是一种经典的环加成反应,可用于合成多种有机化合物,如环烷烃和芳香族化合物。
Lewis 酸催化剂 TiCl4 是这种反应中最常见的催化剂。
3. Mannich 反应:该反应是一种重要的羰基化合物加成反应,可用于合成许多含氮杂环类分子。
氮杂环类试剂如 pyridine 和 imidazole 常被用作本反应中配体或碱性试剂。
高选择性有机合成试剂

选择性差。 • 改进:以氮氧化物、稀硝酸或硝酸盐替代浓硝酸,或
者以催化剂来替代浓硫酸。
OH 60mg/g HNO3, TBAB
CH3 NO2, O2
HZSM-5 沸石
CH3
+
NO 2 100 :
CH3 NO2
8
Br 97%
5. 甲磺酰氯 / 氯化锂(MsCl / LiCl)
适用于对酸敏感的底物
OH OMOM OMOM
OH
MsCl, LiCl Et3N, DMF, toluene
Cl OMOM OMOM
Cl
M sC l
OMs OMOM OMOM
OMs
LiCl MOM = CH2OCH3
6. 2,3,4,5,6,6-六氯-5,6-二氢苯醌
• 胺化试剂:氨基钠、羟胺、偶氮二甲酸酯、氯(溴) 胺-T
1. 氨基钠
NaNH2
N
105~110oC
N NH2
NaNH2, KNH2, Ca(NH2)2
2. 羟胺
碱性条件下,羟胺可作为喹啉、吡啶、硝基苯等的氨基化试剂。 其衍生物酰羟胺、磷酰羟胺、磺酰羟胺、烷(酚)氧基胺、N-氯 代胺等可作为氨基化试剂取代羰基或腈类化合物的活性a-氢。
• 有机氧化剂:硝基苯、有机过氧化物、二甲 亚砜(DMSO)等
1. 氧气(空气)
O 78mg/g NPMoV
CH3 O2, PhMe, 80oC, 2h
O CHO
OH 1 mol% Fe(dmp)3, O3 i-PrCHO, DEC, 25oC, 4.5h
OH O
MeO
OH
第一章 合成设计原理(white)讲解

有机合成设计(第一章)
17
2.确定实用的路线
将按上法推出的各种可能的路线,进行比较和试用。若客观条 件不便实施,则应当放弃,再重新另推,直到得以切实可行的 实用路线为止。
第二步,合成(synthesis) 加上具体条件,以制订〔书写)切实可行的合成路线。
1. 确定反应的具体条件
完成各步反应的具体条件,如,酸、碱环境,溶剂,温度, 压力,光照或加催化剂,反应时间等等。选择的反应条件,要 尽量避免高温、高压、超低温、有毒或昂贵的试剂和溶剂。
1. 容易得到
有机合成设计(第一章)
14
如:某工厂欲上一个新产品,请求设计一条合成路线。
若所用原料需要从边远省份收购,或需从国外进口,就很难组 织生产。而且,即使原料组织过来,成本也会很高,造成产品价 格可能很高,对外销售就无竞争力。所以,就条路线本身而言, 再简单也不能被采用。
若设计出来的合成路线,原料能就地取材,就可大大节省运 费和很多环节的费用,从而降低了成本,其产品就可能有竞争 力。就是路线稍长几步,也是可取的。
又如,Willstatter路线合成颠茄酮:
有机合成设计(第一章)
10
3、骨架变而官能团不变 如,用重氮甲烷与羰基的反应,可进行环的扩环反应
也可以:
有机合成设计(第一章)
11
4、骨架与官能团均变
在复杂分子的合成中,常常用到这样的方法技巧,在变化碳骨 架的同时,把官能团也变化成所需要者。如: Robinsen路线合 成颠茄酮:
将四条路线,可汇集起来,组成一个“合成树”。
有机合成设计(第一章)
24
合成树
合成树: 将TM所有可能的合成路线连同所得的中间体汇成图,
即为合成树。
有机zn试剂

有机zn试剂有机Zn试剂是一类广泛应用于有机合成领域的重要化学试剂。
它们以有机锌化合物为基础,具有较高的反应活性和选择性,被广泛用于碳碳键形成、还原反应、羰基还原以及其他有机合成反应中。
本文将对有机Zn试剂的特点、制备方法以及应用进行探讨。
一、特点有机Zn试剂具有以下几个主要特点:1. 反应活性高:有机Zn试剂中的锌离子能够与电性较强的碳原子形成键,因此在碳碳键形成反应中活性较高。
2. 反应选择性好:有机Zn试剂能够在不引起其他键断裂的情况下与亲电试剂发生反应,具有较好的选择性。
3. 与多种官能团兼容:有机Zn试剂可以与醛、酮、酸酯等多种官能团反应,适用于多样化的有机合成反应。
4. 比较稳定:有机Zn试剂在常温下相对稳定,不易分解,便于储存和使用。
二、制备方法有机Zn试剂的制备方法主要有以下几种常见方式:1. 直接还原法:将适量的锌粉与有机卤化物或有机溴化物在常温下反应,生成相应的有机Zn试剂。
该方法操作简单,但一般要求反应物之间的反应活性适中。
2. 氟化锌中间体法:首先通过锌与氟化氢反应制备氟化锌中间体,再与有机卤化物或有机溴化物在低温下反应,生成有机Zn试剂。
3. 氧化锌法:将有机锌试剂与氧化锌在二甲基亚砜或其他溶剂中反应,生成相应的有机Zn试剂。
该方法适用于制备一些活性较低的有机Zn试剂。
三、应用领域有机Zn试剂在有机合成领域有着广泛的应用,常见的应用领域包括:1. 碳碳键形成反应:有机Zn试剂可以与醛、酮、酸酯等亲电试剂发生反应,形成碳碳键,用于构建有机分子的骨架结构。
2. 还原反应:有机Zn试剂可以还原酮、醛等官能团,用于还原反应的发生。
与传统的金属还原剂相比,有机Zn试剂还原反应的选择性更好。
3. 羰基还原反应:有机Zn试剂可以选择性地将羰基还原为醇,通过羰基还原反应可实现复杂分子的合成。
4. 其他有机合成反应:有机Zn试剂还可以参与其他一些有机合成反应,如重排反应、取代反应等。
总结:有机Zn试剂是一类重要的有机合成试剂,具有高反应活性、好的选择性和广泛的应用领域。
有机合成设计-1
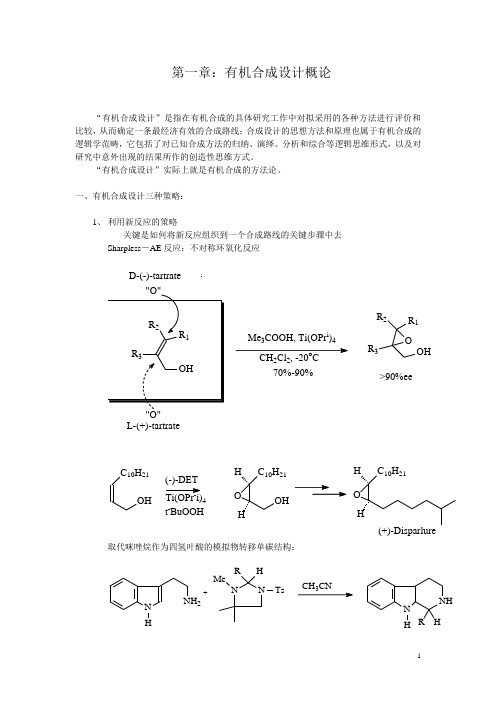
第一章:有机合成设计概论“有机合成设计”是指在有机合成的具体研究工作中对拟采用的各种方法进行评价和比较,从而确定一条最经济有效的合成路线;合成设计的思想方法和原理也属于有机合成的逻辑学范畴,它包括了对已知合成方法的归纳、演绎、分析和综合等逻辑思维形式,以及对研究中意外出现的结果所作的创造性思维方式。
“有机合成设计”实际上就是有机合成的方法论。
一、有机合成设计三种策略:1、利用新反应的策略关键是如何将新反应组织到一个合成路线的关键步骤中去Sharpless-AE反应:不对称环氧化反应D-(-)-tartrate"O"L-(+)-tartrate M e3C O O H, T i(O P r i)4C H2C l2, -20o C70%-90%OR1R2R3O H>90%eeC10H21O H(-)-D E TC10H21O HOHHC10H21OHH(+)-D isp arlu re T i(O P r i)4t-B u O O H取代咪唑烷作为四氢叶酸的模拟物转移单碳结构:N H N H2N NHRT sM e+C H C NN HNH HR2、 由原料而定的策略:关键是如何充分利用原料的结构特征及反应特性葡萄糖用于白三烯A4的合成:O H OHHPHP O O HM sO O C H 3H C l23OOHHC O O C H3以L-谷氨酸合成(+) or(-)-Butyl nonoctaeHO O CC O O N H 2H2(+)-b u ty l n o n o ctate2(-)-b u ty l n o n o ctate3、特定目标分子的合成策略:有机合成设计最常遇到的情况,以上两种情况最终都会归结到一个特定目标分子的合成有机合成的目标分子包括天然的与非天然的有机化合物。
二、有机合成设计的三个步骤:1、对目标分子的结构特征和已知的理化性质进行收集和观察,由此可以简化合成或避免不必要的弯路角鲨烯:30个碳,具有中心对称性,可以从中间向两边对称合成C H O C H OL i+2C H OO H C同上CH O C H O前列腺素E2分子中β-羟基酮体系不稳定,因此在合成时应把这一结构单元的形成放在最后几步:HH2、在对目标分子考察的基础上,采用反合成分析的方法,倒推出合成目标分子的各种路线和各种易得起始原料。
人教版2019)高中化学选择性必修3第一章《有机化合物的结构特点与研究方法》检测题(含答案) (1)

《有机化合物的结构特点与研究方法》检测题一、单选题1.下列说法不正确的是A.实验室处理轻微烫伤,应先用洁净的冷水降低局部温KNO溶液,可通过蒸发浓缩、冷却结晶、过滤、洗涤来提纯B.混有少量KCl的3C.向未知溶液中滴加KSCN溶液,若溶液呈血红色,则说明该溶液不含2+FeD.化学反应中能量较高、有可能发生有效碰撞的分子称为活化分子2.1mol某饱和烷烃在氧气中充分燃烧,需要消耗氧气246.4L(标准状况下).它在光照的条件下与氯气反应能生成3种不同的一氯取代物.该烃的结构简式是()A.B.CH3CH2CH2CH2CH3C.D.3.下列有关化学用语使用正确的是A.丁烷的最简式:C2H5B.—CH3 (甲基)的电子式为C.CH4分子的球棍模型为D.苯的结构式:4.下列各组有机物中,互为同分异构体的是()A.和B.和C.和D.CH3CH3和CH3CH2CH35.下列有机物分子中属于手性分子的是CH CH(OH)COOH①乳酸[]3CH CH(OH)CH CH②2-丁醇[]323③④丙三醇A.只有①B.①和②C.①②③D.①②③④6.如图是立方烷的键线式结构,下列有关说法不正确的是()A.它和苯的最简式相同B.它属于芳香烃C.它只有两种化学键D.它与苯乙烯(C6H5CH=CH2)互为同分异构体7.下列说法错误的是()A.分子中没有手性碳原子B.分子中σ键和π键的数目比为7:1C.某元素气态基态原子的逐级电离能(kJ•mol﹣1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X2+D.反应N2O4(l)+2N2H4(l)═3N2(g)+4H2O(l) 中若有4 mol N﹣H键断裂,则形成的π键数目为3N A8.下列关于物质的分离、提纯实验中的一些操作或做法,不正确的是A.在苯甲酸重结晶实验中,待粗苯甲酸完全溶解后要冷却到常温再过滤B.在组装蒸馏装置时,温度计的水银球应在蒸馏烧瓶支管口C.在苯甲酸重结晶实验中,粗苯甲酸加热溶解后还要加入少量蒸馏水D.96% 的工业酒精制取无水乙醇,可采用的方法是加生石灰,再蒸馏9.有机化合物有不同的分类方法,下列说法正确的是①从组成元素分:烃,烃的衍生物①从分子中碳骨架形状分:链状有机化合物,环状有机化合物①从官能团分:烯烃、炔烃、芳香烃、卤代烃、醇、酚、醛、酮、羧酸、酯等A.①①B.①①C.①①①D.①①10.某有机物的结构如图所示,下列说法不正确的是A.与乙苯不互为同系物B.分子中共直线的碳原子最多有4个C.分子中共平面的原子最多有20个D.与其互为同分异构体且萘环上只有一个侧链的共有4种11.分子式为C4H7O2Cl,且能与碳酸氢钠反应产生气体的有机物可能的同分异构体(不考虑立体异构)数目为A.3B.4C.5D.612.为提纯下列物质(括号内的物质为杂质),所选用的除杂试剂和分离方法都正确的是A.A B.B C.C D.D13.[2016北京]在一定条件下,甲苯可生成二甲苯混合物和苯。
有机合成中的重要还原和氧化试剂

有机合成中的重要还原和氧化试剂有机化学是研究有机物的合成、结构、性质和转化过程的学科。
其中,有机合成是实现有机物的合成重要手段之一。
在有机合成中,还原和氧化反应起着至关重要的作用。
本文将主要探讨有机合成中的重要还原和氧化试剂。
一、重要的还原试剂1. 氢气(H2)氢气是最常用的还原试剂之一。
在有机化学中,氢气常与催化剂如铂(Pt)、铑(Rh)或钯(Pd)等一起使用,形成还原剂。
这种体系常被称为氢气-催化剂。
氢气-催化剂能够将许多有机官能团还原为较低的氧化态,如醛酮可以被还原为醇等。
氢气-催化剂还原反应的副产物为水,因此具有环保优势。
2. 锂铝烷(LiAlH4)锂铝烷是一种常用的强还原剂,可将大多数酮和醛还原为相应的醇。
锂铝烷还可以还原羧酸酯、酰氯等。
需要注意的是,锂铝烷与水反应非常剧烈,因此在使用过程中需要非常小心。
3. 氢化钠(NaH)氢化钠是一种常用的还原试剂,能够将酸性氢离子去除,生成对应的负离子。
这种试剂常用于萃取和溶媒选择性去除酸性氢离子。
此外,氢化钠还可以在格氏试验中帮助生成炔烃。
二、重要的氧化试剂1. 碳酸(POCl3)碳酸是一种常用的氧化试剂,具有选择性氧化的特点。
碳酸可以将烃类氧化为相应的酮,醛或羧酸。
此外,碳酸还可以将醇氧化为相应的醛和酮。
2. 高锰酸钾(KMnO4)高锰酸钾是一种常用的氧化剂,在有机合成中起着重要作用。
高锰酸钾可以将不饱和醇氧化为相应的酮,醛和羧酸。
此外,高锰酸钾还可以将芳香化合物氧化为相应的羧酸。
3. 过氧化氢(H2O2)过氧化氢是一种常用的氧化试剂,可以用于氧化醇、亚胺和醛等。
过氧化氢还可以将苄胺氧化为相应的硝基化合物。
以上只是介绍了有机合成中一些重要的还原和氧化试剂,当然还有其他许多重要试剂,我们只是简要罗列了一些常见的。
有机合成中的还原和氧化反应是高选择性和高效率的合成方法,能够合成复杂和多功能化合物。
在实际应用中,我们可以根据具体反应需要选择合适的还原和氧化试剂,发展经济高效的有机合成方法。
有机合成中的化学选择性例题和知识点总结

有机合成中的化学选择性例题和知识点总结在有机化学的广袤领域中,有机合成无疑是一座璀璨的宝库,而其中的化学选择性更是关键的核心概念之一。
化学选择性关乎着反应的精准性和有效性,决定了我们能否在复杂的分子体系中实现预期的转化。
接下来,让我们通过具体的例题来深入理解化学选择性,并对相关的知识点进行系统总结。
一、化学选择性的基本概念化学选择性是指在一个有机反应中,试剂或反应条件能够有选择地与分子中的某一官能团或部位发生反应,而对其他官能团或部位不产生影响。
简单来说,就是能够精准地“瞄准”我们想要反应的部位,避免“误伤”其他部分。
例如,在一个同时含有羟基和羧基的分子中,如果我们只想让羟基发生反应,而羧基保持不变,这就需要特定的试剂和条件来实现这种选择性。
二、化学选择性的类型1、区域选择性区域选择性是指试剂优先选择分子内的某一区域进行反应。
比如在苯环上有多个取代位置时,反应可能倾向于在特定的位置发生。
例题:当苯环上同时存在邻位、间位和对位取代基时,使用某种亲电试剂进行取代反应,结果主要发生在对位。
这是因为该亲电试剂对苯环的电子云密度分布有特定的要求,导致反应具有明显的区域选择性。
2、官能团选择性官能团选择性是指试剂对不同官能团的反应活性差异。
某些试剂可能更倾向于与某一类官能团反应,而对其他官能团反应活性较低或不反应。
例如,在一个同时含有醛基和酮基的分子中,使用特定的还原剂,可能只还原醛基,而酮基不受影响。
3、立体选择性立体选择性包括对映选择性和非对映选择性。
对映选择性是指反应生成特定手性构型的产物;非对映选择性则是在存在多个非对映异构体的情况下,优先生成其中一种或几种。
例如,在一个含有双键的分子中进行加氢反应,如果使用手性催化剂,可以选择性地得到某一种对映异构体。
三、影响化学选择性的因素1、反应物的结构分子中官能团的电子效应、空间位阻等都会影响反应的选择性。
例如,当一个官能团周围存在较大的取代基时,可能会阻碍试剂的接近,从而影响反应的发生。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氯胺-T, I2
(四) 其他取代试剂
1. 硫氰化物
在 I2 或高岭土催化下,硫氰化铵与芳环或芳杂 环化合物在温和条件下发生硫氰化取代反应,产率 很好。
2. 金属氰化物
在膦-鈀配合物或Cu(I)-二胺配合物催化下,可与卤 代芳烃进行氰解反应,得到芳基氰化物。在氧气中, 三氯化钌(RuCl3)催化下,氰化钠可取代叔胺的 α-氢, 得到相应的 α-氨基氰化物。
照条件下,则发生苯环上的选择性溴代反应。
在乙腈或乙酸乙酯溶液中,Lewis酸 Mg(ClO4)2 催化下,NBS可以作为1,3-二羰基化合物 α-氢的温和 溴化剂,而且不与其他侧链氢反应。底物含双键或其 他敏感基团时,也不影响反应的选择性。类似地,N氯代丁二酰亚胺和N-碘代丁二酰亚胺也可以作为1,3二羰基化合物α-氢的氯化试剂和碘化剂,选择性同样 很高。
催化量的叔胺存在下,四溴环酮还可以作为 酰氯化合物 α-氢的溴代试剂。以手性叔胺为催化 剂时,可以得到手性溴代产物。
手性cat.
二、硝化、磺化、胺化试剂
(一) 硝化试剂 硝化反应常用浓硝酸和浓硫酸或三氟甲烷磺酸等 强酸的混酸作为硝化剂,优点是普适性强,缺点是酸 性太强、腐蚀性强、操作危险、后处理困难、选择性 差。反应条件温和、选择性好的硝化剂主要以氮氧化 物、稀硝酸、或硝酸盐替代浓硝酸,或者以催化剂替 代浓硫酸等进行改进。
≥ O2,PhCl,100℃,2.5~7h
℃
2. 过氧化氢(H2O2)
过氧化氢是一种温和的氧化剂,氧化时放出新生态 氧。氧化反应通常在室温下进行,并且反应后不残留杂 质,因而产物容易提纯。过氧化氢在酸性介质中将烯烃 氧化得到二羟基化合物,在碱性介质中氧化α,β-不饱和羰 基化合物得到环氧化合物,在中性介质中氧化硫醚得到 亚砜。单纯以过氧化氢为氧化剂,选择性较差,产物复 杂。但在催化剂作用下,过氧化氢可以实现多种类型的 选择性氧化反应。
7. 四醋酸铅(Pb(OAc)4)
四醋酸铅只对邻位二醇发生氧化裂解反应, 不与1,3-二醇或1,4-二醇反应;可用于鉴别、纯 化和分析不同的二元醇。反应速度极快,且定量 完成。在合成上,一些不易制备的化合物可以利 用此反应,在温和条件下以较高产率得到。
8. 高碘酸(钠)
高碘酸最经典的氧化反应是使邻二醇、α-二羰基 化合物、α-羟基羰基化合物等发生C-C键氧化裂解。 高碘酸的氧化多用于多元醇类及糖类的降解反应,并 据此研究它们的结构。在三氧化铬催化下,高碘酸可 以将伯醇氧化为羧酸,将仲醇氧化为酮,将芳烃氧化 为醌,将硫醚氧化为砜。在铬酰二醋酸酯催化下,还 可以直接将烷烃氧化为醇、醛或酮。
1. 硝酸
在相转移催化剂存在下,稀硝酸(60mg/g)为硝化剂, 在水/有机两相溶液中,酚和取代酚高选择性地发生硝化 反应,生成相应的单硝化产物,产率和选择性均大于 90%。
2. 氮氧化物 (NO2、NO)
在O2和HZSM-5型沸石存在下,甲苯与NO2反应,主要得 到单硝化产物,邻、对位产率之比为0.08,选择性很好。在同 样条件下,氯苯与NO2反应,选择性也不错。以三氯化铁为催 化剂, NO2和O3还可以实现钝化芳环的硝化反应,产物以单硝 化芳烃为主。在O3和高岭土(K10)或者沸石(HZSM-5,HBEA25)存在条件下,甲苯或氯苯与NO2反应,单硝化反应区域选择 性差;双硝化反应主要以2,4-二硝基产物为主。
8. N-氯代二异丙胺
选择性好、操作简单是 N-氯代二异丙胺作
为氯化剂的主要优点。在稀硫酸溶液中,光照 下,N-氯代二异丙胺可以氯代正庚醇烷基碳链 末端上的氢,而醇羟基不发生反应。
(二)溴化试剂 1. N-溴代丁二酰亚胺(NBS)
在光照下,NBS在乙腈溶液中可以使邻甲氧
基甲苯发生侧链甲基上的选择性溴代反应,无光
2. 氯磺酸 氯磺酸活性比浓硫酸大,可以直接得到磺 酰氯。如果希望反应比较温和,可以用卤代烷 作稀释剂。
3. 三氧化硫(SO3)
三氧化硫是强磺化剂,容易形成砜。调控它的活性 可以用卤代烷烃为溶剂,与二氧六环、吡啶等形成复合 物。三氧化硫与二氧六环的复合物,可用于磺化烯烃、 羰基化合物等。
(三)胺化试剂 氨基化合物可以通过多种途径得到,如硝基化 合物、重氮化合物、腈、酰胺等还原,卤代烃胺解, 烃或取代烃的氨基取代,不饱和烃的氨基加成等。 在此,重点介绍烃或取代烃的氨基取代试剂。
O2, PhCH3,80℃,20h
1,3-二羰基铁、铁卟啉、钌卟啉、钌-氨基酸配 合物、钌-噁唑啉配合物等催化的烯烃在氧气中的环 氧化反应,选择性好,产率高。
25℃,4.5h
2,2,6,6-四甲基哌啶N-氧化物(TEMPO)、吡啶N氧化物、N-甲基吗啡N-氧化物、三甲胺N-氧化物等可 以催化醇在氧气或空气中发生氧化反应,得到醛或酮。
℃
S-Ligand
二、高选择性氧化试剂
(一 ) 无机氧化试剂
1. 氧气(空气)
选择适当的催化剂,不但可以使氧化反应加速,还能使氧化向着预定产物的 方向进行,提高反应选择性,从而提高产物的收率,拓展氧气(空气)的利用范围。
钒和钼催化剂可以催化烯烃在空气或氧气中的环氧化以及烯丙位氧化反应。
。
O2,NHPI,4A MS, PhCN, 50~70℃,14h
6. 2,3,4,5,6,6-六氯-5,6-二氢苯醌
是非常温和的氯代试剂,多用于羰基化合物α氢的氯代,反应一般需要仲胺为催化剂,当使用 手性仲胺或加入手性助剂时,可以得到手性α-氯代 羰基化合物。
仲胺
7. 三聚氯氰(TCT) 在DMF存在下,三聚氯氰几乎能够定量地将醇转化为 氯代物, TCT是相当廉价且高效的氯代试剂。当向反 应中加入溴化钾时,还可以高产率地得到溴代产物。 伯、仲、叔醇的氯代反应都能够定量完成,相比之下, 溴化物的产率稍低。
在三氯乙醛、六氯丙酮、六氟丙酮等含有 吸电子基团的醛酮催化下,过氧化氢氧化烯烃 得到环氧化物,该反应选择性好,产率高。底 物分子中含有羟基、醛、酮、缩醛、缩酮、醚 键等官能团,均不受其影响。
3. 高锰酸盐
高锰酸盐氧化能力强,对于各种可以被氧化 的基团都能进行氧化,是一种通用的氧化剂。但 高锰酸盐对于许多底物氧化产物复杂,选择性差。 氧化芳环侧链成酸是其主要用途,侧链不论长短, 氧化都只发生在α-位,得到芳基甲酸。在碱水溶 液中氧化烯烃得到顺式二醇是高锰酸盐选择性氧 化的另一重要用途。
1. 氨基钠(NaNH2)
胺化试剂多用廉价易得的氨基钠,也有用氨基钾 或氨基钡的,后两者在液氨中溶解度大,更易于反应。 氨基钠与吡啶反应,在2-位引入氨基。
105~110℃
2. 羟胺
在碱性条件下,羟胺可以作为喹啉、吡啶或硝基 苯等的氨基化试剂。羟胺衍生物酰羟胺、磷酰羟胺、 磺酰羟胺、烷氧基胺、酚氧基胺、N-氯代胺(H2NCl) 等也可作为氨基化试剂取代羰基或腈类化合物的活性 α-氢。
沸石, 75℃
以沸石为助剂,在四氯化碳溶液中,NO 可以将烯 硝化而不破坏双键,也不影响芳环、烯丙位或苄位氢。
沸石,75℃
(二) 磺化试剂
磺化试剂主要有硫酸、浓硫酸、发烟硫酸、硫酸钠(钾)、三 氧化硫及其复合物、氯磺酸等,这些试剂,自身的反应选择性不 强,选用依据是底物自身活性或取代反应规律。
1. 硫酸
采用无毒的亚铁氰化物替代剧毒的氰化物进 行氰化反应是这个反应最显著的优点。
3. 三甲基硅氰(TMSCN)
三甲基硅腈是毒性较小的氰化试剂,主要用于醛、 酮、烯烃、炔烃、氮烯等双键或叁键的加成,即硅氰 化反应。在三氟醋酸碘苯以及三氟化硼催化下,三甲 基硅腈还可以取代吡咯、噻吩的α-氢生成相应的α氰 基衍生物。
2. 氯化亚砜(SOCl2) ----自学
3. 氯硅烷 三甲基氯硅烷(TMSCl)在催化量的二甲 基亚砜(DMSO)存在下,可很好地将伯醇和 叔醇转化为相应的氯代烃,而仲醇却几乎不 反应。
4. 四氯化碳/三苯基膦(CCl4/PPh3) 三苯基膦易与氧结合,在CCl4或CBr4存下,卤 原子取代醇分子中的氧,得到相应的卤代烃。三烷基 膦也可以用于 这类反应。
2. 溴/三苯基膦(Br2/PPh3) 溴和三苯基膦能将醇甚至酚转化为相应的溴 代烃。磷极易与氧结合,能夺取醇或酚分子中的 氧原子,利于溴的进攻。三苯基膦还有一个作用 就是与溴结合生成二溴化三苯基膦(Ph3PBr2),从 而稳定溴使其不易挥发。
3. 过溴型季铵盐(R4N+Br3-) 是稳定的固体,具有反应条件温和、操作简便、 选择性强、溴化产率高等优点。与芳胺、酚、酚醚反 应主要生成对溴代产物;与芳甲酮反应得到高产率的 α-溴代酮。三溴化苄基三甲基铵(BTMABr3)、三溴化 苯基三甲基铵(PTMABr3)、三溴化苄基三苯基鏻 (BTPBBr3)等也能发生类似反应,只是在具体反应中选 择性有所不同。
三溴化苄基三甲基铵在NaOH的冰水中与酰胺反 应得到高产率的N-溴代酰胺。在一般的Hoffmann降 解反应中N-溴代酰胺很难分离得到,因为它很容易 继续反应生成胺;该反应为N-溴代酰胺的合成提供 了一种方便的方法。
4. 四溴环酮(TBCO)
全称为2,4,4,6-四溴-2,5-环己二烯酮,为黄色 固体,由2,4,6-三溴苯酚和液溴反应制得。四溴环 酮可用作芳胺和酚类化合物的选择性溴化剂,与 酚、芳甲醚及芳胺反应均得到单溴代产物,产率 高达90%。例如,苯酚与四溴环酮反应,单溴代 产率达到95%,溶剂对邻、对位产物比例影响较 大,选用适当溶剂可实现不同的区域选择性溴化 反应。
现代有机合成化学
第一章 高选择性有机合成试剂
1.1 高选择性取代试剂
一、卤化试剂
(一)氯化试剂
1. N-氯代丁二酰亚胺(NCS)
不需引发剂,也不用光照。如:2-芳基-4,5-二甲基 噻唑的选择性氯代反应,区域选择性在99%以上。
在仲胺催化下,NCS还可以作为多种羰 基化合物(醛、酮、酰氯、酯等) α-氢的氯代 试剂。在手性仲胺催化下,可以得到具有对 映选择性的氯代产物。
