偶电子规则的名词解释
名词解释

无机化学名词解释1、溶解度(solubility):在指定温度下,单位体积饱和溶液中所含溶质的量(g or mol)。
2、稀溶液的依数性(colligative properties):稀溶液的仅由其中所含溶质分子的数目决定,而与溶质的本性无关的性质称作稀溶液的依数性。
136:溶液蒸汽压3、Raoul定律:在一定温度下,难挥发非电解质稀溶液的蒸汽压下降与溶液的摩尔分数成正比,而与溶液的本性无关。
4、溶液渗透压(osmotic pressure):为维持只允许溶剂分子通过的膜所隔开的溶液与溶剂之间的渗透平衡而需要的额外的压力称作该溶液的渗透压。
5、敞开系统(open system):系统与环境之间既有物质交换又有能量交换。
6、封闭系统(closed system):系统与环境之间没有物质交换只有能量交换。
7、孤立系统(isolated system):亦称隔离系统,系统与环境之间既没有物质交换又没有能量的交换。
8、等温过程(isothermal process):在环境温度恒定下,系统始、终态温度相同且等于环境的温度的过程。
9、等压过程(isobaric process):在环境压力恒定下,系统始、终态压力相同且等于环境压力的过程。
10、等容过程(isochoric process):系统的体积保持不变的过程。
11、绝热过程(adiabatic process):系统与环境之间没有热传递的过程。
12、Hess定律:一个化学反应,不论是一步完成的还是分几部完成的,其热效应总是相同的。
13、标准摩尔生成焓(standard molar enthalpy of formation):化学热力学规定,某温度下,由处于标准状态的各种元素的最稳定单质生成标准状态下的1mol某纯物质的热效应,称作该温度下这种纯物质的标准摩尔生成焓。
14、标准摩尔燃烧焓(standard molar enthalpy of combustion):在标准压力和指定温度下,1mol物质完全燃烧的恒压热效应称为该物质的标准摩尔燃烧焓。
有机波谱分析4 质谱

(2 ). 化学电离源(CI):
在质谱中可以获得样品的重要信息之一是其相 对分子质量。但某些物质的分子经电子轰击产生 的M+峰,往往不存在或其强度很低。必须采用比 较温和的电离方法,其中之一就是化学电离法。
CH4反应气,
+和CH + 主要碎片:CH4· 3
再与样品作用
化学电离法是通过离子 - 分子反应来进行,而 不是用强电子束进行电离。离子与试样分子按一定 方式进行反应,转移一个质子给试样或由试样移去 一个电子,试样则变成带+1电荷的离子。 化学电离 源一般在1.3102~1.3103Pa (现已发展为大气压 下化学电离技术)压强下工作,其中充满甲烷 CH4。 首先用高能电子,使CH4电离产生CH5+和C2H5+, 即: CH4 + e CH4+·+ 2e CH4+· CH3+ + H· CH4+· 和CH3+很快与大量存在的CH4分子起反应, 即: CH4+·+ CH4 CH5++ CH3· CH3+ + CH4 C2H5++H2
质谱 (Mass Spectrometry)
Mass Spectrometry is used to determine the mass and structure of molecules based on the mass-to-charge (m/z) ratio of the molecular ion and its fragments.
从低分辨质谱数据(同位素峰簇各峰的强度比)推测 元素组成:
从M+1峰与M峰强度的比值估算分子中含碳的数目 。
第8章质谱法习题与答案
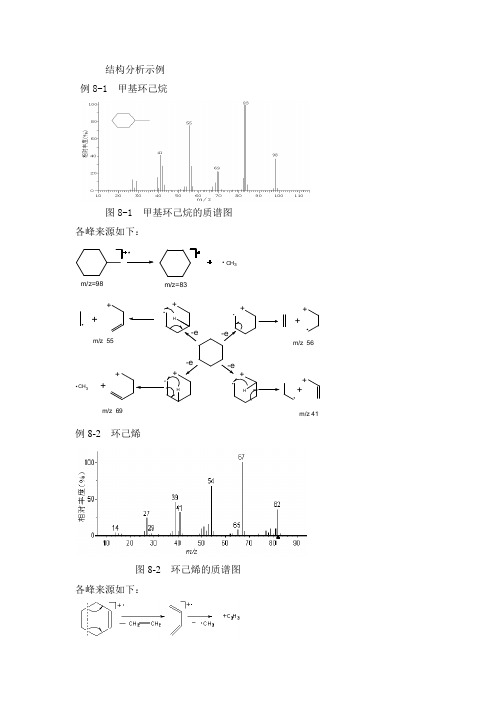
结构分析示例 例8-1 甲基环己烷图8-1 甲基环己烷的质谱图 各峰来源如下:CH 3m/z=98m/z=83HCH 3HH-e++++m/z 55m/z 69m/z 41m/z 56++++++-e-e-e++例8-2 环己烯图8-2 环己烯的质谱图各峰来源如下:+ .H+.++CH3.m/z67+.+.+m/z28例8-3 正丁基苯图8-3 正丁基苯的质谱图各峰来源如下:CH2CH2CH2CH CH2m/z=91m/z=91m/z=65m/z=39m/z=134HC CHHC CH2CH2CH3H2CCH2CHH CH3CH2HHm/z=92CH2HCCH3+m/z=134CH2CH2CH2CHm/z=77m/z=134m/z=51HC CHC H例8-4 对甲苯酚图8-4 对甲苯酚的质谱图各峰来源如下:OH C H3OH CH2+OHm/z 107CH2OHHH-CO+- H2+m/z 79m/z 77-C2H2+m/z 51m/z 108m/z 108HH⎤⎤例8-5 乙基异丁基醚图8-5 乙基异丁基醚的质谱图各峰来源如下:CHH3CCH3CH2H2C O CH2CH2H+m/z 59CH2OH+m/z 31 m/z 102O C2H5m /z 102C H H 3C CH 3CH 2C 2H 5+C HH 3C CH 3CH 2m /z 57i O裂解m /z 102C H 3C CH 3CH 2O CH 2H m /z 87C H H 3C CH 3CH 2O CH 2CH 3CH 2OH +m /z 31四员环过渡重排四员环过渡重排C HH 3C CH 3CH 2OCH 2CH 2H C H 3C CH 3CH 2C CH 3CH 3m /z 56CH 2H OHm /z 102例8-6 正己醛图8-6 正己醛的质谱图各峰来源如下:+ HC m/z 71H C O+m/z 29C O + Hα均裂O .α异裂C 5H 11C 5H 11C 5H 11+.++m/z 99M 100β异裂C 4H 9 CH 2CH O.m/z 57C 4H 9CH 2C OH++CH 2CH 2C O CH 2CH 2m/z 44HH CH C 2H 5C 2H 5 第二种麦氏重排第一种m/z 56OH C H 2C +C 2H CH CH 2+OH C H 2CH例8-7 4-壬酮图8-7 4-壬酮的质谱各峰来源如下:CH 2CC 5H 11O+.H 2CCC 5H 11O +m /z 113C 2H 5βOHC 2H 5C 3H 7CCH2OHHH 2CCC 5H 11OH CH 3OHCH 3OHH 2CO HC 2H 5H 3C+.+.m /z 114m /z 86+.m /z 58γH+βγH+βγH+βH+例8-8 2-甲基丁酸图8-8 2-甲基丁酸的质谱图各峰来源如下:O OHH CH 3-CH 2-CH-COOH -CH3麦氏重排HO CC H OHH 3C i-裂解CH 3-CH 2-CH-CH 3m/z 87m/z 74m/z 57-CH 2=CH 2- COOHα-裂解-CH 3CH 2CHCH 3OH C Om/z 45⎤O OHH CH CH 2 m/z 27+OH OHCH CH 3C OOHCH 3CH 2σ裂解CH 3CH 2+CH CH 3C OOH m/z 29例8-9 水杨酸正丁酯图8-9 水杨酸正丁酯的质谱图各峰来源如下:OH C O OCHC 2H 5H m/z 194麦氏重排OC O OHH 邻位效应-C 4H 9OH-C 4H 8-H 2O C OO CO 邻位效应m/z 138CO -CO-CH ≡CH 例8-10 乙二胺图8-10 乙二胺的质谱图各峰来源如下:①②N - CH 2=CH 2CH 3-CH=NH 2m/z 44CH 3C H NH CH 3CH 3CH CH 2CH 2H H 2CCH 2N H CH 2H22CH 2NH 2m/z 30②m/z 58m/z 72m/z 73β裂解HCH 3--习 题一、简答题1. 质谱仪由哪几部分组成?各部分的作用分别是什么?2. 质谱仪为什么需要高真空条件?3. 试述几种常见的离子源的原理及优缺点。
质谱分析2

例如:
1. α断裂(游离基中心引发的断裂) 断裂(游离基中心引发的断裂) • 在奇电子离子(OE)中,定域的自由位置(即游离 基中心)由于有强烈的电子配对倾向,它即提供了 孤电子与毗邻(α位)的原子形成新的键,导致 α-原子另一端的键断裂。这种断裂通常称为α断 裂。 • 该键断裂时,两个碎片各得一个电子,因此是均裂。 用“ ”表示,也产生一个偶电子离子和一 个自由基。 • 其通式可表达为:
6.2
质谱裂解表示法
6.2.1 分子离子的表示方法 分子离子( 一、分子离子(Molecular ion)和分子离子峰: )和分子离子峰: • 分子经电子轰击,失去一个价电子形成的带正电荷离子称为 分子离子或母离子,质谱中相应的峰称为分子离子峰或母离 子峰。 • 通式为:M+e → M++2e 其中:M+表示分子离子。 • 分子离子峰一般位于质荷比最高位置,它的质量数即是化合 物的相对分子质量。 二、分子离子正电荷 + • 在质谱中用“+”或“ ”表示正电荷,前者表示分子中有 ⋅ 偶数个电子(EE),后者表示有奇数个电子(OE)。 • 正电荷位置要尽可能在化学式中明确表示,这有利于判断以 后的开裂方向。
2.判断裂片离子含偶数个电子还是奇数个电子的方法 判断裂片离子含偶数个电子还是奇数个电子的方法 • 由C、H、O、N组成的离子,其中N为偶数(包括零) 个时,如果离子的质量数为偶数则必含奇数个电子; 如果离子的质量数为奇数则必含偶数个电子。 • 由C、H、O、N组成的离子,其中N为奇数个时,若 离子的质量数为偶数则必含偶数个电子,若离子的 质量数为奇数则必含奇数个电子。 • 如果知道离子的元素组成,若该离子元素组成的总 化合价为偶数时,减去一变奇数,该离子为奇电子 离子,总化合价为奇数时,减去1,变偶数,该离子 为偶电子离子。
质谱技术裂解机理的初步认识

质谱技术中裂解机理的初步认识摘要质谱,即质量的谱图,物质的分子在高真空下,经物理作用或化学反应等途径形成带电粒子,某些带电粒了可进一步断裂。
每一离子的质量与所带电荷的比称为质荷比(m/z ,曾用m/e)。
不同质荷比的离子经质量分离器一一分离后,由检测器测定每一离子的质荷比及相对强度,由此得出的谱图称为质谱,本文从质谱的裂解机理,质谱的裂解方式和质朴中的离子类型三方面进行了介绍,对质谱有了更深的理解。
一、质谱裂解机理离子的裂解并不是随意裂解,它必须按“偶电子规则”进行裂解,当含有奇数个电子的离子裂解时,可以产生游离基与一个偶数个电子的离子,或含偶数个电子的中性分子与一个奇数个电子的离子;当含有偶数个电子的离子裂解时,只能产生偶数个电子的离子和中性分子,而不会产生游离基OE EF+R (断1个键)OE OE+Nee (断2个键)EE EE+ Nee (断2个键)EE OE+R (断1个键)(极少产生)注意:奇电子离子有两个活泼的反应中心,即电荷中心和游离基中心;偶电荷离子只有电荷中心。
分子离子的裂解和产物离子的进一步裂解都是由这些中心引发的。
二、质谱裂解的方式(一)简单裂解1.游离基中心引发的断裂反应(α断裂)分子失去电子,形成游离基离子,它的电子有强烈的成对倾向,电子转移与邻近原子形成一个新键,同时邻近原子的α键断裂。
因此,这种断裂通常称为“α”断裂反应,以下分别举例说明各种化合物α断裂过程。
R2R+CR2YR杂原子(Y)的孤对电子电离能较低,很容易去失,形成游离基离子,进而发生α断裂,如αR2O R'R+CH2O R'2. σ键的断裂化合物中某个单键失去电子,则在此处易进一步发生断裂反应,例如烷烃。
R +RCR 3CR 3CR 3σ 能够稳定正电荷的离子丰度较高,如CH 3CH 2CH 3-e CH 3 32CH 33C 33C CH 2CH 3σ+3、电荷中心引发的反应(诱导断裂,i )① 奇电子离子(OE) a. 饱合中心 R Y R'R +i YR上述反应由正电荷对一对电子的吸引所推动,反应发生的难易与该元素的诱导效应有关,一般为卤素>O 、S >> N 、C ;许多碘代烷烃,溴代仲和叔烷烃及氯代叔烷烃,较易产生这个反应。
07-10年地球化学真题及答案---名词解释

07-10年地球化学真题及答案---名词解释1、克拉克值:元素在地壳中的丰度(平均含量)称为克拉克值。
2、地壳的丰度:指元素在宇宙体或较大的地质体中整体(母体)的含量。
3、类质同像:某些物质在一定的外界条件下结晶时,晶体中的部分构造位置随机的被晶体中的其他质点(原子、离子、配离子、分子)所占据,结果只引起晶格常数的微小改变,晶体的构造类型、化学键类型等保持不变,这一现象称为类质同像。
4、同质多象:同一化学成分的物质,在不同的外界条件(温度、压力、介质)下,可以结晶成两种或两种以上的不同构造的晶体,构成结晶形态和物理性质不同的矿物,这种现象称同质多像。
5、常量元素:即主量元素,其是一个相对概念,通常将自然体系中含量高于0.1%的元素称为常量元素。
它们与氧结合形成的氧化物(或氧的化合物),是构成三大类岩石的主体,因此又常被称为造岩元素。
6、微量元素:微量(minor)或痕迹(trace)元素是一个相对概念,通常将自然体系中含量低于0.1%的元素称为微量元素。
7、不相容元素:在岩浆结晶作用过程中,那些不容易以类质同象的形式进入固相(造岩矿物)的微量元素,称为相容元素。
总分配系数D i<1的元素称为不相容元素,在熔体中富集。
8、相容元素:在岩浆结晶作用过程中,那些容易以类质同象的形式进入固相(造岩矿物)的微量元素,称为相容元素。
总分配系数D i>1的元素称为相容元素,在熔体中贫化。
9、分配系数:在温度、压力一定条件下,微量元素i(溶质)在两相平衡分配时其浓度比为一常数(K D), K D称为分配系数。
10、同位素:核内质子数相同而中子数不同的同一类原子。
11、稳定同位素:原子核稳定,其本身不会自发进行放射性衰变或核裂变的同位素。
12、同位素分馏:同位素以不同比例分配于不同物质或物相的现象。
13、分馏系数:达到同位素交换平衡时,共存相间同位素相对丰度比值为一常数,称分馏系数。
14、SMOW:标准平均大洋水,是氢和氧同位素的世界统一标准。
地球化学知识点整理
地球化学绪论1、地球化学的定义:地球化学是研究地球(包括部分天体)的化学组成、化学作用和化学演化的科学2、地球化学的基本问题:【填空】(1)质:地球系统中元素的组成(2)量:元素的共生组合和赋存形式(3)动:元素的迁移和循环(4)史:地球的历史和演化3、地球化学研究思路:【简答】在地质作用过程中,在宏观地质体变化和形成的同时,亦伴有大量肉眼难以辨别的化学组成变化的微观踪迹,它们包含着重要的定性和定量的地质作用信息,应用现代化学分析测试手段,剖析这些微观踪迹,从而揭示宏观地质作用的奥秘。
即“见微而知著”。
第一章地球和太阳系的化学组成第一节地球的结构和组成1、地球的圈层结构、主要界面名称:(1)地震波(P波和S波)在地球内部传播速度的变化,反映出地球内部物质的密度和弹性是不均一的。
这种不均一性在地球的一定深度表现为突变性质。
由此得出,地球内部具有壳层结构的概念,即认为地球由表及里分为地壳、地幔和地核三个部分。
界面分别为:莫霍面和古登堡面。
(2)上地壳和下地壳分界面为康拉德面。
上地壳又叫做硅铝层,下地壳又叫做硅镁层。
大陆地壳由上、下地壳,而大洋地壳只有下地壳。
【填空】2、固体地球各圈层的化学成分特点:(分布顺序)地壳:O、Si、Al、Fe、Ca地幔:O、Mg、Si、Fe、Ca地核:Fe-Ni地球:Fe、O、Mg、Si、Ni第二节元素和核素的地壳丰度1、基本概念:【名词解释】(1)地球化学体系:我们把所要研究的对象看作是一个地球化学体系,有一定的空间,处于特定的物理-化学状态,并且有一定时间的连续(2)丰度:研究体系中被研究元素的相对含量(3)克拉克值:地壳中元素的平均含量(4)质量克拉克值:以质量计算表示的克拉克值(5)原子克拉克值:以原子数之比表示的元素相对含量。
它是指某元素在某地质体全部元素的原子总数中所占原子个数的百分数。
(6)浓度克拉克值:某一元素在地质体中的平均含量与克拉克值的比值2、克拉克值的变化规律:(1)递减:元素的克拉克值大体上随原子序数的增大而减小。
北京工业大学材料科学基础考研真题名词解释汇编(_终极版)
第1页共8页
北京工业大学材料科学基础(875)名词解释 不息为体 日新为道 21、位错:是晶体内的一种线缺陷,其特点是沿一条线方向原子有规律地 发生错排;这种缺陷用一线方向和一个柏氏矢量共同描述。 22、柏氏矢量:描述位错特征的一个重要矢量,它集中反映了位错区域内 畸变总量的大小和方向,也使位错扫过后晶体相对滑动的量。 23、全位错[2004 年、2011 年]:把柏氏矢量等于点阵矢量或其整数倍的 位错称为全位错。 24、不全位错:柏氏矢量不等于点阵矢量整数倍的位错称为不全位错。 25、肖克莱不全位错:在 FCC 晶体中位于{111}晶面上柏氏矢量为 b=1/6<112>的位错。 26、单位位错:把柏氏矢量等于单位点阵矢量的位错称为单位位错。 27、刃型位错:晶体中的某一晶面,在其上半部有多余的半排原子面,好 像一把刀刃插入晶体中,使这一晶面上下两部分晶体之间产生了原子错 排,称为刃型位错。 28、螺型位错[2004 年]:位错线与柏氏矢量平行的位错。(位错线附近的 原子按螺旋形排列的位错称为螺型位错。) 29、扩展位错:通常指一个全位错分解为两个不全位错,中间夹着一个堆 垛层错的整个位错形态。 30、滑移:位错线沿着滑移面的运动称为位错的滑移。 31、滑移系: 晶体中一个滑移面及该面上一个滑移方向的组合称一个滑移 系。 32、交滑移[2004 年、2013 年]:当某一螺型位错在原滑移面上运动受阻 时,有可能从原滑移面转移到与之相交的另一滑移面上去继续滑移,这一 过程称为交滑移。 33、双交滑移:如果交滑移后的位错再转回和原滑移面平行的滑移面上继 续运动,则称为双交滑移。 34、多滑移[2003 年]:当外力在几个滑移系上的分切应力相等并同时达到 了临界分切应力时,产生同时滑移的现象。 35、位错滑移[2005 年]:在一定应力作用下,位错线沿滑移面移动的位错 运动。 36、位错交割[2007 年、2012 年]:不同滑移面上运动的位错在运动中相遇 发生位错互相切割的现象。 37、点阵畸变(晶格畸变): 在局部范围内,原子偏离其正常的点阵平衡 位置,造成点阵畸变。 38、有序固溶体[2012占据各自的布拉维点阵的一种固溶体,形成一种各组元原子有序排 列的固溶体,溶质在晶格完全有序排列。 39、置换固溶体[2011 年]: 当溶质原子溶入溶剂中形成固溶体时,溶质 原子占据溶剂点阵的阵点,或者说溶质原子置换了溶剂点阵的部分溶剂原 子,这种固溶体就称为置换固溶体。 40、间隙固溶体[2008 年]:溶质原子分布于溶剂晶格间隙而形成的固溶体 称为间隙固溶体。 41、有限固溶体:溶质在固溶体中的溶解度有一定限度,这种固溶体称为 有限固溶体。 42、连续固溶体(无限固溶体)[2010 年]: 某些元素之间可以任意比例 形成固溶体, 即不存在极限浓度的限制,称为无限固溶体或连续固溶 体。
波谱分析习题库答案
7、特征峰:红外光谱中4000-1333cm-1区域为特征谱带区,该区的吸收峰为特征峰。
8、质荷比:质量与电荷的比值为质荷比。
9、磁等同氢核化学环境相同、化学位移相同、对组外氢核表现相同偶合作用强度的氢核。
C、门控去偶谱D、反门控去偶谱
15、1JC-H的大小与该碳杂化轨道中S成分()
A、成反比B、成正比
C、变化无规律D、无关
16、在质谱仪中当收集正离子的狭缝位置和加速电压固定时,若逐渐增加磁场强度H,对具有不同质荷比的正离子,其通过狭缝的顺序如何变化?()
A、从大到小B、从小到大
C、无规律D、不变
17、含奇数个氮原子有机化合物,其分子离子的质荷比值为:()
A、该化合物含奇数氮。
B、该化合物含偶数氮,相对分子质量为265。
C、该化合物相对分子质量为265。
D、该化合物含偶数氮。
7、苯在环己烷中的吸收带包括()。
A 184 B 203 C 256 D 360
四、简答题
1、色散型光谱仪主要有哪些部分组成?
2、紫外光谱在有机化合物结构鉴定中的主要贡献是什么?
A、诱导效应B、共轭效应C、费米共振D、空间位阻
化合物A
26、测定化合物的氢谱时,所用试剂应该是()
A、乙醇B、甲醇C、氘代试剂D、非氘代试剂
27、下列化合物紫外图谱中最大吸收波长的大小顺序为()
① ② ③
A、③>②>①B、③>①>②C、②>③>①D、①>②>③
28、某化合物分子式为C8H7N红外光谱数据如下,IR(cm-1):3020,2920,2220,1602, 1572,1511,1450.1380,817
(完整word版)地球化学知识点整理
地球化学绪论1、地球化学的定义:地球化学是研究地球(包括部分天体)的化学组成、化学作用和化学演化的科学2、地球化学的基本问题:【填空】(1)质:地球系统中元素的组成(2)量:元素的共生组合和赋存形式(3)动:元素的迁移和循环(4)史:地球的历史和演化3、地球化学研究思路:【简答】在地质作用过程中,在宏观地质体变化和形成的同时,亦伴有大量肉眼难以辨别的化学组成变化的微观踪迹,它们包含着重要的定性和定量的地质作用信息,应用现代化学分析测试手段,剖析这些微观踪迹,从而揭示宏观地质作用的奥秘。
即“见微而知著”。
第一章地球和太阳系的化学组成第一节地球的结构和组成1、地球的圈层结构、主要界面名称:(1)地震波(P波和S波)在地球内部传播速度的变化,反映出地球内部物质的密度和弹性是不均一的。
这种不均一性在地球的一定深度表现为突变性质。
由此得出,地球内部具有壳层结构的概念,即认为地球由表及里分为地壳、地幔和地核三个部分。
界面分别为:莫霍面和古登堡面。
(2)上地壳和下地壳分界面为康拉德面。
上地壳又叫做硅铝层,下地壳又叫做硅镁层。
大陆地壳由上、下地壳,而大洋地壳只有下地壳。
【填空】2、固体地球各圈层的化学成分特点:(分布顺序)地壳:O、Si、Al、Fe、Ca地幔:O、Mg、Si、Fe、Ca地核:Fe-Ni地球:Fe、O、Mg、Si、Ni第二节元素和核素的地壳丰度1、基本概念:【名词解释】(1)地球化学体系:我们把所要研究的对象看作是一个地球化学体系,有一定的空间,处于特定的物理-化学状态,并且有一定时间的连续(2)丰度:研究体系中被研究元素的相对含量(3)克拉克值:地壳中元素的平均含量(4)质量克拉克值:以质量计算表示的克拉克值(5)原子克拉克值:以原子数之比表示的元素相对含量。
它是指某元素在某地质体全部元素的原子总数中所占原子个数的百分数。
(6)浓度克拉克值:某一元素在地质体中的平均含量与克拉克值的比值2、克拉克值的变化规律:(1)递减:元素的克拉克值大体上随原子序数的增大而减小。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
偶电子规则的名词解释
偶电子规则(even-odd electron rule)是指物质的电子结构中,原子或分子中的
电子数目遵循特定的模式。
根据这一规则,具有奇数数量的电子将处于不稳定状态,而具有偶数数量的电子则能够形成较为稳定的电子壳层结构。
在原子结构中,每个原子都由质子和中子组成的核心以及环绕核心运动的电子
组成。
根据原子的核电荷和外部环境等因素,电子将会占据不同的能级,即电子壳层。
然而,根据偶电子规则,当原子中电子的总数量为偶数时,这些电子能够更加容易地填充到不同能级中,形成稳定的电子排布。
这是因为电子在填充能级时遵循泡利不相容原理,即相同能级上的电子自旋量子数不能相同。
当电子数量为偶数时,上层能级中的电子能够完全填充下层能级,从而形成更加稳定的结构。
举个例子来说明偶电子规则。
碳原子就是一个具有特定电子结构的例子。
它有
6个电子,分布在能级1s²、2s²和2p²上。
根据偶电子规则,碳原子的电子排布是稳定的,因为6个电子可以完全填充到前两个能级中。
如果碳原子有7个电子,那就违反了偶电子规则,因为这样的话有一个电子将无法填充到下一个能级中,导致若节点的电子状态。
在原子物理学中,这种不稳定的状态往往会导致高度反应性,因为原子会寻求通过与其他原子中的电子发生化学键形成稳定的结构。
偶电子规则不仅适用于原子结构,也适用于分子结构。
在有机化学中,碳原子
通常是分子结构的基础。
根据偶电子规则,有机分子中碳原子的电子数量通常是偶数。
这是因为有机分子中的碳原子往往与其他碳原子或其他原子形成共价键,而共价键的形成需要电子的配对。
因此,具有偶数数量的电子的碳原子能够更容易地形成稳定的共价键,从而形成较为稳定的有机分子结构。
偶电子规则在许多化学领域具有重要意义。
它不仅能够帮助我们理解原子和分
子的电子结构,还可以用来解释和预测化学反应和物质性质。
研究偶电子规则对于开发新的材料和理解物质行为具有重要的应用价值。
总之,偶电子规则是一条描述物质电子结构中偶数数量电子的稳定性质的规律。
它对于理解原子和分子的电子排布以及预测和描述物质性质都具有重要的意义。
通过遵循偶电子规则,我们能够更好地理解和解释自然界中各种物质的行为。
