药物合成反应重要人名反应整理
人名反应(类型整理)

人名反应1氧化:1・Baeyer-Villiger氧化:酮过酸氧化成酯迁移规则:叔>仲>环己基>苄>伯〉甲基〉氢2・Corey-Kim氧化:醇在NCS/DMF作用后,碱处理氧化成醛酮3・Criegee邻二醇裂解:邻二醇由Pb(OAc)4氧化成羰基化合物4・Criegee臭氧化:烯烃臭氧化后水解成醛酮5・Dakin反应:对羟基苯甲醛由碱性H2O2氧化成对二酚6・Dess—Martin过碘酸酯氧化:仲醇由过碘酸酯氧化成酮7・Fleming氧化•硅烷经过酸化,过酸盐氧化,水解以后形成醇8・Hooker氧化:2—羟基一3烷基一1,4—醌被KMnO4氧化导致侧链烷基失去一个亚甲基,同时羟基和烷基位置互变9・Moffatt氧化(Pfitzner—Moffatt)氧化:用DCC和DMSO氧化醇,形成醛酮10・Oppenauer氧化:烷氧基催化的仲醇氧化成醛酮11・Riley氧化:活泼亚甲基(羰基a位等)被SeO2氧化成酮12・Rubottom氧化:烯醇硅烷经过m—CPBA和K2CO3处理后a—羟基化KHCO3氧化成醇13・Sarett氧化:CrO3・Py络合物氧化醇成醛酮14・Swern氧化:用(COC1)2,DMSO为试剂合Et3N淬灭的方法将醇氧化成羰基化合物15・Tamao—Kumada氧化:烷基氟硅烷被KF,H2O2,16・Wacker氧化:Pd催化剂下,烯烃氧化成酮还原:1・・Barton—McCombie去氧反应:从相关的硫羰基体中间用n—Bu3SnH,AIBN 试剂经过自由基开裂发生醇的去氧作用2・Birch还原:苯环由Na单质合液胺条件下形成环内二烯烃(带供电子基团的苯环:双键连接取代基:带吸电子基团的苯环,取代基在烯丙位。
)3・Brown硼氢化:烯烃和硼烷加成产生的有机硼烷经过碱性H2O2氧化得到醇4・Cannizzaro歧化:碱在芳香醛,甲醛或者其他无a—氢的脂肪氢之间发生氧化还原反应给出醇和酸5・Clemmensen还原:用锌汞齐和氯化氢将醛酮还原为亚甲基化合物6・Corey—Bakshi—Shibata(CBS)还原:酮在手性恶唑硼烷催化下的立体选择性还原7・Gribble吲哚还原:用NaBH4直接还原会导致N—烷基化,NaBH3CN在冰醋酸当中还原吲哚双键可以解决8・Gribble二芳基酮还原.用NaBH4在三氟乙酸中还原二芳基酮和二芳基甲醇为二芳基甲烷,也可以应用于二杂芳环酮和醇的还原9・Luche还原:烯酮在NaBH4—CeCl3下发生1,2—还原形成烯丙位取代烯醇10・McFadyen—Stevens还原:酰基苯磺酰肼用碱处理成醛11.Meerwein—Ponndorf—Verley还原:用Al(OPr')3/Pr'OH体系将酮还原为醇12・Midland还原:用B—3—a—蒎烯一9—BBN对酮进行不对称还原13・Noyori不对称氢化.羰基在Ru(II)BINAP络合物催化下发生不对称氢化还原14・Rosenmund还原:用BaSO4/毒化Pd催化剂将酰氯氢化成醛,如催化剂未被毒化,会氢化为醇15・Wolff—Kishner—黄鸣龙还原.用碱性肼将羰基还原为亚甲基成烯反应:1・Boord反应:B-卤代烷氧基与Zn作用生成烯烃2・Chugaev消除:黄原酸酯热消除成烯3・Cope消除:胺的氧化物热消除成烯烃4・Corey-Winterolefin烯烃合成:邻二醇经1,1-硫代羰基二咪唑和三甲氧基膦处理转化为相应的烯5・Doering-LaFlamme丙二烯合成:烯烃用溴仿以及烷氧化物处理以后生成同碳二溴环丙烷再反应生成丙二烯6・Horner-Wadsworth-Emmons反应:从醛合磷酸酯生成烯烃.副产物为水溶性磷酸盐,故以后处理较相应的Witting反应简单的多7・Julia-Lythgoe成烯反应:从砜合醛生成(E)-烯烃8・Peterson成烯反应:从a-硅基碳负离子合羰基化合物生成烯烃.也成为含硅的Witting反应9・Ramberg-Backlund烯烃合成:A-卤代砜用碱处理生成烯烃10・Witting反应:羰基用膦叶立德变成烯烃11・Zaitsev消除:E2消除带来更多取代的烯烃人名反应2偶联反应:Cadiot-Chodkiewicz偶联:从炔基卤和炔基酮合成双炔衍生物Castro—Stephens偶联:芳基炔合成,同Cadiot-Chodkiewicz偶联Eglinton反应:终端炔烃在化学计量(常常过量)Cu(Oac)2促进下发生的氧化偶联反应Eschenmoser偶联:从硫酰胺和烷基卤生成烯胺Glaser偶联:Cu催化终端炔烃的氧化自偶联Gomberg—Bachmann偶联:碱促进下芳基重氮盐和一个芳烃之间经自由基偶联生成二芳基化合物Heck反应:Pb催化的有机卤代物或者三氟磺酸酯和烯烃之间的偶联反应杂芳基Heck反应:发生在杂芳基受体上的Pd(Ph3P)4,Ph3P,CuI,Cs2CO3催化下的分子内或者分子间Heck反应Hiyama交叉偶联反应:Pb催化有机硅和有机卤代物或者三氟磺酸酯等在诸如F—或者OH—之类的活化剂Pd(Ph3P)4,TBAF催化剂存在下发生的交叉偶联反应Kumada交叉偶联(Kharasch交叉偶联):Ni和Pd催化下,格氏试剂和一个有机卤代物或者三氟磺酸酯之间的交叉偶联Liebeskind—Srogl偶联:硫酸酯和有机硼酸之间经过Pd催化发生交叉偶联生成酮McMurry偶联•羰基用低价Ti,如TiC13/LiAlH4产生的Ti(0)处理得到双键,反应是一个单电子过程Negishi交叉偶联:Pd催化的有机Zn和有机卤代物,三氟磺酸酯等之间发生的交叉偶联反应Sonogashira反应:Pd/Cu催化的有机卤和端基炔烃之间的交叉偶联反应Stille偶联:Pd催化的有机Sn和有机卤,三氟磺酸酯之间的交叉偶联反应Stille—Kelly偶联:双Sn试剂进行Pd催化下二芳基卤代物的分子交叉偶联Suzuki偶联:Pd催化下的有机硼烷和有机卤,三氟磺酸酯在碱存在下发生的交叉偶联Ullmann反应:芳基碘代物在Cu存在下的自偶联反应Wurtz反应:烷基卤经Na或Mg金属处理后形成碳碳单键Ymada偶联试剂:用二乙基氰基磷酸酯(EtO)2PO-CN活化羧酸缩合反应:Aldol缩合:羰基和一个烯醇负离子或一个烯醇的缩合Blaise反应:腈和a—卤代酯和Zn反应得到B—酮酯Benzoin缩合:芳香醛经CN—催化为安息香(二芳基乙醇酮)Buchner-Curtius-Schlotterbeck反应:羰基化合物和脂肪族重氮化物反应给出同系化的酮Claisen缩合:酯在碱催化下缩合为B—酮酯Corey-Fuchs反应:醛发生一碳同系化生成二溴烯烃》然后用BuLi处理生成终端炔烃Darzen缩水甘油酸酯缩合:碱催化下从a—卤代酯和羰基化合物生成a,B—环氧酯(缩水甘油醛)Dieckmann缩合:分子内的Claisen缩合Evansaldol反应:用Evans手性鳌合剂,即酰基恶唑酮进行不对称醇醛缩合Guareschi—Thorpe缩合(2—吡啶酮合成):氰基乙酸乙酯和乙酰乙酸在氨存在下生成2—吡啶酮Henry硝醇反应:醛和有硝基烷烃在碱作用下去质子化产生氮酸酯Kharasch加成反应:过渡金属催化的CXCl3对于烯烃的自由基加成Knoevenagel缩合:羰基化合物和活泼亚甲基化合物在胺的催化下缩合Mannnich缩合(羰基胺甲基化):胺,甲醛,和一个带有酸性亚甲基成分的化合物之间的三组分反应发生胺甲基化Michael加成:亲核碳原子对a,B-不饱和体系的共扼加成Mukaiyama醇醛缩合:Lewis酸催化下的醛和硅基烯醇醚之间的Aldol缩合Nozaki—Hiyama—KIshi反应:Cr—Ni双金属催化下的烯基卤对于醛的氧化还原加成Pechmann缩合(香豆素合成):Lewis酸促进的酸和B—酮酯缩合成为香豆素Perkin反应:芳香醛和乙酐反应合成肉桂酸Prins反应:烯烃酸性条件下对于甲醛的加成反应Reformatsky反应.有机Zn试剂(从a—卤代酯来)对羰基的亲核加成反应Reimer—Tiemann反应:从碱性介质当中从酚和氯仿合成邻甲酰基苯酚Schlosser对Witting反应的修正不稳定的叶立德和醛发生的Witting反应生成Z—烯烃,而改进的Schlosser反应可以得到E—烯烃Stetter反应(Michael—Stetter反应):从醛和a,B—不饱和酮可以得到1,4—二羰基衍生物。
人名反应 药物合成反应中主要地人名反应
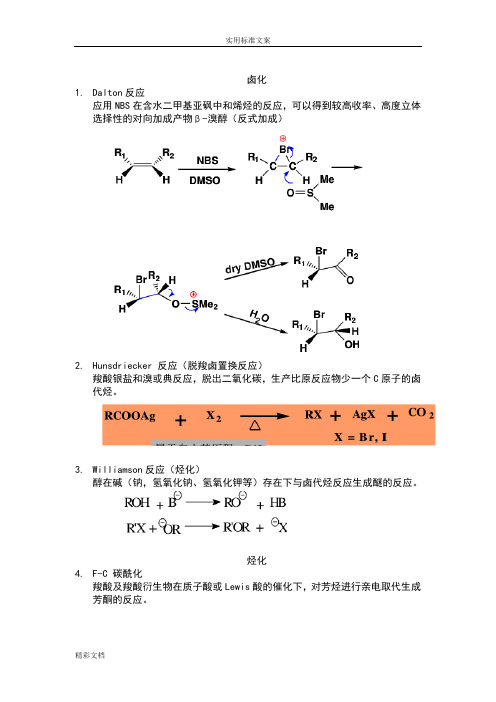
卤化1.Dalton反应应用NBS在含水二甲基亚砜中和烯烃的反应,可以得到较高收率、高度立体选择性的对向加成产物β-溴醇(反式加成)2.Hunsdriecker 反应(脱羧卤置换反应)羧酸银盐和溴或典反应,脱出二氧化碳,生产比原反应物少一个C原子的卤代烃。
3.Williamson反应(烃化)醇在碱(钠,氢氧化钠、氢氧化钾等)存在下与卤代烃反应生成醚的反应。
烃化4.F-C 碳酰化羧酸及羧酸衍生物在质子酸或Lewis酸的催化下,对芳烃进行亲电取代生成芳酮的反应。
酰化1.Gattermann反应羟基或烷氧基取代的芳烃在ZnCl2,AlCl3等Lewis酸的催化下与氰化氢和氯化氢反应,生成亚胺盐酸盐,在经水解生成相应的芳醛的反应。
2.Vilsmeier-Haack反应3.Reimer-tiemann反应4.Claisen和Dieckmann反应缩合1.Claisen-Schmidt反应2.Prins反应3.安息香缩合4.Blanc反应(氯甲基化)5.Mannich反应(氨甲基化)反应机理6.β-羟烷基化反应7. Michael反应8.Wittg反应9.羧基α活性亚甲基反应10.α,β-环氧化烷基化反应(Darens反应)11.D-A反应重排12.13.Pinacol重排14.B-B-Z重排15.Favorskii重排16.Beckmann重排17.Hofmann重排18.Stevens重排19.Sommelet-hauser重排20.Claisen重排还原21.Clemansen还原实用标准文案精彩文档22. 黄明龙反应23. 氨基保护剂还有Boc。
有机化学人名反应大全

一、Arbuzov 反应亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:卤代烷反应时,其活性次序为:R′I >R′Br >R′Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或 b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:如果反应所用的卤代烷 R'X 的烷基和亚磷酸三烷基酯 (RO)3P 的烷基相同(即 R' = R),则Arbuzov 反应如下:这是制备烷基膦酸酯的常用方法。
除了亚磷酸三烷基酯外,亚膦酸酯 RP(OR')2和次亚膦酸酯 R2POR' 也能发生该类反应,例如:反应机理2 进行的分子内重排反应:一般认为是按 SN反应实例二、Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例三、Baeyer----Villiger反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
药物合成反应-人名反应
20
Delépine amine synthesis.
Delepine胺合成
用卤代烃和环六亚甲基四胺(乌洛托品)反应得季铵盐,然后水解可得伯胺。
P057
21
Dieckmann condensation
若两个酯在同一分子之内,在上述条件下可发生分子内缩合,得环状β-酮酸酯,此反应称为Dieckmann反应。
1
Albright-Goldman氧化
P222
2
Aldol condensation
醇醛缩合
含有α-活泼氢原子的醛或酮,在碱或酸的催化下发生自身缩合,或和令一分子的醛或酮发生缩合,生成β-羟基醛或酮类化合物。该类化合物易脱水生成α,β-不饱和醛酮。
P130
3
Arbuzow重排
用亚膦酸酯在卤代烃(或其衍生物)作用下异构化得到膦酸酯。
P202
17
Curtius rearrangement
酰基叠氮化合物加热分解生成异腈酸酯的反应。
P188
18
Dakin oxidation
在芳香醛中,当醛基的邻、对位有羟基等供电子基团时,和有机过氧酸反应,醛基经甲酸酯阶段,最后转换成羟基。
P226
19
Darzens condensation
醛或酮和α-卤代酸酯在碱催化下缩合生成α,β-环氧羧酸酯的反应。
用甲酸及其铵盐可以对醛酮进行还原烃化,得各类胺。
P271
37
Lossen rearrangement
异羟肟酸的O-酰基衍生物用碱处理,有时只需加热,先生成异氰酸酯,然后水解得到伯胺的反应。
P187
38
Mannich reaction
具有活性氢的化合物和甲醛(或其他醛)、胺进行缩合,生成胺甲基衍生物的反应。
人名反应(类型整理)

人名反应1氧化:1.Baeyer-Villiger氧化:酮过酸氧化成酯迁移规则:叔>仲>环己基>苄>伯>甲基>氢2.Corey-Kim 氧化:醇在NCS/DMF作用后,碱处理氧化成醛酮3.Criegee邻二醇裂解:邻二醇由Pb(OAc)4氧化成羰基化合物4.Criegee臭氧化:烯烃臭氧化后水解成醛酮5.Dakin反应:对羟基苯甲醛由碱性H2O2氧化成对二酚6.Dess-Martin过碘酸酯氧化:仲醇由过碘酸酯氧化成酮7.Fleming氧化:硅烷经过酸化,过酸盐氧化,水解以后形成醇8.Hooker氧化:2-羟基-3烷基-1,4-醌被KMnO4氧化导致侧链烷基失去一个亚甲基,同时羟基和烷基位置互变9.Moffatt氧化(Pfitzner-Moffatt)氧化:用DCC和DMSO氧化醇,形成醛酮10.Oppenauer氧化:烷氧基催化的仲醇氧化成醛酮11.Riley氧化:活泼亚甲基(羰基α位等)被SeO2氧化成酮12.Rubottom氧化:烯醇硅烷经过m-CPBA和K2CO3处理后α-羟基化13.Sarett氧化:CrO3·Py络合物氧化醇成醛酮14.Swern氧化:用(COCl)2,DMSO为试剂合Et3N淬灭的方法将醇氧化成羰基化合物15.Tamao-Kumada氧化:烷基氟硅烷被KF,H2O2,KHCO3氧化成醇16.Wacker氧化:Pd催化剂下,烯烃氧化成酮还原:1..Barton-McCombie去氧反应:从相关的硫羰基体中间用n-Bu3SnH,AIBN 试剂经过自由基开裂发生醇的去氧作用2.Birch 还原:苯环由Na单质合液胺条件下形成环内二烯烃(带供电子基团的苯环:双键连接取代基;带吸电子基团的苯环,取代基在烯丙位。
)3.Brown硼氢化:烯烃和硼烷加成产生的有机硼烷经过碱性H2O2氧化得到醇4.Cannizzaro歧化:碱在芳香醛,甲醛或者其他无α-氢的脂肪氢之间发生氧化还原反应给出醇和酸5.Clemmensen还原:用锌汞齐和氯化氢将醛酮还原为亚甲基化合物6.Corey-Bakshi-Shibata(CBS)还原:酮在手性恶唑硼烷催化下的立体选择性还原7.Gribble吲哚还原:用NaBH4直接还原会导致N-烷基化,NaBH3CN在冰醋酸当中还原吲哚双键可以解决8.Gribble二芳基酮还原:用NaBH4在三氟乙酸中还原二芳基酮和二芳基甲醇为二芳基甲烷,也可以应用于二杂芳环酮和醇的还原9.Luche还原:烯酮在NaBH4-CeCl3下发生1,2-还原形成烯丙位取代烯醇10.McFadyen-Stevens还原:酰基苯磺酰肼用碱处理成醛11.Meerwein-Ponndorf-Verley还原:用Al(OPr’)3/Pr’OH体系将酮还原为醇12.Midland还原:用B-3-α-蒎烯-9-BBN对酮进行不对称还原13.Noyori不对称氢化:羰基在Ru(II)BINAP络合物催化下发生不对称氢化还原14.Rosenmund还原:用BaSO4/毒化Pd催化剂将酰氯氢化成醛,如催化剂未被毒化,会氢化为醇15.Wolff-Kishner-黄鸣龙还原:用碱性肼将羰基还原为亚甲基成烯反应:1.Boord反应:β-卤代烷氧基与Zn作用生成烯烃2.Chugaev消除:黄原酸酯热消除成烯3.Cope消除:胺的氧化物热消除成烯烃4.Corey-Winter olefin烯烃合成:邻二醇经1,1-硫代羰基二咪唑和三甲氧基膦处理转化为相应的烯5.Doering-LaFlamme丙二烯合成:烯烃用溴仿以及烷氧化物处理以后生成同碳二溴环丙烷再反应生成丙二烯6.Horner-Wadsworth-Emmons反应:从醛合磷酸酯生成烯烃.副产物为水溶性磷酸盐,故以后处理较相应的Witting反应简单的多7.Julia-Lythgoe成烯反应:从砜合醛生成(E)-烯烃8.Peterson成烯反应:从α-硅基碳负离子合羰基化合物生成烯烃.也成为含硅的Witting反应9.Ramberg-Backlund烯烃合成:Α-卤代砜用碱处理生成烯烃10.Witting反应:羰基用膦叶立德变成烯烃11.Zaitsev消除:E2消除带来更多取代的烯烃人名反应2偶联反应:Cadiot-Chodkiewicz偶联:从炔基卤和炔基酮合成双炔衍生物Castro-Stephens偶联:芳基炔合成,同Cadiot-Chodkiewicz偶联Eglinton反应:终端炔烃在化学计量(常常过量)Cu(Oac)2促进下发生的氧化偶联反应Eschenmoser偶联:从硫酰胺和烷基卤生成烯胺Glaser偶联:Cu催化终端炔烃的氧化自偶联Gomberg-Bachmann偶联:碱促进下芳基重氮盐和一个芳烃之间经自由基偶联生成二芳基化合物Heck反应:Pb催化的有机卤代物或者三氟磺酸酯和烯烃之间的偶联反应杂芳基Heck反应:发生在杂芳基受体上的Pd(Ph3P)4,Ph3P,CuI,Cs2CO3催化下的分子内或者分子间Heck反应Hiyama交叉偶联反应:Pb催化有机硅和有机卤代物或者三氟磺酸酯等在诸如F -或者OH-之类的活化剂Pd(Ph3P)4,TBAF催化剂存在下发生的交叉偶联反应Kumada交叉偶联(Kharasch交叉偶联):Ni和Pd催化下,格氏试剂和一个有机卤代物或者三氟磺酸酯之间的交叉偶联Liebeskind-Srogl偶联:硫酸酯和有机硼酸之间经过Pd催化发生交叉偶联生成酮McMurry 偶联:羰基用低价Ti,如TiCl3/LiAlH4产生的Ti(0)处理得到双键,反应是一个单电子过程Negishi交叉偶联:Pd催化的有机Zn和有机卤代物,三氟磺酸酯等之间发生的交叉偶联反应Sonogashira反应:Pd/Cu催化的有机卤和端基炔烃之间的交叉偶联反应Stille偶联:Pd催化的有机Sn和有机卤,三氟磺酸酯之间的交叉偶联反应Stille-Kelly偶联:双Sn试剂进行Pd催化下二芳基卤代物的分子交叉偶联Suzuki偶联:Pd催化下的有机硼烷和有机卤,三氟磺酸酯在碱存在下发生的交叉偶联Ullmann反应:芳基碘代物在Cu存在下的自偶联反应Wurtz反应:烷基卤经Na或Mg金属处理后形成碳碳单键Ymada偶联试剂:用二乙基氰基磷酸酯(EtO)2PO-CN活化羧酸缩合反应:Aldol缩合:羰基和一个烯醇负离子或一个烯醇的缩合Blaise反应:腈和α-卤代酯和Zn反应得到β-酮酯Benzoin 缩合:芳香醛经CN-催化为安息香(二芳基乙醇酮)Buchner-Curtius-Schlotterbeck反应:羰基化合物和脂肪族重氮化物反应给出同系化的酮Claisen缩合:酯在碱催化下缩合为β-酮酯Corey-Fuchs反应:醛发生一碳同系化生成二溴烯烃,然后用BuLi处理生成终端炔烃Darzen缩水甘油酸酯缩合:碱催化下从α-卤代酯和羰基化合物生成α,β-环氧酯(缩水甘油醛)Dieckmann缩合:分子内的Claisen缩合Evans aldol反应:用Evans手性鳌合剂,即酰基恶唑酮进行不对称醇醛缩合Guareschi-Thorpe缩合(2-吡啶酮合成):氰基乙酸乙酯和乙酰乙酸在氨存在下生成2-吡啶酮Henry硝醇反应:醛和有硝基烷烃在碱作用下去质子化产生氮酸酯Kharasch加成反应:过渡金属催化的CXCl3对于烯烃的自由基加成Knoevenagel缩合:羰基化合物和活泼亚甲基化合物在胺的催化下缩合Mannnich缩合(羰基胺甲基化):胺,甲醛,和一个带有酸性亚甲基成分的化合物之间的三组分反应发生胺甲基化Michael加成:亲核碳原子对α,β-不饱和体系的共扼加成Mukaiyama醇醛缩合:Lewis酸催化下的醛和硅基烯醇醚之间的Aldol缩合Nozaki-Hiyama-KIshi反应:Cr-Ni双金属催化下的烯基卤对于醛的氧化还原加成Pechmann缩合(香豆素合成):Lewis酸促进的酸和β-酮酯缩合成为香豆素Perkin反应:芳香醛和乙酐反应合成肉桂酸Prins反应:烯烃酸性条件下对于甲醛的加成反应Reformatsky反应:有机Zn试剂(从α-卤代酯来)对羰基的亲核加成反应Reimer-Tiemann反应:从碱性介质当中从酚和氯仿合成邻甲酰基苯酚Schlosser对Witting反应的修正:不稳定的叶立德和醛发生的Witting反应生成Z-烯烃,而改进的Schlosser反应可以得到E-烯烃Stetter反应(Michael-Stetter反应):从醛和α,β-不饱和酮可以得到1,4-二羰基衍生物。
人名反应药物合成反应中主要的人名反应
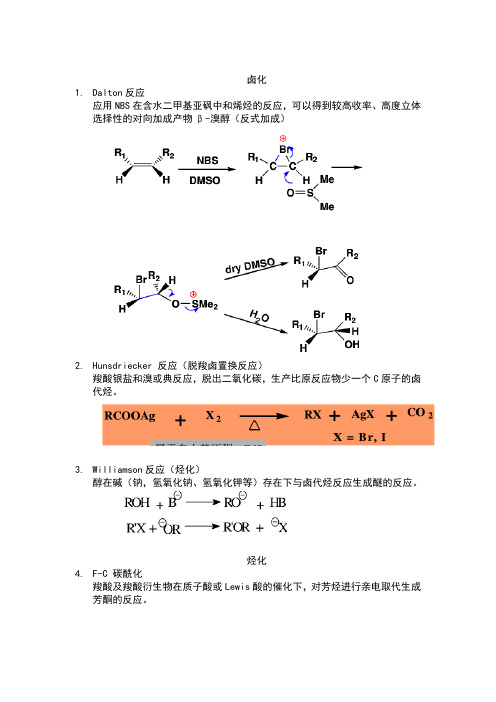
卤化1.Dalton反应应用NBS在含水二甲基亚砜中和烯烃的反应,可以得到较高收率、高度立体选择性的对向加成产物β-溴醇(反式加成)2.Hunsdriecker 反应(脱羧卤置换反应)羧酸银盐和溴或典反应,脱出二氧化碳,生产比原反应物少一个C原子的卤代烃。
3.Williamson反应(烃化)醇在碱(钠,氢氧化钠、氢氧化钾等)存在下与卤代烃反应生成醚的反应。
烃化4.F-C 碳酰化羧酸及羧酸衍生物在质子酸或Lewis酸的催化下,对芳烃进行亲电取代生成芳酮的反应。
酰化1.Gattermann反应羟基或烷氧基取代的芳烃在ZnCl2,AlCl3等Lewis酸的催化下与氰化氢和氯化氢反应,生成亚胺盐酸盐,在经水解生成相应的芳醛的反应。
2.Vilsmeier-Haack反应3.Reimer-tiemann反应4.Claisen和Dieckmann反应缩合1.Claisen-Schmidt反应2.Prins反应3.安息香缩合4.Blanc反应(氯甲基化)5.Mannich反应(氨甲基化)反应机理6.β-羟烷基化反应7. Michael反应8.Wittg反应9.羧基α活性亚甲基反应10.α,β-环氧化烷基化反应(Darens反应)11.D-A反应重排12.13.Pinacol重排14.B-B-Z重排15.Favorskii重排16.Beckmann重排17.Hofmann重排18.Stevens重排19.Sommelet-hauser重排20.Claisen重排还原21.Clemansen还原22.黄明龙反应23.氨基保护剂还有Boc。
有机合成常用人名反应
有机合成常用人名反应有机合成是化学领域中的一个重要分支,它研究有机化合物的合成方法和反应过程。
在有机合成中,常常会使用一些常用的人名反应,这些反应以人名命名,代表了该反应的发现者或者重要贡献者。
本文将介绍一些常用的人名反应,并对其原理和应用进行阐述。
一、格氏反应(Gattermann Reaction)格氏反应是一种用于合成醛的重要反应。
它是由德国化学家格氏(Gattermann)于1898年发现的。
格氏反应通过在芳香化合物上引入氰基,然后将其加氢还原,得到相应的醛。
格氏反应是一种重要的合成醛的方法,广泛应用于有机合成领域。
二、斯特雷克反应(Strecker Reaction)斯特雷克反应是一种合成α-氨基酸的方法,由德国化学家斯特雷克(Strecker)于1850年发现。
该反应通过使用醛、氰化物和胺,经过缩合和水解反应,合成出具有氨基酸结构的化合物。
斯特雷克反应是合成氨基酸的重要方法之一,广泛应用于生物化学和药物化学领域。
三、沃尔夫-克尼希反应(Wolf-Kishner Reduction)沃尔夫-克尼希反应是一种将醛或酮转化为对应的烷烃的方法。
该反应由德国化学家沃尔夫(Wolf)和克尼希(Kishner)于1912年发现。
沃尔夫-克尼希反应通过使用氨水和氢醇钠,将醛或酮转化为相应的烷烃。
这种还原反应在有机合成中具有重要的应用价值。
四、格里格纳德试剂(Grignard Reagent)格里格纳德试剂是一类由法国化学家格里格纳德(Grignard)于1900年发现的有机金属试剂。
格里格纳德试剂可以与卤代烃反应,生成烷基镁试剂。
这些烷基镁试剂可以与酮、醛、酸等化合物发生加成反应,合成出复杂的有机分子。
格里格纳德试剂是一种重要的有机合成试剂,在有机合成中具有广泛的应用。
五、费舍尔试剂(Fisher Reagent)费舍尔试剂是一种用于合成酮的试剂,由德国化学家费舍尔(Fisher)于1895年发现。
药物合成人名反应整理
1.Baeyer-Villiger:酮与过氧酸,重排成酯;如环酮,转化成内酯或羟基酸2.Birch:芳香族化合物在液氮中用钠还原,生成非共轭二烯3.Claisen重排:烯丙基芳基醚加热重排为邻烯丙基酚类4.Claisen反应和Dieckmann:C为羧酸酯与另一分子具有α-活泼氢的酯缩合得到β-酮酸酯;D 发生在同一分子内5.Clemmensen:酸性条件,用锌汞齐或锌粉还原醛基、酮基为甲基和亚甲基6.Friedel-Crafts:羧酸及衍生物在质子酸或Lewis酸催化下对芳烃亲电取代生成芳酮7.Gattermann:羟基或烷氧基取代的芳烃在ZnCl2、AlCl3等Lewis酸的催化下与氰化氢和氯化氢反应生成亚胺盐酸盐,再水解生成芳醛8.Grignard:有机卤素与金属镁在无水醚存在下生成格氏试剂,后者再与羟基反应得醇类9.Hoesch:腈类与氯化氢在Lewis酸催化剂ZnCl2的存在下与羟基或烷氧基取代的芳烃反应生成酮亚胺,再经水解得芳酮10.Michael:活性亚甲基化合物和α,β-不饱和羰基化合物在碱性催化剂存在下发生加成缩合生成β-羰烷基类化合物11.Pinacol:连乙二醇类用酸处理时重排成醛或酮12.Pictet-Spenglerβ-芳乙胺与羟基化合物在酸性溶液中缩合生成1,2,3,4-四氢异喹啉13.Prins:烯烃与甲醛在酸催化下加成得1,3-二醇或其环状缩醛1,3-二氧六环及α-烯醇14.Reimer-Tiemann:苯酚和氯仿在强碱水溶液中加热,生成芳醛15.Schmidt:在酸催化下,叠氮酸与羧酸、酮或醛反应分别生成伯胺、酰胺或腈16.Ullmann:由于卤代芳烃活性较低,又有位阻,不易与芳香伯胺反应。
如加入酮或碘化酮以及碳酸钾并加热,可得二苯胺及其同系物。
17.Vilsmeier-Haack:以N-取代甲酰胺为甲酰化试剂在氧氯化磷的催化下在芳环上引入甲酰基18.Wagner-Meerwein:正溴丙烷与AlBr3反应,形成碳正离子,重排得2-溴丙烷19.Witting:醛或酮与磷叶立德反应合成烯烃20.安息香:芳醛在含水乙醇中,以氰化钠为催化剂,加热后发生双分子缩合生成α-羟基酮1.Aldol缩合:含α-活性氢的的醛或酮,在碱或酸的催化下发生自身缩合,或与另一分子的醛或酮发生缩合,生成β-羟基醛或酮类化合物的反应,称为α-羟烷基化反应。
有机化学人名反应大全
一、Arbuzov 反应亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:卤代烷反应时,其活性次序为:R′I >R′Br >R′Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或 b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得:如果反应所用的卤代烷 R'X 的烷基和亚磷酸三烷基酯 (RO)3P 的烷基相同(即 R' = R),则Arbuzov 反应如下:这是制备烷基膦酸酯的常用方法。
除了亚磷酸三烷基酯外,亚膦酸酯 RP(OR')2和次亚膦酸酯 R2POR' 也能发生该类反应,例如:反应机理2 进行的分子内重排反应:一般认为是按 SN反应实例二、Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例三、Baeyer----Villiger反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
中国人名字命名的化学反应
中国人名字命名的化学反应一、赵明反应赵明反应是一种有机合成反应,以中国化学家赵明的名字命名。
该反应是一种将芳香醛和胺反应生成相应的胺酮的方法。
该反应通常在碱性条件下进行,以加速反应速率。
赵明反应在药物合成和有机合成中具有重要的应用价值。
二、李娜反应李娜反应是一种有机合成反应,以中国网球选手李娜的名字命名。
该反应是一种将芳香胺和醛反应生成相应的亚胺的方法。
该反应通常在酸性条件下进行,以提高反应的选择性和产率。
李娜反应在药物合成和材料科学中得到广泛应用。
三、王刚反应王刚反应是一种有机合成反应,以中国化学家王刚的名字命名。
该反应是一种将酮和醛反应生成相应的烯酮的方法。
该反应通常在氧气存在下进行,以提高反应的效率和产率。
王刚反应在天然产物合成和有机合成中具有重要的应用价值。
四、张丽反应张丽反应是一种有机合成反应,以中国化学家张丽的名字命名。
该反应是一种将醛和亚胺反应生成相应的醛胺的方法。
该反应通常在中性条件下进行,以避免副反应的发生。
张丽反应在药物合成和有机合成中得到广泛应用。
五、刘强反应刘强反应是一种有机合成反应,以中国化学家刘强的名字命名。
该反应是一种将酮和酸反应生成相应的酸酯的方法。
该反应通常在酸性条件下进行,以促进反应的进行。
刘强反应在有机合成和材料科学中具有重要的应用价值。
六、陈秀反应陈秀反应是一种有机合成反应,以中国化学家陈秀的名字命名。
该反应是一种将苯胺和酮反应生成相应的亚胺的方法。
该反应通常在碱性条件下进行,以提高反应的速率和产率。
陈秀反应在药物合成和有机合成中得到广泛应用。
七、杨勇反应杨勇反应是一种有机合成反应,以中国化学家杨勇的名字命名。
该反应是一种将芳香酮和胺反应生成相应的酰胺的方法。
该反应通常在酸性条件下进行,以促进反应的进行。
杨勇反应在药物合成和材料科学中具有重要的应用价值。
八、吴丽反应吴丽反应是一种有机合成反应,以中国化学家吴丽的名字命名。
该反应是一种将酮和胺反应生成相应的胺酮的方法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
药物合成反应重要人名反应整理Happy First, written on the morning of August 16, 20221.Hunsdriecke反应:羧酸银盐和溴或碘反应;脱去二氧化碳;生成比原反应物少一个碳原子的卤代烃..2.Sandmeyer反应:用氯化亚铜或溴化亚铜在相应的氢卤酸存在下;将芳香重氮盐转化成卤代芳烃..3.Gattermann反应:将上面改为铜粉和氢卤酸..4.Shiemann反应:将芳香重氮盐转化成不溶性的重氮氟硼酸盐或氟磷酸盐;或芳胺直接用亚硝酸纳和氟硼酸进行重氮化;此重氮盐再经热分解有时在氟化钠或铜盐存在下加热;就可以制得较好收率的氟代芳烃..5.Williamson合成:醇在碱钠;氢氧化钠;氢氧化钾存在下与卤代烃反应生成醚..6.Gabriel合成:将氨先制备成邻苯二甲酰亚胺;利用氮上氢的酸性;先与氢氧化钾生成钾盐;然后与卤代烃作用;得N-烃基邻苯二甲酰亚胺;肼解或酸水解即可得纯伯胺..7.Delepine反应:用卤代烃与环六亚甲基四胺乌洛托品反应得季铵盐;然后水解可得伯胺..8.Leuckart反应:用甲酸及其铵盐可以对醛酮进行还原烃化;得各类胺..9.Ullmann反应:卤代芳烃与芳香伯胺在铜或碘化铜及碳酸钾存在并加热的条件下可得二苯胺及其同系物..10.Friedel-Crafts反应:在三氯化铝催化下;卤代烃及酰卤与芳香族化合物反应;再环上引入烃基及酰基..11.Meerwein芳基化反应:芳基自由基可与烯反应;引致烯键的碳原子上..12.Gomberg-Bachmann反应:芳香自由基与过量存在的另一芳香族化合物发生取代反应;得到联苯..方向自由基的来源主要有三种:最常用重氮离子的分解;其次为N-亚硝基乙酰苯胺类及芳酰过氧化物的分解13.Hoesch反应:腈类化合物与氯化氢在Lewis酸催化剂ZnCl2的存在下与具有烃基或烷氧基的芳烃进行反应可生成相应的酮亚胺;在经水解则得具有羟基或烷氧基的芳香酮..14.Gattermann反应:将具有羟基或烷氧基的芳烃在三氯化铝或氯化锌催化下与氰化氢及氯化氢作用生成相应芳香醛的反应..15.Vilsmeier-Haack反应:以N-取代的甲酰胺化试剂在氧氯化磷作用下;在芳核或杂环上引入甲酰基..16.Rimer-Tiemann反应:将酚及某些杂环化合物与碱金属的氢氧化物溶液和过量的氯仿一起加热形成芳醛的反应..17.Claisen反应和Dieckmann反应:羧酸酯与另一分子具有α-活泼氢的酯进行缩合的反映称为Claisen缩合..若两个酯在同一分子之内;在上述条件下可发生分子内缩合;得环状β-酮酸酯;此反应称为Dieckmann反应..18.Aldol缩合:含有α-活泼氢原子的醛或酮;在碱或酸的催化下发生自身缩合;或与令一分子的醛或酮发生缩合;生成β-羟基醛或酮类化合物..该类化合物易脱水生成α;β-不饱和醛酮..19.Claisen-Schimidt反应:芳醛与含有α-活泼氢的醛、酮之间的缩合..芳醛和脂肪醛、酮在碱催化下缩合生成β-不饱和醛酮的就反应..20.Tollens缩合:甲醛在碱的催化下;可与含有α-活性氢的醛、酮进行醛醇缩合;在醛、酮的α-碳原子上引入羟甲基;产物是β-羟基醛或其脱水物——α;β-不饱和醛酮..21.Cannizzaro反应:22.Robinson环和:酯环酮与α;β-不饱和酮的共轭加成产物所发生的分子内缩合反应;可以再原来环结构基础上在引入一个环..23.Prins反应:烯烃与甲醛或其他醛在酸催化下加成而得1;3-丙二醇或其环状缩醛1;3-二氧六环及α-烯醇的反应..安息香缩合:芳醛在含水乙醇中;以氰化钾为催化剂;加热后发生双分子缩合生成α-羟基酮的反应..24.Reformatsky反应:醛或酮与α-卤代酸酯在金属锌粉存在下缩合而得β-羟基酸酯或脱水得α;β-不饱和酸酯的反应..25.Grignard反应:由有机卤素化合物卤代烃、活性卤代芳烃等与金属镁在无水乙醚存在下生成格式试剂;后者在与羰基化合物醛、酮等反应而得相应的醇类的反应..26.Blanc反应:芳烃在甲醛、氯化氢及无水二氯化锌三氯化铝、四氯化锡或质子酸等缩合剂的存在下;在芳环上引入卤烷基--CH2Cl的反应..27.Mannich反应:具有活性氢的化合物与甲醛或其他醛、胺进行缩合;生成胺甲基衍生物的反应..28.Pictet-Spengler反应:β-芳乙胺与羰基化合物在酸性溶液中缩合生成1;2;3;4-四氢异喹啉的反应..29.Strecker反应:脂肪族或芳香族醛、酮类与氰化氢和过量氨或胺类作用生成α-氨基腈;再经酸或碱水解得到dl-α-氨基酸类的反应..30.Michael反应:活性亚甲基化合物和α;β-不饱和羰基化合物在碱性催化剂存在下发生加成缩合;生成β-羰烷基类化合物..31.Wittig反应:醛或酮与含磷试剂——烃代亚甲基三苯膦反应;醛、酮分子中的羰基的氧原子被亚甲基或取代亚甲基所取代;生成相应的稀类化合物及氧化三苯膦;此类反应称为羰基稀化反应..32.Horner反应:利用膦酸酯与醛、酮类化合物在碱存在下作用生成烯烃的反应..33.Knoevenagel反应:凡具有活性亚甲基的化合物在氨、胺或其羧酸盐的催化下;与醛、酮发生醛醇型缩合;脱水得α;β-不饱和化合物的反应..34.Stobbe反应:丁二酸酯或α-烃基取代的丁二酸酯在碱性试剂存在下;与羰基化合物进行缩合而得α-烷烃或芳烃亚甲基丁二酸单酯的反应..常用碱性试剂有醇钠;叔丁醇钾;氰化钠和三苯甲烷钠等35.Perkin反应:芳香醛和脂肪酸酐在相应的脂肪酸碱金属盐的催化下缩合;生成β-芳基丙烯酸类化合物的反应..36.Darzens缩合:醛或酮与α-卤代酸酯在碱催化下缩合生成α;β-环氧羧酸酯的反应..37.Diels-Alder反应:共轭二烯烃与烯烃、炔烃进行环加成;生成环己烯衍生物的反应..38.Wagner-Meerwein重排:在质子酸或lewis酸催化下生成的碳正离子中;烷基、芳基、或氢从一个碳原子通过过渡态;迁移至相邻带正电荷碳原子的反应..39.Pinacol重排:在酸催化下;邻二叔醇失去一分子水;重排成醛或酮的反应..40.二苯基乙二酮-二苯基乙醇酸型重排:α-二酮用强碱处理发生重排;生成α-羟基乙酸盐..41.Fovorski重排:α-卤代酮在碱氢氧化钠;醇钠;HNRR’催化下脱去卤原子;重排为羧酸或其衍生物的反应..42.Wolff重排:α-重氮酮经加热、光解或在某些金属等催化剂作用下脱去一分子氮气后重排成烯酮的反应..烯酮经进一步反应;生成羧酸、酯、酰胺或酮..43.Arndt-Eistert反应:酰氯与重氮甲烷反应得α-重氮酮;再经Wolff 重排;生成比原来酰氯多一个碳原子的羧酸..44.Beckmann重排:醛肟与酮肟在酸催化剂作用下重排成取代酰胺的反应..45.Hofmann重排:氮上无取代基的酰胺用卤素溴或氯及碱处理;脱羧生成伯胺的反应..由于产物比反应物少一个碳原子;所以又称为Hofmann降解..46.Curtius重排:酰基叠氮化合物加热分解生成异腈酸酯的反应..47.Schmidt反应:在酸催化下;酸和酮或醛与氨或叠氮化钠反应生成伯胺、酰胺或腈的反应..48.Baeyer-Villiger氧化:在酸催化下;醛或酮与过氧酸作用;在烃基与羰基之间插入氧生成酯的反应..49.Stevens重排:α-位上具有吸电子基Z的季铵盐在强碱作用下;脱去一个α活泼氢生成叶立德;然后季氮上的烃基进行分子内1;2-迁移;生成叔胺的反应..50.Sommelet-Hauser重排:苄基季铵盐在强碱催化下;重排成邻位烃基取代的苄基叔胺的反应..51.Wittig重排:醚类化合物经强碱处理;分子中一个烃基发生迁移;生成醇的反应..52.Claisen重排:烯醇或酚的烯丙基醚加热;通过3;3-σ迁移使烯丙基自氧原子迁移到碳原子上的反应..53.Cope重排:1;5-二稀连二烯丙基经过3;3-σ迁移;异构化成另一双烯丙基衍生物的反应..54.Fischer吲哚合成:醛或酮的芳腙在适当催化剂存在下;脱氨基生成吲哚类化合物的反应..55.Oppenauer氧化:仲醇与丙酮在烷氧基铝存在下一起回流;将仲醇氧化成酮..56.Dakin反应:在芳香醛中;当醛基的邻、对位有羟基等供电子基团时;与有机过氧酸反应;醛基经甲酸酯阶段;最后转换成羟基..57.Sharpless环氧化反应:58.Wacker反应:在氯化钯、氯化铜存在下;利用空气中的氧气使烯烃转化成醛或酮的过程..59.Birch还原:芳香族化合物在液氨中用钠还原;生成非共轭二烯的反应..60.Clemmensen反应:在酸性条件下;用锌汞齐或锌粉还原醛基、酮基为甲基和亚甲基的反应..61.Wolff-кижер-黄鸣龙还原反应:醛酮在强碱条件下;与水合肼缩合成腙;进而放氮分解转化成甲基和亚甲基的反应..62.Meerwein-Ponndorf-Verley反应:将醛、酮等羰基化合物和异丙醇铝在异丙醇中共热;可还原得到相应的醇;同时将异丙醇氧化成丙酮..63.Leuckart反应:在甲酸及其衍生物存在下;羰基化合物与氨、胺的还原胺化反应..64.Rosenmund反应:酰卤在适当的反应条件下;用催化氢化或金属氢化物选择性的还原为醛的反应..65.Bouveault-Blanc反应:将羧酸酯用金属钠和无水醇直接还原生成相应的伯醇;主要用于高级脂肪酸酯的还原..66.偶姻缩合:羧酸酯在惰性溶剂如醚、甲苯、二甲苯中与金属钠发生还原偶联反应;生成α羟基酮..67.脱苄反应:苄基或取代苄基与氧、氮或硫连接生成的醇、醚、酯、苄胺、硫醚等;均可以通过氢解反应脱去苄基生成相应的烃、醇、酸、胺等类化合物..68.Heck反应:卤代烃、苯甲酰氯或芳基重氮盐等与乙烯基化合物的C-C 偶联反应..69.Suzuki交叉偶联反应:钯催化的有机硼化合物与卤代烃生成不对称联芳烃..。
