亚硝化细菌的分离纯化及诱变育种
一株亚硝化细菌的分离鉴定及其发酵工艺优化

一株亚硝化细菌的分离鉴定及其发酵工艺优化赵彭年;杨德玉;王加友;丁一凡;安鹏;王远【摘要】亚硝化细菌(又称氨氧化菌)在自然界中分布广泛,其在土壤、淡水及海洋中均有分布.亚硝化细菌在污水氨氮降解过程中具有重要作用,然而亚硝化细菌的高密度发酵较为困难,使其在实际应用中受到限制.基于此,将海洋污泥在揺瓶中富集培养,利用硅胶平板和水洗琼脂平板分离获得1株亚硝化细菌,经鉴定为亚硝化单胞菌菌属(Nitrosomonas sp.),并通过揺瓶培养确定了此菌株的最优培养条件:最适温度为30℃,最适pH为8.0,最适溶解氧浓度≥1.8 mg/L.经正交试验确定培养基组分的最佳组合及浓度:0.5%NaHCO3,0.8%(NH4)2SO4,0.1%KH2PO4,0.01%FeSO4.最后,在最优培养条件下利用10 L发酵罐进行高密度发酵,并于发酵过程中进行了2次发酵液置换,当发酵75 h时,发酵液的亚硝化速率达到236 mg(N-NO-2)/L·h,与未进行发酵液置换的发酵批次相比,亚硝化速率提高了2倍.研究表明,置换发酵液极大地提高了发酵效率,对后续工业化生产起到了重要的指导作用.【期刊名称】《生物技术进展》【年(卷),期】2019(009)001【总页数】9页(P69-77)【关键词】亚硝化细菌;亚硝化速率;零级反应;培养条件;发酵液置换【作者】赵彭年;杨德玉;王加友;丁一凡;安鹏;王远【作者单位】沈阳化工研究院有限公司生物与医药研究所,沈阳110021;沈阳化工研究院有限公司生物与医药研究所,沈阳110021;沈阳化工研究院有限公司生物与医药研究所,沈阳110021;沈阳化工研究院有限公司生物与医药研究所,沈阳110021;沈阳化工研究院有限公司生物与医药研究所,沈阳110021;沈阳化工研究院有限公司生物与医药研究所,沈阳110021【正文语种】中文亚硝化细菌(又称氨氧化菌)在自然界中分布十分普遍,其在土壤、淡水及海洋中都有存在。
硝化细菌的富集培养,分离纯化

硝化细菌的富集培养,分离纯化硝化细菌将氨氧化为硝酸的过程。
19世纪以前,人们把硝酸盐看作是化学作用的产物,即空气中的氧和氨经土壤催化形成。
1862年L.巴斯德首先指出硝酸盐的形成可能是微生物作用的结果。
1877年,德国化学家T.施勒辛和A.明茨用消毒土壤的办法,证实了氨被氧化为硝酸的确是生物学过程。
1891年,С.Н.维诺格拉茨基用无机盐培养基成功地获得了硝化细菌的纯培养,最终证实了硝化作用是由两群化能自养细菌进行的。
先是亚硝化单胞菌将铵氧化为亚硝酸;然后硝化杆菌再将亚硝酸氧化为硝酸。
这两群细菌统称硝化细菌。
其作用过程如下:硝化细菌从铵或亚硝酸的氧化过程中获得能量用以固定二氧化碳,但它们利用能量的效率很低,亚硝酸菌只利用自由能的5~14%;硝酸细菌也只利用自由能的5~10%。
因此,它们在同化二氧化碳时,需要氧化大量的无机氮化合物。
土壤中硝化细菌的数量首先受铵盐含量的影响,一般耕地里,每克土中只有几千至几万个。
添加铵盐即可使其数量增至几千万个。
土壤中性偏碱,通气良好,水分为田间持水量的50~70%,温度为10~30℃时,最适宜硝化细菌的生长繁殖,铵盐也能迅速被转化为硝酸盐。
自然界中,除自养硝化细菌外,还有些异养细菌、真菌和放线菌能将铵盐氧化成亚硝酸和硝酸,异养微生物对铵的氧化效率远不如自养细菌高,但其耐酸,并对不良环境的抵抗能力较强,所以在自然界的硝化作用过程中,也起着一定的作用。
--------------------------------------------------------------------------------氨在微生物作用下氧化为硝酸的过程。
通常发生在通气良好的土壤、厩肥、堆肥和活性污泥中。
作用机理硝化作用由自养型细菌分阶段完成:第一阶段为亚硝化,即氨氧化为亚硝酸的阶段。
参与这个阶段活动的亚硝酸细菌主要有5个属:亚硝化毛杆菌属(Nitrosomonas) ;亚硝化囊杆菌属(Nitrosocystis);亚硝化球菌属(Nitrosococcus);亚硝化螺菌属(Nitrosospira)和亚硝化肢杆菌属(Nitrosogloea)。
硝化细菌的分离纯化
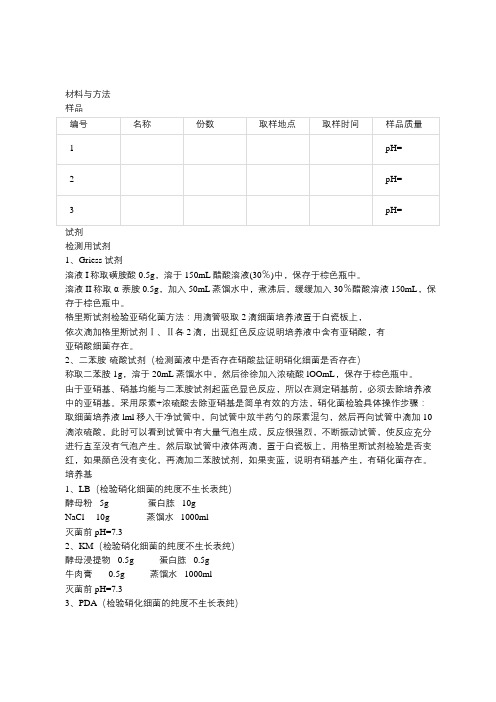
材料与方法样品检测用试剂1、Griess 试剂溶液I称取磺胺酸0.5g,溶于150mL醋酸溶液(30%)中,保存于棕色瓶中。
溶液II称取α-萘胺0.5g,加入50mL蒸馏水中,煮沸后,缓缓加入30%醋酸溶液150mL,保存于棕色瓶中。
格里斯试剂检验亚硝化菌方法:用滴管吸取2滴细菌培养液置于白瓷板上,依次滴加格里斯试剂Ⅰ、Ⅱ各2滴,出现红色反应说明培养液中含有亚硝酸,有亚硝酸细菌存在。
2、二苯胺-硫酸试剂(检测菌液中是否存在硝酸盐证明硝化细菌是否存在)称取二苯胺1g,溶于20mL蒸馏水中,然后徐徐加入浓硫酸lOOmL,保存于棕色瓶中。
由于亚硝基、硝基均能与二苯胺试剂起蓝色显色反应,所以在测定硝基前,必须去除培养液中的亚硝基。
采用尿素+浓硫酸去除亚硝基是简单有效的方法,硝化菌检验具体操作步骤:取细菌培养液lml移入干净试管中,向试管中放半药勺的尿素混匀,然后再向试管中滴加10滴浓硫酸,此时可以看到试管中有大量气泡生成,反应很强烈,不断振动试管,使反应充分进行直至没有气泡产生。
然后取试管中液体两滴,置于白瓷板上,用格里斯试剂检验是否变红,如果颜色没有变化,再滴加二苯胺试剂,如果变蓝,说明有硝基产生,有硝化菌存在。
培养基1、LB(检验硝化细菌的纯度不生长表纯)酵母粉 5g 蛋白胨 10gNaCl 10g 蒸馏水 1000ml灭菌前pH=7.32、KM(检验硝化细菌的纯度不生长表纯)酵母浸提物 0.5g 蛋白胨 0.5g牛肉膏 0.5g 蒸馏水 1000ml灭菌前pH=7.33、PDA(检验硝化细菌的纯度不生长表纯)马铃薯(除皮) 200g 蔗糖(或葡萄糖) 20g水 1000mL灭菌前pH自然硝化细菌培养基富集培养取样品0.5g于有50ml灭菌培养基的250ml三角瓶在恒温30℃,摇床转速为150r/min,条件下富集培养。
每周一次,用Griess试剂(或二苯胺-硫酸试剂)定性检测HN02(或HN03)的生成情况,判断富集情况的好坏。
硝化细菌分离与鉴定

硝化细菌分离与鉴定硝化细菌-一类专性化能自养(无机营养)细菌,包括亚硝化菌和硝化细菌两个菌群,一般种类不能生长在有机培养基中。
在有氧的条件下,亚硝化细菌群将氨氮转化亚硝酸氮,硝化细菌群将亚硝酸氮转化硝酸氮,两者常生长在一起。
硝化细菌分离比较困难,由于它生长缓慢,平均代时10-20h以上,且不同菌株间差异较大。
1.硝化细菌分离:1.1分离材料:氨场周围的土壤池塘或污水出水口污泥1.2培养基:1.2.1富集培养基:亚硝化细菌培养基:1)硫酸铵5g/l 磷酸二氢钾0.7g/l 硫酸镁0.5g/l 氯化钙0.5g/l 用5%碳酸钠调PH8.0 (硝化细菌用亚硝酸钾2 g/l代替硫酸铵5g/l)2)硫酸铵2g/l 氯化钠0.3g/l 硫酸亚铁0.03g/l磷酸氢二钾1.0g/l 硫酸镁0.03g/l 碳酸氢钠1.6g/l PH7.5-8.01.2.2分离培养基:亚硝化细菌培养基:甲液:硫酸铵11.0g 硫酸镁1.4g硫酸亚铁0.3g蒸馏水100ml乙液:磷酸二氢钾1.36g 蒸馏水100ml甲:乙=9:1 PH8.0-8.2硝化细菌培养基:硫酸铵2.0g磷酸氢二钾1.0g/l硫酸镁0.5g/l氯化钠2.0g/l硫酸亚铁0.4g/l碳酸钙5.0g/lPH7.5-8.0用亚硝酸钾2.5 g代替硫酸铵11.0g。
为增加硝化细菌的分离效果,在培养液中添加1%粉状碳酸钙和0.04ml/100ml微量元素溶液。
1.2.3BPY(肉膏蛋白胨酵母膏培养基)牛肉膏5g/l 酵母膏5g/l 蛋白胨10g/l 氯化钠5g/l 葡萄糖5g/l PH7.0(检查硝化细菌纯度用)1.3富集培养:取泥样1.0g或1.0ml活性污泥接入30ml/250ml三角瓶或10ml/18x180mm试管中,28-30℃130r/min震荡培养,每隔几天用格利斯试剂在白瓷板上检验亚硝酸根的生成,培养7-8d后培养液遇格利斯试剂呈红色,表明有亚硝酸盐存在。
亚硝化细菌的分离和特性的研究

亚硝化细菌的分离和特性的研究
曾国驱;许玫英;梁燕珍;岑英华;邓穗儿;孙国萍
【期刊名称】《生物技术》
【年(卷),期】2005(15)1
【摘要】从厌氧好氧 (A O)工艺的废水处理系统活性污泥中分离出亚硝化细菌
A5 ,鉴定为亚硝化单胞菌 (Nitrosomonassp.) ,并对其特性进行了研究。
得出氨氧化作用最适的温度为32℃ ,最适的pH值为 8.0 ,需要充足的溶解氧。
另外 ,亚硝化细菌A5具有较高的耐盐能力 ,NaCl或Na2 SO4 浓度为 5 0g L范围内 ,其氨氧化作用没有受到明显的抑制。
【总页数】2页(P27-28)
【关键词】亚硝化细菌;分离;特性
【作者】曾国驱;许玫英;梁燕珍;岑英华;邓穗儿;孙国萍
【作者单位】广东省微生物研究所广东省菌种保藏与应用重点实验室
【正文语种】中文
【中图分类】Q939
【相关文献】
1.低溶解氧条件下亚硝化细菌的分离及其特性研究 [J], 晏琼
2.共固定化亚硝化-反硝化细菌工艺及特性研究 [J], 边阁;徐笑笑;苗敬芝;涂宝军;董玉玮
3.一株中度嗜盐反硝化细菌的分离鉴定及其代谢特性研究 [J], 焦点;张蕾;蒋欣燃;
张涛;曾星宁;王秋实
4.两株耐碱性亚硝化细菌的初步鉴定和特性研究 [J], 段莎丽;孙亚琴;伍阳;龙用波;谢晴;邓仕槐
5.一株异养硝化细菌的分离鉴定及其亚硝化作用研究 [J], 王成林;周巧红;王亚芬;梁威;吴振斌
因版权原因,仅展示原文概要,查看原文内容请购买。
亚硝化菌的种类,生长特性,亚硝化过程与机理

亚硝化菌的种类,生长特性,亚硝化过程与机理摘要:从亚硝化细菌的生长特性出发,主要介绍了亚硝化细菌的种类,包括亚硝化单胞菌属、亚硝化球菌属、亚硝化螺菌属、亚硝化叶菌属、亚硝化弧菌属,并探讨了亚硝化过程中的氧化和生化机理。
关键词:亚硝化菌,亚硝化作用,机理1 亚硝化细菌生长特性亚硝化细菌又叫氨氧化细菌,有自养型与异氧型之分,一般认为自养型氨氧化细菌是硝化作用的主要菌群。
所有自养型氨氧化细菌,都是革兰氏阴性细菌,自养生长时,以氨为唯一能源,以CO2为唯一碳源;混合营养生长时,可同化有机物质。
亚硝酸细菌的生长极为缓慢。
在适宜的条件下需 24h 才能完成一次分裂周期。
在进行固体培养的过程中一般需数月才能见到菌落生长[1]。
亚硝酸细菌喜欢微偏碱性的环境,适合大多数氨氧化细菌生长的条件为:温度25-30℃,pH 7.5-8.0,氨浓度2-10mmol/L。
倍增时间8小时至数天。
在纯培养中,培养基中若加入有机物质如酵母提取物等将会抑制亚硝酸细菌的生长,因此在进行亚硝酸细菌的分离培养时所培养分离的细菌的纯度可利用在培养基中加入(酵母粉、牛肉膏、蛋白胨等)有机物的方法进行检测[2]。
但是自然环境中有机物质对亚硝酸细菌的影响不如在纯培养中的大大亚硝酸细菌对污水组成、pH和温度等的改变都敏感[3]。
2亚硝酸细菌的分类亚硝酸细菌的分类主要根据细菌形态的表型特征、细胞内细胞质膜的分布及它们16SRNA 序列的同源性。
1984-1989 年的《伯杰氏细菌系统分类学》把硝化细菌分为九个属:硝化杆菌属、硝化刺菌属、硝化球菌属、硝化螺菌属、亚硝化单胞菌属、亚硝化螺菌属、亚硝化球菌属、亚硝化叶菌属和亚硝化弧菌属等。
而目前则倾向于把亚硝酸细菌分为两个单一细胞起源的群体,它们分别属于变形菌纲的β亚纲和γ亚纲。
在对这两个亚纲的亚硝酸细菌作进一步的分类时,不同的学者还有些细微的差别。
Votek 等认为除了海洋亚硝酸球菌属于变形菌γ亚纲外,其它的亚硝酸细菌即亚硝酸单孢菌和亚硝酸螺旋菌两个种群属于变形菌β亚纲。
实验一工业微生物的筛选和紫外诱变育种

实验一工业微生物的筛选和紫外诱变育种一.实验目的:加深对发酵工程上游技术中菌种选育的认识;学会常规选种和育种的方法,树立科学认真仔细的态度,培养科研协作精神。
二、实验原理:根据一定的生产目的如抗生素或酶类的生产,建立不同的筛选模型,并从特定的样品如土壤中筛选出高产适宜的菌株。
三.培养基及仪器:降解亚硝酸盐培养基:NaNO2 0.2%,KH2PO4 0.7%,MnSO4.H2O 0.25%,Na2HPO4 1.35%,MgSO4.7H2O 0.1%,葡萄糖1%,琼脂2%,0.1MPa灭菌20分钟。
6个250ml三角瓶,各装100ml培养基。
同时灭菌试管20支,1ml吸管12支,普通平皿60个,灭菌生理盐水。
培养亚硝酸盐降解菌发酵液1瓶,每位同学准备1个斜面。
3.洁净工作台、培养箱、三角瓶、曲玻棒、平皿。
四.操作方法课前半小时打开超净工作台灭菌。
1.土壤中降解亚硝酸盐细菌的筛选分离稀释土样。
5g土样,加入45ml无菌水中。
为10-1,然后取1ml加入9ml无菌水,为稀释10-2,直至稀释至10-8溶化培养基。
将溶化后不烫手的培养基倒入平皿,刚好盖过平皿底部,迅速摇匀后放置,使培养基冷却,要求平皿培养基表面平整、光滑。
吸取10-4,10-5或10-6相应浓度的土样稀释液0.5ml,加入平皿内,用烧过灭菌的曲玻棒均匀涂平,放入37℃培养箱中倒置培养48小时。
2.亚硝酸盐分解菌的紫外诱变育种取10ml培养好的液体培养液,放入90 mm培养皿,将皿放置于诱变箱的磁力搅拌器上,置于30 W 紫外灯下,照射90 s,用无菌生理盐水稀释至10-6,10-7,10-8,按常规方法涂布筛选平板。
同学可自行选择培养亚硝酸盐降解菌和诱变菌。
每位同学做一个平皿。
并标记好稀释度、种类和名字。
五、实验进程安排及结果分析(1)第1次实验:稀释土样,倒平板,冷却后进行平板涂布,放入恒温培养箱中;或进行菌种诱变,稀释诱变菌,倒平板,冷却后进行平板涂布,放入恒温培养箱中。
亚硝化作用菌种的分离筛选及条件选择

2.3.2 pH 值对亚硝酸盐氮积累的影响。试验结果表明, pH值 过高或过低均不利于亚硝化作用的进行。pH 值对亚硝化反 应的影响有 2 方面: ①亚硝化细菌生长需要有合适的酸碱 环境; ②酸碱度通过对游离氨浓度来影响亚硝化细菌的活 性。因此, 选择合适的 pH 值不仅为亚硝化细菌创造了适宜 的生长条件, 也控制了游离氨的浓度, 以此获得高的亚硝酸 盐氮的积累量。笔者认为亚硝化作用的最佳 pH 值为 7.5 ̄8.0。
Study on Isolation Scr eening and Condition Selection of Nitr obacter ia LIAO Xue! yi et al (Department of Chemistry and Biology, Xiangfan University, Xiangfan, Hubei 441053) Abstr act A nitrobacteria of high nitrosification rate was isolated in this paper. After preliminary examination, it was concluded that the bacteria was Nitrosospira sp. Results showed that the optimal nitrosification condition was 25 ̄30 ℃, pH 7.5~8.0, 110 r/min, 1 700 mg/L NaHCO3 alkalinity, 150 mg/L NH4+! N. Under the above condition and 15 % inoculation rate, after 24 h, the removal efficiency of NH4+! N reached 99.47 %, and accumulative volume of NO2-! N was 116.65 mg/L. Key wor ds Nitrosification; Nitrite bacteria; Bacteria screening; Conditional selection
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
亚硝酸菌的分离纯化及诱变育种
1.硝化细菌背景介绍:
硝化细菌-一类专性化能自养(无机营养)细菌,包括亚硝化菌和硝化细菌两个菌群,一般种类不能生长在有机培养基中。
在有氧的条件下,亚硝化细菌群将氨氮转化亚硝酸氮,硝化细菌群将亚硝酸氮转化硝酸氮,两者常生长在一起。
硝化细菌分离比较困难,由于它生长缓慢,平均代时10-20h以上,且不同菌株间差异较大。
亚硝化菌单细胞杆状以单根极生鞭毛运动,无荚膜,革兰氏阴性严格好氧,在有机培养基不能生长,能利用CO2唯一碳源。
菌落以小圆淡黄色为主,个别呈无色或乳白色。
个别菌株为球状,无鞭毛。
氨转化为亚硝酸盐过程中获得能量。
硝化细菌单细胞杆状不运动好气在有机培养基不能生长,能利用CO2唯一碳源。
亚硝酸细菌用格里斯试剂检测,呈现红色;硝酸细菌用二苯胺检测,呈现蓝色。
2.亚硝化细菌培养基配置:
2.1.富集培养基的配置:
硫酸铵2g/l,氯化钠0.3g/l,硫酸铁0.03g/l,磷酸氢二钾1.0g/l,硫酸镁0.03g/l,碳酸氢钠1.6g/l,pH7.2。
将该培养基在0.1MPa下灭菌30min。
2.2.分离培养基的配置:
硫酸铵0.5 g/l,氯化钠2g/l,硫酸铁0.4g/l,磷酸氢二钾1.0g/l,硫酸镁0.5g/l,碳酸钙5g/l,pH7.2。
将该培养基在0.1MPa下灭菌30min。
亚硝化细菌固体分离培养基:在上述亚硝化细菌分离培养基中加入质量分数为2%的琼脂。
3.实验方法:
3.1.亚硝酸细菌的富集培养
将2mL活性污泥加入装有80m L富集培养基的300mL锥形瓶中,在30℃、130r/min的条件下振荡培养, 每隔几天取样, 采用格里斯试剂检验亚硝酸盐的生成情况, 呈现红色表示有亚硝酸盐存在, 然后移取1mL富集培养液接入新鲜富集培养基, 继续培养并进行上述测试。
经几次重复操作, 不断淘汰其他异养菌。
3.2.亚硝酸细菌的分离培养:
将1mL上述富集培养液涂布于固体分离培养基平板上,在30℃的培养箱中培养7~10d,得到单菌落,再进一步纯化获得纯菌落,对纯菌落尽心编号,置于4℃冰箱中保存,备用。
3.3.亚硝化细菌的活性:
取分离出的菌株,以20%的接种量接种于富集培养基中,通过氨氮去除率或亚硝酸盐氮的质量浓度来考察亚硝化细菌的活性。
3.4.亚硝化细菌的诱变育种:
3.4.1.诱变育种:
是选合适的诱变因素、处理剂量及处理方法,人为地对出发菌株进行诱变处理,然后运用合理的筛选程序及适当的筛选方法把优良的变异菌株筛选出来。
首先,通过诱变雨中可以提高产物的产量,即可以获得高产突变株。
其次,通过诱变育种可以改善菌种特性、提高产品质量。
减少或去除发酵副产物的生成量既可以提高产品质量,又可以简化产品分离提取工艺,降低成本。
第三,通过诱变育种可以选育出更合适于工业化发酵要求的突变株,简化工艺条件。
第四,通过诱变育种可以开发新产品
3.4.2.诱变因素:
3.4.2.1.物理诱变因素:紫外线(UV),X射线和γ射线,快中子(电离辐射)
3.4.2.2.化学诱变因素:碱基类似物,烷化剂,移码诱变剂,脱氨剂,羟化剂
3.4.2.3.生物诱变因素:转位因子(位于染色体或质粒上的一段能改变自身位置的DNA序列)
3.4.3.诱变剂的选择:
诱变剂亚硝基胍和甲基磺酸乙酯由于多数是引起碱基对的转换,得到的突变株的回复变率高,且化学试剂对人体有一定的伤害性。
而能引起缺失、码组移动,巨大损伤的电离辐射、紫外线和吖啶类等诱变剂,则不易产生回复突变。
其中紫外线(UV)作为诱变剂在实验操作中是最为经济简便的。
因此本次实验操作选用UV法进行诱变育种。
3.5.紫外诱变育种的实验方法:
3.5.1.紫外诱变的机理:
①紫外诱变有效范围是200-300nm,其中以260nm左右效果最好,作用光谱与核酸的吸收光谱一致,所以DNA容易受紫外的影响。
②DNA强烈吸收紫外线,尤其是嘧啶比嘌呤对紫外更敏感,引起了DNA分子内和分子间的交联,形成二聚体和水合物。
其中胸腺嘧啶二聚体的形成对生物活性改变研究最多。
③紫外线的主要作用是使同链DNA的相邻嘧啶间形成共价结合的胸腺嘧啶二聚体。
二聚体的出现会减弱双链间氢键的作用,并引起双链结构扭曲变形,阻碍碱基间的正常配对,从而有可能引起突变死亡。
在互补双链间形成嘧啶二聚体的机会较少。
但一旦形成,就会妨碍双链的解开,因而影响DNA的复制和转录,并使细胞死亡。
3.5.2紫外诱变的操作方法
3.5.2.1.菌悬液的制备:取纯菌种,用10ml无菌生理盐水将菌落洗下,倒入一支无菌大试管中,振荡30s,打散菌块。
离心(3000r/min,10min),弃去上清液,用无菌生理盐水将菌体洗涤2-3次,制菌悬液。
用显微镜直接计数法计数,调整细胞浓度107个/ml。
3.5.2.2.平板制作:将富集培养基融化,倒平板,凝固后使用。
3.5.2.3.紫外线处理:将开关打开预热约20min,取直径6cm无菌平皿3套,分别加入菌悬液3ml,放入一根无菌搅拌棒,将平皿置于磁力搅拌器上,打开皿盖,在距离为30cm,功率为15w的紫外灯下分别照射1min,3min,3.5min。
3.5.2.
4.稀释:用10倍稀释法将菌悬液在无菌水中稀释10-1-10-6。
3.5.2.5.涂平板:取10-4-10-6稀释度来涂平板,每一个稀释度涂3套,以同样操作,取未处理菌液稀释涂布平板作对照。
3.5.2.6.培养与鉴定:置37℃,培养48h,在培养好的菌落上滴加格里斯试剂,测量红色光圈的深浅程度,红色光圈的直径。
选取颜色最深,直径最大的诱变菌种进行再次培养,得到高产的亚硝酸菌。
4.亚硝酸菌的活力测定:
硝化速率的测定:将纯化菌株和UV诱变后的菌株分别接种于液体培养基中,28-30℃黑暗培养10d,设立零对照即不加任何细菌的培养液对照和大肠杆菌对照。
采用纳氏试剂比色法测量培养基中氨氮的量,420nm下测量其吸光度。
硝化率(mg/L.d)=(零对照氨氮浓度—实验组氨氮浓度)/时间。
