烃的衍生物的化学方程式
烃的衍生物

若从甲、乙两位同学设计的装置中选择一套作 为实验室制取乙酸乙酯的装置,选择的装置应 乙 是_____( 填“甲”或“乙”)。丙同学将甲装 置中的玻璃管改成了球形干燥管,除起冷凝作 防止倒吸。 用外,另一重要作用是_____________
[实验步骤] A.按所选装置组装仪器,在试管①中先加入2 mL浓硫酸,并在摇动下缓缓加3 mL 95% 的乙醇入充分摇匀,冷却后再加入2 Ml 冰醋酸,将试管固定在铁架台上; B.在试管②中加入5 mL饱和NaHCO3溶液 C.对试管①加热;当观察到试管②中有明显 现象时停止实验 上述操作中有明显错误的有 2 处。装置中 长导管的作用是 导气、冷凝回流
例2
(2012平顶山质检)各取1 mol下列物质, 分别与足量溴水和H2反应。各自消耗的Br2和 H2的最大用量分别是
5、5 2、4
6、7
6、10
例3
用下列装置设计一个简单的一次性完成验
证醋酸溶液、二氧化碳水溶液、苯酚溶液的
酸性强弱的实验
1.各仪器连接顺序是__ __接__ A 接D E接__ B C F
物理性质:无色液体,易溶于水和乙醇,有强
烈刺激性气味
化学性质 ①弱酸性
乙酸的电离方程式:
CH3COOH CH3COO +H
- +
具有酸的通性:
② 酯化反应:酸与醇生成酯和水的反应。
有关酯的反应中物质的量的关系 (1) 酯化反应中,生成的酯基个数等于生成 的水分子个数; (2) 酯水解时,水解的酯基个数等于消耗的 水分子个数。
CH3COOH+HOC2H5 浓硫酸 CH COOC H +H O 3 2 5 2 △
缩聚反应
例2
(2012· 高考新课标全国卷)对羟基苯甲酸丁酯
烃的衍生物重要知识点总结
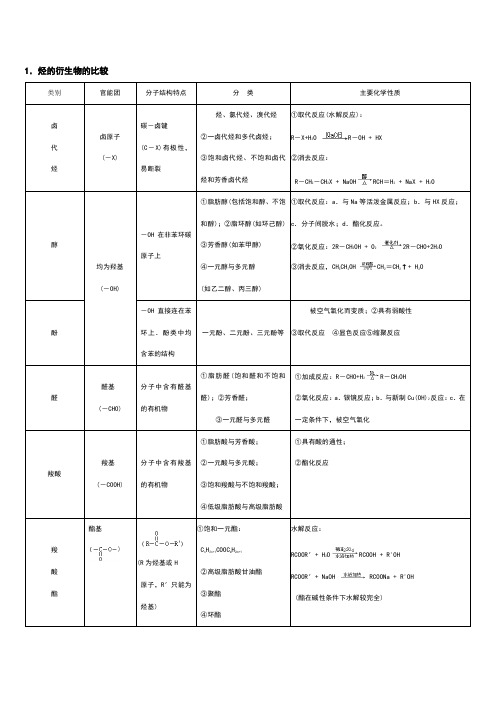
1.烃的衍生物的比较类别官能团分子结构特点分类主要化学性质卤代烃卤原子(-X)碳-卤键(C-X)有极性,易断裂烃、氯代烃、溴代烃②一卤代烃和多代卤烃;③饱和卤代烃、不饱和卤代烃和芳香卤代烃①取代反应(水解反应):R-X+H2O R-OH + HX②消去反应:R-CH2-CH2X + NaOH RCH=H2 + NaX + H2O醇均为羟基(-OH)-OH在非苯环碳原子上①脂肪醇(包括饱和醇、不饱和醇);②脂环醇(如环己醇)③芳香醇(如苯甲醇)④一元醇与多元醇(如乙二醇、丙三醇)①取代反应:a.与Na等活泼金属反应;b.与HX反应;c.分子间脱水;d.酯化反应。
②氧化反应:2R-CH2OH + O22R-CHO+2H2O③消去反应,CH3CH2OH CH2=CH2↑+ H2O酚-OH直接连在苯环上.酚类中均含苯的结构一元酚、二元酚、三元酚等被空气氧化而变质;②具有弱酸性③取代反应④显色反应⑤缩聚反应醛醛基(-CHO)分子中含有醛基的有机物①脂肪醛(饱和醛和不饱和醛);②芳香醛;③一元醛与多元醛①加成反应:R-CHO+H2R-CH2OH②氧化反应:a.银镜反应;b.与新制Cu(OH)2反应:c.在一定条件下,被空气氧化羧酸羧基(-COOH)分子中含有羧基的有机物①脂肪酸与芳香酸;②一元酸与多元酸;③饱和羧酸与不饱和羧酸;④低级脂肪酸与高级脂肪酸①具有酸的通性;②酯化反应羧酸酯酯基(R为烃基或H原子,R′只能为烃基)①饱和一元酯:C n H2n+1COOC m H2m+1②高级脂肪酸甘油酯③聚酯④环酯水解反应:RCOOR′+ H2O RCOOH + R'OHRCOOR′+ NaOH RCOONa + R'OH(酯在碱性条件下水解较完全)2.有机反应的主要类型反应类型定义举例(反应的化学方程式)消去反应有机物在一定条件下,从一个分子中脱去一个小分子(如H2O、HBr等)而生成不饱和(含双键或叁键)化合物的反应C2H5OH CH2=CH2↑+ H2O苯酚的显色反应苯酚与含Fe3+的溶液作用,使溶液呈现紫色的反应还原反应有机物分子得到氢原子或失去氧原子的反应CH≡CH + H2CH2=CH2 CH2=H2 + H2CH3CH3 R—CHO + H2R-CH2OH氧化反应燃烧或被空气中的O2氧化有机物分子得到氧原子或失去氢原子的反应2CH3CH2OH + O2 2CH3CHO + 2H2O2CH3CHO + O2 2CH3COOH银镜反应CH3CHO + 2Ag(NH3)2OH CH3COONH4+2Ag↓+ 3NH3↑+ H2O红色沉淀反应CH3CHO + 2Cu(OH)2CH3COOH + Cu2O↓+ 2H2O取代反应卤代烃水解NaOH水溶液,卤代烃水解,生成醇和卤化氢的反应R-CH2X + H2O RCH2OH + HX 酯化反应酸(无机含氧酸或羧酸)与醇作用,生成酯和水的反应RCOOH + R'CH2OH RCOOCH2R′+ H2O 酯的水解反应在酸或碱存在的条件下,酯与水作用生成醇与酸的反应RCOOR′+ H2O RCOOH + R'OHRCOOR′+ NaOH → RCOONa + R'OH4.醇、酚、羧酸中羟基的活性比较羟基种类重要代表物与Na反应与NaOH反应与Na2CO3反应醇羟基CH3CH2-OH√××酚羟基HO√√√但不放出气体羧酸羟基CH3-C-OHO√√√放出CO2。
高三化学二氧化碳的十一类产生途径和个化学方程式

一、证对市爱幕阳光实验学校烃的燃烧〔氧化反〕产生二氧化碳1、CH4+2O2−−→−点燃CO2+2H2O2、2C4H10+13O2−−→−点燃8CO2+10H2O3、C2H4+3O2−−→−点燃2CO2+2H2O4、2C2H2+5O2−−→−点燃4CO2+2H2O二、烃的衍生物氧化生成二氧化碳5、CH3CH2OH+3O2−−→−点燃2CO2+3H2O三、木炭及一氧化碳的燃烧6、C+O2点燃CO27、2CO+O2点燃2CO2四、碳与氧化性酸反生成二氧化碳8、C+2H2SO4〔浓〕加热CO2↑+2SO2↑+2H2O9、C+4HNO3〔浓〕加热CO2↑+4NO2↑+2H2O五、葡萄糖体内氧化产生二氧化碳10、C6H12O6 +6O2−−→−氧化6CO2↑+6 H2O六、碳酸草酸分解产生二氧化碳11、H2CO3=H2O+CO2↑12、H2C2O4−−−−−→−浓硫酸加热H2O+CO2↑+CO↑七、碳酸盐和碳酸的酸式盐受热分解产生二氧化碳13、CaCO3高温CaO+CO2↑14、Ca(HCO3)2加热CaCO3+H2O+CO2↑15、2NaHCO3加热Na2CO3+H2O+CO2↑八、葡萄糖生物降解产生二氧化碳16、C6H12O6−−−−→−有氧降解 2 CH3CH2OH+2 CO2↑九、碳酸盐和碳酸的酸式盐与强酸反产生二氧化碳17、CaCO3+2HCl=CaCl2+H2O+CO2↑18、Na2CO3+2HCl=2NaCl+H2O+CO2↑19、Na2CO3+H2SO4=Na2SO4+H2O+CO2↑20、Ca(HCO3)2+2HCl=CaCl2+2H2O+2CO2↑21、NaHCO3+HCl=NaCl+H2O+CO2↑22、2NaHCO3+H2SO4=Na2SO4+H2O+CO2↑十、高熔点的氧化物与碳酸盐反产生二氧化碳23、SiO2+ CaCO3高温CaSiO3+CO2↑24、SiO2+ Na2CO3高温Na2SiO3+CO2↑25、Al2O3+ CaCO3高温Ca(AlO2)2+CO2↑26、Al2O3+ Na2CO3高温2NaAlO2+CO2↑十一、可溶性碳酸盐与可溶性铝盐发生双水解反产生二氧化碳27、6NaHCO3+Al2(SO4)3=3Na2SO4+6CO2↑+2Al(OH)3↓28、3Na2CO3+Al2(SO4)3+3H2O=3Na2SO4+6CO2↑+2Al(OH)3↓。
烃的衍生物化学方程式

烃的衍生物的化学方程式必背必会一、溴乙烷与卤代烃(化性:水解、消去)1、溴乙烷与氢氧化钠水溶液共热:CH3CH2Br+3CH2OH+NaBr2、溴乙烷与氢氧化钠的乙醇溶液共热:CH3CH2Br+2=CH2↑+NaBr+H2O二、乙醇与醇类(化性:取代、消去、氧化、酯化)3、乙醇燃烧:CH3CH2OH+3O2+3H2O4、乙醇与钠的反应:2CH3CH2OH+2Na2CH3CH2ONa+H2↑5、乙醇与溴化氢共热:CH3CH2OH+3CH2Br+H2O6、乙醇分子间脱水:2CH3CH23CH2OCH2CH3+H2O7、乙醇与浓硫酸共热170℃(乙醇分子内脱水、实验室制乙烯原理):CH3CH22=CH2↑+H2O8、乙醇的催化氧化:2CH3CH2OH+O3CHO+2H2O9、乙醇与乙酸和浓硫酸共热(酯化反应):CH3COOH+CH3CH23COOCH2CH3+H2O三、苯酚与酚类(化性:取代、加成、缩聚)10、苯酚燃烧:C6H6O+7O2+3H2O11、苯酚与氢氧化钠溶液反应:C6H5OH+NaOH C6H5ONa+H2O12、苯酚钠溶液中通入二氧化碳气体离子:化学方程式C6H5ONa+CO2+H2O===C6H5OH+NaHCO3离子方程式C6H5O-+CO2+H2O===C6H5OH+HCO3-13、苯酚溶液中加入浓溴水(生成白色沉淀):+3Br 2 ↓+3HBrBr14、苯酚溶液中加入氯化铁溶液(溶液变为紫色)15、苯酚在一定条件下与氢气反应:+3H16、酚醛树脂的制备(缩聚反应):四、乙醛与醛类(化性:还原、氧化、缩聚)17、乙醛与氢气反应:CH 3CHO +H 3CH 2OH18、乙醛的燃烧:2C 2H 4O +5O 2+4H 2O19、乙醛的催化氧化: 2CH 3CHO +O 3COOH20、乙醛与银氨溶液反应:CH 3CHO +2[Ag(NH 3)22O +2Ag +3NH 3↑+CH 3COONH 421、乙醛与新制的氢氧化铜反应:CH 3CHO +2Cu(OH)23COOH +Cu 2O↓+2H 2O22、甲醛与过量的银氨溶液反应:HCHO +4[Ag(NH 3)22↑+3H 2O +4Ag +8NH 3↑23、甲醛与过量的新制的氢氧化铜反应:HCHO +4Cu(OH)22↑+2Cu 2O↓+5H 2O五、乙酸与羧酸类(化性:取代、酯化、缩聚)24、乙酸与钠反应:2CH 3COOH +2Na 2CH 3COONa +H 2↑25、乙酸与氧化镁反应:2CH 3COOH +MgO (CH 3COO)2Mg +H 2O26、乙酸与氢氧化钠反应:CH 3COOH +NaOH CH 3COONa +H 2O27、乙酸与碳酸钙反应:CH 3COOH +CaCO 3(CH 3COO)2Ca +CO 2↑+H 2O28、乙酸与碳酸氢钠反应:CH 3COOH +NaHCO 3CH 3COONa +CO 2↑+H 2O29、乙酸与乙醇和浓硫酸共热:CH 3COOH +CH 3CH 23COOCH 2CH 3+H 2On OHCH 2+nH 2O30、乙二酸与足量的乙醇与浓硫酸共热:31、乙二醇与足量的乙酸和浓硫酸共热:3233、对苯二甲酸与乙二醇的缩聚:六、乙酸乙酯与酯类(化性:酸、碱条件下水解)34、乙酸乙酯的燃烧:C 4H 8O 2+5O 2+4H 2O 35、乙酸乙酯在酸性条件下的水解反应:CH 3COOCH 2CH 3+H 23COOH +CH 3CH 2OH 36、乙酸乙酯与氢氧化钠溶液共热: CH 3COOCH 2CH 3+3COONa +CH 3CH 2OH 完成下表:代表物能否与钠反应能否与NaOH 的反应能否与NaHCO3的反应能否与Na 2CO 3的反应乙醇苯酚乙酸乙酸乙酯+2H 2O +2H 2O附:其他一些化学反应方程式使用说明:在掌握上面的化学方程式的基础上尝试书写,不会写的请认真分析官能团在反应前后有何变化,再次理解官能团的概念。
烃的衍生物

烃的衍生物1.烃的衍生物①定义:烃分子中的氢原子被其他原子或原子团取代而衍变成的化合物.②组成:除含C、H元素外,还含有O、X(卤素)、N、S等元素中的一种或几种.③官能团:决定有机物性质的原子或原子团.常见的有:—X、—OH、2.溴乙烷物理性质无色液体,不溶于水,沸点38.4℃,密度比水大ρ=1.46g/cm3,易溶于有机溶剂。
分子结构分子式结构式结构简式官能团C2H5Br CH3CH2Br -Br化学性质C2H5Br分子中C—Br键为极性键,容易断裂,溴原子易被其他原子或原子团取代。
①水解反应属于取代反应.反应条件:强碱水溶液。
②消去反应反应条件:与强碱的醇溶液共热。
反应实质:从分子中相邻的两个碳原子上脱去一个HBr分子,生成不饱和化合物。
消去反应:有机化合物在一定条件下,从一个分子中脱去一个小分子〔如H2O、HBr等〕,而生成不饱和〔含朋键或叁键〕化合物的反应。
从溴乙烷能发生消去反应和水解反应说明,受官能团溴原子(—Br)的阻碍,溴乙烷的化学性质比乙烷的爽朗。
3.卤代烃烃分子中的氢原子被卤素原子取代后所生成的化合物,叫做卤代烃。
〔1〕分类依照分子中所含卤素的不同,可分为氟代烃、氯代烃、溴代烃等。
依照分子中所含烃基不同,可分为脂肪卤代烃和芳香卤代烃。
依照分子中卤素原子的多少不同,可分为一卤代烃和多卤代烃。
〔2〕物理性质都不溶于水,可溶于有机溶剂,卤代烃的沸点随烃基增大出现升高趋势,密度随烃基增大出现减小趋势。
卤代烃的沸点比对应的烷烃要高,这是因为卤素原子的引入使卤代烃分子的极性比烃分子强,从而使分子间的作用力增大。
同一烃基的不同卤代烃的沸点随卤素原子的相对分子质量的增大而增大。
例如RF<RCl<RBr<RI。
含碳原子数目相同的卤代烃的同分异构体,沸点随烃基中支链数的增加而相应减小。
这是因为分子中支链数增加,分子间靠近程度减小,分子间作用力减弱,其沸点相应减小。
〔3〕化学性质卤代烃的化学性质与溴乙烷相似,可发生水解反应和消去反应。
高中有机化学方程式总结(默写版)

高中有机化学方程式总结(默写版) 高中有机化学方程式默写一、烃1.甲烷烷烃通式:1) 氧化反应甲烷燃烧产生二氧化碳和水:CH4 + 2O2 -。
CO2 + 2H2O甲烷不能使酸性高锰酸钾溶液和溴水褪色。
2) 取代反应一氯甲烷:CH3Cl二氯甲烷:CH2Cl2三氯甲烷:CHCl3四氯化碳:CCl42.乙烯烯烃通式:乙烯的制取:1) 氧化反应乙烯燃烧产生二氧化碳和水:C2H4 + 3O2 -。
2CO2 + 2H2O乙烯能使酸性高锰酸钾溶液褪色。
2) 加成反应与溴水加成:C2H4 + Br2 -。
C2H4Br2 与氢气加成:C2H4 + H2 -。
C2H6与氯化氢加成:C2H4 + HCl -。
C2H5Cl 与水加成:C2H4 + H2O -。
C2H5OH 3) 聚合反应乙烯加聚,生成聚乙烯。
3.乙炔乙炔的制取:1) 氧化反应乙炔燃烧产生二氧化碳和水:C2H2 + 5/2O2 -。
2CO2 + H2O乙炔不能使酸性高锰酸钾溶液褪色。
2) 加成反应与溴水加成:C2H2 + Br2 -。
C2H2Br2与氢气加成:C2H2 + H2 -。
C2H4与氯化氢加成:C2H2 + HCl -。
C2H3Cl3) 聚合反应氯乙烯加聚,得到聚氯乙烯。
乙炔加聚,得到聚乙炔。
4.苯苯的同系物通式:1) 氧化反应苯燃烧产生二氧化碳和水:2C6H6 + 15O2 -。
12CO2 + 6H2O苯能使溴水和酸性高锰酸钾溶液褪色。
2) 取代反应①苯与溴反应②硝化反应3) 加成反应5.甲苯1) 氧化反应甲苯燃烧产生二氧化碳和水:C7H8 + 9O2 -。
7CO2 + 4H2O甲苯能使溴水褪色和酸性高锰酸钾溶液褪色。
2) 取代反应甲苯硝化反应生成2,4,6-三硝基甲苯,简称三硝基甲苯(TNT)。
二、烃的衍生物烃的衍生物的重要类别和主要化学性质:类别通式代表性物质分子结构特点主要化学性质卤代烃 R—X 溴乙烷 C-X键有极性,易断裂 1.取代反应 2.消去反应醇 R—OH 乙醇有C-O键和O-H键,有极性;-OH与链烃基直接相连 1.与钠反应,生成醇钠并放出氢气 2.氧化反应:生成乙醛 3.脱水反应:乙醚、乙烯 4.酯化反应酚 -OH 苯酚 -OH直接与苯环相连取代反应醛 O || CH3-C-H C=O双键有极性,具有不饱和性氧化反应:生成酮羧酸 COOH 乙酸有C=O双键和C-OH单键,有极性 1.与碱反应,生成盐 2.酯化反应酯 R-COOR' 乙酸乙酯 C=O双键和O-C单键,有极性 1.水解反应:生成醇和羧酸 2.酸催化下的加成反应注:删除了明显有问题的段落,对每段话进行了小幅度的改写。
烃的衍生物化学方程式

烃的衍生物的化学方程式必 背 必 会一、溴乙烷与卤代烃(化性:水解、消去)1、溴乙烷与氢氧化钠水溶液共热:CH 3CH 2Br +NaOH CH 3CH 2OH +NaBr2、溴乙烷与氢氧化钠的乙醇溶液共热: CH 3CH 2Br +NaOH CH 2=CH 2↑+NaBr +H 2O二、乙醇与醇类(化性:取代、消去、氧化、酯化)3、乙醇燃烧:CH 3CH 2OH +3O 22CO 2+3H 2O4、乙醇与钠的反应:2CH 3CH 2OH +2Na 2CH 3CH 2ONa +H 2↑5、乙醇与溴化氢共热:CH 3CH 2OH +HBr CH 3CH 2Br +H 2O6、乙醇分子间脱水:2CH 3CH 2OHCH 3CH 2OCH 2CH 3+H 2O7、乙醇与浓硫酸共热170℃(乙醇分子内脱水、实验室制乙烯原理):CH 3CH 2OHCH 2=CH 2↑+H 2O8、 乙醇的催化氧化:2CH 3CH 2OH +O 22CH 3CHO +2H 2O9、 乙醇与乙酸和浓硫酸共热(酯化反应):CH 3COOH +CH 3CH 2OH CH 3COOCH 2CH 3+H 2O三、苯酚与酚类(化性:取代、加成、缩聚)10、苯酚燃烧:C 6H 6O +7O 26CO 2+3H 2O11、苯酚与氢氧化钠溶液反应:C 6H 5OH +NaOHC 6H 5ONa +H 2O12、苯酚钠溶液中通入二氧化碳气体离子:化学方程式C 6H 5ONa +CO 2+H 2O ===C 6H 5OH +NaHCO 3 离子方程式C 6H 5O -+CO 2+H 2O ===C 6H 5OH +HCO 3- 13、苯酚溶液中加入浓溴水(生成白色沉淀):170℃浓硫酸点燃点燃 加热浓硫酸加热催化剂140℃浓硫酸加热 加热乙醇加热Br+3Br2↓+3HBr14、苯酚溶液中加入氯化铁溶液(溶液变为紫色)15、苯酚在一定条件下与氢气反应:OH+3H2OH16、酚醛树脂的制备(缩聚反应):四、乙醛与醛类(化性:还原、氧化、缩聚)17、乙醛与氢气反应:CH3CHO+H2CH3CH2OH18、乙醛的燃烧:2C2H4O+5O24CO2+4H2O19、乙醛的催化氧化: 2CH3CHO+O22CH3COOH20、乙醛与银氨溶液反应:CH3CHO+2[Ag(NH3)2]OH H2O+2Ag+3NH3↑+CH3COONH421、乙醛与新制的氢氧化铜反应:CH3CHO+2Cu(OH)2CH3COOH+Cu2O↓+2H2O22、甲醛与过量的银氨溶液反应:HCHO+4[Ag(NH3)2]OH CO2↑+3H2O+4Ag+8NH3↑23、甲醛与过量的新制的氢氧化铜反应:HCHO+4Cu(OH)2CO2↑+2Cu2O↓+5H2O五、乙酸与羧酸类(化性:取代、酯化、缩聚)24、乙酸与钠反应:2CH3COOH+2Na2CH3COONa+H2↑25、乙酸与氧化镁反应:2CH3COOH+MgO(CH3COO)2Mg+H2O26、乙酸与氢氧化钠反应:CH3COOH+NaOH CH3COONa+H2O加热催化剂催化剂加热加热加热水浴加热点燃加热催化剂+nHCHO 催化剂nOHCH2+nH2O27、乙酸与碳酸钙反应:CH 3COOH +CaCO 3(CH 3COO)2Ca +CO 2↑+H 2O28、乙酸与碳酸氢钠反应:CH 3COOH +NaHCO 3CH 3COONa +CO 2↑+H 2O29、乙酸与乙醇和浓硫酸共热:CH 3COOH +CH 3CH 2OHCH 3COOCH 2CH 3+H 2O30、乙二酸与足量的乙醇与浓硫酸共热:31、乙二醇与足量的乙酸和浓硫酸共热:3233、对苯二甲酸与乙二醇的缩聚:六、乙酸乙酯与酯类(化性:酸、碱条件下水解)34、乙酸乙酯的燃烧:C 4H 8O 2+5O 24CO 2+4H 2O35、乙酸乙酯在酸性条件下的水解反应:CH 3COOCH 2CH 3+H 2OCH 3COOH +CH 3CH 2OH36、乙酸乙酯与氢氧化钠溶液共热:CH 3COOCH 2CH 3+NaOH CH 3COONa +CH 3CH 2OH加热 加热稀硫酸点燃 加热浓硫酸+2H 2O +2H 2O附:其他一些化学反应方程式使用说明:在掌握上面的化学方程式的基础上尝试书写,不会写的请认真分析官能团在反应前后有何变化,再次理解官能团的概念。
新教材人教版高中化学选择性必修3第3章烃的衍生物 知识点考点归纳总结

第3章烃的衍生物第一节卤代烃一、卤代烃1.定义烃分子中的氢原子被卤素原子取代后生成的化合物称为卤代烃。
官能团是碳卤键,可表示为R—X(X=F、Cl、Br、I)。
2.分类3.物理性质(1)状态:常温下,卤代烃中除个别为气体外,大多为液体或固体。
如一氯甲烷为气体。
(2)溶解性:卤代烃不溶于水,可溶于有机溶剂,某些卤代烃本身就是很好的有机溶剂,如CCl4、氯仿(CHCl3)等。
(3)密度与沸点:①卤代烃的密度和沸点都高于相应的烃;②卤代烃的密度一般随烃基中碳原子数目的增加而减小,如ρ(CH3Cl)>ρ(CH3CH2Cl);③卤代烃的沸点一般随碳原子数目的增加而升高,如沸点CH3Cl<CH3CH2Cl。
4.卤代烃的系统命名——类似于烃的命名方法二、溴乙烷的结构与性质1.溴乙烷的物理性质纯净的溴乙烷是无色液体,沸点是38.4 ℃,密度比水的大,难溶于水,可溶于多种有机溶剂(如乙醇、苯、汽油等)。
2.溴乙烷的分子结构3.溴乙烷的化学性质(1)取代反应——又称水解反应①条件:NaOH水溶液、加热。
②反应方程式:C 2H5—Br+NaOH――→水△C2H5—OH+NaBr。
③反应原理:(2)消去反应——又称为消除反应。
①条件:NaOH的乙醇溶液、加热。
②反应方程式:(以溴乙烷为例)CH3CH2Br+NaOH――→乙醇△CH2===CH2↑+NaBr+H2O。
③反应原理:④定义:有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如H2O、HX等),而生成含不饱和键的化合物的反应叫做消去反应(消除反应)。
(3)加成和加聚反应含有不饱和键(如)的卤代烃也可以发生加成和加聚反应。
①氯乙烯加聚反应生成聚氯乙烯:。
②四氟乙烯加聚反应生成聚四氟乙烯:。
三、卤代烃破坏臭氧层原理(了解)氟利昂可在强烈的紫外线作用下分解,产生的氯原子自由基会对臭氧层产生长久的破坏作用。
以CCl3F为例,它破坏臭氧层的反应过程可表示为:CCl3F――→紫外线CCl2F·+Cl·卤代烃的主要性质及检验1.卤代烃的消去反应和取代反应的比较消去反应取代反应卤代烃的结构特点与卤素原子相连的碳原子的邻位碳原子上有氢原子一般是1个碳原子上只有1个—X反应实质脱去1个HX分子,形成不饱和键—X被—OH取代反应条件强碱的醇溶液、加热强碱的水溶液、加热化学键变化主要产物烯烃或炔烃醇2.卤代烃消去反应的规律(1)没有邻位碳原子的卤代烃不能发生消去反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
烃的衍生物的化学方程式 姓名 班次一、溴乙烷与卤代烃1、溴乙烷与氢氧化钠水溶液共热:CH 3CH 2Br +NaOH CH 3CH 2OH +NaBr2、溴甲烷与氢氧化钠水溶液共热CH 3Br +NaOH CH 3OH +NaBr3、溴丙烷与氢氧化钠水溶液共热:CH 3CH 2CH 2Br +NaOH CH 3CH 2CH 2OH +NaBr4、2—溴丙烷与氢氧化钠水溶液共热:(CH 3)2CHBr +NaOH (CH 3)2CHOH +NaBr5、1,2—二溴乙烷与氢氧化钠水溶液共热:BrCH 2CH 2Br +2NaOH HOCH 2CH 2OH +2NaBr6、溴乙烷与氢氧化钠的乙醇溶液共热:CH 3CH 2Br +NaOH CH 2=CH 2↑+NaBr +H 2O7、1—溴丙烷与氢氧化钠的乙醇溶液共热:CH 3CH 2CH 2Br +NaOH CH 3CH=CH 2↑+NaBr +H 2O8、2—溴丁烷与氢氧化钠的乙醇溶液共热:CH 3CHBrCH 2CH 3+NaOH CH 3CH 2CH=CH 2↑+NaBr +H 2O9、2—溴丁烷与氢氧化钠的乙醇溶液共热:CH 3CHBrCH 2CH 3+NaOH CH 3CH=CHCH 3↑+NaBr +H 2O10、2,3—二溴丁烷与氢氧化钠的乙醇溶液共热:CH 3CHBrCHBrCH 3+2NaOH CH 2=CH —CH=CH 2+2NaBr +2H 2O加热乙醇 加热乙醇 加热乙醇 加热乙醇 加热乙醇加热加热加热加热加热二、乙醇与醇类1、乙醇与钠的反应:2CH 3CH 2OH +2Na 2CH 3CH 2ONa +H 2↑2、甲醇与钠的反应:2CH 3OH +2Na2CH 3ONa +H 2↑3、2—丙醇与钠的反应:2(CH 3)2CHOH +2Na 2(CH 3)2CHONa +H 2↑4、乙二醇与钠的反应:HOCH 2CH 2OH +2Na NaOCHCH 2ONa +H 2↑5、乙醇与钙的反应:2CH 3CH 2OH +Ca(CH 3CH 2O)2Ca +H 2↑6、乙醇与溴化氢共热:CH 3CH 2OH +HBr CH 3CH 2Br +H 2O7、甲醇与溴化氢共热:CH 3OH +HBr CH 3Br +H 2O8、2—丙醇与溴化氢共热:(CH 3)2CHOH +HBr (CH 3)2CHBr +H 2O9、 乙二醇醇与溴化氢共热:HOCH 2CH 2OH +2HBr BrCH 2CH 2Br +2H 2O10、乙醇分子间脱水:2CH 3CH 2OH CH 3CH 2OCH 2CH 3+H 2O11、乙醇分子间脱水:2CH 3OHCH 3OCH 3+H 2O12、2—丙醇分子间脱水:2(CH 3)2CHOH (CH 3)2CHOCH(CH 3)2+H 2O13、甲醇与乙醇分子间脱水:CH 3CH 2OH +CH 3OH CH 3OCH 2CH 3+H 2O14、乙醇燃烧:CH 3CH 2OH +3O 22CO 2+3H 2O15、乙醇使酸性高锰酸钾溶液褪色: 5CH 3CH 2OH +4KMnO 4+6H 2SO 45CH 3COOH +2K 2SO 4+4MnSO 4+11H 2O16、用酸性重铬酸钾溶液检验酒后驾车: 3CH 3CH 2OH +2K 2Cr 2O 7+8H 2SO 43CH 3COOH +2K 2SO 4+2Cr 2(SO 4)3+11H 2O17、 乙醇的催化氧化:2CH 3CH 2OH +O 22CH 3CHO +2H 2O18、甲醇的催化氧化:2CH 3OH +O 22HCHO +2H 2O19、2—丙醇的催化氧:2(CH 3)2CHOH +O 22CH 3COCH 3+2H 2O加热催化剂加热催化剂 加热催化剂点燃 140℃浓硫酸140℃浓硫酸140℃浓硫酸 140℃浓硫酸加热加热加热加热20、乙二醇的催化氧化:HOCH2CH2OH+O2OHCCHO+2H2O21、乙醇与浓硫酸共热170℃:CH3CH2OH CH2=CH2↑+H2O22、丙醇与浓硫酸共热:CH3CH2CH2OH CH3CH=CH2↑+H2O23、2—丙醇与浓硫酸共热:(CH3)2CHOH CH3CH=CH2↑+H2O24、1,4—丁二醇与浓硫酸共热:HOCH2CH2CH2CH2OH CH2=CH-CH=CH2↑+H2O25、乙醇与乙酸和浓硫酸共热:CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O26、甲醇与乙酸和浓硫酸共热:CH3COOH+CH3OH CH3COOCH3+H2O27、甲酸、乙醇与浓硫酸共热:HCOOH+CH3CH2OH HCOOCH2CH3+H2O28、乙酸、2—丙醇与浓硫酸共热:CH3COOH+(CH3)2CHOH CH3COOCH(CH3)2+H2O29、乙二酸与足量的乙醇与浓硫酸共热:3031、乙二酸与乙二醇和浓硫酸共热:32、3HOCH2CH22O33、334、1,4—丁二酸与乙二醇和浓硫酸共热:加热浓硫酸加热浓硫酸加热浓硫酸加热浓硫酸170℃浓硫酸170℃浓硫酸170℃浓硫酸170℃浓硫酸加热催化剂+2H2O+2H2O1、苯酚燃烧:C 6H 6O +7O 26CO 2+3H 2O2、苯酚与氢氧化钠溶液反应:C 6H 5OH +NaOHC 6H 5ONa +H 2O3、苯酚钠溶液中通入二氧化碳气体: C 6H 5O -+CO 2+H 2O ===C 6H 5OH +HCO 3-4、苯酚钠溶液与氯化铝溶液混合:3C 6H 5O -+Al 3++3H 2O ===3C 6H 5OH +Al(OH)3↓5、苯酚溶液中加入浓溴水: OH OH Br — —Br +3Br 2 ↓+3HBr Br6、苯酚溶液中加入氯化铁溶液6C 6H 5OH +FeCl 3H 3[Fe(C 6H 5O)6]+3HCl 7、苯酚在一定条件下与氢气反应: —OH +3H 2OH8、酚醛树脂的制备:8、苯酚与乙醛的缩聚:加热催化剂点燃 OH +nHCHO 催化剂nOHCH 2+nH 2OCH 3OH+nCH 3CHO 催化剂n OHCH+nH 2O1、乙醛的燃烧:2C 2H 4O +5O 24CO 2+4H 2O2、丙醛的燃烧:C 3H 6O +4O 23CO 2+3H 2O3、乙醛与溴水反应:CH 3CHO +Br 2+H 2O CH 3COOH +2HBr4、乙醛与银氨溶液反应: CH 3CHO +2[Ag(NH 3)2]OH CH 3COONH 4+H 2O +2Ag +3NH 3↑5、甲醛与少量的银氨溶液反应: HCHO +2[Ag(NH 3)2]OHHCOONH 4+H 2O +2Ag +3NH 3↑6、甲醛与过量的银氨溶液反应: HCHO +4[Ag(NH 3)2]OH CO 2↑+3H 2O +4Ag +8NH 3↑7、丙醛与银氨溶液反应: CH 3CH 2CHO +2[Ag(NH 3)2]OH CH 3CH 2COONH 4+H 2O +2Ag +3NH 3↑8、乙二醛与银氨溶液反应: OHCCHO +2[Ag(NH 3)2]OHH 4NOOC —COONH 4+2H 2O +4Ag +6NH 3↑9、乙醛与新制的氢氧化铜反应:CH 3CHO +2Cu(OH)2 CH 3COOH +Cu 2O↓+2H 2O10、甲醛与少量的新制的氢氧化铜反应:HCHO +2Cu(OH)2HCOOH +Cu 2O↓+2H 2O11、甲醛与过量的新制的氢氧化铜反应:HCHO +4Cu(OH)2 CO 2↑+2Cu 2O↓+5H 2O12、乙醛与新制的氢氧化铜反应:CH 3CH 2CHO +2Cu(OH)2CH 3CH 2COOH +Cu 2O ↓+2H 2O13、乙二醛与新制的氢氧化铜反应:OHCCHO +4Cu(OH)2HOOC —COOH +2Cu 2O↓+4H 2O14、乙醛的催化氧化: 2CH 3CHO +O 22CH 3COOH15、甲醛的催化氧化:HCHO +O 22HCOOH16、丙醛的催化氧化:2CH 3CH 2CHO +O 22CH 3CH 2COOH催化剂催化剂催化剂加热加热加热加热加热加热加热加热 加热加热点燃 点燃17、乙二醛的催化氧化:OHCCHO +O 2HOOC —COOH18、乙醛与氢气反应:CH 3CHO +H 2CH 3CH 2OH19、乙醛与氢气反应:HCHO +H 2CH 3OH20、丙醛与氢气反应:CH 3CH 2CHO +H 2CH 3CH 2CH 2OH 21、乙二醛与氢气反应:OHC —CHO +2H 2HOCH 2CH 2OH五、丙酮与酮类1、丙酮燃烧:C 3H 6O +4O 23CO 2+3H 2O2、丙酮与氢气反应:CH 3COCH 3+H 2(CH 3)2CHOH点燃 加热催化剂 加热催化剂 加热催化剂加热催化剂 加热 催化剂催化剂1、乙酸与钠反应:2CH 3COOH +2Na 2CH 3COONa +H 2↑2、乙酸与氧化镁反应:2CH 3COOH +MgO (CH 3COO)2Mg +H 2O3、乙酸与氢氧化钠反应:CH 3COOH +NaOH CH 3COONa +H 2O4、乙酸与碳酸钙反应:2CH 3COOH +CaCO 3(CH 3COO)2Ca +CO 2↑+H 2O5、乙酸与碳酸氢钠反应:CH 3COOH +NaHCO 3CH 3COONa +CO 2↑+H 2O6、乙酸与乙醇和浓硫酸共热: CH 3COOH +CH 3CH 2OHCH 3COOCH 2CH 3+H 2O7、甲酸与乙醇和浓硫酸共热: HCOOH +CH 3CH 2OHHCOOCH 2CH 3+H 2O8、乙酸和甲醇与浓硫酸共热: CH 3COOH +CH 3OHCH 3COOCH 3+H 2O9、乙酸与2—丙醇和浓硫酸共热: CH 3COOH +(CH 3)2CHOHCH 3COOCH(CH 3)2+H 2O9、乙二酸与足量的乙醇与浓硫酸共热:10 11、乙二酸与乙二醇和浓硫酸共热:12、对苯二甲酸与乙二醇的缩聚:13、1,6—己二酸与1,6—己二胺的缩聚:加热浓硫酸加热浓硫酸 加热浓硫酸 加热浓硫酸 COOH COOH +2CH 3CH 2OH COOCH 2CH 3 COOCH 2CH 3 浓H 2SO 4 加热+2H 2O CH 2OH CH 2OH +2CH 3COOH CH 2OOCCH 3 CH 2OOCCH 3 浓H 2SO 4加热 +2H 2O CH 2OH CH 2OH COOH COOH 浓H 2SO 4 加热 +2H 2O COOCH 2 COOCH 2 + 催化剂 nHOOC — —COOH + nHOCH 2CH 2OH +(2n -1)H 2O HO —OC — —CO O CH 2CH 2O — [ ]n H nHOOC(CH 2)6COOH +nH 2N(CH 2)6NH 2 催化剂—OC(CH 2)6CONH(CH 2)6NH — +(2n -1)H 2O HO [ ]n H1、乙酸乙酯的燃烧:C 4H 8O 2+5O 24CO 2+4H 2O2、甲酸甲酯与银氨溶液反应:HCOOCH 3+2[Ag(NH 3)2]OH H 4NOOC —COOCH 3+H 2O +2Ag +3NH 3↑3、甲酸甲酯与新制的氢氧化铜反应:HCOOCH 3+2Cu(OH)2HOOC —COOCH 3+Cu 2O ↓+2H 2O4、乙酸乙酯在酸性条件下的水解反应: CH 3COOCH 2CH 3+H 2OCH 3COOH +CH 3CH 2OH5、甲酸甲酯在酸性条件下的水解反应: HCOOCH 2CH 3+H 2OHCOOH +CH 3CH 2OH6、乙酸甲酯在酸性条件下的水解反应: CH 3COOCH 3+H 2OCH 3COOH +CH 3OH7、丙酸乙酯在酸性条件下的水解反应: CH 3CH 2COOCH 2CH 3+H 2OCH 3CHCOOH +CH 3CH 2OH8、乙酸乙酯与氢氧化钠溶液共热:CH 3COOCH 2CH 3+NaOH CH 3COONa +CH 3CH 2OH9、甲酸乙酯与氢氧化钠溶液共热:HCOOCH 2CH 3+NaOH HCOONa +CH 3CH 2OH10、乙酸甲酯与氢氧化钠溶液共热:CH 3COOCH 3+NaOH CH 3COONa +CH 3OH11、丙酸乙酯与氢氧化钠溶液共热:CH 3CH 2COOCH 2CH 3+NaOH CH 3CHCOONa +CH 3CH 2OH加热加热加热加热 加热稀硫酸加热稀硫酸 加热稀硫酸 加热稀硫酸加热加热点燃考点名称:有机物的推断•(1)有机物推断的一般方法:①找已知条件最多的,信息量最大的。
