有机化学教学之七炔烃与二烯烃
炔烃和二烯烃精品文档
H X RCC H
R CC H 2
X
H X
烯基卤代物
X RCC H 3
X
偕二卤代物
分步加成,可控制在第一步。 合成上应用: (1)制烯基卤代物(2)制偕二卤代物
催化剂(Hg盐或Cu盐)存在时,叁键比双键易加成
H 2 CC HCC H
H C l C u C l
H 2 CC HCC H 2 C l
碳原子杂化状态
杂化态 S 成分 键长 P 轨道重叠 π 键强度
CC
SP2
C C SP
1/3S
1.307Å
较小
1/2S
1.207Å
较大
较小 较大
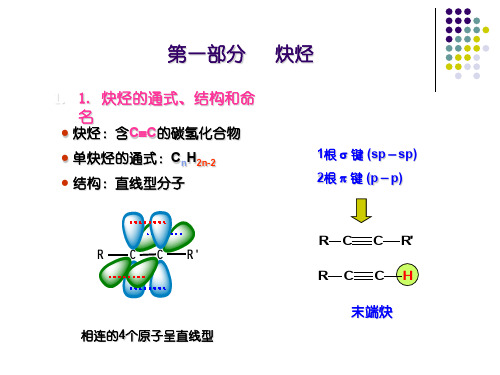
2. 炔烃的命名法 C≡C三键是官能团,结构通式是:CnH2n-2 一、衍生物命名法:
H C 3 C HCC H
C H 3
异丙基乙炔
H C 3 C H 2C HCCC H 3
CH3
b H3C
+ RCOOOH, H2O
CH3
合成路线
方法 a:
H 2 H 3 CC CC H 3
L in d la r催 化 剂 o r P -2 催 化 剂
C H 3 O s O 4o r
C H 3 H O H
C H 3 K M n O 4 (稀 、 冷 ) H O H C H 3
方法 b:
C H 3
甲基仲丁基乙炔
二、系统命名法:
C H 3 H H 3 CC HC H 2C CC H 3 C H 3CCCCC H 3
C H 3
5-甲基-2-己炔
C H 3 C H 3
2,2,5-三甲基-3-己炔
C≡C三键上的氢叫炔氢,有炔氢的化合物叫端炔。
炔烃和二烯烃

H α –碳氢键越多, 超共轭作用越强, CH2=CH—C—H 共轭体系越稳定.
H
• σ – p 共轭: 碳正离子缺电子碳(sp2杂化)上的p轨道与α –
碳氢σ 键虽然不平行, 但仍可部分地重叠形成超共轭.
+
H
CH2—C—H
H
α –碳氢键越多, 超共轭作用越强, 共轭体系越稳定.
产物的比例由各产物的相对生成速率决定. 对上述反应 而言, 1,2–加成的碳正离子中间体较稳定, 反应所需的活 化能较低, 反应速率较快, 因此反应主要得到1,2–加成产 物.
• 常温下, 反应一般受平衡控制或热力学控制, 即产物的比
例由各产物的相对稳定性决定.
6.6 Diels – Alder 反应
• 与碳碳单键和碳碳双键相比, 碳碳叁键的键长较短, 键能
较大, 但并非倍数关系.
6.2 炔烃的同分异构和命名法
6.2.1 炔烃的同分异构
主要有 碳链异构 和 官能团的位置异构, 没有顺反异构.
6.2.2 炔烃的命名法
与烯烃的命名类似.
6.3 炔烃的物理性质 (了解)
与烯烃类似. 炔烃分子的极性比烯烃略强.
6.7 共振结构理论简介和共振式 (了解)
共价键理论之一, 见 第1章 绪论.
• 共轭 π 键 和 共轭体系
凡是涉及3个或3个以上原子的 π 键叫做共轭 π 键.
构成共轭的体系叫做共轭体系.
• 分子轨道理论认为, 在共轭体系中的电子运动不是局限
于两个相邻的原子之间, 而是扩展到组成共轭体系的所 有原子之间, 即共轭体系内电子运动不是定域的, 而是离 域的. (注: 离域电子一般指 π 电子和未共用电子对, σ 电 子的离域程度较小).
炔烃和二烯烃
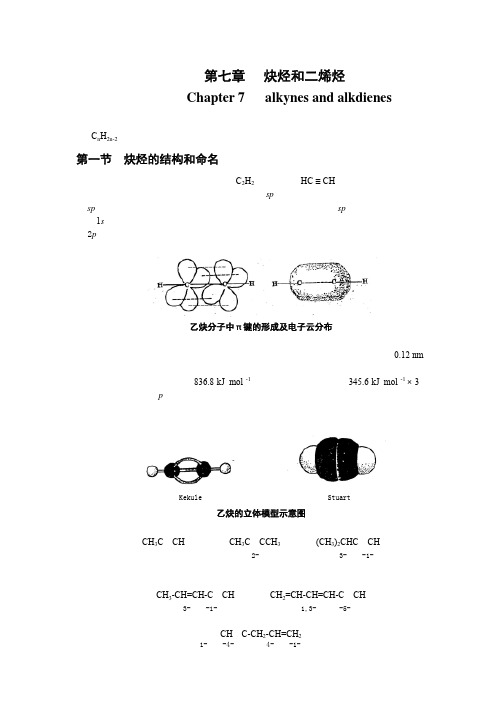
第七章炔烃和二烯烃Chapter 7 alkynes and alkdienes炔烃是分子中含有碳碳叁键的烃,炔烃比相应的烯烃少两个氢原子,通式为C n H2n-2。
第一节炔烃的结构和命名乙炔是最简单的炔烃,分子式为C2H2,构造式为HC ≡ CH。
根据杂化轨道理论,乙炔分子中的碳原子以sp杂化方式参与成键,两个碳原子各以一条sp杂化轨道互相重叠形成一个碳碳σ键,每个碳原子又各以一个sp轨道分别与一个氢原子的1s轨道重叠,各形成一个碳氢σ键。
此外,两个碳原子还各有两个相互垂直的未杂化的2p轨道,其对称轴彼此平行,相互“肩并肩”重叠形成两个相互垂直的π键,从而构成了碳碳叁键。
两个π键电子云对称地分布在碳碳σ键周围,呈圆筒形。
乙炔分子中π键的形成及电子云分布其它炔烃中的叁键,也都是由一个σ键和两个π键组成的。
现代物理方法证明,乙炔分子中所有原子都在一条直线上,碳碳叁键的键长为0.12 nm,比碳碳双键的键长短,这是由于两个碳原子之间的电子云密度较大,使两个碳原子较之乙烯更为靠近。
但叁键的键能只有836.8 kJ·mol -1,比三个σ键的键能和(345.6 kJ·mol -1 × 3)要小,这主要是因为p轨道是侧面重叠,重叠程度较小所致。
乙炔分子的立体模型。
由于叁键的几何形状为直线形,叁键碳上只可能连有一个取代基,因此炔烃不存在顺反异构现象,炔烃异构体的数目比含相同碳原子数目的烯烃少。
Kekule 模型 Stuart模型乙炔的立体模型示意图炔烃的系统命名法与烯烃相同,只是将“烯”字改为“炔”字。
例如:CH3C≡CH CH3C≡CCH3(CH3)2CHC≡CH丙炔 2-丁炔 3-甲基-1-丁炔分子中同时含有双键和叁键的化合物,称为烯炔类化合物。
命名时,选择包括双键和叁键均在内的碳链为主链,编号时应遵循最低系列原则,书写时先烯后炔。
CH3-CH=CH-C≡CH CH2=CH-CH=CH-C≡CH 3-戊烯-1-炔 1,3-己二烯-5-炔双键和叁键处在相同的位次时,应使双键的编号最小。
有机化学第七章炔烃和二烯烃

(c) 由于卤素的吸电子作用,反应能控制在一元阶段。
炔烃与HX的加成 1 遵从马氏规则
R CC H+H X
H X R C = C H
XH
X RCC H 3
X
2 三键在碳链中间,生成反式加成产物
H
C H 2 C H 3
C H 3 C H 2 CC C H 2 C H 3+ H C l
CC
H 3 C H 2 C
+
RC=CH2 + H2O RC CH2 +OH2 RC CH2
OH
RCCH3 O
HC CR + H2O RC CR' + H2O
HgSO4/H2SO4 H2C CR OH
HgSO4/H2SO4
RHC CR' OH
CH3CR O
RCH2CR' O
反应特点:
RC CHR'
OH
(a) Hg2+催化,酸性;符合马氏规则。
H C C H N a N H 2 H C C N a
C 3 H 7 C C H
H CC H +N aN H 2
H CC N aC 2H 5B r C 2H 5CC H
N aN H 2 C 2H 5CC -N a+ C H 3B r C 2H 5CC C H 3
该方法只能用伯卤代烷碳负离子的碱性强,容易使仲和 叔卤代烷脱卤化氢 。
反应机理
+
-
R CC H+HX
R C =C H 2 + C l
其炔中烃的加成反R 应3 C 比+ > 烯> 烃R 2 C 小H + > R C H 2 + , R C = C H 2 > R C H = C H
炔烃和二烯烃

7.2.1.1 C—H的酸性
中性有机分子中的碳 —氢键在强碱的帮助下异裂,氢以质子形式离去, 或者说碳—氢键的氢以质子形式被摘掉,留下一个碳负离子: R—H + : B- → R- + HB
其中中性分子R—H(氢碳酸[1])与碳负离子互为共轭酸碱。
对A−H型的酸而言,A的电负性越强,其氢原子酸性就越强, 相应的共轭碱碱性越弱,负离子A–越稳定。例如,元素周期表中
炔丙基(2-丙炔基)
按炔命名时比较复杂的化合物,可以将炔作为取代基命名。
烯炔(同时含有三键和双键的分子)的命名: (1)选择含有三键和双键的最长碳链为主链。 (2)主链的编号遵循链中双、三键位次最低系列 原则。 (3)通常使双键具有最小的位次。
CH3 CH2C CH
1-甲基-2-(2-丙炔基)环己烯
CH2CH3 Br
n-Bu Br
n-BuC
CH + Br2
速度比乙烯慢。
炔烃与X2的亲电加成比烯烃慢。乙炔与Br2/CCl4反应时,溴褪色
如果烯键和炔键共存与同一分子,并且烯键和炔键隔开至 少两个单键时,与1 mol X2反应,加成发生在烯键上:
乙炔中的 σ键 π H σ C π σ C σ H H
π键的形成
由 于 C–C≡C–C 的 线 性 结 构,至少得有 5 个碳原子 的碳链才能连成封闭的碳 环,形成环炔。也就是说, 环壬炔是能够稳定存在的 最小的环炔。
C 乙炔的电子云
H
乙炔分子的成键
7.1.2 炔烃的异构和命名
炔烃的异构与烯烃相似,但比烯烃简单,因为炔烃不存在顺反异构,只 有碳架异构和三键位置异构。 炔烃的普通命名法是将其他炔烃看成乙炔的衍生物命名。例如: (CH3)3C–C≡C–H
有机化学教学课件炔烃和二烯烃详解演示文稿

Br Br
R-C=C R'
R
Br Br2
C=C
Br
R'
Br Br RC CR
Br Br
R-C ≡ C-R' HX
HX
HX
R-CH=C-R'
R C C R'
X
HX
(1) R-C≡C-H 与HX等加成时先得一卤代烯,而后得二卤代 烷,遵循马氏规则。
例如:
CH
CH + HCl
HgCl2
150-160oC
CH2 CHCl
未杂化的P(PY、PZ)轨道互相垂直,它们与中一碳的两个P轨 道两两互相侧面重叠形成两个互相垂直的键。
py
pz
sp
sp
180°
两个 sp 的空间分布
三键碳原子的轨道分布图
2、三键的形成
叁键是同一个键和两个互相垂直的组成的。两个键的 电子云分布好象是国围绕两个碳原子核心联系的圆柱状的电 子云。其示意如下图:
H
H
=
C2H5CH2 C C2H5 O
一烷基炔的硼氢化 – 氧化产物为醛;而二烷
基炔的硼氢化 – 氧化产物为酮。
2、水化反应
在炔烃加水的反应中,生成先一个很不稳定的醇烯,烯醇很 快转变为稳定的羰基化合物(酮式结构)。
C=C
HO 烯醇式(不稳定)
C=C
HO 酮 式(稳定)
这种异构现象称为酮醇互变异构。
炔烃和二烯烃都是通式为CnH2n-2的不饱和烃,炔烃是分子 中含有-C≡C-的不饱和烃,二烯烃是含有两个碳碳双键的不饱 和烃,它们是同分异构体, 但结构不同,性质各异。
炔烃
一、炔烃的结构
最简单的炔烃是乙炔,我们以乙炔来讨论三键的结构。
《炔烃与二烯烃》课件

本课件将介绍炔烃和二烯烃的定义、命名、化学性质以及应用。同时,我们 还会比较两者的异同、讨论其危害和防护措施,并总结炔烃与二烯烃的特点 和应用前景。
一、炔烃
1.1 炔烃的定义
炔烃是一类含有碳碳三键的有机化合物,通式为 CnH2n-2。
1.3 炔烃的化学性质
炔烃具有较高的活性,可进行加成反应和氧化反 应等。
2.3 二烯烃的化学性质
二烯烃具有较高的反应活性,可以进行加成、聚合 和氢化等反应。
2.4 应用
二烯烃在橡胶、润滑油、塑料和颜料等方面有广泛 的应用。
三、炔烃和二烯烃的比较
3.1 结构差异
炔烃含有碳碳三键, 而二烯烃含有两个非 相邻双键。
3.2 物理性质 的异同
炔烃和二烯烃在熔沸 点、密度等物理性质 上存在差异。
五、总结
5.1 炔烃和二烯烃的特点
炔烃和二烯烃分别具有自己的定义、命名规则和化学性质。
5.2 应用前景
炔烃和二烯烃在聚合物、医药、橡胶、颜料等行业有着广泛的应用前景。
5.3 常见问题解答
解答学生关于炔烃和二烯烃的常见问题,帮助他们更好地理解该领域的知识。
1.2 炔烃的命名
炔烃的命名遵循一定的规则,如以炔基为主体进 行命名。
1.4 应用
炔烃在聚合物、医药和工业原料等方面有广泛的 应用。
二、二烯烃
2.1 二烯烃的定义
二烯烃是一类含有两个非相邻双键的有机化合物, 通式为CnH2n-2。
2.2 二烯烃的命名
二烯烃的命名与炔烃类似,以二烯基为主体进行命 名。
3.3 化学性质 的异同
炔烃和二烯烃具有不 同的化学反应性和官 能团特性。
3.4 应用的差别
炔烃和二烯烃教学

合成纤维
炔烃和二烯烃可用于合成纤维, 如聚乙烯醇纤维、聚丙烯腈纤维 等,具有优良的力学性能和化学 稳定性。
合成塑料
炔烃和二烯烃可以与其他单体共 聚,合成各种塑料,如聚氯乙烯、 聚乙烯等,具有良好的加工性能 和广泛的应用领域。
药物合成
01
02
03
激素类药物
炔烃和二烯烃是合成激素 类药物的重要中间体,如 雌二醇、睾酮等,具有调 节人体生理功能的作用。
炔烃和二烯烃的氧化反应 实验
二烯烃的聚合反应实验
炔烃的加成反应实验
实验一
实验二
实验三
感谢您的观看
THANKS
03
炔烃和二烯烃的反应
总结词
炔烃和二烯烃在一定条件下可以与氢气、卤素、水等发生加 成反应,生成新的有机化合物。
详细描述
炔烃和二烯烃的加成反应通常在酸 催化或金属催化剂的作用下进行。 加成反应后,不饱和键的数量减少, 形成更稳定的有机化合物。例如, 乙炔和氢气在催化剂的作用下反应, 生成乙烯。
总结词
详细描述
炔烃和二烯烃的氧化反应通常在催化剂的作用下进行,通过氧化剂(如氧气、过氧化物等)将不饱和键氧化成羧 基或羰基。氧化反应是有机合成中常用的方法之一,可以用于制备多种有机化合物。例如,乙炔在催化剂的作用 下与氧气反应,可以生成乙酸。
04
炔烃和二烯烃的应用
合成材料
合成橡胶
炔烃和二烯烃是合成橡胶的重要 原料,如丁苯橡胶、丁腈橡胶等, 具有优良的弹性和耐油性。
实验教学法
02
03互动讨ຫໍສະໝຸດ 法组织学生进行炔烃和二烯烃的化 学实验,让他们通过实验操作加 深对知识的理解。
鼓励学生进行小组讨论,分享学 习心得,通过互动交流提高学习 效果。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第七章炔烃和二烯烃学习要求1 掌握炔烃的结构和命名。
2 掌握炔烃的的化学性质,比较烯烃和炔烃化学性质的异同。
3 掌握共轭二烯烃的结构特点及其重要性质。
4 掌握共轭体系的分类、共轭效应及其应用。
炔烃和二烯烃都是通式为C n H2n-2的不饱和烃,炔烃是分子中含有-C≡C-的不饱和烃,二烯烃是含有两个碳碳双键的不饱和烃,它们是同分异构体,但结构不同,性质各异。
§7.1 炔烃7.1.1 炔烃的结构最简单的炔烃是乙炔,我们以乙炔来讨论三键的结构。
现代物理方法证明,乙炔分子是一个线型分子,分之中四个原子排在一条直线上C C H0.106nm0.12nm180°杂化轨道理论认为三键碳原子既满足8电子结构结构和碳的四价,又形成直线型分子,故三键碳原子成键时采用了SP杂化方式 .1 sp杂化轨道2s2p2s2pspp激发杂化杂化后形成两个sp杂化轨道(含1/2 S和1/2 P成分),剩下两个未杂化的P轨道。
两个sp 杂化轨道成180分布,两个未杂化的P 轨道互相垂直,且都垂直于sp 杂 化轨道轴所在的直线。
180°spz 两个 的空间分布sp 三键碳原子的轨道分布图2 三键的形成σ乙烯分子的成键情况H 乙炔的电子云7.1.2 炔烃的命名1 炔烃的系统命名法和烯烃相似,只是将“烯”字改为“炔”字。
2 烯炔(同时含有三键和双键的分子)的命名: (1)选择含有三键和双键的最长碳链为主链。
(2)主链的编号遵循链中双、三键位次最低系列原则。
(3)通常使双键具有最小的位次。
7.1.3 炔烃的化学性质1 亲电加成Br 2C=C R BrBrR'R CC R BrBrBrBr ≡R-C C-R'≡R-C C-R'HX R-CH=C-R'XHXR C C R'X H H(1) R-C ≡C-H 与HX 等加成时,遵循马氏规则。
(2) 炔烃的亲电加成比烯烃困难。
例如:a: CH 2=CH 2 + Br 2/CCl 7 溴褪色快H-C ≡C-H + Br 2/CCl 7 溴褪色慢b:C C≡H H HClHgCl /C 120~180℃CH 2=CH-Cl氯乙烯c:CH 2=CH-CH 2-C CH Br 2/CCl 4CH 2-CH-CH 2-C CH ≡≡Br Br原因: 1° 炔碳原子是sp 杂化的,杂化轨道中S 的成分大,S 的成分大,键 长就越短,键的离解能就越大。
2° 两个轨道分布与键的四周,重叠程度比乙烯中的要大,比双键 难于极化。
2 水化反应在炔烃加水的反应中,先生成一个很不稳定的烯醇,烯醇很快转变为稳定的羰 基化合物(酮式结构)。
C COHC CO烯醇式(不稳定)酮式(稳定)这种异构现象称为酮醇互变异构。
HC CH ≡H 2OHg 2+,H 2SO 4~100℃[ ]H C CH 3-COH这一反应是库切洛夫在1881年发现的,故称为库切洛夫反应。
其他炔烃水化时,则变成酮。
例如:CH 3C CH + H 2OHgSO H 2SO 4[CH 3-C=CH]CH 3-C-CH 3O≡≡C CH + H 2OH 2SO 4C CH 3O91%3 氧化反应 (P 82) (1) KMnO 7氧化 (2) O 3氧化4 炔化物的生产成三键碳上的氢原子具有微弱酸性(pK a =25),可被金属取代,生成炔化物。
H-C C-H ≡2AgNO 3 + 2NH 4OH≡≡2NH 4NO 3 + 2H 2O2NH 4Cl + 2H 2OR-C C-H ≡R-C C-Ag ≡R-C C-Cu ≡Ag(NH )+乙炔银(白色)乙炔亚铜(棕红色)炔铜(棕红生成炔银、炔铜的反应很灵敏,现象明显,可用来鉴定乙炔和端基炔烃。
干燥的炔银或炔铜受热或震动时易发生爆炸生成金属和碳。
Ag-C ≡C-Ag 2Ag + 2C + 367KJ/mol 所以,实验完毕,应立即加盐酸将炔化物分解,以免发生危险。
Ag-C ≡C-Ag + 2HCl H-C ≡C-H + 2AgCl 乙炔和RC ≡C-H 在液态氨中与氨基钠作用生成炔化钠。
2H-C C-H ≡2NaNH 2H-C C-Na ≡NH 3R-C C-Na ≡R-C C-H ≡NaNH 2NH 33液态氨炔化钠是很有用的有机合成中间体,可用来合成炔烃的同系物。
例如: CH 3CH 2C ≡CNa + CH 3CH 2CH 2BrCH 3CH 2C ≡CCH 2CH 2CH 3 + NaBrR-X=1°RX说明: 炔氢较活泼的原因是因 ≡C-H 键是sp-s 键,其电负性Csp > Hs (Csp=3.29,Hs=2.2),因而显极性,具有微弱的酸性。
5 还原(加氢)反应 (1)催化加氢R-C C-R'H 2Ni≡R-CH=CH-R'R-CH 2-CH 2-R'催化氢化常用的催化剂为 Pt , Pd , Ni ,但一般难控制在烯烃阶段。
用林德拉(Lindlar )催化剂,可使炔烃只加一分子氢而停留在烯烃阶段。
且得 顺式烯烃。
R-C C-R'H 2≡Lindlar 催化剂C=C RR'HH例如:C C ≡H 2C=CHH顺二苯基依稀(87%)Lindlar 催化剂的几种表示方法:1°3°Pd BaSO Pd CaCO 3Lindlar Pd2(1)在液氨中用钠或锂还原炔烃,主要得到反式烯烃。
≡-C C-Na, NH ( )C=CHH n-C 3H 7n-C 3H 7n-C 3H 7n-C 3H 7(E)-4-辛烯(97%)4-辛炔NaNH 27.1.4 乙炔(自学)要求: 掌握乙却的制法,重要性质[氧化、加成、聚合(特别是二聚),及主要用途。
7.1.5 炔烃的制备1 邻二卤代烷脱卤化氢R-CH-CH-R'XXR-CH=C-R'≡2醇或KOH( )醇R-C C-R'2 由炔化外物制备≡R-C C-Na ≡R-C C-R'Na X( Li )Li X§7.2 二烯烃分子中含有两个碳碳双键的烃类化合物称为二烯烃。
7.2.1 二烯烃的分类和命名1 分类(根据两个双键的相对位置可把二烯烃分为三类)累积二烯烃 -C=C=C-二烯烃共轭二烯烃 -C=CH-CH=CH-孤立二烯烃 -C=CH(CH 2)n CH=C- n ≥ 1孤立二烯烃的性质和单烯烃相似,累积二烯烃的数量少且实际应用的也不多。
共轭二烯烃有不同于共轭二烯烃的一些特性,在理论和实际应用上都很重要。
下 面我们主要讨论共轭二烯烃。
2 命名(1)和烯烃的命名一样称为某几烯CH 3CH=CH-C=CH 23甲基 戊二烯2--1,3-(2) 多烯烃的顺反异构的标出(每一个双键的构型均应标出)。
例如:C CCH 3H 3CHC C 3CH 2CH 3H(Z),(Z)-2,5-= -2,4-甲基庚二烯共轭二烯烃还存在着不同的构象,应以注意 P 887.2.2 二烯烃结构1.丙二烯烃(累积二烯烃)结构 见P 892.共轭二烯烃结构(以1,3-丁二烯为例)丁二烯分子中碳原子都以杂化轨道相互重叠或与氢的轨道重叠,形成三个键 和6个键,所有的原子都在同一平面上,键角都接近于120。
此外,每个碳原子 上未参与杂化的轨道均垂直于上述平面,四个轨道的对称轴互相平行侧面重叠, 形成了包含四个碳原子的四电子共轭体系。
C CH HHHC H119.8°122.4°483n m37n m0.108n m1,3-丁二烯的结构π键所在平面与纸面垂直σ键所在平面在纸面上按照分子轨道理论的概念,丁二烯的四个P 轨道可以组成四个π电子的分子轨道,ψψψ4321ψ成键轨道反键轨道丁二烯的分子轨道图形原子轨道成键轨道反键轨道E丁二烯π电子分子轨道的能级图从分子轨道图形可以看出,在ψ1轨道中π电子云的分布不是局限在C 1-C 2, C 3-C 7 之间, 而是分布在包括在四个碳原子的两个分子轨道中,这种分子轨道称为离域 轨道,这样形成的键称为离域键。
从ψ2分子轨道中看出,C 1-C 2,C 3-C 7之间的键加 强了,但C 2-C 3之间的键减弱,结果,所有的键虽然都具有π键的性质,但C 2-C 3键 的π键的性质小些。
所以,在丁二烯分子中,四个π电子是分布在包含四个碳原子 的分子轨道中,而不是分布在两个定域的π轨道7.2.3 共轭二烯烃的反应共轭二烯烃具有烯烃的通性,但由于是共轭体系,故又具有共轭二烯烃的特有性质。
下面主要讨论共轭二烯烃的特性。
1.1,7-加成反应共轭二烯烃进行加成时,既可1,2加成,也可1,7加成,CH 2CH 2-CH-CH=CH 2CH 2-CH-CH=CH 2CH 2-CH=CH-CH 2CH 2-CH=CH-CH 2Br Br Br H H 1,2-加成产物1,4-加成产物1,2-加成和1,7-加成是同时发升的,哪一反应占优,决定于反应的温度,反 应物的结构,产物的稳定性和溶剂的极性。
极性溶剂,较高温度有利于1,7-加 成; 非极性溶剂较低温度,有利于1,2-加成。
CH 2=CH-CH=CH 2Br CHClCH 2-CH-CH=CH 2CH 2-CH=CH-CH 2Br BrBr37%63%54%46%-15℃CH 2=CH-CH=CH 2CH 2-CH-CH=CH 2CH 2-CH=CH-CH 2H BrBr4080%20%20%80%为什么即有1,2-加成,又有1,7-加成: 这是由反应历程决定的(其加成反应为亲电加成历程) 第一步:ⅠⅡCH 2+CH 2=CH-CH-CH 3CH 2=CH-CH 2-CH 2烯丙基碳正离子伯碳正离子(Ⅰ)(Ⅱ)-CH-CH烯丙基碳正离子(Ⅰ)的结构为3HP 空π电子可离域到空P轨道上,使正电荷得到分散,故较稳定2伯碳正离子(Ⅱ)的结构为 π电子不能离域,碳正离子上的正电荷得不到分散,故不稳定。
因碳正离子的稳定性为 (Ⅰ) >(Ⅱ),故第一步主要生成碳正离子(Ⅰ)。
第二步:在碳正离子(Ⅰ)中,正电荷不是集中在一个碳上,而是如下分布的。
CH 2=CH CH-CH 3CH 3δCH 2 CH CH-CH 3所以Br -离子既可加到C 2上,也可加到C 7上。
加到C 2得1,2-加成产物,加到C 7上得1,7-加成产物。
反应条件不同,产率不同的原因: 1°速度控制与平衡控制1,2-加成反应的活化能低,为速度控制(动力学控制)产物,故低温主要为 1,2-加成。
1,7-加成反应的活化能较高,但逆反应的活化能更高,一但生成,不易逆 转,故在高温时为平衡控制(热力学控制)的产物,主要生成1,7-加成产物。
