氨及铵盐
氨、铵盐 PPT课件 通用

氨的喷泉实验
(1)实验原理:利用气体极易被一 种液体吸收而形成压强差,是气体 容器(烧瓶)内压强降低,外界大 气压把液体压人气体容器内,在玻 璃导管尖嘴处形成“喷泉”。
(2)成功关键:①气密性好;②烧 瓶干燥;③气体收集满,且在吸收 液中被吸收的既快又多。
只要是气体易溶于吸收剂,均可做喷
将湿润的红色石蕊试纸放在烧瓶口, 若试纸变蓝,说明氨气已收满。
如何干燥氨气? 碱石灰
用途
1。制硝酸 2。制铵盐,如NH4Cl等 3。制纯碱——侯德榜制碱法 4。制化肥
5。致冷剂——液氨
练习:
1.下列离子方程式正确的是( ) A.实验室制氨气: NH4+ +OH-=NH3+H2O B.氢氧化钠和氯化铵溶液混合加热:
NH4+ +OH-=NH3·H2O C.氨水中加盐酸: NH3·H2O +H+ = NH4+ +H2O D.氨气通入硫酸: NH3 +H+ = NH4+
2.已知氨水的密度为0.990g/cm3时,氨的质量 分数为2%,氨水的密度为0.930g/cm3时,氨的 质量分数为18%.氨的质量分数分别为a%和 5a%的氨水按等体积混合均匀后,混合溶液中 氨的质量分数为( )
•
20、没有收拾残局的能力,就别放纵善变的情绪。
•
15、所有的辉煌和伟大,一定伴随着挫折和跌倒;所有的风光背后,一定都是一串串揉和着泪水和汗水的脚印。
•
16、成功的反义词不是失败,而是从未行动。有一天你总会明白,遗憾比失败更让你难以面对。
•
17、没有一件事情可以一下子把你打垮,也不会有一件事情可以让你一步登天,慢慢走,慢慢看,生命是一个慢慢累积的过程。
氨和铵盐(3)
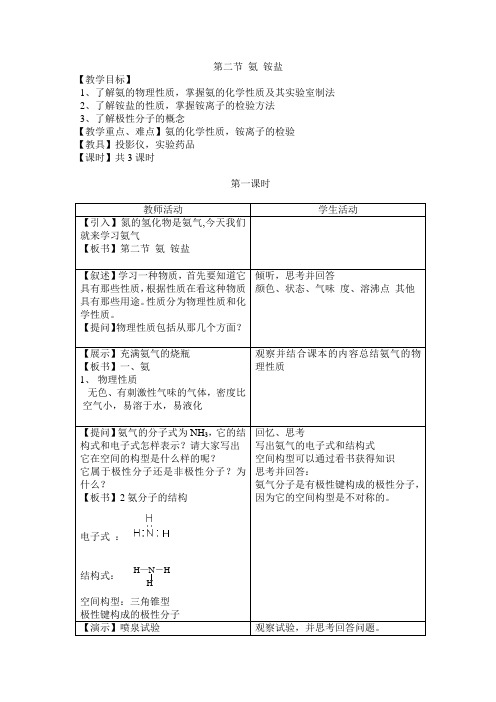
第二节氨铵盐【教学目标】1、了解氨的物理性质,掌握氨的化学性质及其实验室制法2、了解铵盐的性质,掌握铵离子的检验方法3、了解极性分子的概念【教学重点、难点】氨的化学性质,铵离子的检验【教具】投影仪,实验药品【课时】共3课时第一课时一、氨1、物理性质无色、有刺激性气味的气体,密度比空气小,易溶于水,易液化 2、氨分子的结构电子式 : 结构式:H —N -HH空间构型:三角锥型极性键构成的极性分子3、氨的化学性质①与水的反应NH3+H2O NH3·H2O NH4++OH—NH3·H2O NH3+H2O氨水的成分:分子H2O 、NH3、NH3·H2O离子NH4+、OH—、H+液氨成分:NH31体积水溶解700体积的氨气②与酸反应NH3+HCl=NH4ClNH3+HNO3=NH4NO3③与氧气反应4、氨的用途重要的化工原料,制铵盐、硝酸、尿素、制冷剂、医用稀氨水第二、三课时教师活动学生活动【引言】上节课我们学习了氨气的性质,在氨气的化学性质中有一条是氨气与酸反应生成盐,这种由由铵根离子与酸根离子构成的化合物叫做铵盐。
请写出铵根离子的电子式和结构式【板书】二、铵盐1、定义:由铵根离子与酸根离子构成的化合物叫做铵盐。
NH4+ 电子式:结构式:思考倾听回忆【提问】铵盐做为一类物质,他们的物理性质有那些?思考回答4NH3+5O24NO+6H2O催化剂HH—N-HH气的装置、收集方法、检验与验满 【演示】实验室制氨气 【板书】 2、药品反应:3、装置:固+固 气体4、收集:向下排空气法5、检验与验满:湿润的红色石蕊试纸,浓盐酸收集:不能用排水法,只能用向下排空气法 检验:湿润的红色石蕊试纸,浓盐酸 【提问】棉花的作用是什么? 【解释】防止氨气与空气形成对流,以免收集不到氨气思考 讨论 【提问】如何干燥氨气?剩余的尾气如何处理? 【板书】6、干燥:通入碱石灰7、尾气处理:通入蘸有硫酸溶液的棉花团里,或者通入水中但要用倒置的漏斗 思考 回到 【小结】本节的内容进行总结 作业:课本P15 二、四板书: 二、铵盐1、定义:由铵根离子与酸根离子构成的化合物叫做铵盐。
氨盐和铵盐的区别

求助]氨盐与铵盐的区别二、铵盐氨与盐酸反应的产物是NH4Cl,像NH4Cl这样由铵离子(NH4+)和酸根离子构成的化合物叫做铵盐。
铵盐都是晶体,并且都能溶于水。
铵盐主要有以下化学性质:1.铵盐受热分解在试管中加入少量NH4Cl晶体,加热,观察发生的现象。
有些铵盐受热可分解产生NH3。
从实验可以看到,加热后不久,在试管上端的试管壁上有白色固体附着。
这是由于受热时,NH4Cl会分解,生成NH3和HCl,冷却时,NH3和HCl又重新结合,生成NH4Cl。
NH4HCO3受热时也会分解,生成NH3、H2O和CO2。
由上面的反应可以看出,NH4Cl和NH4HCO3受热分解,都能产生NH3,但是,并不是所有的铵盐受热分解都产生NH3,在这里我就不做介绍了。
铵盐可用作氮肥,由于铵盐受热易分解,贮存氮肥时,应密封包装并放在阴凉通风处;施肥时应埋在土下并及时灌水,以保证肥效。
2.铵盐与碱的反应我们在前面曾介绍过,用NH4Cl与Ca(OH)2共热可制取氨气。
同样,其他铵盐是否也能与碱反应生成氨气呢?在两个试管中各加入少量(NH4)2SO4固体和NH4NO3固体,分别向两个试管中滴加10%①的NaOH溶液,加热,并用湿润的红色石蕊试纸靠近试管口。
观察发生的现象。
可以看到,加热后,两个试管中都有气体产生,并可闻到刺激性气味。
同时还看到,湿润的红色石蕊试纸变蓝。
可见,实验中产生了氨气,这说明(NH4)2SO4、NH4NO3都能与碱反应生成NH3事实证明,铵盐与碱共热都能产生NH3,这是铵盐的共同性质。
我们利用铵盐与碱反应的性质在实验室制取氨气,同时也可以利用这个性质检验铵离子的存在。
高中化学精讲氨、铵盐

高中化学58个考点精讲24、氨、铵盐1.复习重点1.氨的分子结构、性质和制取2.铵盐的结构、性质和用途3.氨和铵盐的检验2.难点聚焦一.氨1.氨的结构、性质和用途(1)氨的结构:电子式:结构式:空间构型:三角锥形;NH3是极性分子。
(2)物理性质:无色有特殊剌激性气味的气体,极易溶于水,常温常压下1体积水能溶解700体积的NH3。
(3)化学性质:①与水反应:NH3+H2O NH3·H2O NH4++OH―NH3是唯一能使湿润的红色石蕊试纸变蓝的气体,常用此性质检验NH3。
②与酸的反应:NH3+HCl=NH4Cl(生成白烟)NH3+CO2+H2O=NH4HCO3③与氧化剂反应:4NH3+3O24NO+6H2O2NH3+3CuO N2+3Cu+3H2O 8NH3+3Cl2= N2 + 6NH4Cl2.氨的实验室法:用铵盐与碱共热2NH4Cl+C a(O H)2C a C l2+2N H3↑+2H2O①发生装置:固+固+加热型。
与制备O2和CH4气体相似;收集NH3用向下排空气法收集。
②检验:a.用润湿的红色石蕊试纸检验;b.用沾有浓盐酸的玻璃棒检验,产生白烟。
③干燥:不能用CaCl2、P2O5、浓硫酸作干燥剂,因为NH3能与CaCl2反应生成CaCl2·8NH3。
P2O5与浓硫酸均能与NH3反应,生成相应的盐。
所以NH3通常用碱石灰干燥。
3.氨的工业制法N2+3H2 2NH3一.铵盐(1)结构:离子晶体,具有离子键、共价键和配位键,是由非金属元素组成的离子化合物。
(2)物理性质:都是晶体,都易溶于水。
(3)化学性质①不稳定性:铵盐受热易分解NH4Cl NH3+HCl NH4HCO3NH3↑+CO2↑+H2ONH4NO3受热分解较复杂:NH4NO3N2O+2H2O 2NH4NO32N2↑ +O2↑+4H2O②与碱反应NH4++OH― NH3·H2O 或NH4++OH―NH3↑+H2O③水解反应:NH4++H2O NH3·H2O+H+(4)用途:可用作氮肥,炸药,焊药。
【一轮复习课件】第5课时 氨和铵盐

稳定性
D.将红热的 Pt 丝伸入如图所示的锥形瓶中,瓶口出现少量的红棕色气体,说明氨气催
化氧化的产物中有 NO
解析:B 项,因为氨水中存在氨分子,加热氨气逸出,也能使湿润的红色石蕊试纸变蓝,
不能证明是铵根离子与氢氧化钠反应产生的氨气,错误;D 项,4NH3+5O2 2NO+O2 2NO2,NH3 的氧化产物为 NO,正确。
3.净化装置:如图所示(不能用浓H2SO4、P2O5、CaCl2、无水硫酸铜作干燥剂)。 4.收集方法:向 下 排空气法。
5.验满方法
(1)将 湿润的红色石蕊 已收集满。
试纸放置在试管口附近,若试纸变蓝色,说明NH3
(2)将蘸有 浓盐酸 的玻璃棒靠近试管口,若有白烟产生,说明NH3已收集满。 6.尾气处理:在集气管口塞一团用水或稀硫酸浸湿的棉花,可减小NH3与空气的 对流速度,收集到纯净的NH3。
蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近,其现象为 有白烟生成
,
将浓盐酸改为
浓硝酸
,也会出现相同的现象。
化学方程式:HCl+NH3 NH4Cl、NH3+HNO3 NH4NO3。
(3)与盐溶液的反应
如过量氨水与 AlCl3 反应的离子方程式:
Al3++3NH3·H2O
Al(OH)3↓+3N
H
4
。
(4)氨气的还原性——氨的催化氧化
选项 A B C D
实验现象
浓盐酸附近产生白烟
浓硫酸附近无明显现象 氯化物溶液变浑浊 干燥红色石蕊试纸不变色,湿润红 色石蕊试纸变蓝
解释 NH3与浓盐酸反应产生了 NH4Cl固体 NH3与浓硫酸不发生反应 该溶液一定是AlCl3溶液
氨和铵盐__教学案

氨和铵盐【学习目标】掌握氨、铵盐的性质和用途以及氨的实验室制法;学会铵根离子的检验。
一、氨(气):1、分子结构:⑴电子式:⑵结构式⑶空间构型三角锥型极性分子(键角107º18ˊ)(PCl5呢?)(共用、孤电子对分别为—————据此推测:⑴NH3分子是否极易溶于水?⑵NH3与H+可形成NH4+的原因:2、物理性质:①色味态:。
②(沸点:-34℃) 用途:③密度:④水溶性(常温常压下):。
[思考]液氨为什么可以用作致冷剂?3、化学性质:据氨的结构可推知,其化性可概括为“二性”:碱性还原性。
⑴与水:氨水:叫氨水。
溶质为成分:、、、、、(混)[液氨:(纯)] NH3是唯一使石蕊试纸变蓝的气体。
贮存注意:棕色、细口、磨口、阴凉处。
氨水质量分数越小(大),密度愈大(小).形成喷泉现象条件:气体+极易“溶”的液体。
h(液)=溶解或参加反应的气体的体积(1:V,理论上V≥1充满)。
C(X)=——————————————————————————[思考]如何证明氨极易溶于水且溶液呈碱性?。
⑵与HCl(g):[现象:“白烟”—鉴别:浓盐(硝)酸(玻璃棒)]实质:——————————————————————————(“相见恨晚”)H2O+CO2+1/2 NH3═NH4HCO3(碳铵)/[ (NH4)2CO3][实验1-3]书P11内容、图1-12侯氏制碱法简介:原理: NH3+H2O+CO2+NaCl=NaHCO3↓+NH4Cl,2NaHCO3======Na2CO3+CO2↑+H2O①S(NaHCO3)〈〈S(NH4Cl NH3气体后通CO2气体。
[思考]有的同学说:在用CO2酸化的饱和食盐水溶液中若通入过量的氨气可直接制得纯碱,为什么不直接用此法?⑶与非金属:Pt△①与O 2: 4NH 3+5O 2======———————————————[4NH 3+3O 2(纯)==2N 2+6H 2O]a/现象(空气中): ①————————————————————②—————————————————③————————————————— ②与氯气:2/8NH 3+3Cl 2=N 2+6HCl (6NH 4Cl )④2NH 3+ 3CuO====== 3Cu+N 2+3 H 2O4、用途:⑴化工原料:制氮肥、硝酸、铵盐、纯碱(有机合成工业)等;⑵致冷剂。
氨及铵盐的性质
课题:氨及铵盐的性质一、课标要求:通过实验了解NH3及铵盐的主要性质,认识其在生产中的应用,让学生了解氨循环对维持生态平衡的作用。
二、教学目标:1、了解氨的物理性质和用途,掌握氨的化学性质、铵盐的性质及氨的实验室制法;学会NH4+的检验方法,能设计实验、验证氨及铵盐的化学性质。
2、运用对比方法,区别NH3和铵盐的组成、结构、性质从而培养学生能力;通过对比实验的观察、分析、,培养观察能力,思维能力和应用化学实验发现学习新知识的能力。
3、通过氨的吸收实验培养学生环保意识,激发学习化学的兴趣;不断引导学生发挥主观能动性,自主归纳、整理知识线索、交流学习方法。
三、教学重、难点:1、氨和铵盐的化学性质。
2、实验室制NH3的原理。
四、教学设计思路:氨的性质:通过演示P86实验4-9,让学生观察并思考,明确产生喷泉的关键是烧瓶内外有一定的压强差,从而引出氨的相关物理性质及化学性质,并设置新的情景让学生探究,从而把课堂气氛推向高潮,这样,培养了学生分析问题,交流合作,整理归纳知识的能力。
铵盐的性质和氨气的实验室制法:学生分组实验,对比、分析,发现问题,解决问题,培养学生自主学习的习惯。
自然界中氨的循环:让学生认识氨的循环对于生态平衡的重要性。
五、教学设计:教学进程教师活动学生活动活动目标及说明【准备】【引入新课】在教室里洒一些氨水,使学生感受到氨的气味。
同学们:前面我们已经学到氮的氧化物。
本节课我们来一起探究氮的氢化物——氨的性质,首先请大家观察一个实验,(演示P86实验4-9边实验边引导学生观察①这里是一烧瓶已集满的氨气,烧瓶的双孔塞上接带止水夹的玻璃管及一装有水的滴管。
如图②烧杯的水中滴有无色的酚酞。
③打开止水夹,挤压滴管,使滴管里的水流入烧瓶。
体验氨气的刺激性气味观察使学生对氨气产生感性认识培养学生观察能力,叙述能力和逻辑思维能力。
提出问题:①你看到了什么现象?为什么会有此现象?学生回答:看到红色喷泉。
产生喷泉是因为烧瓶内压强小于大气压强。
高考化学第一轮复习 氨和铵盐课件
• (3)将过量的氧气与A产生的氨气分别从a、 b两管进气口通入到装置C中,并在b管上 端点燃氨气:
• ①两气体通入的先后顺序是 __________________,其理由是 ________________________。
• ②氨气燃烧的化学方程式是 _____________。
• 【解析】 (1)实验室一般使用铵盐和强碱共热来制取NH3,这里使 用的铵盐可以是(NH4)2CO3或者是NH4HCO3。(NH4)2CO3或者 NH4HCO3受热分解还会产生H2O和CO2,需要利用碱石灰除去。
• (a+b+c)mol,故该氨水的物质的量浓度是(a+b+c)mol/L。
• (3)因为氨水的密度小于H2O的密度,故加等体积水稀释后溶液的质 量分数小于原溶液质量分数的一半。
• (4)AgNO3溶液中滴加氨水,开始产生
AgOH白色沉淀,但AgOH(或Ag2O)溶于
过量的氨水形成
,沉淀溶解。
AlCl3溶液中滴加氨水,形成Al(OH)3白色 沉淀。
• 【答案】 (1)②④⑤ (2)(a+b+c)mol/L
(3)<
• (4)先生成白色沉淀,再逐渐溶解 生成 白色沉淀
• (1)常见的实验室制法和工业制法
a.反应原理
2NH4Cl+Ca(OH)2
①实验室制 法
b.发生装置
CaCl2+2NH3↑+2H2O
c.收集方法
向下排空气法
①实验室制
法
d.验满方法
• ①在图乙的锥形瓶中,分别加入足量的下列物质,反应后可能产生
喷泉的是
()ቤተ መጻሕፍቲ ባይዱ
• A.Cu与稀盐酸
B.NaHCO3与NaOH溶液
• C.CaCO3与稀硫酸 D.NH4HCO3与稀盐酸
氨、铵盐
△氨、铵盐1.复习重点1.氨的分子结构、性质和制取 2.铵盐的结构、性质和用途 3.氨和铵盐的检验 2.难点聚焦 一.氨1.氨的结构、性质和用途 (1)氨的结构:电子式: 结构式:空间构型:三角锥形;NH 3是极性分子。
(2)物理性质:无色有特殊剌激性气味的气体,极易溶于水,常温常压下1体积水能溶解700体积的NH 3 。
(3)化学性质: ①与水反应:NH 3+H 2O NH 3·H 2O NH 4++OH ―NH 3是唯一能使湿润的红色石蕊试纸变蓝的气体,常用此性质检验NH 3。
②与酸的反应:NH 3+HCl=NH 4Cl (生成白烟) NH 3+CO 2+H 2O=NH 4HCO 3 ③与氧化剂反应:4NH 3+3O 2 4NO+6H 2O 2NH 3+3CuO N 2+3Cu+3H 2O 8NH 3+3Cl 2 = N 2 + 6NH 4Cl2.氨的实验室法:用铵盐与碱共热 2NH 4Cl+C a (O H )2 C a C l 2+2N H 3↑+2H 2O ①发生装置:固+固+加热型。
与制备O 2 和CH 4 气体相似;收集NH 3 用向下排空气法收集。
②检验:a.用润湿的红色石蕊试纸检验;b.用沾有浓盐酸的玻璃棒检验,产生白烟。
③干燥:不能用CaCl 2、P 2O 5、浓硫酸作干燥剂,因为NH 3能与CaCl 2反应生成CaCl 2·8NH 3。
P 2O 5与浓硫酸均能与NH 3反应,生成相应的盐。
所以NH 3通常用碱石灰干燥。
3.氨的工业制法N 2+3H 2 2NH 3一. 铵盐(1)结构:离子晶体,具有离子键、共价键和配位键,是由非金属元素组成的离子化合物。
(2)物理性质:都是晶体,都易溶于水。
(3)化学性质①不稳定性:铵盐受热易分解NH 4Cl NH 3+HCl NH 4HCO 3 NH 3↑+CO 2↑+H 2ONH 4NO 3受热分解较复杂:NH 4NO 3 N 2O+2H 2O 2NH 4NO 3 2N 2↑ +O 2↑+4H 2O②与碱反应 NH 4++OH ― NH 3·H 2O 或NH 4++OH ― NH 3↑+H 2O③水解反应:NH 4++H 2O NH 3·H 2O+H +(4)用途:可用作氮肥,炸药,焊药。
24_氨、铵盐
△高中化学58个考点精讲24、 氨、铵盐1.复习重点1.氨的分子结构、性质和制取 2.铵盐的结构、性质和用途 3.氨和铵盐的检验 2.难点聚焦 一.氨1.氨的结构、性质和用途 (1)氨的结构:电子式: 结构式:空间构型:三角锥形;NH 3是极性分子。
(2)物理性质:无色有特殊剌激性气味的气体,极易溶于水,常温常压下1体积水能溶解700体积的NH 3 。
(3)化学性质: ①与水反应:NH 3+H 2O NH 3·H 2O NH 4++OH ―NH 3是唯一能使湿润的红色石蕊试纸变蓝的气体,常用此性质检验NH 3。
②与酸的反应:NH 3+HCl=NH 4Cl (生成白烟) NH 3+CO 2+H 2O=NH 4HCO 3 ③与氧化剂反应:4NH 3+3O 2 4NO+6H 2O 2NH 3+3CuO N 2+3Cu+3H 2O 8NH 3+3Cl 2 = N 2 + 6NH 4Cl2.氨的实验室法:用铵盐与碱共热 2NH 4Cl+C a (O H )2 C a C l 2+2N H 3↑+2H 2O ①发生装置:固+固+加热型。
与制备O 2 和CH 4 气体相似;收集NH 3 用向下排空气法收集。
②检验:a.用润湿的红色石蕊试纸检验;b.用沾有浓盐酸的玻璃棒检验,产生白烟。
③干燥:不能用CaCl 2、P 2O 5、浓硫酸作干燥剂,因为NH 3能与CaCl 2反应生成CaCl 2·8NH 3。
P 2O 5与浓硫酸均能与NH 3反应,生成相应的盐。
所以NH 3通常用碱石灰干燥。
3.氨的工业制法N 2+3H 2 2NH 3一. 铵盐(1)结构:离子晶体,具有离子键、共价键和配位键,是由非金属元素组成的离子化合物。
(2)物理性质:都是晶体,都易溶于水。
(3)化学性质①不稳定性:铵盐受热易分解NH 4Cl NH 3+HCl NH 4HCO 3 NH 3↑+CO 2↑+H 2ONH 4NO 3受热分解较复杂:NH 4NO 3 N 2O+2H 2O 2NH 4NO 3 2N 2↑ +O 2↑+4H 2O②与碱反应 NH 4++OH ― NH 3·H 2O 或NH 4++OH ― NH 3↑+H 2O③水解反应:NH 4++H 2O NH 3·H 2O+H +(4)用途:可用作氮肥,炸药,焊药。
