混合离子的分离和鉴定
鉴定铵根离子的方法

鉴定铵根离子的方法
一、引言
铵根离子是指由氮原子与氢原子共价结合而成的离子,常见的铵根离子有NH4+和CH3NH3+等。
在环境监测、水质检测等领域中,对铵根离子的鉴定具有重要意义。
本文将介绍几种常见的鉴定铵根离子的方法。
二、化学试剂法
1. Nessler试剂法
Nessler试剂是一种含有碘化汞和碘化钾的溶液,可以与铵根离子产生特异性反应,生成黄色到棕色沉淀。
该方法操作简单,灵敏度较高,但存在毒性较大的问题。
2. 氯钡试剂法
氯钡试剂是一种含有氯化钡和硝酸的溶液,在加入铵根离子后会生成白色沉淀。
该方法适用于海水等高盐度样品,但其灵敏度较低。
三、仪器分析法
1. 离子色谱法
离子色谱法是一种利用柱上固定相分离不同离子物质并进行检测的方法。
该方法适用于各种样品类型,具有高灵敏度和准确性。
2. 毛细管电泳法
毛细管电泳法是一种利用毛细管内的电场将不同离子物质分离的方法。
该方法操作简单,适用于水样等样品类型。
四、生物传感器法
生物传感器是一种利用生物材料对目标分子进行识别和检测的传感器。
目前已经发展出多种针对铵根离子的生物传感器,如基于蛋白质、酶
等材料的生物传感器。
该方法具有高灵敏度和特异性,但需要特定的
试剂和设备。
五、结论
以上介绍了几种常见的鉴定铵根离子的方法,每种方法都有其优缺点。
在实际应用中需要根据具体情况选择合适的方法进行分析。
同时,在
进行铵根离子检测时需要注意安全问题,并避免可能存在的干扰因素
影响检测结果。
浅谈元素及其化合物性质实验教学

摘
要 : 对元 素及 其化 合 物 性 质 实验 的特 点 , 优 选 实验 内容 、 究 实 验过 程 、 索教 学方 法 三 个 方 面探 讨 了 针 从 研 探
元 素 及 其 化 舍 物 性 质 实验 的 教 学。 关 键 词 : 质 实验 ; 性 实验 过程 ; 实验 教 学 中 图 分 类 号 : 4 G62
知识应 用的现实意义。 2 研 究 实 验 过 程
是化学研究 的起 源 , 实验 能力 培养 的启蒙 , 是 同时也 是 培 养学生实验兴趣 、 固理论知识 的一种 主要手 段。在性质 巩
实验的作用受到充分的重视 的前提下 , 应该对 其实验 内容
进行优选 , 对其 实验 过程进 行研 究 , 其教 学方法 进行 探 对 索, 不断提高教 学效 果 , 全面 培养 学生 的科 学素养 和创 新
物添加的次序 都会 影 响实验 结果l 。在 性质 实验 的教 学 2 ] 过程中 , 以说教 师 和学 生是 站在 同一 学习者 的角 度 , 可 每 次 实验 都会 有“ 异常” 现象的出现。
“ 常” 异 现象 是指 由 于 受 药 品 的 性 状 ( 态 、 粒 大 小 、 状 颗
体 现能力 、 素质和创造性思维 的培养要 求?指导 学生做 好
这 类 实 验 对 教 师 的教 学 提 出 了更 高 的要 求 。 性 质 实 验 是 人 类 主 动 了 解 各 种 自然 物 质 的第 一 步 E “,
兴趣, 进一步认识到知识 的实际 价值 。从社会 生活 中寻找 与元 素及其 化合 物性 质有关 的实 验 内容 , 如人体 尿糖 的测 定, 驾驶员醉酒或 酒精 中毒 检验 , 学生 深刻 体会 到化学 让
实验八Fe3+、Al3+离子的分离

实验八 Fe 3+、Al 3+离子的分离——液-液萃取与分离[实验目的]学习萃取分离法的基本原理;初步了解铁、铝离子不同的萃取行为。
学习萃取分离和蒸馏分离两种基本操作。
在6mol ·L -1盐酸中,Fe 3+离子与Cl -离子生成了[FeCl 4]-配离子。
在强酸-乙酸萃取体系中,乙醚(2t E O )与离子结合,生成了离子(2t E O ·H +)。
由于[FeCl 4]-离子与2t E O ·H +离子都有较大的体积和较低的电荷。
因此,容易形成缔合物2t E O ·H +·[FeCl 4]-,在这种离子缔合物中,Cl -离子和2t E O 分别取代了Fe 3+离子和H +离子的配位水分子,并且中和了电荷,具有疏水性,能够溶于乙醚中。
因此,就从水相转移到有机相中了。
Al 3+离子在6mol ·L -1盐酸中与Cl -离子生成配离子的能力很弱,因此,仍然留在水相中。
将Fe 3+离子由有机相中再转移到水相中去的过程叫做反萃取。
将含有Fe 3+离子的乙醚相与水相混合,这时体系中的H +离子浓度和Cl -离子浓度明显降低。
离子2t E O ·H +和配离子[FeCl 4]-解离趋势增加,Fe 3+离子又生成了水合铁离子,被反萃取到水相中。
由于乙醚沸点较低(35.6),因此,采用普通蒸馏的方法,就可以实现醚水的分离。
这样Fe 3+又恢复了初始的状态,达到了Fe 3+、Al 3+分离的目的。
[实验用品]仪器:圆底烧瓶(250mL )、直管冷凝器、尾接管,抽滤瓶、烧杯、梨形分液漏斗(100mL)、量筒(100mL)、铁架台、铁环液体药品:FeCl 3(5%)、浓盐酸(化学纯)、乙醚(化学纯)、K 4Fe(CN)6(5%)、NaOH(2mol ·L -1、6mol ·L -1)、茜素S 酒精溶液、冰水、热水材料:乳胶管、橡皮管、玻璃弯管、滤纸、pH度纸[基本操作]1.萃取,参见第六章二。
d区元素的无机化学实验(手打)

d区元素的无机化学实验d区元素位于长周期表中第4、5、6周期的中部,从ⅢB到ⅧB共8个纵行。
d区过渡元素在原子结构上的共同特点是:最后一个电子填充到d轨道上,而且次外层轨道尚未充满。
他们的价电子构型为(n-1)d0~10ns0~2。
由于d区元素的电子层结构与主族元素差别较大,决定了他们和主族元素的性质差别明显。
一、实验目的1.试验并掌握二价铁、钴、镍的氢氧化物及配合物的生成和性质2.学习和掌握M(Ⅲ)的氧化性及其变化规律3.学习和掌握M(Ⅱ)的氧化性及其变化规律4.学习掌握Fe2+、Fe3+、Co2+、Ni2+等离子的鉴定方法5. 试验并掌握钛、钒、铬、锰主要氧化态化合物的氧化还原性,难溶铬酸盐的生成和溶解,以及铬的鉴定二、仪器与试剂离心机,瓷坩埚,坩埚钳,泥三角;KI淀粉试纸,PH试纸;FeSO4·7H2O(s),KSCN(s),Cu(s),NH4VO3(s),锌粒(s),NaBiO3(s),MnO2(s),2 mol/L H2SO4,2 mol/L HCl,6 mol/L HCl,浓HCl,浓硫酸,6 mol/L HNO3,饱和H2S,2 mol/L NaOH,6 mol/L NaOH,2 mol/L NH3·H2O,6 mol/L NH3·H2O,3% H2O2,1 mol/LNa2S,0.5mol/LNaNO2,0.1 mol/L CrCl3,0.1 mol/L K2Cr2O7,0.1 mol/L BaCl2,0.1 mol/LPbNO3,0.1 mol/L AgNO3,0.1 mol/L Na2SO3,0.1mol/L MnSO4,0.1 mol/L Fe(NO3)3,1 mol/L NH4Cl,0.1 mol/L FeCl3,0.1 mol/LCoCl2,0.5mol/LCoCl2,0.1 mol/L FeSO4,碘水,溴水,丁二酮肟,丙酮,淀粉溶液,TiOSO4溶液。
阳离子的分离与鉴定

阳离子的分离与鉴定一. 实验目的1. 掌握用两酸三碱系统分析法对常见阳离子进行分组分离的原理和方法。
2. 掌握分离、鉴定的基本操作与实验技能。
二. 实验原理阳离子的种类较多,常见的有二十多种,个别检出时,容易发生相互干扰,所以一般阳离子分析都是利用阳离子某些共同特性,先分成几组,然后再根据阳离子的个别特性加以检出。
凡能使一组阳离子在适当的反应条件下生成沉淀而与其它组阳离子分离的试剂称为组试剂,利用不同的组试剂把阳离子逐组分离再进行检出的方法叫做阳离子的系统分析。
在阳离子系统分离中利用不同的组试剂,有很多不同的分组方案。
如硫化氢分组法,两酸、两碱系统分组法。
下面介绍一种以氢氧化物酸碱性与形成配合物性质不同为基础,以HCl、H2SO4、NH3 H2O、NaOH、(NH4)2S为组试剂的两酸三碱分组方法。
本方法将常见的二十多种阳离子分为六组。
第一组:盐酸组Ag+,Hg22+,Pb2+第二组:硫酸组Ba2+,Ca2+,Pb2+第三组:氨合物组Cu2+,Cd2+,Zn2+,Co2+,Ni2+第四组:易溶组Na+,NH4+,Mg2+,K+第五组:两性组Al3+,Cr3+,Sb III、V,Sn II、IV第六组:氢氧化物组Fe2+,Fe3+, Bi3+,Mn2+,Hg2+用系统分析法分析阳离子时,要按照一定的顺序加入组试剂,将离子一组一组沉淀下来,具体分离方法如下表。
表阳离子分组步骤试液(用个别检出法鉴定NH4+、Fe2+、Fe3+)(Hg)(两性组) (氢氧化物组) (第三组硫化物) (第四组易溶组)AlO2−、Cr O42−Fe(OH)3、K+、Na+、Mg2+、NH4+SbO43−、SnO32−MnO(OH)2、NaBiO3、HgNH2Cl每组分出后,继续再进行组内分离,直至鉴定时相互不发生干扰为止。
在实际分析中,如发现某组离子整组不存在(无沉淀产生)、这组离子的分析就可省去。
从而大大简化了分析的手续。
常见阴离子的分离、鉴定
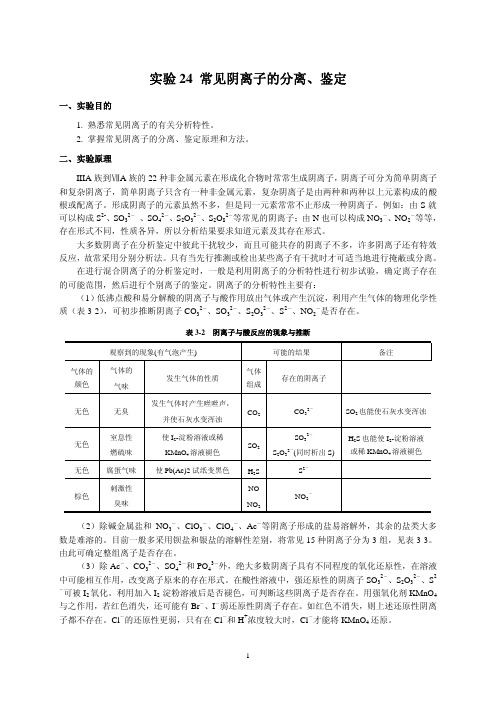
浓)、HNO3 (2.0mol·L-1,6.0mol·L-1,浓)、NaOH (2.0mol·L-1,6.0mol·L-1)、NH3·H2O (2.0mol·L-1,6.0mol·L-1,浓)。 盐溶液: NaNO2 (0.1 mol·L-1)、NaNO3 (0.1 mol·L-1)、KI (0.1 mol·L-1)、NaCl (0.1 mol·L-1)、 KBr (0.1 mol·L-1)、Na2SO3 (0.1 mol·L-1)、Na2S2O3 (0.1 mol·L-1)、Na2CO3 (0.1 mol· L-1)、Na2S (0.1 mol·L-1)、Na2SO4 (0.1 mol·L-1)、AgNO3 (0.1 mol·L-1)、(NH4)2MoO4 (0.1 mol·L-1)、KMnO4 (0.01 mol·L-1)、BaCl2 (0.1 mol·L-1)、K4[Fe(CN)6] (0.1 mol·L-1)、 ZnSO4 (饱和)。 其他试剂:Na2[Fe(CN)5NO]溶液(5%)、氯水(新配制)、I2-淀粉溶液、CCl4、对氨基苯磺酸(1 %)、α-萘胺(0.4%)。
+
+
+
+
(+)
+
+
+
+
(+)
+ (+)
+
+
+
+
+
+
+
(完整版)常见阳离子的分离及鉴定
2020/4/14
(8)Mn2+的鉴定 5BiO3- + 2Mn2+ + 14H+
═ 5Bi3+ + 2MnO4— (紫红色溶液)+7H2O
(9)Co2+的鉴定 Co2+ + 4SCN— = [Co(SCN)4]2—( 蓝色)
试 HCl)
(NH4)2S (NH3-NH4Cl)
(NH4)2CO3 (NH3-NH4Cl)
硫化物 难溶于水
分 组 依 据
两酸两碱系统分析法
分别检出NH4+、Na+、Fe3+、Fe2+
氯化物易溶于水
硫酸盐 难溶于水
硫酸盐易溶于水
氢氧化物难溶于水及 氨水
氨性条件下不生成沉淀
2020/4/14
(2)Pb2+的鉴定 Pb2+ + CrO42—→ PbCrO4↓(黄色沉淀) (3) Cu2+的鉴定 2Cu2++ [ Fe(CN)6]4- → Cu2Fe(CN)6↓ (红棕色)
2020/4/14
(4)Fe3+的鉴定 ①Fe3++ nSCN — == Fe(SCN)nn-3 (血红色溶液) ②K+ + Fe3++ [ Fe(CN)6]4- →[K Fe(CN)6 Fe] ↓
2020/4/14
硫化氢系统分析法
硫化物不溶于水
硫化物溶于水
在稀酸中生成硫化物沉淀
分
组
氯化物溶于热水
依 据
氯化物 不溶于 热水
无机化学常见阳离子分离与鉴定
无机化学常见阳离子分离与鉴定Ag+鉴定方法取2 滴试液,加入2 滴2molL HCl, 若产生沉淀,离心分离,在沉淀中加人6molL-1NH3H2O 使沉淀溶解,再加入6molL-1 HNO3 酸化,白色沉淀重又出现,说明Ag+离子存在。
反应如下:Ag+ +Cl-→AaCl↓ AgCl + 2NH3H2O → [Ag(NH3)2]+ + Cl- + H2O [Ag(NH3)2]+ + Cl- + 2H+ → AgCl↓+ NH4+ + Cl-1备注Al +3+2取试液2 滴,再加入2 滴铝试剂,微热,有红色沉淀,示有Al+3反应可在HAc-NH4Aa 缓冲溶液中进行。
Sr2+对Ba2+的鉴定有干扰,但SrCrO4 与BaCrO4 不同的是,SrCrO4 在乙酸中可溶解。
所以应在乙酸存在下进行反应。
离子。
-1Ba在试液中加入0.2 molL K2CrO4 溶液,生成黄色的BaCrO4 沉淀,示有B a+2 离子存在。
可用K2Cr2O4 溶液代替K2CrO4 溶液。
Bi+3①SnO2 离子将Bi 离子还原,生成金属铋(黑色沉淀), 示有Bi3+离子存在:2 Bi(OH) 3 + SnO22- →2Bi↓+ 3SnO32- + H2O 取2 滴试液,加入2 滴0.2 molL-1 SnCl2 溶液和数滴2molL-1 NaOH 溶液,溶液为碱性。
观察有无黑色金属铋沉淀出现。
②BiCl3 溶液稀释,生成白色BiOCl 沉淀,示有Bi+3 存在:Bi+3 + H2O + Cl- → BiOCl↓+ 2H+2-3+Ca2+试液中加入饱和(NH4)2C2O4 溶液,如有白色的Ca2Cr2O4 沉淀生成,示有Ca2+离子存在。
沉淀不溶于乙酸。
Sr2+、Ba2+离子也与(NH4)2C2O4 生成同样的沉淀,但在乙酸中可溶解。
Cd2+①取 5 滴示液,加入0.5mL 丙酮,然后加入1molL-1 NH4SCN 溶液,溶液显蓝色,表示有Co2+离子存在。
常见阴离子的分离与鉴定
常见阴离子的分离与鉴定实验05常见阴离子的分离与鉴定一、教学要求1、使学生掌握常见阴离子的分离和鉴定方法;2、离子检出的基本操作。
二、注意事项根据材料性质的不同特点和溶液中离子的共存情况,应首先进行初步试验或分组试验,以消除不可能的离子,然后确定可能的离子。
初步性质检验一般包括:(一)、试液的酸碱性试验;(二)、是否产生气体的试验;(三)、氧化性阴离子的试验;(四)、还原性阴离子的试验;(五)、难溶盐阴离子试验;试剂酸Ba2+Ag+h2so4h2so4h2so4离子H2SO4+HNO3+ki+I2+kmno4so42白色沉淀*SO32酸性气体沉淀可溶性酸反应沉淀至灰色气体+浊度*S2O32反应酸性气体S2黑色沉淀反应(臭鸡蛋味)CO32酸性气体沉淀可溶性酸沉淀可溶性酸PO43沉淀可溶性酸aso43——反应sio32白色沉淀白色沉淀CL白色沉淀br浅黄色沉淀反应I黄色沉淀反应CN酸性气体*反应NO2酸性气体反应NO3-*表明浓度较高时可能发生反应。
经过初步试验后,可以对试液中可能存在的阴离子作出判断,然后根据阴离子特性反应作出鉴定。
三、实验仪器和药物离心机、点滴盘、试管、试管夹、酒精灯、蒸发皿、浓硝酸,6mol L-1hno3,浓盐酸,2mol L-1hcl,浓H2SO4,2mol L-1h2so4,浓H3PO4,6mol L-1hac,2mnaoh,6mol。
L-1naoh、NH3(6mol.L-1)、pH试纸、碘化钾试纸、醋酸铅试纸、对氨基苯磺酸、α-萘胺、K4[Fe(CN)6]、ZnSO4、AgNO3、Na2[Fe(CN)5No]、澄清BA(OH)2、CdCl(或CD(NO3)(NH4)2Mo422)Na2CO3、NaCl、KBr、Ki、Na3PO4、BaCl2、naso4、naso4、NaSO3、NaSO3、Na2O3、NaNO3、NaNO2c12水、i2水、cc14、0.1mol.l-1kmno4、四、实验现象及相关化学反应式(一),常见阴离子的鉴定1。
常见阴离子的分离与鉴定
常见阴离子得分离与鉴定一、实验目得①掌握一些常见阴离子得性质与鉴定反应;②了解阴离子分离与鉴定得一般原则,掌握常见阴离子分离与鉴定得原理与方法。
二、实验原理许多非金属元素可以形成简单得或复杂得阴离子,例如S2=、Cl=、Br=、NO3=与SO42—等,许多金属元素也可以以复杂阴离子得形式存在,例如VO3=、CrO42-、Al(OH)4-等。
所以,阴离子得总数很多。
常见得重要阴离子有Cl=、Br=、I=、S2-、SO32-、S2O32-、SO42-、NO3-、NO2—、PO43-、CO32—等十几种,这里主要介绍它们得分离与鉴定得一般方法。
许多阴离子只在碱性溶液中存在或共存,一旦溶液被酸化,它们就会分解或相互间发生反应、酸性条件下易分解得有NO2-、SO32-、S2O32-、S2-、CO32-;酸性条件下氧化性离子(如NO3-、NO2-、SO32—)可与还原性离子(如I-、SO32-、S2O32-、S2-)发生氧化还原反应、还有一些离子容易被空气氧化,例如NO2-、SO32-、S2-分别被空气氧化成NO3-、SO42—与S等,分析不当很容易造成错误。
由于阴离子间得相互干扰较少,实际上许多离子共存得机会也较少,因此大多数阴离子分析一般都采用分别分析得方法,只有少数相互有干扰得离子才采用系统分析法,如S2-、SO32-、S2O32-;Cl-、Br-、I—等。
三、器材与药品①仪器:试管,离心试管,点滴板,滴管,酒精灯,水浴烧杯,离心机等。
②药品:HCl(6mol⋅L-1);HNO3(6mol⋅L—1);H2SO4(3mol⋅L—1);H2SO4(浓);BaCl(0、1mol⋅L-1);AgNO3(0。
1mol⋅L—1);KI(0、1mol·L—1);KMn2O4(0.01mol·L-1);FeSO4(固体);CCl4;pH试纸浓度均为0.1mol·L-1得阴离子混合液:CO32-,SO42-,NO3-,PO43-一组;Cl-,Br-,I-一组;S2—,SO32—,S2O32—,CO32-一组;未知阴离子混合液可配5-6个离子一组。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
混合离子的分离和鉴定
利用铁、钴、镍离子与氨水不同 作用,将其分离。三价铁离子与 过量氨水作用只生成氢氧化 铁沉 淀,而钴与镍都生成相应的氨配 合离子而溶解。
Co2+与SCN-反应生成蓝绿色的 [Co(SCN)4]2-配离子, 可证实 Co2+存在。此配离子可被戊醇煤 炭萃取。
镍离子与丁二酮肟 (HDMG)作用,生成红 色的沉淀来鉴定镍的存在。 用两个反应证实铁离子的存在。 在酸性溶液中,二价铁离子与铁 氰化钾反应生成普鲁 士蓝沉淀, 可证实二阶铁的存在。三价铁可 与硫氰根离子作用显血红色。 Fe3+ + SCN- → [Fe(SCN)]2+
实验中可能存在的问题
NH3水过量的问题:怎么确定NH3水是否过量
分析:如果NH3水不过量,将导致Fe3+对其他两个离子鉴定的干扰较大 解决:1再生成沉淀
钴离子对铁离子鉴定的干扰
分析:如果沉淀中存在Co2+离子,与SCN-也会生成红色,造成对现象的干扰
解决:确保生成的Fe(OH)3要洗涤干净
鉴定钴离子时铁离子的干扰
解决:为了防止铁离子的干扰,加入 NaF 使铁离子形成 [FeF6]3-,而将 铁离子掩蔽起来。
THANKS
讲解: 董雪智 PPT制作:阿尔哈斯 叶尔森
