23氨 硫酸 硝酸---硝酸
初中常用化学式汇总
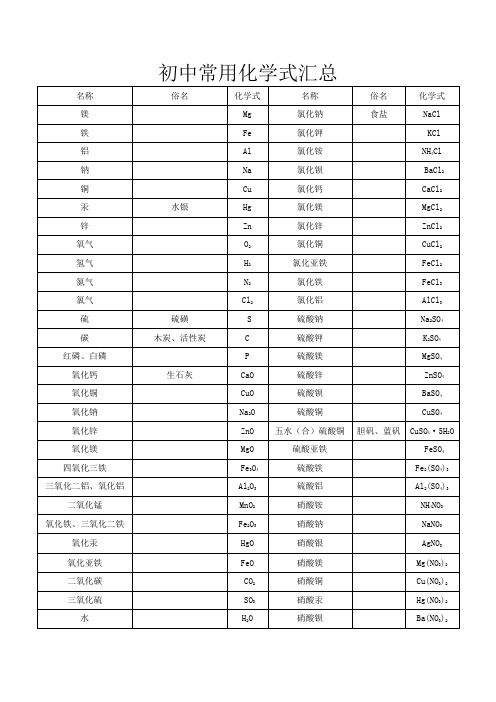
初中常用化学式汇总初中化学式大全编名称化学式式量描述号1 水H2O 182 铁锈Fe2O3·nH2O3 铜绿Cu2(OH)2CO3221 也叫孔雀石;化学名:碱式碳酸铜;绿色固体4 酒精C2H5OH 465 甲醇CH3OH 32 木精(工业酒精)6 乙酸CH3COOH 60 CH3COO-:醋酸根离子。
乙酸也叫醋酸。
7 碳酸钠晶体 Na2CO3·10H2O 2868 硫酸铜晶体CuSO4·5H2O 249.5 俗称:胆矾、蓝矾FeSO4·7H2O 278 俗称:绿矾,皂矾,青矾9 硫酸亚铁晶体10 氯化钙晶体CaCl2·6H2O 21911 硫酸钙晶体CaSO4·2H2O 172 俗称:生石膏12 硫化钠Na2S 7813 氧气O232 无色无味的气体14 氢气H2 2 爆鸣气的主要成分:H2和O2;无色无味的气体15 氮气N228 无色无味的气体16 氯气Cl27117 氨气NH317 NH3是碱性气体;无色,但有刺激性气味18 一氧化碳CO 28 无色无味的气体19 二氧化碳CO244 无色无味的气体20 二氧化硫SO264 无色,但有刺激性气味21 三氧化硫SO38022 二氧化氮NO24623 甲烷CH416 天然气(沼气)的主要成分24 乙炔C2H226 电石气:C2H2(通常含H2S、PH3等)25 氧化钙CaO 56 白色固体26 氧化镁MgO 40 白色固体27 氧化锌ZnO 8128 氧化铜CuO 79.5 黑色固体29 氧化汞HgO 217 红色固体30 二氧化锰MnO287 黑色固体31 三氧化二铝Al2O310232 三氧化二铁Fe2O3160 俗称:赤铁矿石;红色固体33 四氧化三铁Fe3O4232 俗称:磁铁矿石;黑色固体34 五氧化二磷P2O5142 白色固体35 三氧化钨WO34836 过氧化氢H2O23437 盐酸HCl 36.5 无色,但有刺激性气味;38 硝酸HNO363 具有刺激性气味的液体39 硫酸H2SO498 纯净的硫酸是没有颜色、粘稠、油状的液体,不容易挥发。
人教高中化学必修1全册课件:第四节《氨硝酸硫酸》第一课时

一、氨 阅读材料:
2004年4月20日上午10时,杭州市一 制冷车间发生液氨泄漏事件,整个厂区 是白茫茫的一片,方圆数百米,空气中 弥漫着一股浓烈的刺激性气味。厂区内 寒气逼人。
思考:氨气有哪些物理性质?
[实 验4—8] 氨的性质,注意观察现象。
现象:烧杯中的水由玻璃导管进入 烧瓶形成红色的喷泉。
NH4Cl △= NH3 ↑ + HCl ↑ NH4HCO3 △= NH3 ↑ + H2O ↑ + CO2 ↑ (NH4)2CO3 △= 2NH3 ↑ + H2O ↑ + CO2 ↑
由上面的反应可以看出, NH4Cl 、 NH4HCO3、 (NH4)2CO3 受热都能分解,都有NH3产生,但不是所有的铵盐受热分 解都能产生NH3的,例如NH4NO3的分解:
2NH4Cl+Ca(OH)2=△=2NH3↑+2H2O+CaCl2
(3)制取装置:
固固加热装置
棉花的作用: 防止空气对流,保证 氨气纯度
④集气方法:向下排空气法
⑤验满方法: ①将湿润的红色石蕊试纸置于试管口(试纸变蓝) ②将蘸有浓盐酸的玻璃棒靠近试管口(白烟)
⑥干燥方法: 碱石灰(CaO和NaOH混合物)等碱性干燥剂 注意:无水CaCl2不能用来干燥NH3(形成CaCl2.8NH3)
小结:浓硫酸的脱水性是指浓硫酸能把有机物中 的氢氧原子按2∶1(H2O)的个数比脱去。
吸水性、脱水性的比较
性质
吸水性
脱水性
吸收物质中的游 吸收对 离水、水蒸气、 将有机物中的氢、氧
象 结晶水,直接与 元素按水的比例脱去 水分子结合
本
质
与水发生水合作 用,放出热量
硝酸的生产工艺

硝酸的生产工艺硝酸是一种重要的无机化学品,广泛应用于化工行业和农业生产中。
硝酸的生产工艺主要有亚硝酸氧化法、铵盐法和硝基氧化法等。
1. 亚硝酸氧化法:亚硝酸氧化法是硝酸工业生产中最常用的方法。
该方法以氨为原料,通过两步反应生成硝酸。
首先,通过合成氨制取亚硝酸,然后将亚硝酸氧化为硝酸。
具体工艺如下:(1)合成氨制备亚硝酸反应。
在催化剂存在下,将氨与氧气在高温下反应得到亚硝酸:NH3 + O2 → HNO2 + H2O(2)亚硝酸氧化为硝酸反应。
在催化剂存在下,将亚硝酸与氧气反应得到硝酸:2HNO2 + O2 → 2HNO32. 铵盐法:铵盐法是通过铵盐来制备硝酸的方法。
这种方法主要有铵硫酸法和铵硝酸法两种。
具体工艺如下:(1)铵硫酸法。
将硫酸与氨反应得到硫酸铵,然后将硫酸铵在高温下脱水,生成硝酸:2NH3 + H2SO4 → (NH4)2SO4(NH4)2SO4 → 2NH3 + H2SO4 + H2O2NH3 + H2SO4 + H2O + 1/2O2 → 2HNO3 + (NH4)2SO4(2)铵硝酸法。
将铵硫酸和硝酸反应得到硝酸铵,然后经过脱水处理,生成硝酸:HNO3 + NH4OH → NH4NO3 + H2ONH4NO3 → N2O + 2H2O2NH4NO3 → 2N2O + O2 + 4H2ON2O + 3O2 → 2N2O52N2O5 + H2O → 2HNO33. 硝基氧化法:硝基氧化法是将有机化合物中的氨基或羟基氧化为硝基的方法,然后生成硝酸。
这种方法适用于有机合成过程中的硝化反应。
具体工艺如下:R-NH2 + 2HNO3 → R-NO2 + 2H2O + H2OR-OH + HNO3 → R-ONO2 + H2O以上是硝酸的主要生产工艺,不同的工艺适用于不同情况下的生产需求。
在实际生产中,还需要考虑反应条件、催化剂的选择、产品纯度的控制等因素,以提高生产效率和产品质量。
同时,硝酸的生产过程涉及一些化学反应和氧化,所以在操作过程中需要注意安全措施,以防止事故发生。
硫酸铵硝酸铵小苏打化学式-概述说明以及解释

硫酸铵硝酸铵小苏打化学式-概述说明以及解释1.引言1.1 概述概述硫酸铵、硝酸铵和小苏打是常见的化学物质,在许多领域都有着重要的应用。
硫酸铵(NH4)2SO4 是一种重要的氮、硫复合肥,广泛应用于农业生产中。
硝酸铵NH4NO3 是一种常用的炸药原料和高效氮肥。
小苏打NaHCO3 则是一种常用的食品添加剂和缓冲剂。
本文将分别介绍硫酸铵、硝酸铵和小苏打的化学式及性质,探讨它们的应用领域、反应特点,以及未来的研究展望。
通过对这三种化学物质的深入了解,可以更好地应用它们,并促进相关领域的发展和创新。
1.2 文章结构:本文将分为三个主要部分,包括引言、正文和结论。
- 引言部分将介绍本文所涉及的化学物质硫酸铵、硝酸铵和小苏打,并说明为何研究它们的化学式和性质的重要性。
- 正文部分将详细介绍硫酸铵、硝酸铵和小苏打的化学式、物理性质、化学性质等相关内容,以便读者更全面地了解这些化合物。
- 结论部分将总结本文的主要内容,并展望硫酸铵、硝酸铵和小苏打在未来的应用领域和研究方向,以启发读者对这些化合物的进一步探索和研究。
1.3 目的:本文的目的在于深入探讨硫酸铵、硝酸铵和小苏打的化学式及性质,以及它们混合后可能发生的反应。
通过对这些化合物的理解,我们可以更好地了解它们在实际应用领域中的作用,以及该混合物可能具有的潜在应用价值。
同时,通过研究这些化合物的性质和反应特点,我们可以为未来的研究提供一定的参考和启示,为相关领域的进一步发展贡献自己的一份力量。
因此,本文的目的是探讨这些化合物的化学性质,为读者呈现一个全面的视角,促进对这些化合物的更深入理解和应用。
2.正文2.1 硫酸铵的化学式及性质硫酸铵的化学式为(NH4)2SO4,它是一种常见的无机化合物。
硫酸铵是由铵离子(NH4+)和硫酸根离子(SO4^2-)组成的盐类化合物。
硫酸铵具有以下性质:1. 物理性质:硫酸铵是白色结晶固体,有时呈现出无色或淡黄色,易溶于水,是常用的氮肥。
氨、硫酸、硝酸

三、铵盐
物理性质:铵盐均溶于水,为白色固体 化学性质: ①、铵盐不稳定 NH4Cl = NH3↑+ HCl ↑ NH4HCO3 = NH3↑+ H2O ↑ +CO2 ↑ ②、铵盐与碱反应,生成氨气
知识拓展· 氨水、液氨、一水合氨的比较 名称
化学式 分类 成分 联系
氨水
— 混合物
NH3、H2O、 NH3· H2O、NH4+、 OH-、H+
液氨
NH3 纯净物 NH3
一水合氨
NH3· H 2O 纯净物 NH3· H 2O
氨溶于水形成氨水,氨水中含有NH3 和NH3· H2O
(2)、氨与酸反应
NH +HCl = NH Cl 3 4 书p98页 (图4-28) 氨与氯化氢的反应
NH3 · H2O == NH3↑ + H2O 氨水中含少量氢氧根离子,呈弱碱性,故能使酚 酞试液变红。
知识拓展
1. 氨水的主要成分:NH3、H2O、NH3· H2O、
NH4+、OH-、H+
2. NH3· H2O不稳定,受热易分解生成NH3和水
3. NH4+和OH-在溶液中不能大量共存,两者反应
生成NH3· H 2O
问题探究
1、写出蔗糖遇浓硫酸发生的化学方程式: C12H22O11 =12C+11H2O 2、蔗糖分子中含有水,浓硫酸将水吸去使它 生成炭而变黑,这种说法对吗?试分析。 不对,因为蔗糖分子中没有水
一、硫酸
浓硫酸的特性 (3)强氧化性 ① 与金属的钝化:在常温下,铝和铁被浓硫 酸氧化时,在金属表面形成一层致密的氧 化膜,阻止了内部金属与浓硫酸进一步反 应,这种现象叫做钝化。因此,工业上常 用铝或铁制的容器储存或运输浓硫酸。
高中化学必修1 第四章 第四节 氨 硝酸 硫酸

(2)强氧化性: 浓硝酸和稀硝酸都能与铜发生反应: • 4HNO3(浓)+ Cu ═ Cu(NO3)2 + 2NO2 ↑ + 2H2O
H2SO4 ═
Zn H2SO4 +
Cu(OH)2 CuO BaCl2
2H+ + SO42变红
ZnSO4 + H2↑
CuSO4 + 2H2O CuSO4 + H2O BaSO4 +
@皮皮课件
紫色石蕊试液
2HCl
17
第二章 硫酸和硝酸的氧化性
2.2 硫酸 A.浓硫酸的特性:
① 吸水性:
向蔗糖中加入浓硫酸时,蔗糖变黑,体积 膨胀,变成疏松多孔的海绵状炭,并放出 刺激性气味。
@皮皮课件
20
第二章 硫酸和硝酸的氧化性
2.2 硫酸
小贴士
有些气体可以用浓硫酸干燥,有些气体却不能用浓硫酸干燥:
能用浓硫酸干燥的气体: H2、O2、N2、CO、CO2、CH4、SO2、HCl、Cl2
不能用浓硫酸干燥的气体:
① 碱性气体(NH3) ② 还原性气体(H2S、HI、HBr)
@皮皮课件 21
• 氧化非金属单质:
加热盛有浓硫酸和木炭的试管,碳就被氧化成二 氧化碳,而硫酸被还原为二氧化硫。
C + 2H2SO4(浓)
==
CO2↑ +
2SO2↑ + 2H2O
@皮皮课件
24
第二章 硫酸和硝酸的氧化性
2.4 硫酸的用途
@皮皮课件
25
第二章 硫酸和硝酸的氧化性
2.5 硝酸
(1)不稳定性(易分解): 4HNO3 ═ 4NO2 + 2H2O + O2↑
硝酸-硫酸法
硝酸-硫酸法
硝酸-硫酸法是一种常用的化学分析方法,它通常用于测定无机
物质的氮含量。
这种方法基于硝酸和硫酸的氧化还原反应,可以将被
测物质中的氮转化为硝酸盐,测量硝酸盐的含量以计算氮含量。
硝酸-硫酸法是一种比较简单的方法,通常可以在实验室中进行
操作。
使用该方法时,需要准备硝酸和硫酸的混合液,称为硝化混酸。
在加入待测物质之前,需要将硝酸和硫酸的比例调整到适当的值,以
确保反应的准确性。
通常,硫酸的体积应该为硝酸的两倍,以确保反
应充分进行。
在制备好硝化混酸后,需要将待测物质加入其中,然后加热至沸点。
在此过程中,硝酸和硫酸将会进行氧化还原反应,将待测物质中
的氮氧化为硝酸盐。
反应完成后,需要用蒸馏水或去离子水冲洗反应釜,然后用离心机离心,得到固体残渣。
该残渣中的硝酸盐可以用恰当的方法进行测量,从而计算出待测
物质中氮的含量。
例如,可以使用红外吸收光谱法测量硝酸盐的含量,或者使用光度法、滴定法等其他方法进行测量。
总的来说,硝酸-硫酸法是一种常用的化学分析方法,可以用于
测定许多不同物质中氮的含量。
它的操作相对简单,适用于许多实验
室中的分析需求。
当然,在使用该方法时需要注意安全,因为硝酸和
硫酸都是具有腐蚀性的强酸,需要遵循相应的安全规定,避免发生意
外事故。
湿法分解硝酸-硫酸法
湿法分解硝酸-硫酸法
湿法分解是一种化学反应过程,通常用于从化合物中提取出所需的物质。
硝酸-硫酸法是一种特定的湿法分解方法,常用于实验室中从样品中提取出特定的化合物或元素。
在硝酸-硫酸法中,通常使用硝酸和硫酸作为反应的溶剂。
这种方法通常用于分解有机物或者其他化合物,以便提取出其中的特定物质。
硝酸和硫酸的混合物具有强氧化性,可以有效地分解许多有机物和其他化合物。
在实验室中,硝酸-硫酸法通常用于分解有机物样品,以便提取出其中的金属离子或其他化合物。
这种方法可以通过加热样品与硝酸和硫酸的混合物来进行,通常在反应过程中会产生大量的气体和有色气体,需要在通风橱或者通风良好的环境下进行操作。
总的来说,硝酸-硫酸法是一种常用的湿法分解方法,适用于实验室中从化合物中提取出特定物质的过程。
这种方法需要在安全的环境下进行操作,以确保实验人员的安全,并且需要严格控制反应条件以获得准确的实验结果。
第四节 氨 硝酸 硫酸
一水合氨很不稳定 NH 3· 2O =NH3↑ +H2O H
目录
①NH3极易溶于水。(1 :700),
②NH3与水反应后有碱性物质生成。
大部分NH3与水结合成 NH3· 2O, H NH3· 2O可以小部分电离成NH4+和OH-。 H NH3+H2O
△
NH3· 2O H
NH4++OH-
NH3· 2O = NH3 ↑+ H2O H
与碱发生中和反应: H+ + OH - = H2O 与碱性氧化物反应: 2 H+ + CuO = Cu2+ + H2O 与盐反应:2 H+ + CO3 2- = H2O + CO2
-
使指示剂变色: 稀硫酸与硝酸使紫色石蕊试液变红
与活泼金属反应
(一)硫酸的性质
• 1、浓H2SO4的物理性质 A.色态:无色、粘稠的油状液体 B.沸点:约338℃——难挥发酸(高沸点酸) C.密度:1.84g/cm3——高密度酸 D.溶解性:跟水任意比互溶,溶解放出大量热。 • 两高:沸点、密度高 • 两大:溶解度、溶解放热量大
强热 微热
2.浓硫酸的特性: 1) 吸水性:能吸收水份
可干燥与它不反应的气体 O2、H2、N2、 Cl2、 CO2、SO2、HCl
讨论:1.能用浓硫酸干燥H2S、NH3气体吗? 2.将硫酸铜晶体投入浓硫酸中,有何现象?
浓硫酸与木屑、棉花、纸屑反应
2)、脱水性
浓硫酸与蔗糖反应 浓硫酸能按水的组成比脱去有机物中的氢和氧元素 浓硫酸的吸水性与脱水性有何区别?
所以:液氨是纯净物。
(2)氨跟酸的反应
NH3+HCl=NH4Cl (白烟)
人教版高中化学必修一课件高一化学《第四章第四节氨硝酸硫酸(第3课时)》.pptx
2019/11/17
18
二、硫酸和硝酸的氧化性
浓硝酸、浓硫酸、浓盐酸性质对比
有 有 无 稳定 易挥发 无 无
有有 有有
浓有 稳定 难挥发 有 有 有 不稳定 易挥发 无 无
2019/11/17
2019/11/17
10
二、硫酸和硝酸的氧化性
△ C+4HNO3(浓)===CO2↑+4NO2↑+2H2O
当硝酸与金属或非金属(如碳、硫等)及 某些有机物反应时,反应物反应条件不 同,硝酸被还原得到的产物也不同.硝酸 中的+5价的氮得电子,被还原成较低得 氮的化合物。如: +4+3+2+10-3 NO2HNO2NON2ON2NH3
保存:
密封于棕色瓶中,并放在阴暗处!
2019/11/17
7
二、硫酸和硝酸的氧化性
浓硝酸与铜的反应:
现象:1、产生红棕色气体;2、溶液由无色变为
绿色;3、铜在不断的溶解。
固+液→气
浓HNO3
2019/11/17
NaOH溶液
8
二、硫酸和硝酸的氧化性
3、硝酸具有强氧化性:
还C原u+剂4H氧N化O3剂(浓)=Cu(NO3)2+2NO2↑+2H2O
空白演示
在此输入您的封面副标题
新课标人教版高中化学课件系列
必修化学1 第四章非金属及其化合物 第四节氨硝酸硫酸 第3课时
2019/11/17
2
二、硫酸和硝酸的氧化性
二、硝酸
(一)硝酸的物理性质:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
武威第六中学课堂教学设计编写时间:2018年月日第二学期总第23课时编写人:马雪成课型新课授课班级高一13/14/16 授课时间2018年4月2日课题氨硫酸硝酸------硝酸教学目标1、了解硝酸物理性质,利用实验使学生掌握硝酸的化学性质(酸性、不稳定性、强氧化性)2、复习氧化还原反应的概念,深入理解物质的氧化性、还原性。
3、培养学生的动手、动脑和运用知识的能力4、认识硝酸在生产中的应用5、在浓硝酸与稀硝酸的对比学习中,渗透“量变质变”规律和尊重客观实际、力求实事求是原则的教育。
通过微型实验培养学生节约意识和环保意识。
教学重点硝酸的化学性质(不稳定性、强氧化性)教学难点硝酸的强氧化性,对氧化还原反应内容的深化。
教学方法教学过程设计各环节教后反思[引]盐酸、硝酸、硫酸是中学化学常见的三大强酸,它们除了都具有酸的通性外,又都有各自的特殊性质,我们这节课就来学习HNO3的性质。
[板书]第四章第一节氨硫酸硝酸(三)------硝酸三、硝酸( nitric acid )(一) 硝酸的物理性质[展示]HNO3样品,[讲]纯HNO3是无色、易挥发、有刺激性气味的液体,能跟H2O以任意比互溶,是一元强酸。
请同学们阅读教材,结合你所看到的,总结一下硝酸的物理性质。
[板书]1、纯硝酸是无色、有刺激性气味的液体, 密度比水大,能以任意比溶解于水。
2、低沸点(83℃),易挥发。
3、质量分数为69%的硝酸为浓硝酸。
4、质量分数为98%以上的硝酸为发烟硝酸。
[讲]硝酸是三大无机强酸之一,具有酸的通性,[板书](二) 硝酸的化学性质1、硝酸具有酸的通性HNO3= H++ NO3―[投影视频]浓硝酸、稀硝酸酸与石蕊溶液的反应[讲]酸能使指示剂变色,但浓硝酸具有强氧化性,能将有色物质结构破坏, [板书](1)使指示剂变色A 、稀硝酸中加入紫色石蕊试液:变红B 、浓硝酸中加入紫色石蕊试液:先变红后褪色(微热)[思考与交流]氯水、过氧化钠加入紫色石蕊试液中现象氯水加入紫色石蕊试液中现象:先变红后褪色过氧化钠加入紫色石蕊试液中现象:先变蓝后褪色[思考与交流]将浓盐酸、浓硫酸、浓硝酸分别滴在三块蓝色石蕊试纸上,会出现什么现象?为什么?浓盐酸------只变红------有酸性浓硫酸------变黑------脱水性浓硝酸------先变红后变白------有酸性和强氧化性[投影视频]硝酸通性的实验[板书](2)与碱反应:HNO 3 +NaOH=NaNO 3 +H 2O(3)与碱性氧化物反应:2HNO 3 +CuO==C u (N O 3)2 +H 2O(4)与某些盐反应:2HNO 3 +CaCO 3 ==C a (N O 3)2+H 2O +CO 2↑[思考与交流]为什么硝酸保存在棕色试剂瓶中?前面我们遇到什么物质也保存在棕色试剂瓶中?能否根据其保存预测硝酸有什么样的性质?我们学过的氯水以及常见的AgNO 3、AgCl 等均用棕色试剂瓶保存,它们的共同特点是见光易分解,因此,我们可推测HNO 3具有不稳定性。
[板书]2. 硝酸的不稳定性[讲]HNO 3在见光和受热时均易分解,而且越浓越易分解,我们看到装在无色试剂瓶中的浓硝酸变黄色就是因为HNO 3分解产生的NO 2又溶于HNO 3中的缘故。
[板书]4HNO 3 4NO 2↑+O 2↑+2H 2O [讲]硝酸越浓越易分解,因此硝酸要放在棕色试剂瓶中避光、低温保存。
[思考与交流]硝酸显黄色,是因其溶有NO 2,那么工业上制的盐酸也显黄色,这又是什么原因呢?有Fe 3+[讲]我们上节刚学习了浓硫酸,除了有酸性和脱水性外,也具有强氧化性,不仅常温下可使Fe 、Al 钝化,加热时和Cu 等不活泼金属反应,和非金属反应和H 2S 等还原性化合物反应。
同样,浓硝酸在常温下也可使Fe 、Al 钝化,因此也可用铁或铝容器盛放或运输浓HNO 3。
[板书]3、强氧化性(1) 与金属反应[问]HNO 3能不能和Cu 发生反应呢?浓、稀HNO 3有什么不同,需要什么条件呢?下面让我们来做一个实验[投影视频]浓、稀硝酸与金属Cu 的反应光照或△[投影]实验观察计划:1、溶液颜色的变化。
2、是否有气体生成,如有,观察颜色。
3、向生成的无色气体中通入空气,气体颜色是否变化。
[投影小结]实验现象:浓硝酸和Cu 反应剧烈,生成红棕色气体,溶液变成蓝色。
而稀硝酸和Cu 反应较慢,需加热加快反应速率,生成无色气体,当松开气球后,瓶口处变红棕色,溶液变成蓝色。
[讲]通过刚才的实验,我们可以看出,浓、稀硝酸在常温下与Cu 反应,这说明HNO 3与H 2SO 4一样具有强氧化性。
[板书]Cu + 4HNO 3 (浓) == C u (N O 3)2 +2NO 2 ↑+2H 2O3Cu +8HNO 3(稀) == 3C u (N O 3)2 +2NO ↑+4H 2O[学生活动]用双线桥标出电子转移,并指出氧化剂和还原剂,氧化产物和还原产物[思考与交流]在上述反应中,浓硝酸与铜反应N 原子只得到1个电子,而稀硝酸与铜反应N 原子得到3个电子,能否由此说明稀硝酸氧化性比浓硝酸强?为什么?不能说明。
1.浓硝酸和铜反应比稀硝酸剧烈;2.氧化性强弱取决于得电子的难易而不是多少[讲]硝酸具有强的氧化性,几乎可以使所有金属(金、铂 除外)氧化而生成硝酸盐。
[板书]HNO 3与金属反应规律小结:○⑴ 常温下,浓硝酸使铁、铝等金属钝化 ○⑵ 硝酸与金属反应不放出氢气○⑶ 氧化性:浓硝酸 > 稀硝酸(均比浓硫酸强) ○⑷ 一般情况下:浓硝酸被还原为NO 2 ,稀硝酸被还原为NO [讲]位于金属活动顺序表氢以后的金属(Cu 、Ag 、Hg)符合最后一条规律,但对于一些较活泼的金属,如Mg 、Zn 等金属跟不同浓度的HNO 3反应,可将HNO 3还原为N 2O ,甚至于NH 3。
[投影]4Zn +10HNO 3 == 4Z n (N O 3)2 + N 2O ↑+5H 2O4Zn+10HNO 3 == 4Z n (N O 3)2 + NH 4NO 3 +3H 2O[点击试题]实请写出银与硝酸(浓、稀)、(足量和不足量)铁与稀硝酸的反应化学方程式。
银与浓HNO 3:Ag +2 HNO 3(浓) == AgNO 3 + NO 2 ↑+H 2O银与稀HNO 3:Ag + 4HNO 3(稀) == 3AgNO 3 +NO ↑+2H 2O少量铁粉与稀HNO 3:Fe + 4HNO 3(稀) == F e (N O 3)3 + NO ↑+2H 2O过量铁粉与浓HNO 3:3Fe + 8HNO 3(稀) == 3F e (N O 3)2 + 2NO ↑+4H 2O [讲]HNO 3不仅可以氧化金属,还可以氧化非金属,它可以和C 、P 、S 等多种非金属及某些还原性物质发生氧化还原反应。
[板书](2) 与非金属单质反应:[投影视频]浓硝酸与C 、S 、P 反应[板书]C + 4HNO 3 (浓) 2H 2O +4NO 2 ↑+CO 2 ↑[点击试题]请同学们写出S 、P 与热的浓HNO 3 反应的化学方程式S+6HNO 3(浓) H 2SO 4 +6NO 2 ↑+2H 2OP+ 5HNO 3(浓) H 3PO 4 +5NO 2 ↑+H 2O [讲]浓HNO 3与非金属反应时,还原产物一般是NO 2,而非金属一般被氧化成最高价氧化物,同时浓、稀HNO 3都可将含I ―、S 2―、Br ―、SO 32―、Fe 2+等还原性物质发生氧化还原反应[板书](3) 与还原性化合物的反应6HI+2HNO 3 (稀) == 3I 2 +2NO ↑+4H 2O2Na 2SO 3 +2HNO 3(稀) == 2Na 2SO 4+ 2NO ↑+H 2O[讲]HNO 3遇到指示剂使之氧化褪色,遇到金属放出的气体也不是H 2,HNO 3都表现的强氧化性,在表现HNO 3的酸性时,HNO 3能与碱反应生成盐和水、与碱性氧化物反应生成盐和水、与盐反应生成另一种盐和酸,但是若与到变价金属或低价金属的化合物都可氧化到最高价态。
[讲]Au 和Pt 不能被浓H 2SO 4溶解,也不能被浓HNO 3溶解,那么有没有溶解Au 和Pt 的溶液呢?[板书]4、王水:浓硝酸和浓盐酸以体积之比为1:3混合而成[投影拓展]Au 、Pt 能溶于王水Au + HNO 3 + 4HCl == H[AuCl 4]+NO ↑+2H 2O3Pt + 4HNO 3 + 18HCl == 3H 2[PtCl 4] +4NO ↑+ 8H 2O[讲]HNO 3是重要的化工原料,在工农业生产有重要的用途,下面阅读材料,了解HNO 3的用途。
[板书](三) 硝酸的用途:用于制炸药、染料、塑料、硝酸盐[知识拓展]硝酸的制法1、实验室制法:NaNO 3+H 2SO 4(浓)NaHSO 4+HNO 3 ↑原理:难挥发性酸(高沸点)制易挥发性酸装置:曲颈甑(HNO 3对橡胶有腐蚀性,不能用胶管)2、工业上制HNO 3 :4NH 3+5O 2 4NO+6H 2O 2NO+O 2 == 2NO 23NO 2+H 2O == 2HNO 3+NO[资料卡片]火药 gun-power我国隋末唐初有个医学家孙思邈,在他所著的《丹经内伏硫磺法》一书中,写了使硫磺伏火的方法:取用硝石、硫磺各二两研细,再加上三个炭化皂角子,这样△△△△催化剂 △就能烧起焰火。
这大概就是我国最早配制火药的方子了。
许多事实都证明,在唐朝(公元618—907年),我们的祖先已发明火药了。
[过]硝酸盐最初被用来做黑火药,下面让我们来了解一下硝酸盐的性质。
