沉积物氮测定方法

实验所用玻璃器皿需用10%盐酸浸洗,再用去离子水冲洗。
TN
总氮(TN)的测定:准确称取0.1000 g 沉积物于50 mL 比色管中,加入25 mLK 2S 2O 8 和NaOH 混合氧化剂溶液(含K 2S 2O 8 和NaOH 各0.15 mo1),在0.15~0.16 MPa 压力下保持120~124 o C 1 h ,自然冷却后分取上清液,测定氮。
1ml 原液加到25ml 比色管中定容10ml c=1mg/L 稀释25倍 一、方法的适用范围
方法检测下限为0.05mg/L;测定上限为4mg/L 。 二、试剂
1)碱性过硫峻钾溶液:称取40g 过硫酸钾K 2S 2O 8,15g 氢氧化钠,过硫酸钾在不超过60°的水浴中加热溶解。碱性过硫酸钾溶液的配制中,应该将过硫酸钾试剂和氢氧化钠试剂分别溶解后再混合配制。溶于无氨水中,稀释下1000ml 。溶液存放在聚乙烯瓶内,可贮存一周。 2)(1+9)盐酸。 三、测量步骤
(1ml 原液加到25ml 比色管中定容,)1 mg/L 3)硝酸钾标准溶液:
①标准贮备液:称取0.7218g 经105一110℃烘干4h 的优级纯硝酸钾(KNO 3)溶于无氨水中,,移至1000ml 容量瓶,定容。此溶液每毫升含100ug 硝酸盐氮。加入2m1三氯甲烷为保护剂,至少可稳定6个月。
②硝酸钾标准使用液:将贮备液用无氨水稀释10倍而得。此溶液每毫升含
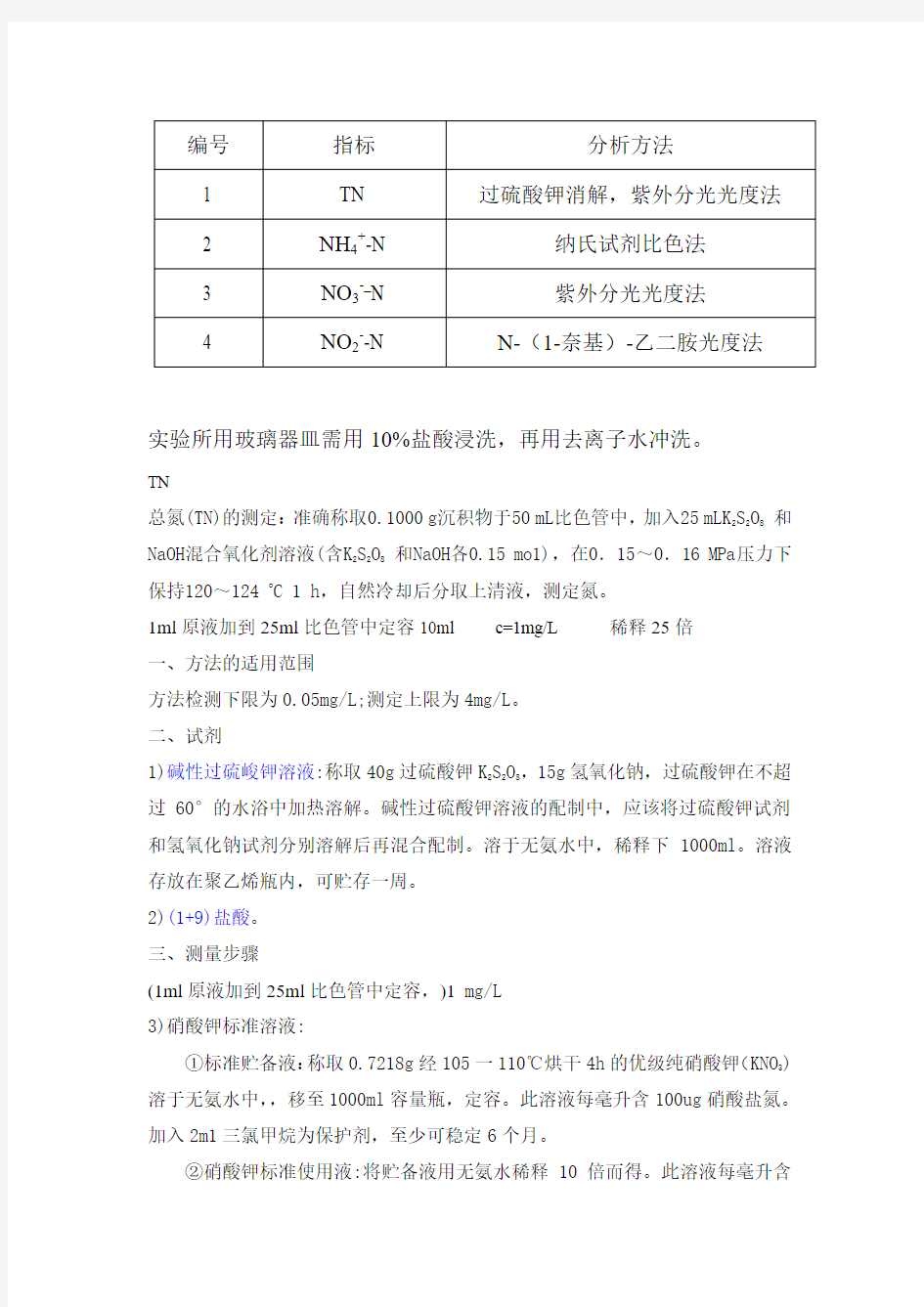
编号 指标 分析方法
1 TN 过硫酸钾消解,紫外分光光度法
2 NH 4+-N 纳氏试剂比色法
3 NO 3-_N 紫外分光光度法
4 NO 2--N
N-(1-奈基)-乙二胺光度法
10ug硝酸盐氮。即10mg/L
4)校准曲线的绘制
①分别吸取0,0,0.5,1,2,3,5,7,8ml硝酸钾标准使用溶液于25ml比色管中,用无氨水稀释至10ml标线。0.2 0.4 0.8 1.2 2 2.8 3.2mg/L
②加入5m1碱性过硫酸钾溶液,塞紧磨口塞,用纱布及纱绳裹紧管塞,以防迸溅出;
③将比色管置于压力蒸汽消毒器,,加热O.5h,放气使压力指针回零。然后升温至120-- 124℃开始计时(或将比色管置于民用压力锅中,加热至顶压阀吹气开始计时),使比色管在过热水蒸气中加热0.5h。
④白然冷却,开阀放气,移去外盖,取出比色管并冷至室温。
⑤加入(1+9)盐酸1m1,用无氨水稀释至25m1标线。
⑥在紫外分光光度计上,以无氨水作参比,用lOmm石英比色皿分别在220nm
及275nm波长处测定吸光度。按A=A
220-2A
275
计算吸光度值,用校正的吸光度绘制
出总氮含量与吸光度的校准曲线。
TDN(溶解性总氮)
过0.45um 滤膜,测定方法同TN。
NO3--N
过滤膜,不加过硫酸钾,不消解,测定方法同TN。
NH3-N1ml
原液加到50ml比色管中定容50倍或500倍。波长在410—425nm范围。本法最低检出浓度为。0.025mg/L(光度法),测定上限为2mg/L。
一、试剂
1)纳氏试剂:
①称取16g氢氧化钠,溶于50ml水中,充分冷却至室温。
②另称取7g碘化钾和10g碘化汞( HgI2)溶于水,然后将此溶液在搅拌下徐徐注入氢氧化钠溶液巾,用水稀释至100ml贮于聚乙烯瓶中,密塞保存。
2)酒石酸钾钠溶液:称取50g酒石酸钾钠溶于100ml水中,加热煮沸以除去氦,放冷,定齐至100ml。
3)铵标准储备溶液:称取3.819g经100℃干燥过的优级纯氯化铵(NH4CI)溶于
水中,移入1000m1容量瓶中,稀释至标线。此溶液每毫升含lmg氨氮。
4)铵标准使用溶液:移取5ml铵标准贮备液于500ml容量瓶中,用水稀释至标线。此溶液份毫升含0.01mg氨氮。(10mg/L)
二、标准曲线的绘制
①吸取0 0 0.5 1 3 5 7 10ml标准使用液于50ml比色管中,加水至标线,加1.0m1酒石酸钾钠溶液,混匀。加1.5m1纳氏试剂,混匀。放置10min 后,在波长420nm处,用光程20mm比色皿,以水为参比,测量吸光度。
②由测得的吸光度,减去零浓度T白的吸光度后,得到校正吸光度,绘制以氨氮含量对校正吸光度的校准曲线。得到NH3-N值分别为0mg/L,0mg/L,0.1mg/L,0.2mg/L,0.6mg/L,1mg/L,1.4mg/L,2mg/L。
NO2—N
一.方法的适用范围
方法最低检测限为0.003mg/L,测定上限为0.20mg/L亚硝酸盐氮。
二.试剂
1)无亚硝酸盐的水
2)磷酸密度为1.70mg/L
3)显色剂:于500mL烧杯内,加入250mL水和50mL磷酸,加入20.0对氨基磺
酰胺,再将1.00gN-(1-奈基)-乙二胺二盐酸盐(C
10H
7
NHC
2
H
4
NH
2
2HCl)溶于上述
溶液中,转移至500mL容量瓶中,用水稀释至标线,混匀。贮存于棕色瓶中,保存在2-5。C,至少可以稳定一个月。
4)亚硝酸盐氮标准贮备液:称取1.232g亚硝酸钠(NaNO
2
)溶于150mL水中,转移至1000mL容量瓶中,用水稀释至标线。每毫升含约0.25mg亚硝酸盐氮。贮存于棕色瓶中,加入1mL三氯甲烷,保存在2-5。C,至少可稳定一个月。
5)亚硝酸盐氮标准中间液:分取50.00mL亚硝酸盐氮标准贮备液(使含12.5mg 亚硝酸盐氮),置于250mL容量瓶中,用水稀释至标线。溶液每毫升含50.0ug 亚硝酸盐氮。贮存于棕色瓶中,保存在2-5。C,可稳定一个周。
6)亚硝酸盐氮标准使用液:取10.00mL亚硝酸盐标准中间液,置于500mL容量瓶中用水稀释至标线。溶液每毫升含1.00ug亚硝酸盐氮。
三.测定步骤
1.标准曲线的绘制
分别吸取0、0、1.00、3.00、5.00、7.00 和10.0mL亚硝酸盐氮标准使用液于50mL比色管中,用水稀释至标线。加入1.0mL显色剂,密塞,混匀。静置20min后,在2h以内,于波长540nm处,用光程长10nm的比色皿,以水为参比,测定吸光度。
从测得的吸光度,减去零浓度空白管的吸光度后,获得校正吸光度,绘制以氮含量(ug)对校正吸光度的标准曲线。
2.水样的测定
分取经预处理的水样于50mL比色管中(如含量较高,则分取适量,用水稀释至标线),加1.0mL显色剂,然后按标准曲线绘制的相同的步骤操作,测定吸光度。经空白校正后,从标准曲线上查得亚硝酸盐氮量。
3.空白试验
用纯水代替水样,按相同步骤进行测定。
实验试剂:1.0mol/L KCl,HAc一NaAc 溶液(pH=5),0.lmol/L Na0H,H
2O
2
,碱性
过硫酸钾氧化剂(NaOH 0.24mol/L,K
2S
2
O
8
20 g/L),(1+9)盐酸,碘化钾,碘化钾,
酒石酸钾钠溶液,硝酸钾标准溶液,亚硝酸盐氮标准溶液,铵标准溶液
亚硝酸盐氮测定方法
亚硝酸盐氮测定方法 关键词:生活饮用水,亚硝酸盐氮,测定 水中亚硝酸盐氮含量的多少是了解水污染程度的重要指标,况且亚硝酸盐氮被公认为是潜在的致癌物质,人体摄入过高可使血液中的变性蛋白增加。在《国家标准生活饮用水卫生规范》中亚硝酸盐氮被列为常规检测项目。因此,在日常水质亚硝酸盐氮的检测中,其检测结果的准确性、及时性显得尤为重要。 水中亚硝酸盐氮的测定方法国标采用重氮偶合分光光度法,不仅需要消耗大量的标准溶液、标准样品和试剂,而且极为费时,特别是当测定的水样较多时,采样后如不及时测定,检测人员难以及时判断水质污染程度及水体净化情况。通过查阅大量相关资料,对国标法进行适当改进。本文通过分光光度法和比色法测定水中亚硝酸盐氮,经过一年多的实验及大量检测数据证实:比色法测定水中亚硝酸盐氮具有仪器便宜、操作方便、成本低、检测时间短。精密度、准确度在误差允许范围之内。在紧急情况和平常可以代替分光光度法测定水中亚硝酸盐氮。 一、分光光度法 测定原理 在pH1.7以下,水中亚硝酸盐与氮基苯磺酰胺重氮化,再与盐酸N-(1萘)-乙二胺产生偶合反应。生成紫红色的偶氮染料。 1、方法依据 《生活饮用水标准检验方法》GB/T5750-2006 2、测定范围 本法用重氮偶合分光光度法测定生活饮用水及其水源水中的亚硝酸盐氮。 本法适用于测定生活饮用水及其水源水中亚硝酸盐氮的含量。 水中三氯胺产生红色干扰。铁,铅等离子可能产生沉淀,引起干扰。铜离子起催化作用,可分解重氮盐使结果偏低,有色离子干扰,也不应存在。 3、试剂 (1)氢氧化铝悬浮液 称取125g硫酸铝钾[KAl(SO4)2.12H2O]或硫酸铝铵[NH4Al(SO4)2.12H2O]溶于1000mL纯水中。加热至60oc,缓缓加入55mL氨水(ρ20=0.88g/mL)。使氢氧化铝沉淀完全。充分搅拌后静置,弃取上清液。用纯水反复洗涤沉淀,至倾出上清液中不含氯离子(用硝酸银溶液试验)。然后加入300mL纯水成悬浮液,适应前振摇均匀。 (2)对氨基苯磺酰胺溶液:(10g/L) (3)盐酸N-(1萘)-乙二胺溶液(1.09g/L) (4)亚硝酸盐氮标准储备液[ρ(NO2-_N)=50μg/mL]: 称取0.2463g在玻璃干燥器内放置24h的亚硝酸钠(NaNO2),溶于纯水中,并定容至1000mL。每升加2mL氯仿保存(本试剂剧毒)。 (5)亚硝酸盐氮标准使用液[ρ(NO2-_N)=0.1μg/mL]: 取10.00mL标准储备液于容量瓶中,用纯水定容至500mL。再从中吸取10mL,用纯水于容量瓶中定容至100mL。 (6)仪器
04水质 总氮的测定 碱性过硫酸钾消解分光光度法
水质总氮检测标准操作规程 碱性过硫酸钾消解紫外分光光度法 一、目的 规范水中总氮的碱性过硫酸钾消解紫外分光光度法标准操作规程。 二、适用范围 1、适用于地表水、地下水、工业废水和生活污水中总氮的测定。 2、当样品量为10ml时,本方法的检出限为0.05mg∕L,测定范围为 0.20-7.00mg∕L。 三、责任者 实验室检验人员及负责人。 四、正文 1、术语和定义 总氮:指在规定的条件下,能测定的样品中溶解态氮及悬浮物中氮的总和,包括亚硝酸盐氮、硝酸盐氮、无机铵盐、溶解态氨及大部分有机含氮化合物中的氮。 2、方法原理 在120~124℃下,碱性过硫酸钾溶液使样品中含氮化合物的氮转化为硝酸盐,采用紫外分光光度法于波长220nm和275nm处,分别测定吸光度A220和A275,按公式(1)计算校正吸光度A,总氮(以N 计)含量与校正吸光度 A 成正比。 A=A220-2 A275 (1) 3、仪器 分析天平、紫外分光光度计、高压蒸汽灭菌器、25ml具塞磨口玻璃比色管、
10mm石英比色皿、实验室常用玻璃仪器等。 4、试剂 4.1、浓盐酸:ρ=1.19g/ml。 4.2、浓硫酸:ρ=1.84g/ml。 4.3、盐酸溶液:(1+9)。 将100ml浓盐酸沿烧杯壁慢慢加入到900ml蒸馏水中,搅拌均匀,冷却备用。 4.4、硫酸溶液:(1+35)。 将10ml浓硫酸沿烧杯壁慢慢加入到350ml蒸馏水中,搅拌均匀,冷却备用。 4.5、氢氧化钠溶液:ρ=200g/L 称取20.0g氢氧化钠溶于少量水中,稀释至100ml。 注:氢氧化钠含氮量应小于0.0005%。 4.6、氢氧化钠溶液:ρ=20g/L 量取ρ=200g/L氢氧化钠溶液10.0ml,用水稀释至100ml。 4.7、碱性过硫酸钾溶液 称取40.0g过硫酸钾溶于600ml水中(可置于50℃水浴中加热至全部溶解);另称取15.0g氢氧化钠溶于300ml水中。待氢氧化钠溶液冷却至室温后,混合两种溶液定容至1000ml,存放于聚乙烯瓶中,可保存一周。 注:氢氧化钠和过硫酸钾含氮量应小于0.0005%。 4.8、硝酸钾标准贮备液:ρ(N)=100mg/L 取硝酸钾(基准试剂或优级纯)在105~110℃下烘干2h,在干燥器中冷却至室温。称取0.7218g硝酸钾溶于适量(约100-200ml)水中,移至1000ml容量瓶中定容,混匀。加入1-2ml三氯甲烷作为保护剂,在0-10℃暗处保存,可稳定6个月。 4.9、硝酸钾标准使用液:ρ(N)=10.0mg/L 量取10.00ml硝酸钾标准贮备液至100ml容量瓶中,用水稀释至标线,混匀,临用现配。 4.10、5%盐酸羟胺溶液 称取5.0g盐酸羟胺溶于少量水中,加水稀释至100ml。
★海水和海洋沉积物中总N的测定
海水和海洋沉积物中总N 的测定 Ξ 王正方 扈传昱 吕海燕 (国家海洋局第二海洋研究所,杭州,310012) 摘 要 系统介绍海水和海洋沉积物中总氮的测定方法。作者选用过硫酸钾为氧化剂将有关形式的氮转化成硝酸盐,将其还原成亚硝酸盐,连同原有的亚硝酸盐一起测定,获得海水和海洋沉积物中总氮。该方法操作简单安全,精密度为4.7%,回收率为95%~104%,适于船上操作。关键词 海水;海洋沉积物;总氮;分析方法中图法分类号 P734 海水中最重要的无机氮有氨氮,亚硝酸盐氮和硝酸盐氮。除无机氮外还有多种溶解的和 颗粒态的有机氮化物。通过对氮化物含量的测定可以了解水域被污染状况[2],肥源情况以及有机物的分解趋势。以前的研究均以无机氮的测定见多[1,3,4],而对于海水和海洋沉积物中总氮测定的研究却不是十分系统。本文详细介绍了海水和沉积物中总氮的测定方法,此法操作简单安全,精密度高,适于船上操作。已作为第二次全国海洋污染基线调查的推荐方法。 1 材料与方法 1.1仪器 (1)反应瓶:50m L 有聚丙烯或聚四氟乙烯螺旋盖的玻璃瓶 (2)普通厨用压力锅(3)50m L 容量瓶若干(4)振荡器1.2试剂及配制 (1)无氨蒸馏水或纯水。 (2)NaCl 溶液:31gNaCl (优级纯)溶于1000m L 无氨蒸馏水中。 (3)0.12m ol/L NaOH 溶液:4.8g 分析纯NaOH 溶于1L 无氨蒸馏水中,煮沸10min 后冷却稀 释至原体积。 (4)K 2S 2O 8氧化剂:称取10g 重结晶的K 2S 2O 8溶于1L0.12m ol/L 的NaOH 溶液中,保存于具塞棕色试剂瓶中。置于冰箱可至少稳定7d 。 K 2S 2O 8的提纯:在70~80℃的温度下溶解20gK 2S 2O 8于100m L 重蒸馏水中,将溶液冷却至接近零摄氏度,过滤。由于K 2S 2O 8在零度时的溶解度仅为1.75g/100m L ,因此试剂的损失很 增刊 1999年10月 青岛海洋大学学报 JOURNA L OF OCE AN UNIVERSITY OF QING DAO Supplement Oct.1999 Ξ收稿日期:1999204208;修订日期:1999207212 王正方,男,1941年出生,研究员。
空气质量氮氧化物的测定
空气质量氮氧化物的测定 GB/T 13906-92 Air quality—Determination of nitrogen oxides 本标准规定了测定火炸药生产过程中,排出的硝烟尾气中所含的一氧化氮和二氧化氮以及其他氮的氧化物的方法。 本标准分为两篇,第一篇中和滴定法,第二篇二磺酸酚分光光度法。 第一篇中和滴定法 1 主题内容与适用范围 1.1 主题内容 本标准规定了火炸药工业硝烟尾气中氮氧化物测定的中和滴定法。 1.2 适用范围 1.2.1 本标准适用于火炸药工业硝烟尾气中氮氧化物的测定。
1.2.2 本标准测定范围为1000~20000mg/m3。 1.2.3 本标准规定的方法受其他酸碱性气体(如:二氧化硫、氨等)的干扰。 2 原理 氮氧化物被过氧化氢溶液吸收后,生成硝酸,用氢氧化钠标准溶液滴定,根据其消耗量求得氮氧化物浓度。 3 试剂和材料 在测定过程中,除另有说明外均使用符合国家标准的分析纯试剂和蒸馏水或同等纯度的水。 3.1 过氧化氢:30%。 3.2 过氧化氢:3%。取过氧化氢(3.1)100mL,用水稀释至1000mL。 3.3 氢氧化钠标准溶液:c(NaOH)=0.0100mol/L。
3.4 甲基红-次甲基蓝混合指示液:称取0.10g甲基红和0.10g次甲基蓝,溶解在100mL95%乙醇溶液中,装入棕色瓶中,于暗处保存,此溶液有效期为一周。 3.5 氟橡管或厚壁胶管:φ5~8mm。 3.6 采样瓶布套。 4 仪器和设备 实验室常用仪器及下列专用仪器: 4.1 真空采样瓶:容积为2000mL左右,形状如图1。 图1 真空采样瓶 4.2 加热采样管:形状如图2。
废水中总氮的测定
过硫酸钾氧化紫外分光光度法测废水中总氮 1 方法原理 在60℃以上的溶液中,过硫酸钾按如下反应式分解,生成氢离子和氧。 K2S2O8+H2O---2KHSO4+1/2O2 KHSO4---K++HSO4- HSO4----H++SO42- 加入氢氧化钠中和掉氢离子,使过硫酸钾完全分解。 在120-140℃的碱性介质条件下,用过硫酸钾做氧化剂。不仅可以将水样中的氨氮和亚硝酸盐氧化为硝酸盐,同时将水样中大部分有机氮也氧化为硝酸盐。硝酸根离子对220nm波长光有特征吸收,用标准溶液定量。 溶解性的有机物在220nm处也有吸收,故根据实践,引入一个经验校正值。该校正值是在275nm处测得吸光度的2倍2A275。在220nm 处的吸光值减去经验校正值即为硝酸盐离子的净吸光值(A=A220-2A275)。 2 干扰及消除 (1)水样中有六价铬及三价铬时,加入5%盐酸羟胺溶液1-2ml消除。(2)碳酸盐和碳酸氢盐对测定的影响,在加入一定盐酸后可消除。 3 方法的测定范围 适用于地面水,测定范围为0.05-4mg/l。 4 仪器 (1)紫外分光光度计 (2)压力锅,压力1.1-1.3kg/cm2,相应的温度为120-124℃ (3)25ml具塞比色管。每组3个,2各组作曲线16只,共38个。(4)移液管、容量瓶等玻璃仪器。 5 试剂
1)无氨水:用新制备的去离子水。或每升水中加入0.1ml浓硫酸,蒸馏。 2)20%的氢氧化钠:称取20g氢氧化钠,于无氨水中至100ml。(调pH) 3)碱性过硫酸钾溶液:称取40g过硫酸钾(K2S2O8),15g氢氧化钠,溶于无氨水中,至1000ml。存于塑料瓶中,可存一周。 4)1+9盐酸。 5)硝酸钾标准溶液: (1)储备液:称取0.7218g经105-110℃烘干4小时的优级纯硝酸钾(KNO3)溶于无氨水中,移至1000ml容量瓶定容。此溶液为100ug/ml 硝酸盐氮。加入2ml三氯甲烷为保护剂,稳定6个月。 (2)使用液:将储备液稀释10倍。取10ml稀释至100ml,含硝酸盐氮10ug/ml 6 步骤 6.1 校准曲线绘制(2个组) (1)分别吸取0、0.5、1.00、2.00、3.00、5.00、7.00、8.00ml硝酸钾标准使用液于25ml比色管中,用无氨水稀释至10ml标线。 (2)加入5ml碱性过硫酸钾溶液,塞紧磨口塞,用纱布和纱绳裹紧管塞,以防溅出。 (3)将比色管置于压力锅中,升温至120-124℃(或顶压阀放气时)开始计时,加热0.5h。 (4)自然冷却,开阀放气,移去外盖,取出比色管冷至室温。(5)加入(1+9)盐酸1ml,用无氨水稀释至25ml标线。 (6)在紫外分光光度计上,以无氨水作参比,用10mm比色皿分别在220nm和275nm波长处测定吸光度,用校正的吸光度(A=A220-2 A275)绘校准曲线。 6.2 样品测定
水质指标测定方法 简单版
水中总氮的测定(过硫酸钾氧化紫外分光光度法) (一)主要试剂: 碱性过硫酸钾溶液:称取4g过硫酸钾(K2S208)和1.5g氢氧化钠,溶于无氨水中,稀释至100mL。 1mol/L的HCL :取8.33 mL的浓盐酸稀释至100 mL。 (二)测定步骤: 水样加5mL碱性过硫酸钾溶液,包扎高温消解30min。于消解完全的试样中加入1mL 1mol/L的HCL,加水至刻度,充分混匀后,分别于220nm和275nm波长处测定吸光值,吸光度计算:A=A220nm-2A275nm。 水中总磷的测定(过硫酸钾氧化-钼锑抗比色法) (一)主要试剂: 6.5mol/L钼锑储备液:取180.6ml分析纯浓硫酸,缓缓加入到400ml蒸馏水中,不断搅拌,冷却。加入20g钼酸铵和0.5g酒石酸锑钾,搅拌,待溶液冷却后定容至1000ml。 钼锑抗混合显色剂:取100ml钼锑贮存液,加入1.5g抗坏血酸,此试剂宜现配现用。 5%的过硫酸钾溶液:5g过硫酸钾溶解于水,定容至100ml。 二硝基酚指示剂:称取0.2克2,6-二硝基酚溶于100ml水中。 (二)测定步骤: 水样加4ml 5%的过硫酸钾溶液,包扎高温消解30min。 测定:经消解后的样品加入2,6-二硝基酚指示剂2滴,用氢氧化钠和盐酸调节至微黄色。再加入2.5 ml 6.5mol/L钼锑抗显色剂,定容摇匀,放置30min后,在700nm波长处测量吸光度。 水中氨氮的测定(苯酚-次氯酸钠分光光度法) (一)主要试剂: 1%EDTA溶液:溶解1g EDTA于100ml水中,用浓氢氧化钠将pH调至10。 溶液B:溶解5g苯酚和25mg亚硝酰氰化钠(亚硝酰铁氰化钠)于水中稀释至500毫升,放棕色瓶中,置于冰箱中贮存。 溶液C:溶解2.5g氢氧化钠,18.7 g磷酸氢二钠和15.9g磷酸三钠于水中,加入含有效氯4.3ml次氯酸钠,定溶至500ml,放棕色瓶中,置于冰箱中贮存。 (二)测定步骤: 于抽滤过后的水样中加1ml 1%EDTA,加入5ml B溶液,5ml C溶液,摇匀,定容,置37℃恒温水浴中发色30分钟。在625nm处测定吸光度。 水中硝态氮的测定(紫外分光光度法) 测定方法:于抽滤后的试样中加入1mL 1mol/L的HCL,加水至刻度,充分混匀后,分别于220nm和275nm波长处测定吸光值,吸光度计算:A=A220nm-2A275nm。 水质高锰酸盐指数的测定 (一)试剂配制: 0.1mol/L KMnO4储备液:3.2g高锰酸钾溶解定容至1L。 0.1mol/L的草酸钠储备液: 称取0.6705g经120℃烘干2h并放冷的草酸钠溶解并定
水中总氮的测定(标准操作规程作业指导书)
1.适用范围 本测定规程规定了碱性过硫酸钾消解紫外分光光度法测定水中的总氮。 当样品量为10ml时,本方法的检出限为0.05mg/L,测定范围为0.20~7.00mg/L。2.测定原理 在120-124℃下,碱性过硫酸钾溶液使样品中含氮化合物的氮转化为硝酸盐,采用紫外分光光度法于波长220nm和275nm处,分别测定吸光度A220和A275,按下面公示计算校正吸光度A,总氮(以N计)含量与校正吸光度A成正比。 A=A220-2A275 3.仪器设备 3.1 紫外分光光度计:配有10mm石英比色皿。 3.2高压蒸汽灭菌器:最高工作压力不低于1.1~1.4kg/cm2,;最高工作温度不低 于120~124℃。 3.3玻璃具塞比色管:25ml。 3.4 分析天平:精度0.01g。 3.5一般实验室常用仪器和设备。 4.试剂 除另有说明,分析时均使用符合国家标准的的分析纯试剂,试验用水为蒸馏水。 4.1 蒸馏水。 4.2 碱性过硫酸钾溶液:称取10.0g过硫酸钾(进口试剂)溶于150ml水中(可置于50℃水浴中加热至全部溶解);另称取3.75g氢氧化钠溶于75m水中。待氢氧化钠溶液温度冷却至室温后,混合两种溶液定容至250ml,存放于聚乙烯瓶中。可保存一周。 4.3 (1+9)盐酸溶液:取100ml浓度为1.19g/ml的盐酸于900ml蒸馏水中混匀。 4.4 (200g/L)氢氧化钠溶液:称取20.0g氢氧化钠溶于少量水中,用水稀释至100ml。 4.5 (20g/L)氢氧化钠溶液:取200g/L氢氧化钠溶液10.0 ml,用水稀释至100ml。 4.6 浓硫酸:ρ(H2SO4)=1.84g/ml
测定三氮的基本原理和方法
实验四水体自净程度的指标 前言 各种形态的氮相互转化和氮循环的平衡变化是环境化学和生态系统研究的重要内容之一。水体中氮产物的主要来源是生活污水和某些工业废水及农业面源。当水体受到含氮有机物污染时,其中的含氮化合物由于水中微生物和氧的作用,可以逐步分解氧化为无机的氨 (NH3)或铵 (NH4+)、亚硝酸盐 (NO2-)、硝酸盐 (NO3-)等简单的无机氮化物。氨和铵中的氮称为氨氮;亚硝酸盐中的氮称为亚硝酸盐氮;硝酸盐中的氮称为硝酸盐氮。通常把氨氮、亚硝酸盐氮和硝酸盐氮称为三氮。这几种形态氮的含量都可以作为水质指标,分别代表有机氮转化为无机氮的各个不同阶段。在有氧条件下,氮产物的生物氧化分解一般按氨或铵、亚硝酸盐、硝酸盐的顺序进行,硝酸盐是氧化分解的最终产物。随着含氮化合物的逐步氧化分解,水体中的细菌和其它有机污染物也逐步分解破坏,因而达到水体的净化作用。 有机氮、氨氮、亚硝酸盐氮和硝酸盐氮的相对含量,在一定程度上可以反映含氮有机物污染的时间长短,对了解水体污染历史以及分解趋势和水体自净状况等有很高的参考价值,见表6-1。目前应用较广的测定三氮方法是比色法,其中最常用的是:纳氏试剂比色法测定氨氮,盐酸萘乙二胺比色法测定亚硝酸盐氮,二磺酸酚比色法测定硝酸盐氮。 一实验目的 1.掌握测定三氮的基本原理和方法。 2.了解测定三氮对环境化学研究的作用和意义。 二仪器器材 (1) 玻璃蒸馏装置。 (2) pH 计。 (3) 恒温水浴。 (4) 分光光度计。 (5) 电炉:220V/1KW。 (6) 比色管:50 mL。 (7) 陶瓷蒸发皿:100或200 mL。 (8) 移液管:1 mL、2 mL、5 mL。容量瓶:250 mL。 三实验步骤 1. 氨氮的测定——纳氏试剂比色法 (1) 原理 氨与纳氏试剂反应可生成黄色的络合物,其色度与氨的含量成正比,可在425 nm波长下比色测定,检出限为0.02 μg/mL。如水样污染严重,需在pH为7.4的磷酸盐缓冲溶液中预蒸馏分离。 (2) 试剂 ①不含氨的蒸馏水:水样稀释及试剂配制均用无氨蒸馏水。配制方法包括蒸馏法(每升蒸馏水中加入0.1 mL浓硫酸,进行重蒸馏,流出物接受于玻璃容器
空气中氮氧化物的测定
空气中氮氧化物(NOx)的测定 (盐酸萘乙二胺分光光度法) 摘要:本文采用盐酸萘乙二胺分光光度法测定室内空气中氮氧化物(NOx),根据配置标准溶液用分光光度计测定其吸光度,绘制标准曲线,分析空气中氮氧化物的含量结果。 关键词:氮氧化物分光光度法含量 综述 大气中氮氧化物主要包括一氧化氮和二氧化氮,其中绝大部分来自于化石燃料的燃烧过程,包括汽车及一切内燃机所排放的尾气,也有一部分来自与生产和使用硝酸的化工厂、钢铁厂、金属冶炼厂等排放的废气中。动物实验证明,氮氧化物对呼吸道和呼吸器官有刺激作用,是导致目前支气管哮喘等呼吸道疾病不断增加的原因之一,二氧化氮与二氧化硫和浮游颗粒物共存时,其对人体的影响不仅比单独二氧化氮对人体的影响严重的多,而且也大于各自污染物之和。对人体的实际影响是各污染物之间的协同作用。因此大气氮氧化物的监测分析是环境保护部门日常工作的重要项目之一。 采用化学发光法测定空气中氮氧化物较以往的盐酸禁乙二胺分光光度法具有灵敏度高、反应速度快、选择性好等特点 ,现已被很多国家和世界卫生组织全球监测系统作为监测氮氧化物的标准方法 ,也已引起我国环保部门的注意和重视 ,相信不久将来 ,此方法也会成为我国环境空气监测氮氧化物的首推方法。 1、实验目的 (1)熟悉、掌握小流量大气采样器的工作原理和使用方法; (2)熟悉、掌握分光光度计的工作原理及使用方法。 (3)掌握大气监测工作中监测布点、采样、分析等环节的工作内容及方法。2、实验原理 ,测定氮大气中的氮氧化物(NOx)主要是一氧化氮(NO)和二氧化氮(NO 2) )氧化管将一氧化氮成二氧化氮。二氧化氧化物浓度时,先用三氧化铬(CrO 3 ),与对氨基苯磺酸起重氧化反应,再与盐氮被吸收在溶液中形成亚硝酸(HNO 2
北运河沉积物中主要脱氮功能微生物的群落特征
中国环境科学 2016,36(5):1520~1529 China Environmental Science 北运河沉积物中主要脱氮功能微生物的群落特征 鲍林林1,2,3,王晓燕1,4*,陈永娟1,张苓荣1 (1.首都师范大学资源环境与旅游学院,北京 100048;2.中国科学院生态环境研究中心城市与区域生态国家重点实验室,北京 100085;3.中国科学院大学,北京 100049;4.首都师范大学首都圈水环境研究中心,北京 100048) 摘要:应用分子生物学技术研究北运河沉积物中主要脱氮功能微生物,反硝化细菌和厌氧氨氧化细菌(Anammox)的群落特征,探讨了微生物群落的季节变化及其与环境因子的响应关系.结果表明,沉积物中反硝化细菌和Anammox的丰度和群落组成随季节变化差异显著.从夏季到冬季,反硝化细菌丰度逐渐增加,Anammox的丰度却逐渐降低;反硝化细菌的多样性均显著的高于Anammox的多样性,反硝化细菌是北运河沉积物中主要的脱氮微生物.从夏季到冬季,沉积物中氮和TOC含量均逐渐升高,温度是决定脱氮微生物群落特征季节变化的关键因子,TN与反硝化细菌的群落丰度显著正相关,C/N与Anammox的丰度显著正相关;反硝化细菌的群落结构主要受到硝氮和pH的影响,pH也是影响Anammox物种时空分布的主要因子.系统发育分析表明,两种脱氮微生物的主要类群均具有较高的耐污性和良好的脱氮效率,反硝化细菌主要从属于Pseudomonas和Halomonas, Anammox物种发育多样性较低,主要为浮霉菌门的Candidatus Brocadia. 关键词:北运河沉积物;反硝化细菌;厌氧氨氧化细菌;季节变化;环境因子;系统发育 中图分类号:X172 文献标识码:A 文章编号:1000-6923(2016)05-1520-10 Diversity, abundance and distribution of nirS-type denitrifiers and Anammox bacteria in sediments of Beiyun River. BAO Lin-lin1,2,3, WANG Xiao-yan1,4*, CHEN Yong-juan1, ZHANG Ling-rong1 (1.College of Resources, Environment and Tourism, Capital Normal University, Beijing 100048, China;2.State Key Laboratory of Urban and R egional Ecology, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China;3.University of Chinese Academy of Sciences, Beijing 100049, China;4.Research Center of Aquatic Environment in the Capital Region, Capital Normal University, Beijing 100048, China). China Environmental Science, 2016,36(5):1520~1529 Abstract:Denitrification and anaerobic ammonia oxidation are two main processes for nitrogen removal in nitrogen cycle. The seasonal variation of community diversity and abundance, phylogenetic composition of nirS-type denitrifiers and Anammox (anaerobic ammonia oxidation) bacteria of sediments in Beiyun River were compared based on PCR (polymerase chain reaction), T-R FLP (terminal restriction fragment length polymorphism), clone and sequencing. The abundance of nirS-type denitrifiers increased from summer to winter while the abundance of Anammox bacteria decreased significantly. What’s more, the abundance of nirS-type denitrifiers was significantly higher than Anammox in fall and winter. Community composition of the two microbial groups varied seasonally and the community diversity of nirS-type denitrifiers was much higher than Anammox bacteria. Concentrations of nitrogens and organic carbon in the sediments increased significantly from summer to winter. Environmental temperature was significantly correlated with the seasonal changes of abundance and community distribution of the two microbial groups in sediments. Correlation analysis revealed that total nitrogen had a great effect on the abundance of nirS-type denitrifiers, while C/N was significantly correlated with abundance of Anammox bacteria. NO x? and pH were also the main environmental factors determining the community distribution of nirS-type denitrifiers and Anammox bacteria in sediments. Phylogenetic analysis revealed that most of the denitrifying microbes belonged to species with relatively high pollution-resistance and efficiency of nitrogen removal. Phylogenetic diversity of nirS-type denitrifiers was much higher than that of Anammox bacteria. nirS-type denitrifiers were grouped into genera Pseudomonas and Halomonas, while Anammox was mainly bacteria belonged to Candidatus Brocadia. Key words:Beiyun River sediment;nirS-type denitrifiers;Anammox;seasonal change;environmental factors;phylogeny 收稿日期:2015-10-08 基金项目:国家自然科学基金项目(41271495);国家重大水专项(2009ZX07209-001-02) * 责任作者, 教授, wangxy@https://www.360docs.net/doc/c22057056.html,
氮氧化物测定
空气中氮氧化物检测报告 一、原理 空气中的二氧化氮NO2被吸收液吸收并反应生成粉红色偶氮染料,空气中的一氧化氮NO被氧化剂氧化为NO2再进行吸收。生成的偶氮染料在波长540nm处的吸光度与溶液中NO2-的含量成正比,可以通过测定吸收瓶样品中的吸光度,计算吸收液中NO2-的含量,从而计算出空气中氮氧化物的浓度(以NO2计)。 二、试剂 吸收液 亚硝酸盐标准溶液 氧化剂 三、仪器设备 分光光度计 空气采样器 吸收瓶 氧化管 四、步骤 1、采样 取装好吸收液的多孔板吸收瓶,用硅橡胶管连接在空气采样器上,设定好采样流量和采样时间(以0.4L/min流量采气4~24L),进行采样。样品的采集、运输及存放过程中应避光。 现场空白,把装有吸收液的吸收瓶带到采样现场,与样品相同条件下保存(不采样),直至送实验室分析。 2、绘制标准曲线 配制亚硝酸盐标准液系列,加入显色液后于暗处放置20min,用10mm 比色皿,在波长540nm处以水作参比测量吸光度,对应溶液的NO2-质量浓度计算标准曲线的回归方程。
3、样品测定 采样后放置20min,用水将采样瓶中吸收液的体积补充至标线,混匀。用10mm比色皿,在波长540nm处以水作参比测量吸光度,同时测定空白样品的吸光度。 五、结果计算 1、标准曲线的回归方程 A-A0=f(c) (1) A,标准系列的吸光度 A0,空白吸收液的吸光度 c,标准系列的NO2-质量浓度(ug/ml) 2、样品溶液的NO2-质量浓度 根据(1)式计算出样品溶液的NO2-质量浓度,样品溶液的吸光度为扣除空白的吸光度 3、空气中NO x的浓度(以NO2计) ρNO2=CV/Q N f mg/m3 C,样品溶液NO2-的质量浓度(ug/ml) V,样品吸收液的体积,mL Q N,标况下的空气采样体积,L Saltzman实验系数,取0.76 六、实验结果分析 附: -标准溶液系列 实验数据记录: NO2-标准溶液系列吸光度
水质总氮的测定
水质总氮的测定 ——碱性过硫酸钾消解紫外分光光度法 1 目的 1.1 了解碱性过硫酸钾消解紫外分光光度法测定总氮的原理 1.2 掌握水样消解的方法 1.3 了解总氮的来源 1.4 掌握紫外光度计的使用 1.5 掌握工作曲线的制作方法,区别工作曲线与标准曲线。 2 测定原理 本方法适用于地面水,地下水含亚硝酸盐氮、硝酸盐氮无机铵盐、溶解态氨及在消解条件下碱性溶液中可水解的有机氮的总和。水体总氮含量是衡量水质的重要指标之一。 过硫酸钾是强氧化剂,在60℃以上水溶液中可进行如下分解产生原子态氧: K2S2O8+H2O 2KHSO4+[O]
分解出的原子态氧在120—140℃高压水蒸气条件下可将大部分有机氮华合物及氨氮、亚硝酸盐氮氧化成硝酸盐。以CO(NH2)2代表可溶有机氮合物,各形态氮氧化示意式如下:CO(NH2)2+2HaOH+8[O]→2NaNO3+3H2O+CO2 (NH4)2SO4+4NaOH+8[O] 2NaNO3+Na2SO4+6H2O NaNO2+[O] →NaNO3 硝酸根离子在紫外线波长220nm有特征性的量大吸收,而在275nm波长则基本没有吸收值。因此,可分别于220和275nm处测出吸光度。A220及A275按下式求出校正吸光度A:A= A220—2A275 (1) 按A的值扣除空白后用校准曲线计算总氮(以NO3——N计)含量。 3 试剂 3.1 无氮化合物的纯水 3.2 氢氧化钠溶液20.0g/L: 称取2.0氢氧化物(NaOH A.R),溶于纯水中,稀释至100ml。 3.3 碱性过硫酸钾溶液 称取40g过硫酸钾(K2S208 A.R),另称取15g氢氧化钠(NaOH A.R)溶于纯水中并稀释至1000ml,溶液贮存于聚乙烯瓶中最长可保存一周。 3.4 盐酸溶液(1+9) 量取1份HCl(A.R)与9份水混合均匀。 3.5 硝酸钾标准溶液(以计),100mg/L:NNO3 硝酸钾(KNO3 ,A.R)在105—110℃烘箱中烘干3h,于干燥器中冷却后,称取0.7218g 溶于纯水中,移至1000ml溶量瓶中,用纯水稀释至标线在0~10℃保存。可稳定六个月。 3.6 硝酸钾标准使用溶液(以计),10.0mg/L NNO3 用硝酸钾标准溶液(3.5)稀释10倍而得,使用时配制。 3.7 硫酸溶液(H2SO4,A.R)ρ=1.84 3.8 硫酸,(1+35) 1体积硫酸(3.7)与35体积水混合均匀。 4 仪器和设备 4.1 紫外分光光度计及10mm石英化色皿。 4.2 医用手提式蒸气灭菌器或家用压力锅(压力为1.1—1.4kg/cm2),锅内温度相当于120—140℃。 4.3 具玻璃磨口塞比色管,25ml。
凯氏氮的测定方法
凯氏氮的测定方法 (1)、原理 当样品与浓硫酸和硫酸钾的混合物(沸点315~370℃)在催化剂硫酸铜或硫酸汞存在时,一起加热,其中的有机氮和氨态氮转化为硫酸铵。然后加入NaOH溶液使之成碱性,蒸镏使氨释放出来并以硼酸吸收,然后用硫酸滴定硼酸铵。 此法测得的总氮包括了有机氮和原来即以氨态存在的氮,但不包括硝酸盐或亚硝酸盐形式存在的氮,有机氮中的某些化合物如含氮的杂环化合物、吡啶、叠氮化合物、偶氮化合物、硝基和亚硝基化合物等也未包括在内。以此法测定的总氮称之为凯氏(Kjeldagl)氮,即TKN。测定同一水样中氨态氮含量后,总凯氏氮和氨态氮的差值即为有机氮。 (2)、药品与仪器 ①、浓硫酸,密度1.84g/cm3;②、50% NaOH溶液;③、10% CuSO4溶液;④、4%硼酸溶液; ⑤、无水硫酸钾或无水硫酸钠; ⑥、0.020mol/L(1/2H2SO4标准溶液:吸取分析纯浓硫酸2.80ml,溶于1000ml蒸镏水中,得到约0.10mol/L(1/2H2SO4)溶液,用碳酸钠标定。然后从中吸取200ml,用蒸镏水稀释至1000ml 备用。⑦、混合指示剂:取0.05g甲基红和0.10g溴甲酚绿溶于100ml乙醇中; ⑧、1%酚酞的乙醇溶液;⑨、4%Na2S。9H2O溶液; ⑩、蒸镏水:将普通蒸镏水酸化后加入KMnO4进行蒸镏,并重复蒸镏一次,以使其中不含有任何铵盐或氨。本试验所用蒸镏水均应经过这样的处理; ⑩、浮石:在蒸镏水中煮沸后干燥备用;⑩、600瓦可调温电炉两台;⑩、凯氏烧瓶及凯氏蒸镏装置 (3)、操作步骤 ①消化: 准确量取一定体积(以含氮0.5~10mg为宜)的废水水样置于凯氏烧瓶,加入10ml浓硫酸、5克硫酸钾或硫酸钠、1ml硫酸铜溶液,并放入几块沸石,将凯氏烧瓶以45度的角度固定于通风橱内加热煮沸,烧瓶内将产生白烟。继续煮沸,烧瓶中颜色逐渐变黑,直至溶液完全透明无色或浅绿色。再继续煮沸20分钟。 ②蒸镏: 将凯氏烧瓶冷却,以约150ml蒸镏水冲洗烧瓶壁,加入2.5ml硫化钠溶液和3~5滴酚酞,然后缓慢沿壁加入50mlNaOH溶液尽量使其不与烧瓶内液体混合。立刻将烧瓶按图所示安装到蒸镏装置上去(事先安装好含50ml硼酸的吸收瓶),小心转动烧瓶使烧瓶内的两层液体混合并开始加热。煮沸20~30分钟或在不使用蒸气发生器时蒸发至烧瓶内液体体积减少至原体积约约1/3时,停止蒸镏。 ③滴定: 卸下吸收瓶,加入几滴混合指示剂,以0.02mol/L(1/2H2SO4)滴定至溶液变为紫色。 ④空白试验: 用同样体积蒸镏水代替废水水样,按上述步骤作空白试验。 (4)、计算 总氮=(V1-V0)* C *14000 / V (mmol/L) V1  ̄ ̄滴定样品消耗的标准硫酸溶液的体积,ml; V0  ̄ ̄滴定空白试验消耗的标准硫酸溶液的体积,ml; C  ̄ ̄硫酸标准溶液的准确浓度,mol/L; 14000 ̄ ̄每摩尔氮的质量(毫克)数; V  ̄ ̄样品水样的取样体积,ml。
海洋沉积物分析的主要方法
海洋沉积物分析的主要方法概述
地质分析测试工作是地质科学研究和地质调查工作的重要技术手段之一。其产生的数据是地质科学研究、矿产资源及地质环境评价的重要基础,是发展地质勘查事业和地质科学研究工作的重要技术支撑。现代地球科学研究领域地不断拓展对地质分析测试技术的需要日益增强,迫切要求地质分析测试技术不断地创新和发展,以适应现代地球科学研究日益增长的需求。 海洋地质样品的分析测试是海洋地质工作的重要组成部分,无论是资源勘查还是环境评价均离不开相关样品的分析测试。选择准确可靠的分析方法是保证分析测试质量的关键,也是进行质量监控的重要手段之一。 1.电子探针分析(EMPA) 电子探针(EPMA),全名为电子探针X射线显微分析仪,又名微区X射线谱分析仪可对试样进行微小区域成分分析。电子探针的大批量是利用经过加速和聚焦的极窄的电子束为探针,激发试样中某一微小区域,使其发出特征X射线,测定该X射线的波长和强度,即可对该微区的元素作定性或定量分析。 电子探针仪是X射线光谱学与电子光学技术相结合而产生的,1958年法国首先制造出商品仪器。从Castaing奠定电子探针分析技术的仪器、原理、实验和定量计算的基础以来,电子探针分析(EPMA)作为一种微束、微区分析技术在50~60年代蓬勃发展,至70年代中期已比较成熟;近年来,由于计算机、网络技术的迅猛发展,相关应用软件的开发与使用的加快,使得装备有高精度的波谱仪的新一代电子探针仪具有数字化特征、人工智能和自动化的分析程序、网络功能以及高分辨率图象的采集、分析及处理能力。 EPMA技术具有高空间分辨率(约1μm)、简便快速、精度高、分析元素范围广(4Be~92U)、不破坏样品等特点,使其很快就在地学等研究领域得到应用。电子探针分析(EPMA)主要用于矿物的主要元素分析,但也可用于熔融岩石(玻璃)样品的主要元素分析,但不用来分析微量元素。它的主要优点是具有优良的空间分辨率,可以用电子束直径为1—2um进行分析。这意味着可以分析极其小的样品面积。岩石样品的常规分析局限于天然的和合成的玻璃样品。在这种应用中,常用非聚焦的电子束,以减小玻璃非均匀性问题。硅酸盐玻璃的电子探针分析在实验岩石学中具有特殊的重要性,但是很少利用电子探针进行岩石粉末的熔融片的主要元素分析。下面简要介绍电子探针在系列矿物研究和蚀变矿物带研究中的
总氮的测定方法
总氮的测定方法 (1)、原理 当样品与浓硫酸和硫酸钾的混合物(沸点315~370℃)在催化剂硫酸铜或硫酸汞存在时,一起加热,其中的有机氮和氨态氮转化为硫酸铵。然后加入NaOH溶液使之成碱性,蒸镏使氨释放出来并以硼酸吸收,然后用硫酸滴定硼酸铵。 此法测得的总氮包括了有机氮和原来即以氨态存在的氮,但不包括硝酸盐或亚硝酸盐形式存在的氮,有机氮中的某些化合物如含氮的杂环化合物、吡啶、叠氮化合物、偶氮化合物、硝基和亚硝基化合物等也未包括在内。以此法测定的总氮称之为凯氏(Kjeldagl)氮,即TKN。测定同一水样中氨态氮含量后,总凯氏氮和氨态氮的差值即为有机氮。 ------------------------------------------------------- (2)、药品与仪器 ①、浓硫酸,密度1.84g/cm3; ②、50% NaOH溶液; ③、10% CuSO4溶液; ④、4%硼酸溶液; ⑤、无水硫酸钾或无水硫酸钠; ⑥、0.020mol/L(1/2H2SO4标准溶液:吸取分析纯浓硫酸2.80ml,溶于1000ml蒸镏水中,得到约0.10mol/L(1/2H2SO4)溶液,用碳酸钠标定。然后从中吸取200ml,用蒸镏水稀释至1000ml备用。 ⑦、混合指示剂:取0.05g甲基红和0.10g溴甲酚绿溶于100ml乙醇中; ⑧、1%酚酞的乙醇溶液; ⑨、4%Na2S。9H2O溶液; ⑩、蒸镏水:将普通蒸镏水酸化后加入KMnO4进行蒸镏,并重复蒸镏一次,以使其中不含有任何铵盐或氨。本试验所用蒸镏水均应经过这样的处理; ⑩、浮石:在蒸镏水中煮沸后干燥备用; ⑩、600瓦可调温电炉两台; ⑩、凯氏烧瓶及凯氏蒸镏装置 (3)、操作步骤 操作可分为消化、蒸镏和滴定三个步骤。 ①、消化: 准确量取一定体积(以含氮0.5~10mg为宜)的废水水样置于凯氏烧瓶,加入10ml浓硫酸、5克硫酸钾或硫酸钠、1ml硫酸铜溶液,并放入几块沸石,将凯氏烧瓶以45度的角度固定于通风橱内加热煮沸,烧瓶内将产生白烟。继续煮沸,烧瓶中颜色逐渐变黑,直至溶液完全透明无色或浅绿色。再继续煮沸20分钟。 ②、蒸镏: 将凯氏烧瓶冷却,以约150ml蒸镏水冲洗烧瓶壁,加入2.5ml硫化钠溶液和3~5滴酚酞,然后缓慢沿壁加入50mlNaOH溶液尽量使其不与烧瓶内液体混合。立刻将烧瓶按图所示安装到蒸镏装置上去(事先安装好含50ml硼酸的吸收瓶),小心转动烧瓶使烧瓶内的两层液体混合并开始加热。煮沸20~30分钟或在不使用蒸气发生器时蒸发至烧瓶内液体体积减少至原体积约约1/3时,停止蒸镏。 ③、滴定: 卸下吸收瓶,加入几滴混合指示剂,以0.02mol/L(1/2H2SO4)滴定至溶液变为紫色。
土壤硝态氮和铵态氮的测定方法
一、原理: 过滤后的样品经过一个开放的镀铜镉还原器通道后,硝酸根被还原成亚硝酸根,亚硝酸根通过磺胺处理后,与N-(1-萘基)-乙二胺二盐酸盐偶联,形成深红色的偶氮染料,然后在550nm或者520nm比色分析。 二、样品处理 土壤鲜样采取四分法处理,根据实验用量进行过筛(比目大小视样品含水量而定)。过筛后的土样,取出5g土样放入离心管,加入25ml 氯化钾提取液(2moL/L),震荡2小时后进行离心(8000 g ,15min),静置后过滤,取上清液测定。若不能及时测定,放入4℃冰箱保存。 三、试剂配制: 试剂用水:蒸馏水或去离子水。 (1)显色试剂:(棕色玻璃瓶,避光保存) 150ml水,加入25ml浓磷酸▲,冷却至室温后,加入10g磺胺,再加入0.5g N-(1-萘基)-乙二胺二盐酸盐溶解。用水定容至250ml。加入浓缩探针清洗液(表面活性剂)。 (2)氯化铵-EDTA缓冲液(ammonium chloride-EDTA):把85g氯化铵和0.1g 乙二胺四乙酸二钠盐(EDTA-Na2)溶解 于水,定容至1L。用浓氨水▲调节PH至。 (3)硝化组件缓冲液:{用来清洗OTCR(镀铜镉还原器通道)}取100ml的氯化铵-EDTA缓冲液,稀释至1L。调节PH至。(4)2%硫酸铜: 10g 五水硫酸铜()溶于水,定容至500ml。 (5)5mol/L盐酸: 小心慢慢加入浓盐酸▲于水中,冷却后定容至100ml。 (6)硝酸盐存储溶液(1g/L):(溶液6个月内有效) 7.218g硝酸钾溶于水,定容至1L,加入1ml氯仿▲(防腐剂)。(7)比色管清洗液:(定容时缓慢,防止出现泡沫,室温保存,两个月内有效)取50ml比色管清洗液,加水定容至1L。 (8)进样针清洗液:(定容时缓慢,防止出现泡沫,室温保存,两个月内有效。) 取进样针清洗液,加水定容至1L。 四、测定方法: 土壤硝态氮测定采用SmartChem全自动间断化学分析仪。
