《热工基础与应用》第二章-习题课
热工基础与应用第三版课后题答案

热工基础与应用第三版课后题答案热工基础与应用第三版课后题答案:第一章热力学基础1. 什么是热力学系统?热力学系统的分类?答:热力学系统是指一定空间范围内的物质,它可以与外界进行能量、物质和动量的交换。
热力学系统分为开放系统、闭合系统和孤立系统。
2. 热力学第一定律及其公式表达?答:热力学第一定律是指能量守恒原理,即一定量的能量在各种形式间的转换中,总能量量保持不变。
它的公式表达为: $\Delta U = Q -W$,其中$\Delta U$表示系统内能的变化,$Q$ 表示系统所吸收的热量,$W$表示系统所做的功。
第二章理想气体1. 什么是理想气体?理想气体的特点有哪些?答:理想气体是指在一定温度和压力下,以分子作为粗略模型,遵守物理气体状态方程,没有相互作用力的气体。
理想气体的特点是分子间没有相互作用力,分子大小可忽略不计,分子数很大,分子与容器壁之间的碰撞是完全弹性碰撞。
2. 理想气体状态方程及其公式表达?答:理想气体状态方程是描述理想气体状态的基本方程,公式表达为$pV=nRT$,其中$p$表示压力,$V$表示体积,$n$表示物质的定量,$R$为气体常数,$T$表示气体的绝对温度。
第三章湿空气1. 什么是湿空气?湿空气的组成及其特点?答:湿空气是指空气中含有一定量的水蒸气的气体体系。
湿空气主要由氧气、氮气和水蒸气等气体组成。
湿空气的特点是其含水量随着温度和压力的变化而发生变化,同时湿空气的性质也会随着水蒸气的增加发生改变。
2. 湿空气状态的计算方法?答:湿空气的状态可用气体混合物的状态方程描述,即Dalton分压定律。
同时,根据水蒸气分压度和空气分压度的表格,可以通过查表法来计算湿空气的状态。
第四章热功学性质1. 热功学性质的三种基本类型是什么?答:热功学性质的三种基本类型是热力学势、热容和熵。
2. 熵的基本概念及其计算?答:熵是指物理系统内部不可逆过程的度量。
根据定义,熵的计算公式为$\Delta S = Q/T$,其中$\Delta S$表示熵的变化量,$Q$表示系统吸收的热量,$T$表示系统的温度。
热工基础与应用课后习题答案(全)第二版

山东大学热工基础课后习题解答第一章思考题1. 平衡状态与稳定状态有何区别?热力学中为什幺要引入平衡态的概念?答:平衡状态是在不受外界影响的条件下,系统的状态参数不随时间而变化的状态。
而稳定状态则是不论有无外界影响,系统的状态参数不随时间而变化的状态。
可见平衡必稳定,而稳定未必平衡。
热力学中引入平衡态的概念,是为了能对系统的宏观性质用状态参数来进行描述。
表压力或真空度能否作为状态参数进行热力计算?若工质的压力不变,问测量其压力的压力表或真空计的读数是否可能变化?答:不能,因为表压力或真空度只是一个相对压力。
若工质的压力不变,测量其压力的压力表或真空计的读数可能变化,因为测量所处的环境压力可能发生变化。
3.当真空表指示数值愈大时,表明被测对象的实际压力愈大还是愈小?答:真空表指示数值愈大时,表明被测对象的实际压力愈小。
4. 准平衡过程与可逆过程有何区别?答:无耗散的准平衡过程才是可逆过程,所以可逆过程一定是准平衡过程,而准平衡过程不一定是可逆过程。
5. 不可逆过程是无法回复到初态的过程,这种说法是否正确?答:不正确。
不可逆过程是指不论用任何曲折复杂的方法都不能在外界不遗留任何变化的情况下使系统回复到初态,并不是不能回复到初态。
6. 没有盛满水的热水瓶,其瓶塞有时被自动顶开,有时被自动吸紧,这是什幺原因?答:水温较高时,水对热水瓶中的空气进行加热,空气压力升高,大于环境压力,瓶塞被自动顶开。
而水温较低时,热水瓶中的空气受冷,压力降低,小于环境压力,瓶塞被自动吸紧。
7. 用U 形管压力表测定工质的压力时,压力表液柱直径的大小对读数有无影响?1答:严格说来,是有影响的,因为U 型管越粗,就有越多的被测工质进入U 型管中,这部分工质越多,它对读数的准确性影响越大。
习题1-1 解:5p b 755 133.3 10 1.006bar 100.6kPa1. p p b p g 1 0 .06 1 3 6 0 013 7 0.6k0 P a2. p g p p b 2.5 1. 006 1.494bar 149.4 k P a3. p p b p v 755 700 55m m H g 7.3315k P a4. p v p b p 1.006 0.5 0. 506bar 50.6k P a1-2 图1-8 表示常用的斜管式微压计的工作原理。
热工基础与应用课后习题答案(全)第二版

山东大学热工基础课后习题解答第一章思考题1.平衡状态和稳定状态有何区别?热力学中为什幺要引入平衡态的概念?答:平衡状态是在不受外界影响的条件下,系统的状态参数不随时间而变化的状态。
而稳定状态则是不论有无外界影响,系统的状态参数不随时间而变化的状态。
可见平衡必稳定,而稳定未必平衡。
热力学中引入平衡态的概念,是为了能对系统的宏观性质用状态参数来进行描述。
表压力或真空度能否作为状态参数进行热力计算?若工质的压力不变,问测量其压力的压力表或真空计的读数是否可能变化?答:不能,因为表压力或真空度只是一个相对压力。
若工质的压力不变,测量其压力的压力表或真空计的读数可能变化,因为测量所处的环境压力可能发生变化。
3.当真空表指示数值愈大时,表明被测对象的实际压力愈大还是愈小?答:真空表指示数值愈大时,表明被测对象的实际压力愈小。
4. 准平衡过程和可逆过程有何区别?答:无耗散的准平衡过程才是可逆过程,所以可逆过程一定是准平衡过程,而准平衡过程不一定是可逆过程。
5. 不可逆过程是无法回复到初态的过程,这种说法是否正确?答:不正确。
不可逆过程是指不论用任何曲折复杂的方法都不能在外界不遗留任何变化的情况下使系统回复到初态,并不是不能回复到初态。
6. 没有盛满水的热水瓶,其瓶塞有时被自动顶开,有时被自动吸紧,这是什幺原因?答:水温较高时,水对热水瓶中的空气进行加热,空气压力升高,大于环境压力,瓶塞被自动顶开。
而水温较低时,热水瓶中的空气受冷,压力降低,小于环境压力,瓶塞被自动吸紧。
7. 用U形管压力表测定工质的压力时,压力表液柱直径的大小对读数有无影响?答:严格说来,是有影响的,因为U 型管越粗,就有越多的被测工质进入U 型管中,这部分工质越多,它对读数的准确性影响越大。
习 题1-1 解:kPa bar p b 100.61.00610133.37555==⨯⨯=-1. k P a p p p g b 6.137********.100=+=+=2. k P a b a r p p p b g 4.149494.1006.15.2==-=-=3. k P a m m H g p p p v b 3315.755700755==-=-=4. k P a b a r p p p b v 6.50506.05.0006.1==-==-1-2 图1-8表示常用的斜管式微压计的工作原理。
《热工基础与应用》 khdaw

《热工基础与应用》傅秦生 主编 机械工业出版社课后习题参考答案海南大学 xiaomw1101@ 第二章 热能转换的基本概念和基本定律2.3 容器中气体的绝对压力为206.6kPa 。
2.4 g b P P P =+ 压力表A 的读数为155k Pa 。
b V P P P =−2.14Q U W =Δ+82634()U Q W kJ Δ=−=−−=− 返回初态时 34()U U k ′Δ=−Δ=J 63428()W Q U kJ ′′′=−Δ=−=−故外界对系统做功28kJ 。
2.15 压缩过程;系统与外界交换的功是-40 kJ 。
2.160;0;-390 kJ2.18 60 kJ ;-73 kJ ;50 kJ 、10 kJ2.19 0;0、2800 kJ2.24 180 kJ/kg2.25 1152m/s ;652 kJ/kg ;3650kW 2.31 72.7%;12.1kW ;4.55 kW 2.32 600K ;519.6K 2.33 31809601.02/()0467273293H L H L q q qkJ kg K T T T δ=+=−=>+∫i 不满足克劳修斯不等式 2.34 -0.3kJ/K 满足克劳修斯不等式2.351A L BH T T ηη=+课后答案网ww w.kh da w.c om2.36 (1)孤立系的熵增1.92J/K ,可行但不可逆 (2)孤立系的熵增-0.33 J/K ,不可行2.37 运用孤立系统的熵增原理可解得:可行但不可逆 2.38 5.416kg/min ;0.123 kJ/K 2.39 0.61 kJ/K 2.40 3000 kJ2.44 0.151 kJ/k g·K2.46 0.165 kJ/K第三章 工质的热力性质和热力过程3.6 27.93g/mol3.7 612.3kJ ;714kJ3.8 557.9 kJ/kg3.10 热力学能-396.6kJ ;焓变-510kJ ;熵变0.215 kJ/K3.17 略 3.18 略3.19 过程功0;过程热量295.4kJ ;熵变0.568 kJ/K 3.20 热力学能变化量41540kJ ;焓变58200kJ 3.21 -86.55 kJ/kg ;-101.7 kJ/kg ;略课后答案网ww w.kh da w.c om。
热工基础与应用课后习题答案(全)第二版

山东大学热工基础课后习题解答第一章思考题1.平衡状态与稳定状态有何区别?热力学中为什幺要引入平衡态的概念?答:平衡状态是在不受外界影响的条件下,系统的状态参数不随时间而变化的状态。
而稳定状态则是不论有无外界影响,系统的状态参数不随时间而变化的状态。
可见平衡必稳定,而稳定未必平衡。
热力学中引入平衡态的概念,是为了能对系统的宏观性质用状态参数来进行描述。
表压力或真空度能否作为状态参数进行热力计算?若工质的压力不变,问测量其压力的压力表或真空计的读数是否可能变化?答:不能,因为表压力或真空度只是一个相对压力。
若工质的压力不变,测量其压力的压力表或真空计的读数可能变化,因为测量所处的环境压力可能发生变化。
3.当真空表指示数值愈大时,表明被测对象的实际压力愈大还是愈小?答:真空表指示数值愈大时,表明被测对象的实际压力愈小。
4. 准平衡过程与可逆过程有何区别?答:无耗散的准平衡过程才是可逆过程,所以可逆过程一定是准平衡过程,而准平衡过程不一定是可逆过程。
5. 不可逆过程是无法回复到初态的过程,这种说法是否正确?答:不正确。
不可逆过程是指不论用任何曲折复杂的方法都不能在外界不遗留任何变化的情况下使系统回复到初态,并不是不能回复到初态。
6. 没有盛满水的热水瓶,其瓶塞有时被自动顶开,有时被自动吸紧,这是什幺原因?答:水温较高时,水对热水瓶中的空气进行加热,空气压力升高,大于环境压力,瓶塞被自动顶开。
而水温较低时,热水瓶中的空气受冷,压力降低,小于环境压力,瓶塞被自动吸紧。
7. 用U形管压力表测定工质的压力时,压力表液柱直径的大小对读数有无影响?答:严格说来,是有影响的,因为U 型管越粗,就有越多的被测工质进入U 型管中,这部分工质越多,它对读数的准确性影响越大。
习 题1-1 解:kPa bar p b 100.61.00610133.37555==⨯⨯=-1. kPa p p p g b 6.137********.100=+=+=2. kPa bar p p p b g 4.149494.1006.15.2==-=-=3. kPa mmHg p p p v b 3315.755700755==-=-=4. kPa bar p p p b v 6.50506.05.0006.1==-==-1-2 图1-8表示常用的斜管式微压计的工作原理。
热工基础1
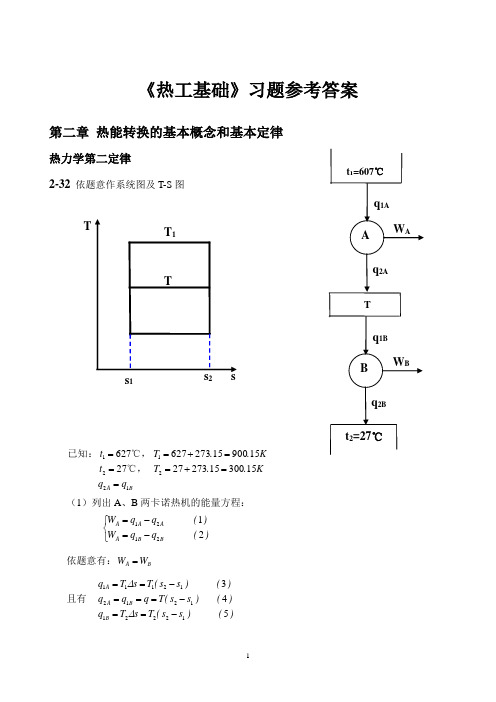
《热工基础》习题参考答案第二章 热能转换的基本概念和基本定律热力学第二定律2-32 依题意作系统图及T-S 图BA q q K ..T t K..T t 122211153001527327271590015273627627==+===+==℃,℃,已知: (1)列出A 、B 两卡诺热机的能量方程:⎩⎨⎧-=-=)(q q W )(q q W BB A A A A 212121依题意有:B A W W =且有 )()s s (T s T q )()s s (T q q q )()s s (T s T q B B A A 54312221121212111-==-===-==∆∆ t 2=27℃t 1=607℃A q 1Aq 2AW ATB q 1B q 2B W BT 1Ts s 2s 1T解之,得:(2)列出A 、B 两卡诺热机的热效率公式:TT ,T T C ,B C ,A 2111-=-=ηη 依题意,有C ,B C ,A ηη=,即Ct K K .K .T T T T T T TT T T ︒=≈⨯===∴-=-24752015300159001121212212-33 依题意有:02112753296415293960157403180>=⋅-⋅=-+=+=∴⎰.)K kg /(kJ .)K kg /(kJ .K.kg /kJ K .kg /kJ T q T q TqLLH Hδδδ 故此循环不满足克劳修斯不等式。
2-36 取热源、冷源、热机和工质为系统,作系统图如右下图。
该系统为孤立系。
系统总熵变为:===++=m L L L HH H mL H iso S ;T QS ;T QS S S S S ∆∆∆∆∆∆∆工质熵变冷源熵变热源熵变其中:T H = 2000KQ HQ LWkg/kJ q K.T ,C t kg/kJ q K.T ,C t L L L H H H 9601529320318015740467==︒===︒=(1)依题意,有J Q ,J Q L H 8001500=-=9310300800200015000>=++-=++=∴)K /J (.KJK J T Q T Q S LLH H iso ∆根据孤立系熵增原理判定:该循环可行,且不可逆。
热工基础与应用课后习题答案(全)第二版.doc
山东大学热工基础课后习题解答第一章思考题1.平衡状态与稳定状态有何区别?热力学中为什幺要引入平衡态的概念?答:平衡状态是在不受外界影响的条件下,系统的状态参数不随时间而变化的状态。
而稳定状态则是不论有无外界影响,系统的状态参数不随时间而变化的状态。
可见平衡必稳定,而稳定未必平衡。
热力学中引入平衡态的概念,是为了能对系统的宏观性质用状态参数来进行描述。
表压力或真空度能否作为状态参数进行热力计算?若工质的压力不变,问测量其压力的压力表或真空计的读数是否可能变化?答:不能,因为表压力或真空度只是一个相对压力。
若工质的压力不变,测量其压力的压力表或真空计的读数可能变化,因为测量所处的环境压力可能发生变化。
3.当真空表指示数值愈大时,表明被测对象的实际压力愈大还是愈小?答:真空表指示数值愈大时,表明被测对象的实际压力愈小。
4. 准平衡过程与可逆过程有何区别?答:无耗散的准平衡过程才是可逆过程,所以可逆过程一定是准平衡过程,而准平衡过程不一定是可逆过程。
5. 不可逆过程是无法回复到初态的过程,这种说法是否正确?答:不正确。
不可逆过程是指不论用任何曲折复杂的方法都不能在外界不遗留任何变化的情况下使系统回复到初态,并不是不能回复到初态。
6. 没有盛满水的热水瓶,其瓶塞有时被自动顶开,有时被自动吸紧,这是什幺原因?答:水温较高时,水对热水瓶中的空气进行加热,空气压力升高,大于环境压力,瓶塞被自动顶开。
而水温较低时,热水瓶中的空气受冷,压力降低,小于环境压力,瓶塞被自动吸紧。
7. 用U形管压力表测定工质的压力时,压力表液柱直径的大小对读数有无影响?答:严格说来,是有影响的,因为U 型管越粗,就有越多的被测工质进入U 型管中,这部分工质越多,它对读数的准确性影响越大。
习 题1-1 解:kPa bar p b 100.61.00610133.37555==⨯⨯=-1. kPa p p p g b 6.137********.100=+=+=2. kPa bar p p p b g 4.149494.1006.15.2==-=-=3. kPa mmHg p p p v b 3315.755700755==-=-=4. kPa bar p p p b v 6.50506.05.0006.1==-==-1-2 图1-8表示常用的斜管式微压计的工作原理。
《热工基础与应用》课后参考答案
《热工基础与应用》傅秦生 主编 机械工业出版社课后习题参考答案海南大学******************第二章 热能转换的基本概念和基本定律2.3 容器中气体的绝对压力为206.6kPa 。
2.4 g b P P P =+ 压力表A 的读数为155k Pa 。
b V P P P =−2.14Q U W =Δ+82634()U Q W kJ Δ=−=−−=− 返回初态时 34()U U k ′Δ=−Δ=J 63428()W Q U kJ ′′′=−Δ=−=− 故外界对系统做功28kJ 。
2.15压缩过程;系统与外界交换的功是-40 kJ 。
2.16 0;0;-390 kJ2.18 60 kJ ;-73 kJ ;50 kJ 、10 kJ2.19 0;0、2800 kJ2.24 180 kJ/kg2.25 1152m/s ;652 kJ/kg ;3650kW2.31 72.7%;12.1kW ;4.55 kW2.32 600K ;519.6K 2.33 3180960 1.02/()0467273293H L H L q q qkJ kg K T T T δ=+=−=>+∫i 不满足克劳修斯不等式2.34-0.3kJ/K 满足克劳修斯不等式 2.35 1A L BH T T ηη=+2.36(1)孤立系的熵增1.92J/K,可行但不可逆(2)孤立系的熵增-0.33 J/K,不可行2.37 运用孤立系统的熵增原理可解得:可行但不可逆2.38 5.416kg/min;0.123 kJ/K2.39 0.61 kJ/K2.40 3000 kJ2.44 0.151 kJ/k g·K2.46 0.165 kJ/K第三章工质的热力性质和热力过程3.6 27.93g/mol3.7 612.3kJ;714kJ3.8 557.9 kJ/kg3.10 热力学能-396.6kJ;焓变-510kJ;熵变0.215 kJ/K 3.17 略3.18 略3.19 过程功0;过程热量295.4kJ;熵变0.568 kJ/K3.20 热力学能变化量41540kJ;焓变58200kJ3.21 -86.55 kJ/kg;-101.7 kJ/kg;略。
热工基础与应用课后习题问题详解(全)第二版
山东大学热工基础课后习题解答第一章思考题1.平衡状态与稳定状态有何区别?热力学中为什幺要引入平衡态的概念?答:平衡状态是在不受外界影响的条件下,系统的状态参数不随时间而变化的状态。
而稳定状态则是不论有无外界影响,系统的状态参数不随时间而变化的状态。
可见平衡必稳定,而稳定未必平衡。
热力学中引入平衡态的概念,是为了能对系统的宏观性质用状态参数来进行描述。
表压力或真空度能否作为状态参数进行热力计算?若工质的压力不变,问测量其压力的压力表或真空计的读数是否可能变化?答:不能,因为表压力或真空度只是一个相对压力。
若工质的压力不变,测量其压力的压力表或真空计的读数可能变化,因为测量所处的环境压力可能发生变化。
3.当真空表指示数值愈大时,表明被测对象的实际压力愈大还是愈小?答:真空表指示数值愈大时,表明被测对象的实际压力愈小。
4. 准平衡过程与可逆过程有何区别?答:无耗散的准平衡过程才是可逆过程,所以可逆过程一定是准平衡过程,而准平衡过程不一定是可逆过程。
5. 不可逆过程是无法回复到初态的过程,这种说法是否正确?答:不正确。
不可逆过程是指不论用任何曲折复杂的方法都不能在外界不遗留任何变化的情况下使系统回复到初态,并不是不能回复到初态。
6. 没有盛满水的热水瓶,其瓶塞有时被自动顶开,有时被自动吸紧,这是什幺原因?答:水温较高时,水对热水瓶中的空气进行加热,空气压力升高,大于环境压力,瓶塞被自动顶开。
而水温较低时,热水瓶中的空气受冷,压力降低,小于环境压力,瓶塞被自动吸紧。
7. 用U形管压力表测定工质的压力时,压力表液柱直径的大小对读数有无影响?答:严格说来,是有影响的,因为U 型管越粗,就有越多的被测工质进入U 型管中,这部分工质越多,它对读数的准确性影响越大。
习 题1-1 解:kPa bar p b 100.61.00610133.37555==⨯⨯=-1. kPa p p p g b 6.137********.100=+=+=2. kPa bar p p p b g 4.149494.1006.15.2==-=-=3. kPa mmHg p p p v b 3315.755700755==-=-=4. kPa bar p p p b v 6.50506.05.0006.1==-==-1-2 图1-8表示常用的斜管式微压计的工作原理。
热工基础与应用课后习题答案(全)第二版
大学热工基础课后习题解答第一章思考题1.平衡状态与稳定状态有何区别?热力学中为什幺要引入平衡态的概念?答:平衡状态是在不受外界影响的条件下,系统的状态参数不随时间而变化的状态。
而稳定状态则是不论有无外界影响,系统的状态参数不随时间而变化的状态。
可见平衡必稳定,而稳定未必平衡。
热力学中引入平衡态的概念,是为了能对系统的宏观性质用状态参数来进行描述。
表压力或真空度能否作为状态参数进行热力计算?若工质的压力不变,问测量其压力的压力表或真空计的读数是否可能变化?答:不能,因为表压力或真空度只是一个相对压力。
若工质的压力不变,测量其压力的压力表或真空计的读数可能变化,因为测量所处的环境压力可能发生变化。
3.当真空表指示数值愈大时,表明被测对象的实际压力愈大还是愈小?答:真空表指示数值愈大时,表明被测对象的实际压力愈小。
4. 准平衡过程与可逆过程有何区别?答:无耗散的准平衡过程才是可逆过程,所以可逆过程一定是准平衡过程,而准平衡过程不一定是可逆过程。
5. 不可逆过程是无法回复到初态的过程,这种说法是否正确?答:不正确。
不可逆过程是指不论用任何曲折复杂的方法都不能在外界不遗留任何变化的情况下使系统回复到初态,并不是不能回复到初态。
6. 没有盛满水的热水瓶,其瓶塞有时被自动顶开,有时被自动吸紧,这是什幺原因?答:水温较高时,水对热水瓶中的空气进行加热,空气压力升高,大于环境压力,瓶塞被自动顶开。
而水温较低时,热水瓶中的空气受冷,压力降低,小于环境压力,瓶塞被自动吸紧。
7. 用U形管压力表测定工质的压力时,压力表液柱直径的大小对读数有无影响?答:严格说来,是有影响的,因为U 型管越粗,就有越多的被测工质进入U 型管中,这部分工质越多,它对读数的准确性影响越大。
习 题1-1 解:kPa bar p b 100.61.00610133.37555==⨯⨯=-1. kPa p p p g b 6.137********.100=+=+=2. kPa bar p p p b g 4.149494.1006.15.2==-=-=3. kPa mmHg p p p v b 3315.755700755==-=-=4. kPa bar p p p b v 6.50506.05.0006.1==-==-1-2 图1-8表示常用的斜管式微压计的工作原理。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2. 热力学第二定律可否表述为“机械能可以全部变为热能,而热能不可 能全部变为机械能”?
答: 否。 必须保证过程结束后对系统和外界没有造成任何影响。 否则热能可以全部变为机械能,比如理想气体的定温膨胀过程,系统把从外 界吸收的热量全部转化为机械能,外界虽然没有任何任何变化,但是系统的
体积发生改变了。
4
4. “任何没有体积变化的过程就一定不对外作功” 的说法是否正确?
答:不正确,因为外功的含义很广,比如电磁功、表面张 力功等等,如果只考虑容积功的话,那么没有容积变化的 过程就一定不对外作功。
5.试比较图1所示的过程1-2与过程1-a-2中下列各量 的大小: ⑴ W12与W1a2;(2) DU12 与DU1a2; (3) Q12与Q1a2
答;不对,S为状态参数,和过程无关,ΔS相等。
(4)工质经历不可逆循环后ΔS>0。
答:不对,工质经历可逆和不可逆循环后都回到初态,所以熵变为零。
(5) 自然界的过程都是朝着熵增的方向进行的,因此熵减小的过程 不可能实现。
答:不对,比如系统的理想气体的可逆定温压缩过程,系统对外放热,熵减小。
10
二、判断各情况的熵变
答:(1)W1a2大。
(2)一样大。
(3)Q1a2大。
图1 思考题5附图
5
6. 下列说法是否正确?
⑴ 气体膨胀时一定对外作功。 答:错,比如气体向真空中的绝热自由膨胀,对外不作功。 ⑵ 气体被压缩时一定消耗外功。 答:对,因为根据热力学第二定律,气体是不可能自压 缩的,要想压缩体积,必须借助于外功。 ⑶ 气体膨胀时必须对其加热。 答:错,比如气体向真空中绝热自由膨胀,不用对其加热。
13
二、计算分析题
14
1、 定量工质,经历了一个由四个过程组成的循环,试填充 下表中所缺的数据。 过程 1-2 2-3 3-4 4-1 解:求解依据: 对于过程: 对于循环: QQ/ kJ /kJ 1390 0 -1000 0 W /kJ W/ kJ 0 395 0 -5
12
3. 系统在某过程中从热源吸热20 kJ,对外作功25 kJ,请问能否通过可 逆绝热过程使系统回到初态?为什么?能否通过不可逆绝热过程使系 统回到初态?
答:否!!系统吸热熵增加。要使系统回到初态,新的过程必须使系
统熵减少。而可逆绝热过程熵不变,不可逆绝热过程熵增加,因而不可
能通过一个可逆绝热过程或者一个不可逆绝热过程使系统回到初态。 4. 既然能量是守恒的,那还有什么能量损失呢? 答:热力学第一定律表明能量在转移和转换过程中,能量数量是 守恒不变的。但是由于在能量转移和转换的实际过程中不可避免地 存在各种不可逆因素,如相对运动的物体之间的摩擦以及传热过程 中的温差,等等,这些不可逆因素总会造成能量转移和转换后能量 品位的降低和做功能力的减少,而这种降低或减少不是能量数量上 的而是能量质量上的,即由可用能变成废热的不可逆损失,这就是 热力学第二定律所揭示的另外一种意义上的能量损失。
8
热力学第二定律
9
一、下列说法是否正确?为什么? ⑴ 熵增大的过程为不可逆过程。
答: 不正确。只有孤立系统才可以这样说。
⑵ 不可逆过程的熵变ΔS无法计算。
答:不正确。S为状态参数,和过程无关,知道初态和终不可
逆途径的ΔS必大于可逆途径的ΔS。
3
3.绝热刚性容器,中间用隔板分为两部分,左边 盛有空气,右边为真空,抽掉隔板,空气将充满 整个容器。问:⑴ 空气的热力学能如何变 化? ⑵ 空气是否作出了功? ⑶ 能否在坐标图上 表示此过程?为什么?
答:(1)空气绝热自由膨胀过程的热力学能不变。 (2)空气对外不做功。 (3)不能在坐标图上以实线表示此过程,因为不是 准静态过程。
DS DSf DSg
(1)闭口系经历一可逆变化过程,系统与外界交换 功量10kJ,热量-10kJ,系统熵变 。 减少
(2)闭口系经历一不可逆变化过程,系统与外界交换功 量10kJ,热量-10kJ,系统熵变 。 不一定 (3)在一稳态稳流装置内工作的流体经历一不可逆过程, 装置作功20kJ,与外界交换热量-15kJ,流体进出口熵变。 不一定 (4)在一稳态稳流装置内工作的流体,经历一可逆过程, 装置作功20kJ,与外界交换热量-15kJ,流体进出口熵变。
第二章 习题课
1
一、简答题
2
基本概念和热力学第一定律
1. 当真空表指示数值愈大时,表明被测对象的实际 压力愈大还是愈小?
答:真空表指示数值愈大时,表明被测对象的实际压力愈小。
2. 不可逆过程是无法回复到初态的过程,这种说法 是否正确?
答:不正确。不可逆过程是指不论用任何方法都不能在外界不 遗留任何变化的情况下使系统回复到初态,并不是不能回复到 初态。
减少
(5)流体在稳态稳流的情况下按不可逆绝热变化,系统对外 作功10kJ,此开口系统的熵变。 变大
11
三、简答题
1. ”循环输出净功愈大,则热效率愈高;可逆循环的热效率都相等; 不可逆循环的热效率一定小于可逆循环的热效率。” 这些说法是否正确?为什么?
答: 不正确,热效率为输出净功和吸热量的比,因此在相同吸热量 的条件下,循环输出的净功愈大,则热效率愈高。不是所有的可逆循 环的热效率都相等,必须保证在相同的条件下。在相同的条件下,不 可逆循环的热效率一定小于可逆循环的热效率。
7. 说明下列各式的应用条件:
⑴
q Du w
答:闭口系统的任何过程,任何工质。 ⑵ q Du pdv 答:闭口系统的可逆过程,任何工质。
7
⑶
q Du ( p2 v2 p1v1 )
答:开口系统的稳定流动过程,并且技术功为零,任何工质。 ⑷ q Du p(v2 v1 ) 答:开口系统的稳定定压流动过程,并且技术功为零; 或者闭口系统的可逆定压过程。
⑷ 气体边膨胀边放热是可能的。
答:对,如多变过程,当n大于k时,可实现边膨胀边放热。
6
⑸ 气体边被压缩边吸入热量是不可能的。 答:错,如多变过程,当n大于k时,可实现边压缩边吸热。 ⑹ 对工质加热,其温度反而降低,这种情况不可能。 答:错,比如多变过程,当n大于1,小于k时,可实现对 工质加热,其温度反而降低。
