有机化学期末复习-(第5-8章).ppt
高中化学选修5有机化学总复习总结.ppt

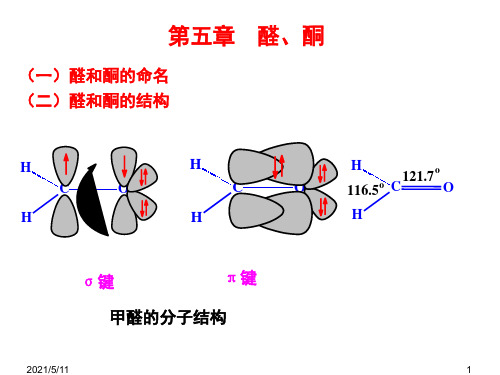
1
• 一、同分异构体 • 二、几种基本分子的结构模型(共线共面问题) • 三、有机物重要物理性质 • 四、有机物的化学性质
(一)官能团的性质 (二)常见有机物之间的转化关系 (三)有机化学反应类型 (四)反应条件小结
• 五、常见的有机实验、有机物分离提纯
• 六、有机推断合成的一般思路
越大越难溶于水,亲水基团:-OH,-CHO,COOH
• 能溶于水的:低碳的醇、醛、酸、钠盐, 如乙(醇、醛、酸)乙二醇、丙三醇、苯酚钠
• 难溶于水的:烃,卤代烃,酯类,硝基化合物 • 微溶于水:苯酚、苯甲酸 • 苯酚溶解的特殊性:常温微溶,65℃以上任意
溶
16
沸点 • 同系物比较:沸点随着分子量的增加(即C原子 个数的增大)而升高 • 同类物质的同分异构体:沸点随支链增多而降 低 • 衍生物的沸点高于相应的烃,如氯乙烷>乙烷 • 饱和程度大的有机物沸点高于饱和程度小的有 机物,如脂肪>油 • 分子间形成氢键的有机物沸点高于不形成氢键 的有机物如:乙醇>乙烷
③ CnH2n-6(n≥6) 苯及其同系物与多烯
④ CnH2n+2O(n≥2) 饱和一元醇和醚
⑤ CnH2nO(n≥3) 饱和一元醛、酮和烯醇
⑥ CnH2nO2(n≥2) 饱和一元羧酸、酯、羟基醛
⑦ CnH2n-6O(n>6) 一元酚、芳香醇、芳香醚
⑧ CnH2n+1NO2, 氨基酸和一硝基化合物
⑨ C6H12O6, 葡萄糖和果糖,
什么样的醇可催化氧化? (同C有H)
• 七、有机计算 2
一、同分异构体
(1) 判断同分异构体、同系物的方法: 根据概念判断(考点)
同系物
同分异构体
《有机化学》PPT课件

羧酸衍生物命名
羧酸衍生物结构
物理性质
以相应的羧酸为母体,将衍生物 中的官能团作为取代基、酸酐、酯 等,它们都具有不同的官能团, 但都与羧基相连。
羧酸衍生物的物理性质因官能团 的不同而有所差异。例如,酰卤 具有刺激性气味,易挥发;酸酐 多为无色晶体,具有吸湿性;酯 类具有芳香气味,难溶于水。
亚硝基化合物
含有亚硝基(-NO)的化合物称为亚硝基 化合物。亚硝基化合物不稳定,易转化 为其他含氮化合物,如硝基化合物或胺 类。
07
杂环化合物和生物碱
杂环化合物定义与分类
定义
杂环化合物是指分子中含有杂原子(如O、S、N等)的环状有机化合物。
分类
根据杂原子的种类和数量,杂环化合物可分为单杂环、双杂环和多杂环等。
06
含氮有机化合物
胺类命名、结构及物理性质
1 2 3
胺类的命名 根据与氮原子相连的烃基的不同,胺可分为伯胺、 仲胺和叔胺。命名时,需注明烃基的名称和胺的 类别。
胺类的结构 胺分子中的氮原子具有孤对电子,可接受质子形 成铵盐。同时,氮原子上的氢原子可被烃基取代, 形成不同种类的胺。
胺类的物理性质 低级胺具有刺激性气味,易溶于水。随着烃基增 大,高级胺的气味逐渐减弱,溶解度降低。
酮类命名、结构及物理性质
命名
酮的命名通常是以含有酮羰基的碳链作为主体,称为某酮。例如, 丙酮、丁酮等。
结构
酮类化合物分子中含有酮羰基(>C=O),酮羰基中的碳原子与两个 烃基相连。
物理性质
酮类多为无色液体,具有特殊的气味。酮类化合物密度比水小,难 溶于水,易溶于有机溶剂。
醌类命名、结构及物理性质
《有机化学》PPT课件
目录
• 有机化学概述 • 烃类化合物 • 卤代烃和醇酚醚类化合物 • 醛酮醌类化合物 • 羧酸及其衍生物 • 含氮有机化合物 • 杂环化合物和生物碱
高中化学选修五有机化学总复习PPT课件演示文稿

H2O
CH3CHO
C2H5OH
水解
O2
CH3COOH
Na
C2H5ONa
分子间脱水
C2H5—O—C2H5
+ Cl2
FeCl3
—Cl 水解
—OH + NaOH
CO2 或 强酸
—ONa
第9页,共77页。
延伸转化关系举例
CH H2 CH2 Br2 CH2Br 水解 CH2OH 脱H2 CHO O2 COOH
第29页,共77页。
• 乙二酸和乙二醇酯化
+H2O
+2H2O
H
OH
+(2n-1)H2O
第30页,共77页。
(四)反应条件小结
1、需加热的反应
水浴加热:
热水浴:银镜反应、酯的水解、蔗糖水解、
沸水浴:酚醛树脂的制取
控温水浴:制硝基苯(50℃-60 ℃
KNO3溶解度的测定
直)接加热:制乙烯,酯化反应、与新制氢氧
高中化学选修五有机化学总复 习PPT课件演示文稿
第1页,共77页。
(优质)高中化学选修五有机 化学总复习PPT课件
第2页,共77页。
一、各类有机物的化学性质
(一)结构特点和官能团性质
类 别 结构特点
主要性质
1.稳定:通常情况下不与强酸、 强碱、强氧化剂反应
烷烃 碳碳单键(C-C) 2.取代反应(卤代)
• NaHCO3
第34页,共77页。
五、常见的有机实验、有机物分离提纯
1、乙烯
化学药品 无水乙醇(酒精)、浓硫酸 反应方程式
CH2-CH2
170℃
浓硫酸
CH2=CH2↑+H2O
高中化学选修5_有机化学总复习.ppt

溶解性
• 有机物均能溶于有机溶剂 • 有机物中的憎水基团:-R(烃基);烃基部分
越大越难溶于水,亲水基团:-OH,-CHO,COOH
• 能溶于水的:低碳的醇、醛、酸、钠盐, 如乙(醇、醛、酸)乙二醇、丙三醇、苯酚钠
• 难溶于水的:烃,卤代烃,酯类,硝基化合物 • 微溶于水:苯酚、苯甲酸 • 苯酚溶解的特殊性:常温微溶,65℃以上任意
类 别 结构特点
烷烃 单键(C-C)
双键(C=C) 烯烃 二烯烃
(-C=C-C=C-)
主要性质
1.稳定:通常情况下不与强酸、 强碱、强氧化剂反应 2.取代反应(卤代) 3.氧化反应(燃烧) 4.加热分解 1.加成反应;与H2、X2、H X、H2O 2.氧化反应(燃烧;被KMnO4[H+] 氧化) 3.加聚反应 (加成时有1,4加成和1,2加成)
n
CH=CH-C=CH2
A
B
温度压强[CAH-CH=CB-CH2]n
天然橡胶(聚异戊二烯)
氯丁橡胶(聚一氯丁二烯)
含有双键的不同单体间的共聚(混合型) 乙丙树脂(乙烯和丙烯共聚), 丁苯橡胶(丁二烯和苯乙烯共聚)
n 催化剂
O CH=CH2+ n CH2=CH2
[ CH-CH2-CH2-CH2] n
侧链、醇、醛等可被某些氧化剂所氧化。它 包括两类氧化反应
1)在有催化剂存在时被氧气氧化
从结构上看,能够发生氧化反应的醇一定是 连有—OH的碳原子上必须有氢原子,否则不能 发生氧化反应
CH3
如
CH3—C—OH 就不能发生氧化反应
CH3
2)有机物被除O2外的某些氧化剂
(如强KMnO4、弱Cu(OH)2、[Ag(NH3)2OH]等 氧化)
有机化学ppt课件完整版

有机化学ppt课件完整版目录•绪论•有机化合物的结构与性质•烃类化合物•烃的衍生物•有机合成与反应机理•生物活性有机化合物绪论碳氢化合物研究碳氢化合物(烃)的结构、性质、合成和反应机理。
碳氢化合物的衍生物研究烃的衍生物,如醇、醛、酮、羧酸、酯等有机化合物的结构、性质、合成和反应机理。
生命体系中的有机化合物研究生物体内的氨基酸、蛋白质、核酸、多糖等生命物质的结构、性质和功能。
经典时期19世纪初到20世纪初,以经验规律为指导,通过大量的实验总结出了许多有机化学的基本概念和原理。
萌芽时期从远古时期到18世纪,人们开始使用天然有机物,如木材、植物、动物等。
现代时期20世纪至今,以量子力学和统计力学为基础,发展出了现代有机化学的理论和方法,如分子轨道理论、价键理论、反应机理理论等。
环境领域有机化学在环境保护方面发挥着重要作用,如研究大气污染物、水体污染物的来源和治理方法等。
同时,有机化学也致力于开发环保材料和清洁能源。
材料领域合成纤维、塑料、橡胶等高分子材料广泛应用于服装、家居用品、交通工具等领域。
医药领域合成药物如抗生素、抗癌药物等对于治疗疾病具有重要意义。
同时,天然药物中提取的有效成分也是有机化学的研究对象。
农业领域合成农药和化肥对于提高农作物产量具有重要作用。
此外,生物农药和生物肥料的研发也需要有机化学的支持。
有机化学与生产生活的关系有机化合物的结构与性质碳原子通过四个共价键与其他原子或基团相连,形成复杂的有机分子结构。
碳原子的四价性键的极性空间构型碳原子与其他原子形成的共价键具有不同的极性,影响有机物的物理和化学性质。
有机化合物分子中的原子或基团在空间的排列方式不同,导致同分异构现象的产生。
030201有机化合物的结构特点03同分异构体的性质差异由于结构上的差异,同分异构体在物理性质、化学性质以及生物活性等方面表现出明显的不同。
01构造异构分子式相同但连接方式不同,如正丁烷和异丁烷。
02立体异构分子式相同、连接方式也相同,但空间构型不同,如顺反异构、对映异构等。
有机化学 第8章 卤代烃

CH3CH2CHCH2CH2CH3 CH2Br
2-乙基-1-溴戊烷
CH3CH2CHCH2CHCH2CH3
CH3 Cl 3-甲基-5-氯庚烷 (不叫5-甲基-3-氯庚烷)
CH3CHCH2CHCH2Cl CH3 Cl
4-甲基-1,2-二氯戊烷
CH3CH2CHCHCH2CH3 Br Cl
3-氯-4-溴己烷 (不叫3-溴-4-氯己烷)
O…C…Br三个原子在同一直线上,两者相互垂直。
❖ 过渡态后,反应继续进行,体系能量下降,最后形成一个稳 定的C—O共价键,C—Br键同时断裂,溴原子带者一对电 子离去,生成甲醇和Br-,反应完成。
❖ 3.说明 (1)中心C原子杂化态的变化:在形成过渡 态的过程中,中心C原子的杂化态就开始“改组”, 由sp3向着sp2和p轨道的方向“改组”,到过渡态 “改组”完成。反应完成后,碳原子的杂化态又恢 复到sp3杂化态。
CH3CH2CH2CH2Br + 2NH3 (大大过量)
CH3CH2CH2CH2NH2 + NH4Br 正丁胺(伯胺)
说明
❖ 1.叔卤代烷分别与上述试剂反应,发生的主 要反应则不是取代,而是消除——消除一分 子卤化氢生成烯烃。
CH3 H3C C Cl
CH3 叔丁基氯
NaOH或RONa 或NaCN或NH3
△
CH3CH2CH=CH2 + KBr + H2O(消除反应)
(浓乙醇溶液)
❖ (一)消除反应 由一个分子中脱去一些小分子,如
HX、H2O等,同时产生C=C的反应叫消除反应。
❖ (二)卤代烷分子中在β—碳原子上必须有氢原子时,
才有可能进行消除反应。
❖ (三)脱HX的能力 叔卤代烷>仲卤代烷>伯卤代 烷
有机化学第8章 芳 香 烃

18
官能团的保护: 苯胺的硝化
邻-硝基苯胺的合成
19
8.5
芳烃的来源
芳香烃主要来源于煤焦油工业和石油化工。 煤和石油都是由动、植物埋藏在地下,在隔绝空气的情况 下,受长期地质应力和细菌的作用,经复杂的化学变化而形 成的。
煤焦油:一种具有特臭,黑褐色粘稠液体,组成十分复杂,目前已能 分离出来的有机物有几百种,其中大部分是芳烃及其他芳香族化合物。 2010年中国十大科技成果之一,煤的烃化(即煤的液化己实现工业 化)。
付--克反应是一个可逆反应,所以引入的烷基又可以从芳 环上失去或分子内重排。如:
11
(2)
付克酰基化反应
在无水三氯化铝作用下,芳烃与酰卤反应生成芳酮:
利用分子内的酰基化反应来合成环酮化合物:
12
5
、其他亲电取代反应
(1) 氯甲基化反应 在无水氯化锌的存在下,芳烃与甲醛及氯化氢作用,芳环 上的氢原子即被氯甲基(-CH2Cl)取代,此反应叫氯甲基化 反应。
14
8.3.3
加成反应
苯虽然较一般不饱和烃(烯炔)稳定,但在特殊条件下, 仍可与氢、卤素发生加成反应。例如:
自由基反 应历程
自由基历程如下:
15
8.4 苯环上取代基的定位效应和规律 芳环上己有的基团对新进入基团进入位置的影响,称作定位效应。 8.4.1 定位基的分类
(1) 邻、对位定位基
烷基化试剂除卤代烃外,烯、醇等都可以作为烷基化试剂。 催化剂除了三氯化铝外,还可以用SnCl4、BF3、ZnCl2、 H2SO4、HF、磷酸等。 它们都是路易士(Lewis)酸,即缺电子试剂。但最常用的 是AlCl3,也是最有效的。
《有机化学》PPT课件
H R C COOH
H
COOH H
2021/5/11
16
R
α氢
卤代
O 羰基
生成 羧酸衍生物
还原为亚甲基
H O
H H 断C-C键
脱羧,失去CO2
断O-H键
酸的 离解作用
2021/5/11
17
(1)羧酸的酸性
O
甲、羧酸的酸性比醇强:
R CH2OH 乙、成盐
RCH2O + H 定域
RC OH
RCOOH + NaOH
2021/5/11
12
(c) Meerwein-Pondorf 还原
O
OH CH3CHCH3
Al(OCHMe)3
异丙醇是还原剂,异丙醇铝是催化剂。
O OH CH3 C CH3
异丙醇只还原羰基,不还原不饱和碳键。
(d) Clemmensen 还原
O
Zn(Hg), 浓HCl
C CH2CH2COOH reflux, 30 h 要求底物不含对酸或还原剂敏感基团:
pKa
Cl < RCOO < RO < NH2
HCl > RCOOH > ROH > NH3
-2.2 4~5
16~19 34
2021/5/11
28
(2)还原反应
用氢化铝锂还原
O RCCl
OO RCOCR
O
① LiAlH4,乙醚 ②H2O
RCH2OH
RCOR'
O
① LiAlH4,乙醚
RCNR2 ②H2O
2HCHO NaOH HCO2Na CH3OH
O HCH
HO-
OHC
H
OH
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
碳正离子稳定性
R 3C R 2C H RC H2 H3C
四种共轭体系:π-π和p-π共轭体系 以及π-σ和p-σ超共轭。
碳自由基的稳定性:
3R 2R 1R CH3
碳正离子的稳定性:
CH2=CHCH2 ,
CH2 >3°R+〉2°R+〉1°R+〉+CH3
7、共轭二烯烃
• 双烯合成
O
+
CH=CHOH
O CH2C H
2、烯烃的自由基型加成反应 ----过氧化物效应(反马氏加成产物)
H2C
CHCH2Br+HBr
O2 或ROOR
BrCH2CH2CH2Br
烯丙 基 溴
1,3-二 溴 丙 烷
在光照射下,也得到过氧化物效应的产物。 只有溴化氢有过氧化物效应,而氯化氢和碘化氢无过 氧化物效应。
+
• π-π共轭体系 CH2=CH CH=CH CH2C=CCH2CH3
• p-π共轭体系
..
..
+
C
C
CI C
CC
.
CC
O
CH3
CH2 CH
H CC
CCH C
-
C
C
H
• 超共轭体系
– σ-π超共轭体系
– σ-p超共轭体系
HHH HC
H C C.
HC H HH
HHH HC
H C C. H
H
H.
H C CH H
• (2) 将氯气先经光照,,然后在黑暗中放置一段时间再与甲烷 混合,则不发生氯代反应。
• (3) 将甲烷先经光照,,然后在黑暗中与氯气混合,也不发生 氯代反应。
• (合1),CCl2l先·来用不光及照相,互产结生合氯,自可由与基甲·C烷l,产迅生速连在锁黑反暗应中得与到C氯H化4混产 物。
• (2) Cl2通过光照射虽产生自由基·Cl.,但在黑暗中经过一段时 间 存后在,,又也重无新产结生合自成由C基l2条,件C,l2再故与不甲发烷生混反合应时。,由于无自由基
CH2CH2OH
马氏规则:①不对称烯烃(双键两碳被不对称取代) 加成时,酸的质子主要加到含氢较多的碳上,而负性 离子加到含氢较少的碳原子上 ②不对称烯烃与亲电试剂加成反应,试剂带部分正电 荷的部分加到双键带部分负电荷碳上,而试剂带部分 负电荷的部分加到双键带部分正电荷的碳上。
R
-
CH CH2+ Z
H3C C C CH3 HCI
H3C C
CI C
HCI
H
CH3
CI
CH3CH2C CH3 CI
CH3C CCH3+ 2Br2
CH3CBr2 CBr2CH3
COOH COOH
((86))
KMnO4 H
O
+
COOH
CH2CH3 KMnO4/H
O
O
HO CCH2CH2CH2CCH2CH3
5、烯烃α-氢的反应
CH3CH CH2+ CI2
<200℃ CH3CHCICH2CI
>300℃
Or hv
CH2CICH CH2
+ Br2 hv
Br + HBr
6、共轭体系及共轭效应
CH3 CH3 H
CH3 CH3 H2
CH3 CH3 H2
H2C
C
C
C H
CH3
H3C
C
C
C H
CH3 H3C
C
CLeabharlann CCH3 H3CC
C
C H
CH2
CH3
CH3
CH3
CH3
5-13甲烷在用光照进行氯代反应时,可以观察到如下 现象,试用烷烃的氯代反应机理解释这些现象。
• (1) 将氯先经用光照,然后立即在黑暗中与甲烷混合,可以获 得氯代产物。
Br2 hυ
+ HBr
Cl
Cl
+
Cl
Cl
碳正离子重排导致的产物
CH(CH3)2 +
Br
C(CH3)2 Br
Br
自由基的稳定性:3°R·>2°R·>1°R·>CH3·
CH3 (CH3)2CH (CH3)2CHCH2 (CH3)3CCH2 (CH3)3C CH3CHCH2C(CH3)3
CH3 CH3 H2
4H2O
碱性介质 0-5℃
3
H
H +2 MnO2+2KOH
OH
OH
(2) 浓的KMnO4溶液,在酸性介质或较高温度下 氧化烯烃得到烯烃双键断链的含氧化合物:
RCH CH2 KM△nO4/H+ RCOOH + CO2+ H2O
RCH C R KM△nO4/H+
R'
R
RCOOH + C O
R'
KMn△O4/H+
有机化学复习
(二)烃及其衍生物
第五章 饱和烃
• 饱和烃的沸点判断: • 在正构烷烃中,相对分子质量增加,沸点
增加
• 在同分异构体中:正构烷烃沸点>异构烷 烃沸点;支链数增加,沸点降低;分子的 对称性增加,沸点升高。
• 沸点高低取决于液体分子间力的大小,链 烷烃的稳定构象是分子中碳链呈锯齿状排 列。因此,有上述规律。
3、烯烃的加氢
• 烯烃的热稳定性的一般规律: RCH=CHR' >RCH=CH2 > CH2=CH2 R2C=CR2 > R2C=CHR > R2C=CH2 >RHC=CH2
4、烯烃的氧化反应
(1). 稀的KMnO4溶液(<5%)在碱性或中性、 较低温度下氧化烯烃,得到顺式邻二元醇:
3
+2KMnO4+
Y
RCH CH2
H CI,Br,I Y Z H OSO3H H OH
H OR
C I OH
Br OH
• 马氏加成(不对称加成)
CH3C=CH2CH3 CH3
HBr
CH3
CH3CCH2CH3
Br
• 硼氢化反应
CH=CH2 1, BH3/THF 2, H2O2/OH-
CH2CH2OH
CH CH2 1, BH3/THF 2, H2O2/OH-
• (3) 甲烷解离能较大,光照不足以产生自由基,黑暗中Cl2也 不产生自由基,故不发生反应。
第六章 不饱和烃
1、烯烃的亲电加成反应
–与质子酸反应(HX,H2SO4) –与卤素和次卤酸反应
–HBr的过氧化物效应
–硼氢化反应
CH=CH2 1, BH3/THF 2, H2O2/OH-
–碳正离子稳定性及碳正离子重排
O
100℃ 苯
O
顺丁烯二酸酐
O O 产率100% O
CHO
+
2,3-二甲基 丙烯醛 -1,3-丁二烯
CHO
产率100%
CO2C2H5
+
+
CO2C2H5
84%
CO2C2H5
16%
+
((181)) ((1120))
O C
O (1mol)
C O
△
CHO
+
△
O C
O C
O
CHO
8、炔烃
• 亲电加成(与烯烃相同)
环丙烷的开环加成
• 烷烃的卤代
H2SO4 Br2 / CCl4 Br
OSO3H
Br
HBr (1)
HBr / -O-O- Br
Br
H2 Pt / C
(2)
(3) (4) (5)
+ HNO3
70℃
HO2C(CH2)4CO2H
+ Br2 -60℃
Br
Br
燃烧
CO2 + H2O
CH(CH3)2
Cl2 FeCl3
