酶工程实验大纲
蛋白质与酶工程.

蛋白质与酶工程JIAOXUEDAGANG 教学大纲河北经贸大学生物科学与工程学院生物工程教研室薛胜平2010年11月编写说明使用教材是2008科学出版社陈守文的《酶工程》。
蛋白质与酶工程是将酶学理论与工程技术相结合,研究酶的研发改造、生产应用的一门新兴学科。
在研究内容、手段和目的上与基因工程、蛋白质工程、细胞工程、发酵工程等孪生学科是相互交融的整体。
其主要内容有酶学基础、酶的生产、酶的分离纯化、固定化酶及固定化细胞、酶的修饰、酶反应器、酶的非水相催化、模拟酶、抗体酶、核酶、酶的应用。
通过本课程的学习,对蛋白质与酶工程有一个比较全面的了解和掌握,为今后从事生物化学或酶学、酶工程的教学与研究,乃至整个生命科学的研究打下基础,扩大知识面,拓宽相关的科学研究领域进行必要的知识储备。
掌握基本概念和基本理论,酶学和酶工程研究中重要的设计思想、方法和应用,酶与酶工程在医学、工农业、畜牧业中的应用等,未来在酶学与酶工程领域中的研究方向、进展和热点。
适应今后酶工程将引起的发酵工业和化学合成工业的巨大变革。
要求学生按照大纲,突出重点,把酶学的基础理论知识,酶工程的理论知识和广泛的应用基础结合起来进行学习。
了解和掌握蛋白质与酶工程理论、研究方法与应用,有所发现,有所创造。
本大纲共有八章内容,适用于理工科的本科学生,由生物工程教研室薛胜平编写,集体讨论而定。
大纲编修时间:2010年11月课时分配表目录第一章绪论第一节.酶的基本概念与发展史一、催化作用的特点二、影响酶催化作用的因素三、酶的分类与命名四、酶的活力测定第二节.酶工程发展概况第三节.酶的生产方法。
第二章酶的分离工程第一节酶分离纯化的一般原则一.建立一个可靠和快速的测活方法二.酶原料的选择三.酶的提取四.酶的提纯五.酶的纯度检验第二节细胞的破碎及酶的提取一.生物材料的破碎(一)机械破碎法(二)物理破碎法1.温度差破碎法2.压力差破碎法3.超声波法(三)化学破碎法(四)酶促破碎法二.酶液的提取1.典型的提取液的组成2.提取液各组分的作用(1)离子强度调节剂与缓冲剂(2)温度调节剂(3)蛋白酶抑制剂(4)抗氧化剂(5)重金属螯合剂(6)增溶剂(去垢剂)3.酶的提取方法(1)盐溶液提取(盐溶)(2)酸溶液提取(3)碱溶液提取(4)有机溶剂提取第三节酶的纯化(一).调节溶解度(二)改变pH值(等电点沉淀法)(三)改变温度(四)有机溶剂沉淀法(五)复合沉淀法二.根据酶分子大小、形状不同的分离方法(一)离心分离:①差速离心②速率区带离心③等密度梯度离心(二)凝胶过滤:(三)过滤与膜分离三.根据酶分子电荷性质的方法(一)离子交换层析(二)电泳(三)等电聚焦四.根据专一性结合的方法(一)亲和层析(二)吸附层析(三)共价层析五.萃取分离①双水相系统萃取法②双水相亲和萃取③超临界萃取六.酶的结晶①盐析结晶②有机溶剂结晶③透析平衡结晶④等电点结晶⑤温度差法结晶⑥金属离子复合结晶法第四节酶纯度的检验一.超速离心法二.电泳(一)PAGE的优点(二)聚丙烯酰胺凝胶的聚合SDS-PAGE三.免疫技术(一)免疫扩散(二)免疫电泳四.恒溶度法一.浓缩:二.干燥:①真空干燥②冷冻干燥③喷雾干燥④气流干燥⑤吸附干燥第三章酶与细胞固定化第一节酶的固定化一.定义二.固定化酶的优缺点三.固定化酶的制备原则四.酶的固定化方法(一)非共价结合法(二)化学结合法(三)包埋法(四)无载体固定化(五)各种固定化方法的比较五.固定化酶的性质第二节辅酶的固定化第三节细胞的固定化一.概述二.固定化细胞的分类三.固定化细胞的制备四.固定化细胞技术今后发展的重要方向—基因工程菌的固定第四节原生质体的固定化一.固定化细胞在实际应用中的缺陷二.固定化原生质体的制备第四章化学酶工程第一节概述一.酶的分子工程二.具体内容第二节酶分子的化学修饰一.酶化学修饰的目的二.影响酶蛋白化学修饰反应的因素(一)蛋白质功能基的反应性(二)修饰剂的反应性三.酶化学修饰的设计(一)对酶性质的了解(二)修饰试剂的选择四.修饰程度和修饰部位的测定(一)分析方法1.直接法2.间接法(二)化学修饰数据的分析1.化学修饰的时间进程分析2.确定必需基团的性质和数目五.酶蛋白侧链的修饰六.酶的化学交联七.蛋白质化学修饰的局限性第四节酶的人工模拟一.模拟酶的概念二.模拟酶的理论基础(一)酶学基础(二)超分子化学1.主—客体化学(host-guest chemistry)2.超分子化学(supramolecular chemistry)三.模拟酶的设计四.模拟酶的分类五.主-客体酶模型六.胶束酶模型七.肽酶八.半合成酶九.印迹酶(一)分子印迹技术(二)分子印迹酶第五章酶的非水相催化第一节酶非水相催化的研究概况第二节有机介质中酶催化反应的影响因素第三节酶在有机介质中的催化特性第四节有机介质中酶催化反应的条件及控制第五节有机介质中酶催化的应用第六章生物酶工程第一节酶基因的克隆和表达第二节酶分子的改造第三节融合酶第七章酶反应器第一节酶反应器的类型与特点第二节酶反应器的选型与酶反应器的设计第三节酶反应器的操作第八章研究的方向、进展和热点、核酶第一节核酶(一)核酶(二)脱氧核酶(三)核酶的应用第二节抗体酶(一)抗体酶概念、产生的理论基础(二)抗体酶的制备方法(三)抗体酶的应用第一章绪论【教学目的与要求】通过本章的学习使学生了解和掌握蛋白质与酶工程的定义、特点及蛋白质与酶工程的应用。
基础生物学

目录《基础生物学》实验教学大纲 (1)《生物化学(Ⅰ)》实验教学大纲 (2)《微生物学》实验教学大纲 (5)《遗传学》实验教学大纲 (8)《细胞生物学》实验教学大纲 (10)《分子生物学》实验教学大纲 (13)《生物信息学》实验教学大纲 (15)《食品分析》实验教学大纲 (19)《人类遗传病》实验教学大纲 (21)《实验动物学》实验教学大纲 (23)《实验动物营养学》实验教学大纲 (24)《人体解剖生理学》实验教学大纲 (26)《仪器分析》实验教学大纲 (28)《植物生物学》实验教学大纲 (30)《动物生物学》实验教学大纲 (32)《医学遗传学》实验教学大纲 (34)《酶工程》实验教学大纲 (36)《动物实验方法学》实验教学大纲 (38)《光镜与电镜》实验教学大纲 (40)《实验动物繁殖育种学》实验教学大纲 (41)《生物工程下游技术》实验教学大纲 (43)《基因工程》实验教学大纲 (45)《细胞工程》实验教学大纲 (47)《植物组织培养技术》实验教学大纲 (49)《微生物工程》实验教学大纲 (51)《生物工艺学》实验教学大纲 (53)《医学微生物与免疫学》实验教学大纲 (54)《生物标本制作》实验教学大纲 (57)《比较解剖学》实验教学大纲 (59)《基础生物学》实验教学大纲课程代码:课程名称:基础生物学课程性质:必修课程类别:专业基础实验项目个数:9面向专业:生物技术实验教材:黄诗笺主编《动物生物学实验指导》,高等教育出版社,2001王英典、刘宁主编《植物生物学实验指导》,高等教育出版社,2001一、课程学时学分课程学时:80学分:4实验学时:28二、实验目的、任务、教学基本要求及考核方式1、目的和任务:通过本课程的学习,获得基础生物学必要的基本理论、基本知识和基本技能。
了解生物的基本特性及其生命活动规律,为学习后续课程及从事于本专业有关的生物技术打下一定基础。
2、教学基本要求:掌握基础生物学实验技术的基本操作和技能,熟练使用显微镜,并对原生生物及动植物的基本形态和结构有所了解。
酶工程实验碱性磷酸酶实验报告

猪肝中碱性磷酸酶的分离纯化及部分性质研究实验报告摘要:碱性磷酸酶(alkaline phosphatase,简称ALP)广泛存在于微生物和动物体内,是一种非特异性磷酸单酯酶。
本实验材料取自猪肝,采用有机溶剂沉淀分离纯化其中所含的碱性磷酸酶,运用终止法和考马斯亮蓝法测定其酶活力和蛋白质含量。
根据酶活力变化,进行不同温度,PH对该酶的影响的实验,得出最适温度和最适PH。
关键词:碱性磷酸酶;有机溶剂沉淀;酶活力;PH;温度1 前言碱性磷酸酶是广泛分布于人体肝脏、骨骼、肠、肾和胎盘等组织经肝脏向胆外排出的一种酶。
碱性磷酸酶是一种能够将对应底物去磷酸化的酶,即通过水解磷酸单酯将底物分子上的磷酸基团除去,并生成磷酸根离子和自由的羟基,这类底物包括核酸、蛋白、生物碱等。
而该脱去磷酸基团的过程被称为去磷酸化或脱磷酸化。
本实验中所用的猪肝中的碱性磷酸酶含量颇高,且其活性可在较长时间内得以保持。
1.1实验目的掌握以有机溶剂分离技术提取蛋白质及酶的原理和方法;酶蛋白纯化过程中的活性、比活性、得率及纯化倍数的概念及计算;了解AKP的临床意义及纯化蛋白质的一般方法。
1.2 实验试剂与仪器1.2.1 实验仪器电子天平;匀浆器;紫外可见分光光度计;高速冷冻离心机;PH计;磁力加热搅拌机1.2.2实验试剂及配制95%乙醇、丙酮、正丁醇、醋酸镁、醋酸钠、Tris、考马斯亮蓝G-250、硫酸镁、氢氧化钠(1)0.01mol/L醋酸镁-0.01mol/L醋酸钠混合溶液:取0.5mol/L醋酸镁20mL 及0.1mol/L醋酸钠100mL,混匀后加蒸馏水稀释至1000mL。
(2)0.01mol/L Tris-硫酸镁缓冲液(pH8.8):称取三羟甲基氨基甲烷(Tris)12.1g,用蒸馏水溶解,并稀释至1000mL,配制0.1mol/L Tris溶液;取0.1mol/L Tris溶液100mL,加蒸馏水约700mL,再加0.5mol/L醋酸镁20mL,混匀后用1%醋酸溶液调节pH至8.8,用蒸馏水稀释至1000mL即可。
酶工程的概念?其主要研究内容和任务有哪些?

1酶工程的概念?其主要研究内容和任务有哪些?概念:酶的生产与应用的技术过程称为酶工程。
内容:微生物细胞发酵产酶、动植物细胞培养产酶、酶的提取与分离纯化、酶分子的修饰、酶,细胞和原生质体固定化、酶的非水相催化、酶反应器和酶的应用。
任务:经过预先设计,通过人工操作,获得人们所需的酶,并通过各种方法使酶充分发挥其催化功能2.什么是核酸酶类?其发现有何重要意义?定义:主要由核糖核酸组成——核酸类酶(R酶)意义:它的发现,改变了有关酶的概念,被认为是最近20年来生物科学领域最令人鼓舞的发现之一。
3.P酶和R酶的分类和命名有何异同?主要由蛋白质组成——蛋白类酶(P酶);主要由核糖核酸组成——核酸类酶(R酶)P酶的分类原则:a按照酶催化作用的类型,将蛋白质酶类分为六大类b每个大类中,按照酶的作用底物、化学键或基团的不同,分为若干亚类c每一亚类中再分为若干小类d每一小类中包含若干具体的酶命名:根据系统命名法,每一种具体的酶,除了有一个系统名称以外,还有一个系统编号。
系统编号采用四码编码方法。
第一个号码表示该酶属于6大类酶中的某一类,第二个号码表示该酶属于该大类某一亚类,第三个号码表示亚类中的某一个小类,第四个号码表示这一具体的酶在该小类中的序号。
R酶的分类原则:a根据酶作用的底物是其本身RNA分子还是其他分子,可以将R酶分为内催化和分子间催化两大类。
b在每个大类中,根据酶的催化类型不同,将R酶分为若干亚类c在每个亚类中,根据酶的结构特点和催化特性的不同,分为若干小类d在每一小类中包含若干具体的酶4.简述酶活力单位的概念和酶活力的测定方法?概念:在最适条件(温度25℃)下,每分钟内催化1微摩尔(μmol)底物转化为产物所需的酶量为1个酶活力单位,即IU=1μmol /min。
测定方法:化学测定法、光学测定法、气体测定法5.试述酶工程的发展概况与前景?发展概况:1894年,日本的高峰让吉用米曲霉制备得到淀粉酶,开创了酶技术走向商业化的先例。
《基因工程制药》课程教学大纲
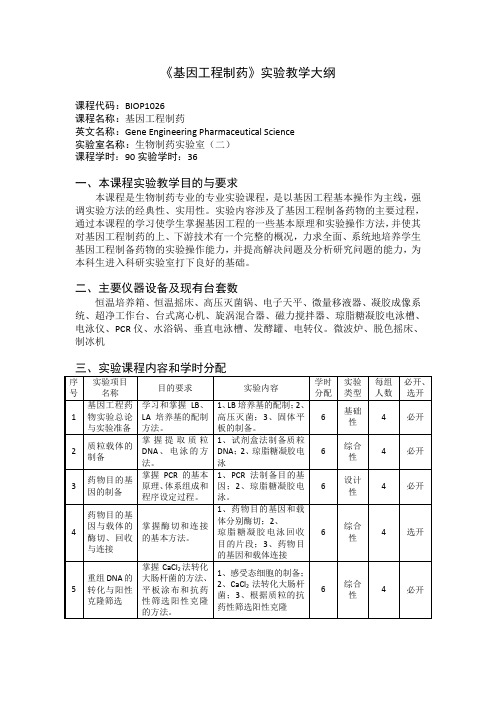
《基因工程制药》实验教学大纲课程代码:BIOP1026课程名称:基因工程制药英文名称:Gene Engineering Pharmaceutical Science实验室名称:生物制药实验室(二)课程学时:90实验学时:36一、本课程实验教学目的与要求本课程是生物制药专业的专业实验课程,是以基因工程基本操作为主线,强调实验方法的经典性、实用性。
实验内容涉及了基因工程制备药物的主要过程,通过本课程的学习使学生掌握基因工程的一些基本原理和实验操作方法,并使其对基因工程制药的上、下游技术有一个完整的概况,力求全面、系统地培养学生基因工程制备药物的实验操作能力,并提高解决问题及分析研究问题的能力,为本科生进入科研实验室打下良好的基础。
二、主要仪器设备及现有台套数恒温培养箱、恒温摇床、高压灭菌锅、电子天平、微量移液器、凝胶成像系统、超净工作台、台式离心机、旋涡混合器、磁力搅拌器、琼脂糖凝胶电泳槽、电泳仪、PCR仪、水浴锅、垂直电泳槽、发酵罐、电转仪。
微波炉、脱色摇床、制冰机三、实验课程内容和学时分配四、考核方式1、实验报告:本门课程要求实验报告应具有“实验目的与要求、原理、实验基本过程、实验结果与讨论”等几个方面的内容。
2、考核方式(1)实验课的考核方式:本课程按等级制评定与考核,评分标准分为:A、B、C、D、E五个等级。
考核主要包括两部分:实验操作技能、实验报告(包括实验预习报告)。
(2)实验课考核成绩确定,实验课成绩占课程总成绩的比例等:在该课程的评定分数中,实验课内容占30%,其中实验课考核又分为两部分,即实验操作技能占实验课总分数的60%、实验报告(包括实验预习报告)占实验课总分数的40%。
五、实验教材、参考书1、教材:自编参考楼士林主编《基因工程》,科学出版社20072、参考书目:(1)基因工程技术实验指导,钟卫鸿主编,化学工业出版社 2007(2)基因工程实验指导,朱旭芬主编,高等教育出版社,2006(3)基因工程实验技术,彭秀玲编著,湖南科学技术出版社 1997《酶工程制药》实验教学大纲课程代码:BIOP1027课程名称:酶工程制药英文名称:Enzyme Engineering Pharmaceutical science实验室名称:药学院实验中心生物制药实验室课程学时:90实验学时:36一、本课程实验教学目的与要求本课程实验教学的目的是让学生掌握酶制剂的发酵生产方法、酶的固定化原理与操作方法、酶分子的修饰原理和实验方法等,加深学生对抽象的理论内容的理解;通过实验训练,培养学生的动手操作能力和观察能力,正确掌握实验仪器的使用方法和实验操作技能,培养学生独立解决问题的能力和严谨的科学态度。
酶工程酶学概论

A对照管— A实验管
(
×
1
×
1
×
1 0.1
× 10
发酵液体积 反应时间 0.1A= 1单位
0.2
15
稀释倍数
)
比色法:
酶反应的产物可与特定的化学试剂反应而生成稳定的有色溶液, 生成颜色的深浅与产物浓度在一定范围内有线性关系。
过氧化物酶活性的测定
过氧化物酶是植物体内普遍存在的、活性较高的一种酶。 在有过氧化氢存在的条件下,过氧化物酶能使愈创木酚氧化,生 成茶褐色物质,该物质在 470 nm 处有最大吸收。
与酶分子上的某些必需基团结合,使这些基团的结构 和性质发生改变,从而引起酶活力的下降或丧失。
与变性剂的区别: 1. 没有引起酶的变性 2. 有一定的选择性
抑制剂的分类:
不可逆抑制剂
不可逆抑制剂通常以比较牢固的共价键与酶蛋 白中的基团结合,而使酶失去活性。 不可逆抑制剂与酶结合后,不能通过透析和超 过滤等物理方法除去抑制剂。 如:有机磷, 有机汞、有机砷、氰化物,重金属等。
米氏常数的意义:
3. Km值可帮助判断某一代谢的方向及生理 功能。催化可逆反应的酶,对正逆两个方向 反应的Km常常是不同的。
测定这些Km的大小及细胞内正逆两向的底物浓度,
可以大致推测该酶催化正逆两向反应的效率;这对了解酶在细 胞内的主要催化方向及生理功能具有重要的意义。
4. 判断酶的最适底物。 有的酶可作用多种 底物,因此对每一个底物都有一个Km值,Km最 小的那个底物为该酶的最适底物或天然底物。
(1)竞争性抑制作用(competitive inhibition) (2)非竞争性抑制作用(noncompetitive inhibition) (3)反竞争性抑制作用(Uncompetitive inhibition) (4)线性混合型抑制作用
酶的特异性实验实验报告(3篇)
第1篇一、实验目的1. 理解酶的特异性原理;2. 通过实验验证酶对特定底物的催化作用;3. 掌握实验操作步骤和数据处理方法。
二、实验原理酶是一种生物催化剂,具有高度的特异性。
酶的特异性表现为:一种酶只能催化一种或一类底物发生反应,而对其他底物无催化作用。
本实验以唾液淀粉酶对淀粉和蔗糖的催化作用为例,验证酶的特异性。
三、实验材料与仪器1. 实验材料:- 新鲜唾液;- 2%淀粉溶液;- 2%蔗糖溶液;- 0.3% NaCl溶液;- 碱性硫酸铜溶液(班氏试剂);- 恒温水浴;- 试管及试管架。
2. 实验仪器:- 移液器;- 烧杯;- 玻璃棒;- 酒精灯;- 滴管。
四、实验步骤1. 配制唾液淀粉酶溶液:取少量新鲜唾液,用0.3% NaCl溶液稀释10倍,得到唾液淀粉酶溶液。
2. 配制底物溶液:分别取2%淀粉溶液和2%蔗糖溶液各5mL,加入等量的唾液淀粉酶溶液,混合均匀。
3. 水浴加热:将混合后的溶液放入恒温水浴中,保持50℃恒温30分钟。
4. 加入班氏试剂:分别取混合后的淀粉溶液和蔗糖溶液各2mL,加入等量的班氏试剂,充分振荡。
5. 观察结果:静置5分钟,观察溶液颜色变化。
若出现砖红色沉淀,说明底物被酶催化分解;若无颜色变化,说明底物未被酶催化分解。
五、实验结果与分析1. 实验结果:- 淀粉溶液中加入班氏试剂后,出现砖红色沉淀,说明淀粉被唾液淀粉酶催化分解;- 蔗糖溶液中加入班氏试剂后,无颜色变化,说明蔗糖未被唾液淀粉酶催化分解。
2. 结果分析:- 本实验验证了酶的特异性原理,唾液淀粉酶只能催化淀粉的分解,而对蔗糖无催化作用;- 酶的特异性是酶催化作用的重要特征,也是酶在生物体内发挥重要作用的基础。
六、实验结论通过本实验,我们成功验证了酶的特异性原理。
酶只能催化特定底物的分解,对其他底物无催化作用。
这一特性使得酶在生物体内发挥重要的催化作用,为生物体内的化学反应提供高效、特异的催化。
七、实验注意事项1. 实验过程中,注意溶液的混合均匀,避免因混合不充分导致实验结果不准确;2. 实验操作过程中,严格遵守操作规程,确保实验安全;3. 注意观察实验现象,及时记录实验结果,为后续分析提供依据。
蛋白质与酶工程实训报告
2014-2015学年第二实践学期蛋白质与酶工程综合实训报告专业:生物技术班级: B1204*名:***学号: **********指导教师:***二○一五年七月六日100g/LZnSO4 0.5 0.5 0.5 0.5 0.5 蒸馏水 3 3 3 3 3 0.5 mol/L NaOH 0.5 0.5 0.5 0.5 0.5 充分摇匀,室温下静放5min,过滤,另取5支中试管,同上编号,按下表加入试剂滤液(mL) 1 1 1 1 1 蒸馏水(mL) 2 2 2 2 2 显色液(mL) 0.75 0.75 0.75 0.75 0.75 迅速摇匀,用分光光度计在420 nm 下测定各管A 值。
5支试管在420 nm 下各管A 值分别为0.294、0.278、0.254、0.243、0.180三、实验结果:以尿素终浓度1/C为横坐标,1/A(1/v)为纵坐标作图,然后依1/C找出对应1/A点,将各点连线并延长与1/C轴相交,得- 1/Km ,计算出Km(以x×10-nmol·L-1表示)。
1/C 100 150 200 2501/A 1.01 1.02 1.08 1.12Km值代表酶的亲和力,km值越大亲和力越小,反之则越大。
三、实验结果:测得糖浆液重:45.5g实训三、不同浓度果胶酶对澄清果汁收得率的影响所需药品与仪器:药品:桃子、果胶酶溶液、抗坏血酸溶液、明胶、活性炭。
仪器:榨汁机、水果刀、PH试纸、温度计、定性滤纸、量筒、烧杯、刻度试管、恒温水浴器等。
一、实验原理桃汁中存在的果胶,有很强的保护胶体的作用,能保持稳定的浑浊度,同时,果胶溶液粘度大,如果不加处理,过滤是困难的,而且即使过滤之后,在果汁中所存在的果胶和其它高分子物质,在贮藏中,由于分解、与金属离子结合及其他作用,也会产生凝固沉淀,因此,在过滤之前,必须先进行澄清,常用的澄清方法主要有自然澄清法和热处理法、冷冻法、酶法、加澄清剂法、离心分离法、超滤法等。
《发酵工程》课程实验教学大纲(生物制药方向)
《发酵工程》课程实验教学大纲(生物制药方向)《发酵工程》课程实验教学大纲(生物制药方向)1. 实验教学目的:本课程旨在通过实验教学,使学生通过参与实际的发酵工程操作,了解发酵过程的基本原理与技术,并培养其实验操作、数据处理、问题解决和团队合作等能力,为将来从事相关生物制药工作做好准备。
2. 实验教学内容:(1)发酵工艺基础实验:学生学习发酵基本原理、发酵微生物筛选与培养方法、介质配方与调控策略等。
实验内容包括发酵微生物的分离与纯化、菌种的培养与保藏、生物酶的筛选与鉴定、酵母菌的发酵与调控等。
(2)发酵设备与控制实验:学生学习发酵设备的结构与工作原理、发酵过程的监测与控制方法等。
实验内容包括发酵设备的组装与调试、发酵过程中的参数监测与控制、发酵设备的日常维护与管理等。
(3)发酵工程实验:学生参与真实的发酵工程项目,掌握从发酵微生物的分离与培养到产品的提取与纯化的整个流程。
实验内容包括发酵工艺的设计与优化、发酵过程的实时监测与控制、产品的提取与纯化等。
3. 实验教学安排:(1)实验前准备:学生提前学习与准备实验所需的理论知识,包括发酵工艺原理、发酵微生物的特性、发酵设备的工作原理等。
(2)实验讲解与指导:教师进行实验讲解,包括实验目的、操作步骤与注意事项等,并指导学生进行实验操作,确保实验工作的安全与顺利进行。
(3)实验数据处理与报告撰写:学生对实验数据进行整理与分析,并撰写实验报告,包括实验目的、方法、结果与讨论等,培养学生的科学研究与论文写作能力。
4. 实验成果评价:(1)实验报告:根据实验报告的完整性、准确性、逻辑性和深度等维度对学生进行评价,并根据评价结果进行成绩评定。
(2)实验操作:根据学生在实验过程中的操作规范性、技术熟练度和实验结果的准确性等维度进行评价,并根据评价结果进行成绩评定。
(3)实验问题解决与团队合作:根据学生在实验中遇到问题的解决能力和与同学协作的团队精神进行评价,并根据评价结果进行成绩评定。
酶学及酶工程1章
酶学的回顾:近代
二十世纪酶学进入快速发展。前半期, 过渡态理论解释了酶催化的物理化学机 理(Linus Pauling, 1948)。50-60年 代Koshland提出了诱导契合模型,此时 有关酶活性调节的理论也被提出。1965 年Monod,Wyman和Changeux提出了别 构理论。与此同时,Clealand发展了多底 物多产物的酶动力学原理和公式。
教学内容和方法的特点
1. 和国内院校酶学教学相比,对酶动力学内容 有一定侧重。 1)和国际接轨; 2)重点解决难点; 3)发挥教师特长。 2. 理论和方法并重。和一般专业基础课相比更 偏重于研究方法。 3. 有一定的课外练习。记分,占成绩的30%, 考试占70%(课堂开卷)。
选课
要求:有本科生物化学基础。 根据所学专业的需求和本人现有的专业 基础进行选课。 可能需要花费较多时间完成课程学习, 对于还不习惯和较多公式打交道的同学 会有难度,但也会学到一些在科研和技 术上实用的东西。 不保证全部通过。不要盲目选课。
酶存在形式
自由酶(游离酶) 固定化酶: 固定化酶: ①稳定性高;②可反复使用; ③ 产物纯度高,副产物少,从而有利提纯;④生 产可连续化、自动化;⑤设备小型化,节约能 源等。 固定化细胞: 固定化细胞:在实际应用方面已大大超过固定 化酶。 瑞典Mosbach等提出一种利用高分子聚合物包 埋各种细胞的通用的固定化方法,能固定细菌、 酵母、动植物细胞及人工组建的细胞,生产各 种代谢产物。
酶工程简介
酶工程(enzyme engineering)是生物工程的主要内 容之一。 研究(以应用为目的) 研究(以应用为目的):是在一定生物反应装置中 利用酶的催化性质,将相应原料转化成有用物质的技术。 应用(工业规模): 应用(工业规模):①酶的产生;②酶的分离纯化; ): ③酶的固定化;④酶生物反应器。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
湖北大学酶工程实验(0818800193)实验教学大纲(第2版)生命科学学院生化教研室2014年7月前言课程名称:酶工程实验实验学时:16学时适用专业:生物工程课程性质:必修一、实验课程简介酶工程是生物工程的主要内容之一,是现代酶学和生物工程学相互结合而发展起来的一门新的技术学科。
它将酶学、微生物学的基本原理与化工、发酵等工程技术有机结合起来,并随着酶学研究的迅速发展,特别是酶的广泛应用而在国民生产生活中日益发挥着越来越重要的作用。
酶工程实验课是生物工程等本科实验教学的一个重要组成部分,通过实验教学可以加强学生对酶工程基本知识和基本理论的理解,掌握现代酶学与相关技术的有关的基本的实验原理与技能。
在实验过程中要求学生自己动手,分析思考并完成实验报告。
酶工程实验性质有基础性、综合性、设计(创新)性三层次。
二、课程目的本实验课程主要根据酶工程的三大块内容即酶的生产、酶的改性与酶的应用来设计安排实验,通过这些实验内容,使学生深入理解酶工程课程的基本知识;巩固和加深所学的基本理论;掌握酶工程中基本的操作技能。
同时,通过实验培养学生独立观察、思考和分析问题、解决问题和提出问题的能力,养成实事求是、严肃认真的科学态度,以及敢于创新的开拓精神;并在实验中进一步提高学生的科学素养。
三、考核方式及成绩评定标准考核内容包括实验过程中的操作情况,实验记录及结果的准确性,实验报告的书写及结果分析,思考题的回答情况,仪器设备的使用情况及遵守实验室规章制度的情况等,根据这些方面进行成绩评判和记录,综合给出实验总成绩。
四、实验指导书及主要参考书1.魏群:生物工程技术实验指导,高等教育出版社,2002年8月。
2.禹邦超:酶工程(附实验),华中师范大学出版社,2007年8月五、实验项目实验项目一览表(可选)实验类型:演示性、验证性、综合性、设计性、其它实验一双酶法制备淀粉糖(3课时)一、实验原理目前国内外淀粉糖的生产大都采用双酶法。
双酶法生产淀粉糖是以淀粉为原料,先经α-淀粉酶液化成糊精,再用糖化酶催化生成淀粉糖浆。
α-淀粉酶又称为液化型淀粉酶,它作用于淀粉时,随机地从淀粉分子内部切开α-1,4葡萄糖苷键,使淀粉水解成糊精和一些还原糖。
糖化酶又称为葡萄糖淀粉酶,它作用于淀粉时,从淀粉分子的非还原端开始逐个地水解α-1,4葡萄糖苷键,生成葡萄糖和一些低聚糖。
且糖化酶还有一定的水解α-1,6葡萄糖苷键和α-1,3葡萄糖苷键的能力。
二、实验步骤1.液化:准确称取50g生粉,加150mL水(pH 6.0~6.4,HCl)配制成40%的淀粉浆,加入0.1gCaCl2,加入0.7gα-淀粉酶,在75℃温度下保温40min左右,使淀粉液化成糊精。
液化反应过程中用碘反应检测,至颜色变为黄棕色时,即为终点。
升温至100℃并保温10min。
2.糖化:将液化淀粉液冷却至55℃~60℃,用0.1m1/LHCl调pH至4.5~5.0,加入0.12g糖化酶,将水浴槽温度升至60土2℃,保温糖化16h,使糊精转变为葡萄糖和低聚糖(淀粉糖浆)。
3.脱色:在淀粉糖浆中加入1g活性炭,在80℃下搅拌30min后,滤去活性炭,得无色透明糖液。
4. 所得糖液中葡萄糖含量的测定。
用3,5-二硝基水杨酸法测定。
三、实验结果:测定所得无色透明糖液中葡萄糖的浓度。
四、仪器和试剂1.仪器:恒温水浴器、烧杯、玻璃棒、天平、量筒及其他常规仪器用具。
2.试剂:生粉、α-淀粉酶、糖化酶、0。
1mol/L HCI、无水CaCl2、。
碘液、活性炭。
实验二、不同浓度果胶酶澄清苹果汁效果、对收得率的影响(4课时)实验类型:验证性实验目的:通过实验掌握酶在食品工业上的基本应用,果胶酶作用的基本原理和果汁生产的基本工艺与过程。
实验内容:1.制备苹果汁:将苹果洗净,切成小块,用榨汁机打碎成果汗匀浆。
加热苹果汁到100℃使酶钝化后,再冷却至50℃左右。
2.配制不同浓度的酶液:取5支10mL的刻度试管,依次编为2号~6号。
分别加入2mL、4mL、6mL、8mL、10mL质量浓度为10g/L的果胶酶溶液,再分别加入苹果酸定容至10mL,依次配制质量浓度为2,4,6,8,10g/L的果胶酶溶液备用。
(实验老师已配好)3.降解苹果汗:取6个号烧杯,向1号烧杯加蒸馏水1mL,向2号~6号烧杯分别加入1mL质量浓度为2,4,6,8,10g/L的果胶酶溶液。
再向6只烧杯中均加入4mL蒸馏水,摇匀,然后都加入95mL经钝化的苹果汁,45℃水浴中恒温60min。
4.沉淀:向上述6只烧杯中均添加明胶约0.02g,硅溶胶约0.1mL,膨润土约0.20g,活性炭约0.05g处理,添加顺序为:明胶等主要起吸附、沉淀和过滤作用。
所用物品符合食品安全要求。
充分混匀后静置60min,使其充分沉淀后过滤。
过滤进先用纱布初滤,并挤干,所得初滤液再抽滤。
5.记录结果观察6个样品滤液的澄清度,用量筒测量澄清滤液(即苹果汁)的体积,将结果填入下表。
不同酶浓度下苹果汗收得率澄清效果苹果汗体积(mL)澄清苹果汁收得率(%)实验要求:总结不同果胶酶浓度下苹果汁的澄清效果,并观察使苹果汁获得最高收得率时所需的果胶酶浓度。
分析所出现的实验结果的原因,并回答相应的实验思考题。
实验三、实习参观细胞发酵罐细胞培养产酶(1课时)实验类型:演示性实验目的:了解产酶的细胞发酵罐的基本结构,掌握细胞发酵产酶时的工艺条件及进行相关调控的基本原理和方法。
实验内容:参观发酵罐及其配套的空压机、蒸汽机、发酵罐调控主机,了解各个设备的主要功能。
熟悉发酵罐的运行的基本操作,对pH、溶氧、温度、搅拌速度等重要参数动手进行设定、调节。
掌握发酵罐的基本结构,内部组成、有关的通气、通水等管道走线的构造、规律等。
主要设备器材:江苏大学产自动控制发酵罐及配套蒸汽机、空压机。
实验要求:了解发酵罐的基本结构,有关的通气、通水等管道走线的构造、规律,掌握有关发酵罐运行时有关参数的设定、检测及调节的方法,对利用细胞发酵罐进行细胞培养用以产酶的流程有大致的了解。
实验四、有机溶济沉淀法制备大豆脲酶及测定(3课时)实验类型:综合性实验目的:掌握酶的提取与性质测定中的实验方法,熟悉有关酶提取与活力、Km值测定的基本原理和基本操作。
实验内容:1.提取:(1)称取约5g人造浮石,置小烧杯中,用2%乙酸浸泡1-2分钟,倾去酸,用蒸馏水洗涤至中性,沥干备用。
(2)称取约10g新鲜大豆粉,置于锥形瓶中,加上述人造浮石,加50ml32%丙酮溶液,在冰浴中持续摇动4~5min,4层纱布过滤,收集滤液。
(3)将滤渣重新置于锥形瓶中,另加10ml32%丙酮,再提取一次。
纱布过滤,滤液在4℃,3500r/min 下离心8~10min,倾出上清液,计量体积。
取1mL酶液保存,供测酶活力用。
2.沉淀酶:(1)将提取的酶液置冰浴中缓慢搅拌下,用滴管逐滴滴加2%醋酸,并不断用精密pH试纸检测pH变化,观察产生混浊现象,至pH4.9。
置4℃10分钟。
(2)4℃3500r/min 离心10min,沉淀用电吹风稍微吹干,所得即为脲酶粗品。
称重,计算酶收得率。
3.脲酶的活力测定:脲酶的活力测定利用脲酶催化尿素水解成氨和二氧化碳,氨与纳氏试剂反应生成黄色化合物,吸光度与氨年度成正比,可测定脲酶活力大小。
实验要求:提取大豆脲酶,并进行收得率和脲酶的活力测定,结果计算:1)提取制备脲酶的收得率:样品重酶液总体积测酶活留取液体体积酶干重酶干重酶收得率%100 /(%)⨯+=2)脲酶活力测定:式中:n为酶样品的稀释倍数实验五、尼龙固定化木瓜蛋白酶(5课时)实验类型:综合性实验目的:通过实验掌握酶固定化的基本原理,学习酶固定的基本方法和了解固定化酶在实际中的应用及固定化酶活力回收率及相对活力的测定。
实验内容:1.固定化酶的制备(1)每组取5块尼龙布洗净、晾干,浸入含18.6%CaCl2溶液和18.6%水的甲醇溶液中,在室温下保温10s左右,并轻轻搅拌至尼龙布发粘。
取出后用水冲去污物,用吸水纸吸干。
(2)将尼龙布用3.65mol/LHCI溶液在室温下水解45min,用水洗至pH值中性。
(3)将尼龙布用5%戊二醛溶液在室温下浸泡偶联20min。
(4)取出尼龙布,用0.1mol/L磷酸缓冲液(pH值7.8)反复洗涤,洗去多余的戊二醛,吸干之后,立即用酶液(0.5~1mg/mL)在4℃下固定 3.5h(酶液用量每块尼龙布不宜超过0.8mL)。
(5)从酶液中取出尼龙布(保留残余酶液作测定用),用0.5mol/LNaCl溶液(用0.1mol/L 磷酸缓冲液(pH值7.2)配制),洗去多余的酶蛋白,即为尼龙固定化酶。
2.酶活力测定(1)溶液酶活力测定:取0.2mL酶液,加入1.8mL激活剂,于37℃下预热10min,加入37℃预热的0.5%酪蛋白溶液1mL,准确反应10min,然后加入10%三氯乙酸溶液2.0mL 终止酶反应。
对照管先加入10%三氯乙酸溶液,后加酪蛋白溶液,其他与测定管相同,以4000r/min的转速离心5min或过滤,取其上清液于波长280nm处测定消光值。
在上述条件下,每10min增加0.001个消光值为1个酶单位(U)(以下同)。
(2)残留酶活力测定:方法同溶液酶活力测定。
(3)固定化酶活力测定:取一块尼龙布固定化酶,加入2.0mL激活剂,其余步骤与溶液酶测定相同。
实验要求:使用交联法用尼龙固定木瓜蛋白酶,计算测定尼龙固定的木瓜蛋白酶的活力及固定效率。
结果计算:活力回收=固定化酶总活力/溶液酶总活力×100%;相对活力=固定化酶总活力数/溶液酶总活力数—残留酶活力数。
实验六、酶工程的设计实验与考查(3课时)实验类型:设计性实验目的:学生根据酶工程课程所学知识和前几个实验所掌握的内容,自己查找资料,设计一个酶的相关实验。
让学生自己动手动脑,进行设计性或创新性实验,锻炼学生的综合、创新能力。
实验内容:学生在实验室现有的条件和合理的经费预算下,根据酶工程理论课所学的知识和范围,自己设计实验内容与过程。
实验要求:根据所学课程知识,设计出与酶工程相关的合理、可行的实验方案,列出详细的实验步骤,配置实验相关的试剂,独立进行实验操作,记录实验过程及结果数据,并分析出现所得实验结果的原因,讨论所设计的实验相应的完善方案。
