东华理工大学 物理化学试题和答案
物理化学__华东理工大学(9)--《物理化学》(上)考试试卷及答案(A)
四、(14 分) 20℃时,HCl 气体溶于苯中形成理想稀溶液。
(1)当达气液平衡时,若液相中 HCl 的摩尔分数为 0.0385,气相中苯的摩尔分数为 0.095。试求气相 总压。(7 分)
(2)当达气液平衡时,若液相中 HCl 的摩尔分数为 0.0278。试求气相中 HCl 气体的分压。(7 分) 已知 20℃时纯苯的饱和蒸气压为 10010Pa。
D.
K 1
(K
2
)0.5
=1
二、(15 分) 以 25℃的 1mol CH4 (g) 和 4mol H2O(l) 为原料,在恒定压力下进行如下化学反应: CH4 (g) + H2O(g) → CO(g) + 3H2 (g)
第2页
若 CH4 的转化率为 50%,终态温度为 700℃,试求整个过程的热量。设气体服从理想气体状态方程,各物
相化合物之间彼此完全不互溶,则在 A 和 B 完整的液固平衡相图中最低共熔点有( )个。
A. 2 ; B. 3 ; C. 4;
D.5
17. 对于正偏差系统,下列正确的说法是( )。
A. pi < pi*xi ;
B.正偏差强烈时,可形成最高恒沸混合物 ;
C. pi = pi*xi ;
D.正偏差强烈时,可形成最低恒沸混合物
8. 体积功的定义式是( )。
∫ A.W
=−
V2
pdV
;
V1
∫ B.W = − V2 p外dV ; V1
∫ C.W = V2 p外dV ; V1
∫ D.W =
V2
Vd p
V1
9. 当化学反应 H2 (g) + 0.5O2 (g) = H2O(g) 达平衡时,下列式子何者正确?(
东华理工大学物理(上)
l
l2
2 sin
2n
l 1 l 2 1 11 / n ) ] · / ( 2Δl) =1.7×10-4 rad λ
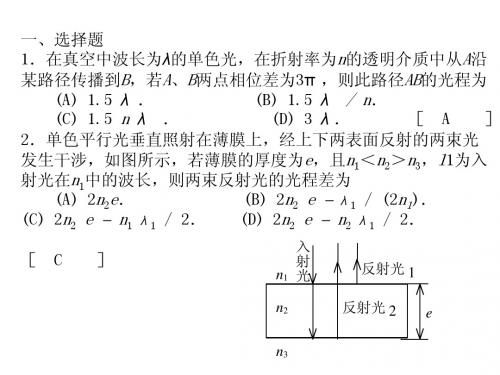
13.波长λ= 650 nm的红光垂直照射到劈形液膜上,膜 的折射率n = 1.33,液面两侧是同一种媒质.观察反 射光的干涉条纹. (1) 离开劈形膜棱边的第一条明条纹中心所对应的膜 厚度是多少? (2) 若相邻的明条纹间距L= 6 mm,上述第一条明纹 中心到劈形膜棱边的距离x是多少? 解: (1) 2n ek+ λ / 2 = k λ (明纹中心) 现 k = 1, ek = e1 膜厚度 e1 = λ / 4n = 1.22×10-4 mm (2) x = L/ 2 = 3 mm
二、填空题 8.若一双缝装置的两个缝分别被折射率为n1和n2的两块厚度 均为e的透明介质所遮盖,此时由双缝分别到屏上原中央 极大所在处的两束光的光程差δ =(n1-n2)e或(n2-n1)e均 可.
9.用λ =600 nm的单色光垂直照射牛顿环装置时,从中央向 外数第4个(不计中央暗斑)暗环对应的空气膜厚度 为 1.2 mm.(1 nm=10-9 m)
1
n2 n3
e
4.在双缝干涉实验中,光的波长为600 nm (1 nm=10-9 m),双 缝间距为2 mm,双缝与屏的间距为300 cm.在屏上形成的干涉图 样的明条纹间距为 (A) 0.45 mm. (B) 0.9 mm. (C) 1.2 mm (D) 3.1 mm. [ B ]
5.把双缝干涉实验装置放在折射率为n的水中,两缝间距离为d, 双缝到屏的距离为D (D >>d),所用单色光在真空中的波长为λ , 则屏上干涉条纹中相邻的明纹之间的距离是 (A) λ D / (nd) (B) n λ D/d. (C) λ d / (nD). (D) λ D / (2nd). [ A ] 6.由两块玻璃片(n1=1.75)所形成的空气劈形膜,其一端厚度 为零,另一端厚度为0.002 cm.现用波长为700 nm (1nm = 10 9 m)的单色平行光,沿入射角为30°角的方向射在 膜的上表面,则形成的干涉条纹数为 (A) 27. (B) 40. (C) 56. (D) 100. [ A ] 7.若把牛顿环装置(都是用折射率为1.52的玻璃制成的)由空气 搬入折射率为1.33的水中,则干涉条纹 (A) 中心暗斑变成亮斑. (B) 变疏. (C) 变密. (D) 间距不变. [ C ]
东华理工大学物理(上)

16.波长λ=600nm(1nm=10﹣9m)的单色光垂直入射到一光栅上, 测得第二级主极大的衍射角为30°,且第三级是缺级. (1) 光栅常数(a + b)等于多少? (2) 透光缝可能的最小宽度a等于多少? (3) 在选定了上述(a + b)和a之后,求在衍射角-π/2<< π/2 范围内可能观察到的全部主极大的级次.
三、计算题 13.在某个单缝衍射实验中,光源发出的光含有两秏波长λ1和 λ2,垂直入射于单缝上.假如λ1的第一级衍射极小与λ2的第二 级衍射极小相重合,试问 (1) 这两种波长之间有何关系? (2) 在这两种波长的光所形成的衍射图样中,是否还有其他 (2) 极小相重合? 解:(1) 由单缝衍射暗纹公式得
15.单缝的宽度a =0.10 mm,在缝后放一焦距为50 cm 的会聚透镜,用平行绿光(λ=546 nm)垂直照射到单缝上, 试求位于透镜焦平面处的屏幕上中央明条纹宽 度.(1nm=10-9m)
解:中央明纹宽度 Δx≈2fλ/ a =2×5.46×10-4×500 / 0.10mm =5.46 mm
二.填空题 8.在单缝的夫琅禾费衍射实验中,屏上第三级暗纹对应于单 缝处波面可划分为 6 个半波带,若将缝宽缩小一半,原 来第三级暗纹处将是 第一级明 (只填“明”也可以) 纹. 9.平行单色光垂直入射于单缝上,观察夫琅禾费衍射.若屏 上P点处为第二级暗纹,则单缝处波面相应地可划分为 4 个 半波带.若将单缝宽度缩小一半,P点处将是 第一 级 暗 纹. 10.波长为λ的单色光垂直入射在缝宽a=4 λ的单缝上.对应 于衍射角=30°,单缝处的波面可划分为 4 个半波带. 11.将波长为λ的平行单色光垂直投射于一狭缝上,若对应于 衍射图样的第一级暗纹位置的衍射角的绝对值为θ,则缝的宽 度等于 λ/ sinθ . 12.一束平行单色光垂直入射在一光栅上,若光栅的透明缝 宽度a与不透明部分宽度b相等,则可能看到的衍射光谱的级 次为 0,±1,±3,......... .
物理化学思考题(东工)(复习用)

物理化学 思考题10.下列几种说法是否有错误,请予指出:(1) 因为内能和焓是状态函数,而恒容过程Qv =∆U ,恒压过程Qp =∆H , 所以Qv 和Qp 也是状态函数(2) 由于绝热过程Q =0,∆U =W ,所以W 也是状态函数。
11.在一个绝热密闭(容积不变)的反应器中,通一电火花(设电火花的能量可以不计),使下列物质反应:由于过程是绝热恒容的,所以 Q =0、W =0、∆U =0、∆H=0,这个结论对吗?12.有一个绝热密闭容器(如习题l —12图所示),带有理想的(无摩擦,无质量)活塞,活塞左边盛空气,右边为真空。
习题1—12 图(1)若将销子拔掉,则空气向真空膨胀,间过程的Q 、W 、∆U 为若干?(2)如上题膨胀后,再将活塞推回原位置,问过程的Q 、W 、∆U 为正,为负还是为零?(3)当活塞回到原位置时,体系和环境是否都恢复原状态?13.如在12题所示的容器中,中间设一隔板,隔板左右两边分别盛等量的H 2和N 2,过程的Q 、W 、∆U 为正,为负还是为零?1. ―理想气体恒温膨胀的结果是把吸收的热完全变成功”这种说法与第二定律的开尔文说法是否有矛盾?2.有人声称,他设计的热机高温热源和低温热源的温度分别为400K 和250K ,当热机从高温热源吸热5000kJ 时,可对外作功4000N ,同时放出1000kJ 的热给低温热源。
这可能吗?根据是什么?3.下列说法如有错误,请予以改正。
(1)在一可逆过程中,体系的熵值不变。
(2)体系作一不可逆循环,熵变等于零。
(3)任一过程,体系的熵变等于过程的热温商。
(4) ∆S <0的过程不能发生。
(5)因为熵是状态函数,所以,绝热可逆过程与绝热不可逆过程的熵变都等于零。
4. ―110。
C 、1atm 下,过热的水变成汽所吸收的热Q P =∆H 。
因为∆H 只决定于初、末态,与过程是否可逆无关,故可根据:来计算此过程的熵变。
”这种算法是否正确?为什么?5. 在哪些情况下,体系的自由能变化∆F 与自由焓变化∆G 相等?试举例说明之。
华东理工大学《物理化学》 练习题答案

第1章 物质的pVT 关系和热性质基本概念1.(1) (3)。
2. (1)分子无体积;(2)分子间无相互作用。
3.气。
4.气液共存区的边界线;不稳定区的边界线。
375.0ccc c ==RT V p Z ,得到普遍化的范德华方程以及对应状态原理。
5.a 气体;b 饱和气体;c 气液共存;d 饱和液体;e 液体。
6.不能,MPa 8.59=p7.状态一定,状态函数的量值一定;状态函数量值的变化仅与系统的初终状态有关。
对于一个均相系统,如果不考虑除压力以外的其他广义力,为了确定平衡态,除了系统中每一种物质的数量外,还需确定两个独立的状态函数。
8. (1) 外p p =,(2) =常数外p p =。
9. (1)封闭系统;(2)封闭系统,恒容过程,非体积功为零;(3)封闭系统,恒压过程,非体积功为零。
10. 压力为0.1MPa 下处于理想气体状态的气态纯物质。
压力为0.1MPa 下的液态和固态纯物质。
压力为0.1MPa 下浓度为3dm mol 1-⋅或1kg mol 1-⋅的理想稀溶液中的溶质。
11. 降低;=。
12.BB B )0(νζn n -=。
从数量上统一表达反应进行的程度。
13.<, =。
14.=, <。
15.=, >。
16. (1)×;(2)×;(3)√。
17. 实验测定;经验半经验方法;理论方法。
18. 反应前后气体的物质的量之差。
计算题1. 解:mol 1071.6mol )15.27330(3145.8101001021.169363--⨯=⎥⎥⎦⎤⎢⎢⎣⎡+⨯⨯⨯⨯==RT pV n []211122112211 )-(1 M y M y n M n y M y n M n M n m +=+=+= []2211) -( M M M y n +=836.001.4601.30101.461071.6219.0132121=-⋅⎪⎭⎫ ⎝⎛-⨯=-⋅⎪⎭⎫⎝⎛-=∴-M M M n m y 2. 解:以“1”代表空气,以“2”代表H 2O ,()mol 613.0mol 15.273253145.8100.1510325.1013311=⎥⎦⎤⎢⎣⎡+⨯⨯⨯⨯==-RT pV n3.174kPa kPa 01982.0613.001982.0325.10121222=⎪⎭⎫⎝⎛+⨯=+⋅==n n n p y p p331121dm 5.15dm 0.15613.001982.0613.0=⨯+=⋅+=V n n n V3. 解:以“1”代表NO ,以“2”代表“Br 2”,以“3”代表NOBr 开始时,p 1(0) = 23.102kPa9.76kPa Pa 10055.13003145.8)81.159/660.0()/()0(32222=⨯⨯⨯===-V RT M m V RT n p 平衡时,[]3213323132121)0()0(21)0()0(p p p p p p p p p p p p -+=+⎥⎦⎤⎢⎣⎡-+-=++=[]14.25kPa kPa )737.2576.9102.23(2)0()0(2213=-+=-+=∴p p p p 8.85kPa kPa )25.14102.23()0(311=-=-=p p p 2.64kPa kPa )25.142176.9(21)0(322=⨯-=-=p p p 4. 解:()RT b V p =-m , b pRTV +=m ,1,m 2,m kV V = 即kb p RT k b p RT k b p RT +=⎪⎪⎭⎫ ⎝⎛+=+112, ⎪⎪⎭⎫ ⎝⎛-=-=-21121)1(p p k p RT p RT p RT k k b ⎪⎪⎭⎫ ⎝⎛-⋅-=∴21111p p k p RT k b 133mol m 10132.5101.3250.01107510101.325273.15)(08.31450.01107511-⋅⎪⎭⎫ ⎝⎛-⋅⨯+⨯⋅-=135mol m 102.437--⋅⨯=A 3*m 3444N r V b ⋅⋅==π0.134nm m 100.134m 10022.61610437.2316393/12353/1A =⨯=⎪⎪⎭⎫⎝⎛⨯⨯⨯⨯=⎪⎪⎭⎫ ⎝⎛=∴--ππN b r5. 解:(1) I ,液-固;II ,气-液;III ,气-固。
华东理工大学《物理化学》(上)单元测试卷(二)

华东理工大学《物理化学》(上)单元测试卷(二)热力学定律和热力学基本方程一、选择题(每小题1分,共30分)1. 下列叙述不正确的是 。
A :不可逆过程发生的实质都归结于能量品位的降低;B :凡是不违背能量守恒原理的过程都能发生;C :一个不可能进行的过程假设已经进行,必将使能量的品位升高2. 在800K 的高温热源和300K 的低温热源之间运转的热机,当其从高温热源吸收800kJ 的热量并对外做功时,则热机至少需将 kJ 的热量传给低温热源。
A :300;B :400;C :5003. 从熵的统计意义可判断下列过程的熵变S ∆大于零的是 。
A :苯乙烯聚合成聚苯乙烯;B :气体在催化剂上吸附;C :液态苯汽化成气态苯4. 下列说法中不正确的是 。
A :可逆绝热过程的ΔS 总是等于零;B :不可逆绝热过程的ΔS 总是大于零;C :不可逆绝热过程的ΔS 总是小于零5.绝热不可逆过程中,系统(Sys )与环境(Sur )的熵变,正确的是 。
A :Sys Sur Δ0,Δ0S S ==;B :Sys Sur Δ0,Δ0S S >=;C :Sys Sur Δ0,Δ0S S =< 6. 在一绝热恒容的系统中发生了一个爆炸反应,系统的温度和压力都升高了,以下结论正确的是 。
A :Δ0,Δ0,Δ0U H S =>=;B :Δ0,Δ0,Δ0U H S =>>;C :Δ0,Δ0,Δ0U H S ==>7. 一化学反应在恒压绝热的条件下发生(W /=0),反应系统的温度升高且体积增加了,以下结论正确的是 。
A :Δ0,Δ0,Δ0U H S =>>;B :Δ0,Δ0,Δ0U H S >=>;C :Δ0,Δ0,Δ0U H S <=>8. 恒温恒容条件下进行某化学反应,其1135kJ mol A -∆=-⋅,以下不正确的是 。
A :理论上最多可对外做135kJ 的非体积功;B :要使化学反应逆向进行,则外界至少需提供135kJ 的非体积功;C :理论上至少可对外做135kJ 的非体积功9. 关于吉布斯函数G ,下列说法中正确的是 。
华东理工大学物理化学练习题答案12

第12章 独立子系统的统计热力学基本概念1. 各粒子间除可以产生弹性碰撞外,没有任何相互作用的系统;各粒子间存在相互作用的系统;各粒子只能在固定位置附近的小范围内运动的系统;各粒子可在整个空间运动的系统;独立的离域子系统;相倚的离域子系统。
2. 平动、转动、振动、电子运动、核运动;平动、转动、振动;电子运动、核运动;平动;转动、振动、电子运动、核运动。
3. 1个三维平动子,1个线型刚性转子和1个单维简谐振子;1个三维平动子,1个三维刚性转子和3n -6个单维简谐振子。
4. 3;3;3。
5. )(82223/22z y x n n n mVh ++;)1(822+πJ J I h ;νυh )2/1(+。
6. 指粒子在各能级上的分布;540。
7. ∏jj N jN g N j!!。
8.∏jjN jN g j!;j jN g>>(温度不太低、密度不太高、粒子的质量不太小)。
9. 最概然分布;相对微观状态数较为显著的那些分布在一定误差范围内与最概然分布已无实际区别,故最概然分布代表一切可能的分布,系统的微观粒子的分布方式几乎不随时间变化。
10. (1)一定的宏观状态对应着巨大数目的微观状态,它们各按一定的概率出现;(2)宏观力学量是各微观状态相应微观量的统计平均值;(3)孤立系统中每一个微观状态出现的概率都相等Ω1=i P 。
11. ()1ln /ln lim max =∞→ΩNω 。
12. qg N N kTi i i ε−=e ;平衡的独立子系统,对于独立的离域子系统还必须满足温度不太低、密度不太高、粒子质量不太小的条件。
13. ∑−=i kT i i g q )/(e ε;∑−=h kT h q )/(e ε; ∑−−=i kT i i g q )/()(00e εε;)/(00e kT q q ε−=。
14. 粒子逃逸基态能级程度的度量;N 个粒子均处于基态能级;1。
15. 子配分函数是相应各种运动形式的子配分函数之积;0n e 0v 0r t q q q q q 。
物理化学__华东理工大学(1)--单元测试卷

。
A:临界温度;B:沸点;C:摩尔体积
10. 为使纯物质气体经恒温压缩而液化,其温度必须低于它的
温度。
A:冰点; B:三相点; C:临界
11. 在一定温度和压力下求解范德华方程,得到三个摩尔体积的值:0.0523、0.2534 和 2.9523
m3 ⋅ mol−1 ,其中饱和液体的摩尔体积为
。
A: 0.0523 m3 ⋅ mol−1 ;B: 0.2534 m3 ⋅ mol−1 ;C: 2.9523 m3 ⋅ mol−1
5. 压力趋近于零时,物质在任何温度下的压缩因子都趋近于
。
A: 1; B:0; C:无法确定
6. 对于实际气体的压缩因子,以下错误的说法是
。
A:压缩因子是温度和压力的函数;
B:压缩因子仅是压力的函数;
C:压力一定时,压缩因子是温度的函数
7. 考察压力接近于零时 Z 随 p 变化的斜率(∂Z/∂p)T,p→0,发现低温时<0,高温时>0,其间必有
一温度使(∂Z/∂p)T,p→0=0,这一温度称为
。
A:波义耳温度;B:临界温度;C:沸点
8. 某气体的状态方程为 pVm=A+Bp+Cp2+…,其中 A, B,C 等均是温度的函数,则在 400K
时,A 的值等于
。
A:3325.6;B:4325.6;C:无法确定
9. 当压力发生变化时,物质的性质不发生变化的是
试求反应 0.5H2 (g) + 0.5I2 (g) → HI (g) 在 225 °C 时的恒压热效应 Qp 和恒容热效应
QV
。已知
25
°C
时
∆f
H
m
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物理化学模拟题一、选择题(30分,每题2分)1. 热力学第三定律可以表示为┈┈┈┈┈┈┈┈┈┈┈┈┈( ) (A).在0K 时,任何晶体的熵等于零 (B).在0K 时,任何完整晶体的熵等于零 (C).在0℃时,任何晶体的熵等于零 (D).在0℃时,任何完整晶体的熵等于零2. 理想气体从状态p 1,V 1,T 等温膨胀到p 2,V 2,T ,此过程的ΔA 与ΔG 的关系为┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈( )(A). ΔA >ΔG (B). ΔA <ΔG (C ). ΔA =ΔG (D).无法确定3.一定量的理想气体,从同一初态分别经历等温可逆膨胀、绝热可逆膨胀到具有相同压力的终态,终态体积分别为V 1、V 2。
┈┈┈( ) (A). V 1 < V 2 (B). V 1 = V 2(C ). V 1 > V 2 (D). 无法确定4.方程mmV T H T Pβαβα∆∆=d d 适用于以下哪个过程┈┈┈┈┈┈┈┈┈┈┈┈┈( ) (A).NH 4Cl(s)= NH 3(g)+ HCl(g) (B).NH 4Cl(s)溶于水形成溶液 (C).H 2O (s)= H 2O (l) (D).H 2和O 2化合为水 5. 两液体的饱和蒸汽压分别为p*A ,p *B ,它们混合形成理想溶液,液相组成为x ,气相组成为y ,若 p *A > p *B ,则:┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈( ) (A) y A > x A (B) y A > y B (C) x A > y A (D) y B > y A6. 在通常情况下,对于二组分物系能平衡共存的最多相为:┈┈┈┈┈┈( ) (A) 1 (B) 2 (C) 3 (D) 47. 25℃时水的饱和蒸气压为3.168kPa, 此时液态水的标准生成吉布斯自由能Δf G m 为-237.19kJ ·mol -1,则水蒸气的标准生成吉布斯自由能为:┈┈┈( ) (A) -245.76kJ ·mol -1 (B) -229.34kJ ·mol -1 (C) -245.04kJ ·mol -1 (D) -228.60kJ ·mol -18. 已知反应 3O 2(g) = 2O 3(g) 在25℃时θm r H ∆ =-280J ·mol -1,则对该反应有利的条件是:┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈( ) (A) 升温升压 (B) 升温降压 (C) 降温升压 (D) 降温降压 9. 298K 0.01mol•kg -1的CaCl 2水溶液中,CaCl 2的离子平均活度系数γ±为( )(A )0.847 (B )0.791 (C )0.889 (D )0.66610. 某反应表观速率常数k 与基元步骤速率常数间的关系为21412)(k kk k =,则表观活化能与各基元步骤活化能的关系为┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈( )(A )E=E 2+21(E 1-E 4) (B )E=E 2+21(E 1+E 4) (C )E=E 2+E 1-E 4 (D )E=E 2(41E E)2111. 由MgCO 3(s)、BaCO 3(s)、BaO(s)、MgO(s)及CO 2(g)构成的一个平衡系统,其独立组分数和自由度分别为┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈( ) (A) 5,3 (B) 4,2 (C) 3,1 (D) 3,0 12. 同一温度和压力下,一定量某物质的熵值存在┈┈┈┈( ) (A).s l g S S S 〈〈 (B). s l g S S S 〉〉 (C). s l g S S S == (D). s l g S S S =〉13.某反应物的速率常数为0.099min -1,反应物初始浓度为0.2mol·dm -3,则反应的半衰期为┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈( )(A). 7 min (B). 1.01 min (C). 4.04 min (D).50.5 min14.在α、β这两相中均含有A 、B 两种物质,当达到相平衡时下列化学势关系中正确的是┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈┈( )(A). ααμμB A = (B). βαμμA A = (C). αβμμB A = (D). ββμμB A =15.已知电极反应(1) Cu e Cu →++22 ,E 1 =0.34V (2) ++→+Cu e Cu 2,E2=0.167V则Cu e Cu →++的标准电极电势E 3为┈┈┈┈┈┈┈┈┈( ) (A).0.507V (B). 0.513V (C). 0.173V (D). 0.267V二、填空题(10分,每题2分)1、25℃时,0.5molA 与0.5molB 形成理想液态混合物,则混合过程的 ΔS=________。
2、有相同活度的Fe 2+,Ca 2+,Zn 2+,Cu 2+的电解质溶液,已知E (Fe 2+/Fe ) =-0.440V ,E (Ca 2+/Ca ) =-2.861V ,E (Zn 2+/Zn ) =-0.763V ,E (Cu 2+/Cu ) =0.340V,则溶液中它们的析出先后顺序为________________。
3、水平放置的毛细管中间放有一段液体,液体完全润湿,在右端对液体加热,则液体会向_______移动(左,右,不)4、在393K 时,水的表面张力σ=0.0727 N·m -1 ,一根毛细管插入其中,管内液面上升了2.97cm ,。
设水的密度ρ=1.0×103 kg ·m -3 。
设接触角为0o,已知g=9.81m ·s -1。
毛细管半径为___________m 。
5、一定量的理想气体经历某过程变化到终态,若变化过程中,PV γ不变,则状态函数______不变。
三、 计算题1、(12分)5mol 单原子理想气体,从始态300K ,50kPa 先绝热可逆压缩至100kPa ,再恒压冷却至体积85dm 3的末态,求整个过程的Q 、W 、ΔU 、ΔH 、ΔS 、ΔG 。
(已知300K 、50kPa 下该气体的摩尔熵为100J ·K -1·mol -1)2、(13分)已知298.15K 以下数据:物质SO 3(g) SO 2(g) O 2(g) θm f H ∆/kJ ·mol -1-395.2 -296.1 0 θm S /J ·K -1·mol -1256.2248.5205.03(1)、求298.15K ,θP 下反应 SO 2(g) +21O 2(g) = SO 3(g)的θK ;(2)、设θm r H ∆,θm r S ∆不随温度变化,反应物按反应计量系数比进料,在什么温度下,SO 2的平衡转化率可以达到80%?3、(12分)在298K 时,已知AgBr 的溶度积K sp (AgBr)=4.88×10-13,E θ(AgBr|Ag)=0.0715V ,E θ(Br 2|Br -)=1.065V 。
(1) 将AgBr(s) 的生成反应: Ag(s)+1/2Br 2(l)=AgBr(s),设计成原电池。
(2) 求出上电池的标准电动势和AgBr(s)标准生成吉布斯函数。
(3) 若上电池电动势的温度系数(∂E /∂T )p =1×10-4V ·K -1,计算该电池反应的∆r H m θ,∆r S m θ,Q r ,m 。
(4) 计算银电极的标准电极电势 E θ(Ag +|Ag)。
4、(6分)在300K 时若某物质A 的分解反应为一级反应,初速率为1.00×10-5mol ·dm -3·s -1,1小时后的速率为3.26×10-6 mol ·dm-3·s -1,求300K 时(1)反应的速率常数和反应的半衰期t 1/2 。
(2)分解率达80%时,所需的时间?5、(5分)证明:dV V T C dp p T C TdS P P V V ⎪⎭⎫⎝⎛∂∂+⎪⎪⎭⎫ ⎝⎛∂∂=6、(12分)下图为一二组分凝聚系统相图, (1)在图中标明各相区;(2)画出由状态点W 和I 冷却的步冷曲线;(3)将物系点W 的熔体100g 进行冷却,可得到何种纯固体,最多得到多少克纯固体。
物理化学本1参考答案一、 选择题 BCCCA DDCDA DBABB 二、填空题1、5.76 J ·K -12、Cu- Fe- Zn- Ca3、左水4、m 3105.0-⨯ 5、熵或S三、1、解:n=5mol⎩⎨⎧==−−→−⎩⎨⎧=−−→−⎩⎨⎧====3332302201185,10030050dm V T p p T kPa p K T kPa p dp Qr 单原子理想气体Cv,m=1.5R ,Cp,m =2.5RK K K p p T T mCp R 85.395501003004.01212,=⎥⎥⎦⎤⎢⎢⎣⎡⎪⎭⎫ ⎝⎛⨯=⎪⎪⎭⎫ ⎝⎛= ……… (1.5分)K K nR V p T 46.204314.8585100333=⎪⎭⎫⎝⎛⨯⨯==……………………(1.5分) 整个过程)(.13T T m Cv n U -⋅⋅=∆=[5×1.5×8.314× (204.46-300)]J =-5.958 K J (1.5分) )(.13T T m Cp n H -⋅⋅=∆=-9.930 K J …………………………………………(1.5分) 因01=∆S 所以=⨯=∆=∆+∆=∆23221ln ,T Tm nCp S S S S [5× 2.5×8.314×ln85.39546.204]J ·K -1= -68J ·K -1…………………………………………………(1.5分)J T T m nCp H Q Q Q Q ]]85.39546.204{314.85.25[){,232221-⨯⨯⨯=-=∆==+== -19.891 kJ …………………………………………………………………(1.5分)()()()()[]231223212215.1,T T T T nR V V P T T m nCv W W W ---=---=+==()()[]{}KJ J 93.1385.39546.20430085.3955.1314.85=---⨯⨯…………(1分)S 3=S 1+ΔS=(5×100-68)=432 J ·K -1(1分)())(1133T S T S H TS H G --∆=∆-∆=∆=-68.32 kJ (1分)2、解:①. 11(395.2)(296.1)099.1kJ mol 2r m H θ-∆=----⨯=-⋅┈┈┈( 2分 ) -11256.2248.5205.0394.82J K 2r m S θ∆=--⨯=-⋅┈┈( 2分 )31(99.1)298.15(94.82)1070.83kJ mol r m G θ--∆=--⨯-⨯=-⋅( 2分 )28.571270830exp() 2.56108.314298.15K e θ===⨯⨯┈┈( 2分 )②. SO 2(g) + 1/2O 2(g) = SO 3(g)t =0时 mol 1 0.5 0t =∞时 mol 1-α 0.5-1/2α α n 总=1.5-1/2α┈┈( 1分 )121211.52()10.5.05111.5 1.522P x P K K Pθθαααααα-⎛⎫ ⎪ ⎪ ⎪-⎝⎭==⎛⎫⎛⎫ ⎪⎪-- ⎪⎪ ⎪⎪--⎝⎭⎝⎭11221122(3)0.8 2.213.27(1)(1)0.20.2αααα-⨯===--⨯┈┈( 2分 )99100852ln 94.828.314ln13.27r m r m H T K S R K θθθ∆-===∆---⨯( 2分 ) 3、解:(1) 将生成反应 Ag(s) + (1/2)Br 2(l) → AgBr(s) 设计成电池:正极: (1/2) Br 2(l) +e - → Br -负极: Ag(s) + Br - → AgBr(s) + e -电池:Ag(s) | AgBr | Br - | Br 2(l) (2分)E θ= E θ [Br 2(l)/Br -]-E θ [AgBr(s)/Ag]=1.065V -0.0715V=0.9935V (1分) ∆r G m θ= -zFE θ= (-1×96500×0.9935) J ·mol 1= -95872 J ·mol 1(1.5分)(2) ∆r S m θ=zF (∂E /∂T ) p =1×96500C ·mol -1×1×10-4V ·K -1=9.65 J ·K -1·mol -1 (1.5分)Q r =T ∆r S m θ= 298K ×9.65 J ·K -1·mol -1=2876J ·mol -1(1分)∆r H m θ=∆r G m θ+T ∆r S m θ=∆r G m θ+Q r = -(95872+2876)J ·mol -1= -92996 J ·mol -1(1分)(3) AgBr 的沉淀反应 : Br - + Ag + → AgBr(s), K =K sp -1正极: Ag ++ e - → Ag(s)负极: Ag(s) +Br - → AgBr(s) +e -(2分) E θ= RT ln K sp -1/ F = E θ (Ag +|Ag)-E θ (AgBr|Ag) 所以 E θ (Ag +|Ag)=E θ (AgBr|Ag) -RT ln K sp / F= [0.0715V -8.315×298×ln(4.88×10-13)/96500]V = 0.7994V (2分)4、解:(1) υA =kc A = kc A0exp(-kt ))= υA,0exp(-kt )υA /υA,0=exp(-kt )代入数值 3.26×10-6 /1.00×10-5=exp(-3600s ×k ) 得 k =3.11×10-4s -1(2分)t 1/2=ln2/k =ln2/3.11×10-4s -1=2229s (2分)(2) t =-ln(1-x A )/k =-ln(0.2)/ 3.11×10-4s -1=5175s (2分) 5、(5分)证明:S=S (p,V )dV V T T C dp p T TC dV V T T S dp p T T S dV V S dp p S dS pp VVp p V V p V⎪⎭⎫⎝⎛∂∂+⎪⎪⎭⎫⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂⎪⎭⎫ ⎝⎛∂∂+⎪⎪⎭⎫ ⎝⎛∂∂⎪⎭⎫ ⎝⎛∂∂=⎪⎭⎫⎝⎛∂∂+⎪⎪⎭⎫ ⎝⎛∂∂= dV V T C dp p T C TdS P P V V ⎪⎭⎫⎝⎛∂∂+⎪⎪⎭⎫ ⎝⎛∂∂= 6、每个相区1分,每条步冷曲线1分首先析出C S (1分),根据杠杆规则m C ×(0.50―0.33)=(100―m C )(0.33― 0.20) m C =43.33g(2分)。
