烯烃和水的加成反应
第八章 烯烃 亲核加成 自由基加成 共轭加成

1. 烯烃的分类:累积二烯烃(H 2C=C=CH 2)、孤立二烯烃、共轭二烯烃2. 烯烃的结构特征:未参与杂化的p 轨道与烯烃平面垂直。
如果吸收一定的能量,克服了p 轨道的结合力,顺式或反式可以互转。
C=C 键的平均键能为610.9kJ ·mol -1,C-C σ键的平均键能为347.3 kJ ·mol -1,因此 键的键能大约为263.6 kJ ·mol -1。
二元取代烯烃比一元取代烯烃稳定8.3~12.5 kJ ·mol -1。
所以烯烃取代越多越稳定。
1,3-丁二烯是一个平面型分子。
键长均匀化是共轭烯烃的共性。
3. 烯烃的物理性质含2~4个碳原子的烯烃是气体,含5~15个碳原子的烯烃为液体,高级烯烃为固体。
所有烯烃都不溶于水,所有烃(C 、H )都不溶于水。
燃烧时,火焰明亮。
在sp n 杂化轨道中,n 数值越小,s 性质越强。
由于s 电子靠近原子核,它比p电子与原子核结合得更紧,轨道的电负性越大,所以电负性大小次序为s>sp>sp 2>sp 3>p 。
即碳原子的电负性随杂化时s 成分的增大而增大。
烯烃由 于sp 2碳原子的电负性比sp 3碳原子的大,比烷烃容易极化,成为有偶极矩的分子。
以丙烯为例,甲基与双键碳原子相连的键易于极化,键电子偏向于sp 2碳原子,形成偶极,负极指向双键,正极位于甲基一边。
因此当烷烃和不饱和碳原子相连时,由于诱导效应与超共轭效应成为给电子基团。
第八章 烯烃 亲核加成 自由基加成 共轭加成①在abC=Cab类型的烯烃中,顺型异构体总是偶极分子,而且沸点较高。
这对于识别顺反异构体是很有用的。
②也可以通过X射线衍射的方法测定相同基团之间的距离,以确定顺反异构体。
③核磁共振也是测定顺反异构体的有效方法。
共轭烯烃物理性质的特点:①紫外(电子)吸收光谱——向长波方向移动②易极化——折射率增高③趋于稳定——氢化热(烯烃催化加氢生成烷烃放出的热)降低。
与氢氧化钠反应的有机物

与氢氧化钠反应的有机物一、引言氢氧化钠(NaOH)是一种强碱性化合物,在有机合成中常用于碱催化反应、酸中和等反应中。
本文将重点介绍与氢氧化钠反应的有机物,包括它们的反应机理、反应条件以及产物特点等方面。
二、与氢氧化钠反应的有机物分类1. 羟基化反应羟基化反应是指在NaOH存在下,醛或酮与水发生加成反应,生成相应的醇。
这种反应通常需要高温高压条件下进行。
例如:CH3CHO + H2O → CH3CH2OH2. 羰基还原反应羰基还原是指在NaOH存在下,醛或酮与还原剂(如硼氢化钠)发生还原反应,生成相应的醇。
例如:CH3CHO + NaBH4 → CH3CH2OH3. 酯水解反应酯水解是指在NaOH存在下,酯与水发生加成反应,生成相应的羧酸和醇。
例如:CH3COOC2H5 + H2O → CH3COOH + C2H5OH4. 羧酸盐形成反应羧酸盐形成是指在NaOH存在下,羧酸与碱发生酸碱中和反应,生成相应的盐和水。
例如:CH3COOH + NaOH → CH3COONa + H2O5. 烯烃加成反应烯烃加成是指在NaOH存在下,烯烃与水发生加成反应,生成相应的醇。
例如:CH2=CH2 + H2O → CH3CH2OH三、反应机理1. 羟基化反应机理醛或酮分子中的羰基(C=O)与氢氧根离子(OH-)发生加成反应,生成相应的醇。
此过程中,氢氧根离子充当了亲核试剂的角色。
例如:CH3CHO + OH- → CH3CH2OH2. 羰基还原反应机理在NaBH4存在下,硼氢化钠(BH4-)可以向羰基中的C=O键提供一个负电荷,使得C=O键上的电荷变为负电荷。
此时,NaOH作为碱性催化剂,在体系中起到了促进还原反应的作用。
例如:CH3CHO + BH4- → CH3CH2OH + B(OH)33. 酯水解反应机理在NaOH存在下,水分子中的氢离子(H+)与酯分子中的羰基(C=O)发生加成反应,生成相应的羧酸和醇。
丙烯酸的加成反应

丙烯酸的加成反应是有机化学的重要反应之一,广泛应用于药品、染料、化妆品、塑料、合成橡胶等领域。
本文将从四个方面展开对做详细介绍。
一、什么是?添加反应主要是指在烯烃(如丙烯)的双键上添加另一种分子(如卤代烷、水、醇、酸、酯、醛等),从而构成更大的分子,突破原有分子结构的一种反应。
当双键被添加物位于两侧时,称为1,2-加成或顺式加成;当添加物位于同一侧时,称为1,4-加成或反式加成。
二、种类1、羟基丙烯酸酯的加成反应羟基丙烯酸酯是一种常用的丙烯酸衍生物,它可以通过加成反应与各种反应物反应,制备出具有不同结构和性质的化合物。
例如,与甲醇发生酯化反应,可以制得甲基丙烯酸甲酯;与乙二醇反应则可得乙二醇羟基丙烯酸酯;与亚硫酸氢钠反应则得硫醇羟基丙烯酸酯。
2、卤代烷的加成反应卤代烷是很常见的亲电试剂,在中也可以发挥重要的作用。
例如,与溴化氢反应得到丙醇溴化物,它可以与甲醛反应生产3-羟甲基丙酸甲酯;与氢氧化钠反应得到丙醇,它可以与苯甲酸反应生成苯乙酸。
3、水的加成反应丙烯酸的水解反应是一种常见的加成反应,丙烯酸与水在酸性条件下反应生成3-羟基丙酸,这是一种重要的有机合成反应。
该反应也可以发生于相反应体系中,由此开发出了新型催化剂和反应方式,促进了这类反应在实际中的应用。
4、其他加成反应还有很多种类,在有机合成中有很大的应用价值。
例如,通过氧化丙烯酸可得到丙烯酸醛;通过三乙零反应可以得到三丙烯酸酯;通过戊烯基锂反应可以得到2,4-庚二酮等。
这些反应种类在不同的研究领域、应用场合中发挥着各自的作用。
三、丙烯酸加成反应的机理丙烯酸加成反应的机理比较复杂,涉及到分子间的相互作用、电子云共振、原子轨道杂化等多种环节。
例如1,2-加成反应的机理,通常认为是亲电性试剂的负中心靠近了丙烯酸的双键,形成中间体,过渡态以上中间体的影响为引导;而1,4-加成反应通常认为是一个亲核试剂通过单一的nucleophilic attack,反应物的烷基和杂环核团增加残留类似之间的异质。
第二章 第二节 第2课时 烯烃的加成、氧化规律(学生版)

第2课时 烯烃的加成、氧化规律[核心素养发展目标] 1.掌握单烯烃的加成反应、加聚反应。
2.掌握二烯烃的加成反应。
3.掌握烯烃的氧化规律。
一、烯烃的加成规律1.单烯烃的加成(1)对称单烯烃的加成CH 3CH==CHCH 3+Br 2―→CH 3—CH==CH—CH 3+HBr ――→催化剂△(2)不对称单烯烃的加成 CH 3—CH==CH 2+HBr ――→催化剂△⎩⎪⎨⎪⎧ (主要产物)(次要产物)研究发现,当不对称单烯烃与卤化氢发生加成反应时,通常“氢加到含氢多的不饱和碳原子的一侧”,即遵循马尔科夫尼科夫规则(简称马氏规则)。
2.二烯烃的加成二烯烃是分子中含有两个碳碳双键的烯烃。
(1)n (CH 2==CH—CH==CH 2)∶n (Br 2)=1∶1的两种加成方式(2)CH 2==CH—CH==CH 2与足量Br 2的完全加成CH 2==CH—CH==CH 2+2Br 2―→。
3.烯烃的加聚反应 (1)二烯烃的加聚反应:n CH 2==CH—CH==CH 2――→催化剂CH 2—CH==CH—CH 2催化剂(2)多个烯烃的加聚反应:n CH2==CH2+n CH2==CH—CH3――→1.β-月桂烯的结构如图所示,一分子该物质与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有()A.2种B.3种C.4种D.6种2.现有两种烯烃:CH2==CH2和。
它们的混合物进行聚合反应,则聚合反应的产物中含有如下四种物质中的()①CH2—CH2②③④A.①④B.③C.②D.①②④二、烯烃的氧化规律烯烃与酸性KMnO4溶液的反应规律烯烃与酸性KMnO4溶液反应的生成物会因烯烃的结构不同而不同:烯烃被氧化的部分CH2==RCH==氧化产物CO2、H2O(酮)1.下列烯烃被酸性高锰酸钾溶液氧化后产物中可能有乙酸的是()A.CH3CH2CH==CHCH2CH2CH3 B.CH2==CH(CH2)3CH3C.CH3CH==CHCH==CHCH3 D.CH3CH2CH==CHCH2CH32.(2021·银川高二月考)已知某种烯烃经臭氧氧化后,在Zn存在下水解,可得到醛和酮。
有机化学课件 第三章 烯烃3
应经历溴 离子、反式加成。 • 反应经历溴鎓离子、反式加成。
Br H C C CH3 H H3C H C Br
+
H3C C C
H
H C
Br2
CH3
H Br
-
CH3 H CH3 C
Br
CH3
Br C H CH3
CH3 Br H (R) H Br (R) CH3 dl-
CH3 H Br (S) Br H (S) CH3
CH3 CH3 C CH=CH2 CH3 CH3 CH3 C CH CH3 + CH3 H3C Cl CH3 C CH CH3 Cl CH3 83%
HCl
17%
反应经历碳正离子中间体。 反应经历碳正离子中间体。 1,2-甲基迁移、1,2-负氢迁移。重排为更稳定的碳正离子。 1,2-甲基迁移、1,2-负氢迁移。重排为更稳定的碳正离子。
试比较下列分子或离子的超共轭效应大小。 [讨论] (1) 试比较下列分子或离子的超共轭效应大小。 讨论]
1) CH3CH=CH2 CH3CH2CH=CH2 (CH3)2CHCH=CH2 A B C 2) (CH3)3C (CH3)2CH CH3CH2 CH3 A B C D
+ + + +
(2) 试静态分析烯烃双键碳原子上电子云密度的大小。 试静态分析烯烃双键碳原子上电子云密度的大小。
碳正离子稳定性次序: 碳正离子稳定性次序: 3o C+ > 2o C+ > 1oC+ >CH3+
G
C
+
G
C
+
给电子基,使正电荷分散,碳正离子稳定: 给电子基,使正电荷分散,碳正离子稳定: 吸电子基,使正电荷更集中 碳正离子不稳定 碳正离子不稳定; 吸电子基,使正电荷更集中,碳正离子不稳定;
《烯烃》 知识清单

《烯烃》知识清单一、烯烃的定义与结构烯烃是一类含有碳碳双键(C=C)的不饱和烃。
最简单的烯烃是乙烯(C₂H₄),其结构中两个碳原子以双键相连,每个碳原子还分别与两个氢原子结合。
碳碳双键是由一个σ键和一个π键组成。
σ键较为稳定,而π键相对较弱,容易发生加成反应。
烯烃中碳原子的杂化方式通常为 sp²杂化,这使得碳原子形成平面三角形的构型。
二、烯烃的通式烯烃的通式为 CₙH₂ₙ(n≥2)。
例如,丙烯(C₃H₆)、丁烯(C₄H₈)等都符合这一通式。
三、烯烃的命名1、选择含有碳碳双键的最长碳链作为主链。
2、从距离双键最近的一端开始给主链碳原子编号。
3、标明双键的位置,将双键的碳原子编号写在烯烃名称的前面。
例如,CH₃CH=CHCH₃命名为 2-丁烯。
四、烯烃的物理性质1、状态在常温常压下,C₂C₄的烯烃为气体,C₅C₁₈的烯烃为液体,C₁₉以上的烯烃为固体。
2、溶解性烯烃难溶于水,易溶于有机溶剂。
3、密度烯烃的密度一般小于水。
五、烯烃的化学性质1、加成反应(1)与氢气加成例如,乙烯与氢气在催化剂的作用下发生加成反应生成乙烷:CH₂=CH₂+ H₂ → CH₃CH₃(2)与卤素加成如乙烯与溴水发生加成反应,使溴水褪色:CH₂=CH₂+ Br₂ → CH₂BrCH₂Br(3)与卤化氢加成丙烯与氯化氢加成可能生成 1-氯丙烷或 2-氯丙烷。
(4)与水加成在一定条件下,乙烯与水发生加成反应生成乙醇:CH₂=CH₂+H₂O → CH₃CH₂OH2、氧化反应(1)燃烧烯烃燃烧生成二氧化碳和水,如乙烯燃烧的化学方程式:C₂H₄+3O₂ → 2CO₂+ 2H₂O(2)使酸性高锰酸钾溶液褪色这是鉴别烯烃和烷烃的一种常用方法。
3、聚合反应烯烃可以发生加聚反应生成高分子化合物。
例如,乙烯发生加聚反应生成聚乙烯:nCH₂=CH₂ → CH₂CH₂ₙ六、烯烃的制备1、醇的脱水在一定条件下,醇可以脱水生成烯烃。
例如,乙醇在浓硫酸的作用下,加热到 170℃时发生脱水反应生成乙烯:CH₃CH₂OH → CH₂=CH₂↑ + H₂O2、卤代烃的消去反应七、烯烃的用途1、重要的化工原料用于生产塑料、橡胶、纤维等高分子材料。
加成反应

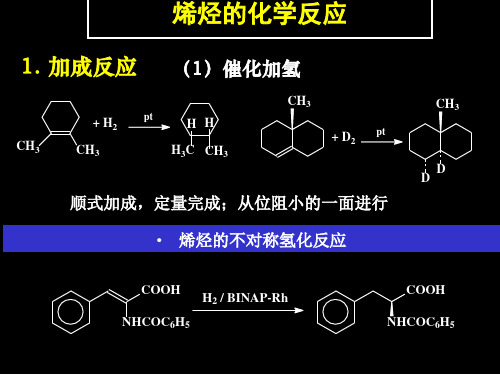
(1)催化加氢 )
在Pt、Pd、Ni等催化剂存在下,烯烃和炔烃与氢进行加成反应, 生成相应的烷烃,并放出热量,称为氢化热(heat of hydrogenation, 1mol不饱和烃氢化时放出的热量)如:
CH3CH=CHCH 3 + H 2
2012-4-16
Pt Ni
CH3CH2CH2CH3 CH3CH2CH2CH2CH3
3. 加成反应 (addition reaction) . •定义
烯烃或炔烃分子中存在π键,π键键能较小,容易断裂形成两个σ 键。即能在含双键或三键的两个碳原子上各加上一个原子或原子团 的反应即为加成反应(多为放热,是烯烃和炔烃的特征反应)。不稳 定的环烷烃的开环反应也属于加成反应。
C=C + X Y C=C X Y
12
(5)与水的加成 ) •烯烃加成及应用
磷酸作催化剂,不对称烯与水加成服从马氏规则:
H3PO 4 CH2=CH2 + H 2O 300℃7MPa~ CH3CH2OH , 8MPa H3PO 4 CH3CH=CH 2 + H 2O (CH3)2CHOH , 195℃ 2MPa
工业制醇的另一种方法——直接水合法。与间接水合法相比,可 减少硫酸对设备的腐蚀。
1
CH3CH2CH2C CH + H 2
•催化加氢的机理(改变反应途径,降低活化能)
吸附在催化剂上的氢分子生成活泼的氢原子与被催化剂削弱了π键 的烯、炔加成。
•氢化热与烯烃的稳定性
乙烯 丙烯 1﹣丁烯 顺﹣2﹣丁烯 反﹣2﹣丁烯 -119.7 -115.5 氢化热/kJ•mol﹣1 -137.2 -125.9 -126.8
2012-4-16
5
乙烯和溴水的反应方程式

乙烯和溴水的反应方程式
乙烯和溴水反应的化学方程式是C2H4 + Br2(溶液)= C2H4Br2。
乙烯是一种高分子有机物,也被称为乙烯基烯烃,是一种简单的烯烃
分子,由两个碳原子和四个氢原子组成,其分子式为C2H4。
溴水是由
氢溴酸和水组成的溶液,其分子式是HBrO。
当乙烯与溴水反应时,氢
溴酸中的氢原子会和乙烯中的氢原子发生取代反应,从而产生一种新
的烯丙烷烃,其分子式为C2H4Br2,这就是乙烯和溴水反应的简式反应
方程式。
反应的过程是,当乙烯与溴水反应时,会有一定数量的水分子被
拆解成氢和氧两种离子,并且氢溴酸中的氢原子会和乙烯中的氢原子
发生取代反应,从而产生出新的烯丙烷烃,其分子式为C2H4Br2。
此外,在乙烯与溴水反应中,还会释放出大量的热量,即热化学
反应,这也是它能发生反应的原因之一,也是乙烯和溴水热化学反应
的必要条件。
当反应结束后,会出现余氯(Cl2),这是反应的副产物。
总结而言,乙烯和溴水反应可以用如下反应方程式表示:
C2H4 + Br2(溶液)= C2H4Br2 + Cl2。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
烯烃和水的加成反应
烯烃和水的加成反应是指烯烃与水分子发生反应,在双键上加成一个水分子的过程。
这类反应通常需要催化剂存在,常见的催化剂有酸、碱、过渡金属化合物等。
在加成反应中,烯烃的双键被水分子的氢原子和氢氧根离子攻击,生成一个醇。
具体来说,反应的机理分为两步:亲电加成和负离子迁移。
亲电加成是指烯烃中的π电子云与质子化的水分子产生相互作用,形成一个高度极化的中间体。
这个中间体随后会发生负离子迁移反应,其中π电子的一个占据了质子化水中连接氢原子的位置,形成一个负离子中间体。
最终,这个负离子会失去一个氢离子,生成一个醇。
加成反应是常见的化学反应之一,对于不同结构的烯烃和不同催化剂条件下,反应的速率和产物可能有所不同。
通过调整催化剂和反应条件,可以选择性地加成双键上的一个氢原子,也可以选择性地加成双键的不同位置,从而合成不同的醇化合物。
