甲醇丙醇水系统的活度系数计算模型研究
活度系数计算

电解质溶液活度计算理论进展【摘要】:由于溶液大多数不是理想溶液,需要用活度来代替浓度。
活度系数又是描述活度与浓度的差异程度,因此活度系数的计算对于反应过程相当的重要。
近几年,随着活度系数理论模型的不断发展,活度系数的计算方法也在不断的提高、创新。
本文在回顾电解质溶液热力学经典理论的基础上,对活度系数计算做了综述。
【关键词】:活度系数活度模型热力学模型活度计算Electrolyte solution activity in recent years, progressin computational theoryAbstract:Solution is not ideal because most of the solution need to replace the concentration of activity. Activity coefficient is described differences in degree of activity and concentration, so the calculation of activity coefficients for the reaction process was very important. In recent years, with the activity coefficient of the continuous development of theoretical models, the calculation of activity coefficients are also constantly improving and innovation. In this paper, recalling the classical theory of thermodynamics of electrolyte solution, based on calculations made on the activity coefficient is reviewed.Keywords: Activity coefficient, Activity Model, Thermodynamic model, Activity calculation1、活度与活度系数绝大多数的反应都有溶液(固溶体、冶金熔体及水溶液)参加,而这些溶液经常都不是理想溶液,在进行定量的热力学计算和分析,溶液中各组分的浓度必须代以活度。
热力学习题及答案2010.11.

2-13. 某反应器容积为31.213m ,内装有温度为0227C 的乙醇45.40kg 。
现请你试用以下三种方法求取该反应器的压力,并与实验值(2.75MPa )比较误差。
(1)用理想气体方程;;(2)用RK 方程;(3)用普遍化状态方程。
解:(1)用理想气体方程M P a V n R T P 38.310213.115.50010314.8987.063=⨯⨯⨯⨯== 误差:%9.22 (2)用R-K 方程乙醇:K T C 2.516=, MPa P C 38.6=765.2625.22108039.21038.62.51610314.842748.042748.0⨯=⨯⨯⨯⨯==CCP T R a 0583.01038.62.51610314.808664.008664.063=⨯⨯⨯⨯==C C P RT b 3229.1987.0213.1m V ==()()MPab V V T a b V RT P 76.2109247.7105519.30583.0229.1229.115.500108039.20583.0229.115.50010314.85625.0735.0=⨯-⨯=⨯+⨯--⨯⨯=+--=误差:%36.0(3)用三参数普遍化关联 (2<r V 用维里方程关联,MPa P 7766.2=)635.0=ω, 43.038.675.2===C r P P P , 97.02.51615.500==r T 查图2-12~2-13:82.00=Z , 055.01-=Z7845.0055.0645.082.010=⨯-=+=Z Z Z ω MPa V ZRT P 65.210229.115.50010314.87845.063=⨯⨯⨯⨯== 误差:%64.32-21 一个0.5 m 3压力容器,其极限压力为2.75 MPa ,若许用压力为极限压力的一半,试用普遍化第二维里系数法计算该容器在130℃时,最多能装入多少丙烷?已知:丙烷T c =369.85K ,P c =4.249MPa ,ω=0.152。
ASPEN详细算例-甲醇、二甲醚、水-课程设计

《化工过程数学模型与计算机模拟》课程案例研究之一甲醇→二甲醚 + 水前言概念设计又称为“预设计”,在根据开发基础研究成果、文献的数据、现有类似的操作数据和工作经验,按照所开发的新技术工业化规模而作出的预设计,用以指导过程研究及提出对开发性的基础研究进一步的要求,所以它是实验研究和过程研究的指南,是开发研究过程中十分关键的一个步骤。
概念设计不同于工程设计,因而不能作为施工的依据,但是成功的概念设计不但可以节省大量的人力和物力,而且又可以加快新技术的开发速度,提高开发的水平和实用价值。
即使一个很普通的单一产品的生产过程,也可能有104~109个方案可供选择。
如何从技术、经济的角度把最有希望的方案设计出来,是作为强化研究开发工作的方向,这是一种系统化的分级决策过程,也正是概念设计的真谛。
概念设计是设计者综合开发初期收集的技术经济信息,通过分析研究之后。
对开发项目作出一种设想的方案,其主要内容包括:原料和成品的规格,生产规模的估计,工艺流程图机简要说明,物料衡算和热量衡算,主要设备的规模,型号和材质的要求,检测方法,主要技术和经济指标,投资和成本的估算,投资回收预测,三废治理的初步方案以及对中试研究的建议。
随着计算技术和计算机技术的发展,化工流程过程模拟软件也越来越成熟,计算机辅助设计也日趋广泛。
在进行概念设计时,采用流程系统模拟物料衡算和热量衡算,投资和成本估算等问题以及采用流程模拟软件进行整体优化业越来越普遍。
本文采用国际上最成功和最流行的过程模拟软件之一的ASPLEN PLUS作为辅助设计的主要工具。
与过程有关的物料和能量的衡算基本上有该软件给出,并从设计流程计算的收敛与否来检验该流程是否可行。
本文通过概念设计,其目标是寻找最佳工艺流程(即:选择过程单元以及这些单元之间的相互连接)和估算最佳设计条件。
采用分层次决策的方法和简捷设计能消去大量无效益的方案。
本文按照以下基本步骤进行设计计算:1. 间歇对连续;2. 流程图的输入−输出结构;3. 流程图的循环结构;4. 分离系统的总体结构;a. 蒸气回收系统;b. 液体回收系统。
丙酮-异丙醇-甲基烯丙醇体系气液平衡数据测定及关联
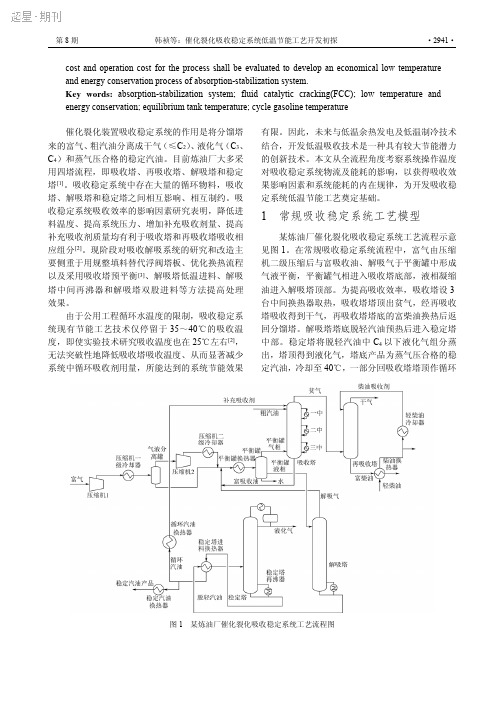
第8期韩祯等:催化裂化吸收稳定系统低温节能工艺开发初探·2941·cost and operation cost for the process shall be evaluated to develop an economical low temperature and energy conservation process of absorption-stabilization system.Key words:absorption-stabilization system;fluid catalytic cracking(FCC);low temperature and energy conservation;equilibrium tank temperature;cycle gasoline temperature 催化裂化装置吸收稳定系统的作用是将分馏塔来的富气、粗汽油分离成干气(≤C 2)、液化气(C 3、C 4)和蒸气压合格的稳定汽油。
目前炼油厂大多采用四塔流程,即吸收塔、再吸收塔、解吸塔和稳定塔[1]。
吸收稳定系统中存在大量的循环物料,吸收塔、解吸塔和稳定塔之间相互影响、相互制约。
吸收稳定系统吸收效率的影响因素研究表明,降低进料温度、提高系统压力、增加补充吸收剂量、提高补充吸收剂质量均有利于吸收塔和再吸收塔吸收相应组分[2]。
现阶段对吸收解吸系统的研究和改造主要侧重于用规整填料替代浮阀塔板、优化换热流程以及采用吸收塔预平衡[3]、解吸塔低温进料、解吸塔中间再沸器和解吸塔双股进料等方法提高处理效果。
由于公用工程循环水温度的限制,吸收稳定系统现有节能工艺技术仅停留于35~40℃的吸收温度,即使实验技术研究吸收温度也在25℃左右[2],无法突破性地降低吸收塔吸收温度、从而显著减少系统中循环吸收剂用量,所能达到的系统节能效果有限。
因此,未来与低温余热发电及低温制冷技术结合,开发低温吸收技术是一种具有较大节能潜力的创新技术。
活度与活度系数.ppt

若用汽液平衡常数表示这一类体系的汽液
r 平衡,由平衡常数定义,可得 Ki
由
pio
,
ri
p及K
pyi xi Pio
i
可求出
i ,(由
yi xi
ri pio p
, )
若用相对挥发度表示这类体系 的汽液平衡:
vi pyi xi
v j py j x j
若是理液, ri 1
(汽相为理想气体)
pio poj
i
fˆiV
f
V i
Pi Pi o
f i oL:纯i时液相的逸度
f
V i
:与纯i液体呈平衡的物质作为气相时
的逸度
r即由i 上aˆxiiPP式iio 可PPi,io知,应:是用根对道据拉尔实乌顿测尔分汽定压液律定平的律衡校r数i正据x,pi Pyii有o
(
r xi yi P , Pio 可由所处T查出)可求出 i
一压力下的纯组分作为标态)
以有效浓度(活度)代替实际浓度,可用来计算真 实溶液与理想溶液的区别以及那些目前尚无法去计算 的一切量。
对理想溶液(气相不是 i.g )
fˆi xi fi xi fio
Lewis-Randall
故
aˆi
fˆi fio
xi
f
o i
fio
xi
即理想溶液中组分i的活度等于 xi
则得ui 即 ui (l
(l) ui
) ui (
(g
g)
)= u
ui0 (g)
0 i
(液)
RT ln pi0 po
RT ln xi
RT
ln
xi
其中,u
0 i
活度系数

活度系数
真实溶液中各组分的质点有的相互吸引,有的有排斥倾向,导致质点间的作用力不同。只有对组分的浓度加以校正,表示蒸气压关系的拉乌尔定律才能适用,
pi=p孂(γiNi)
也即符合于真实溶液的拉乌尔定律应写为:
活度系数
(3)
活度系数反映有效浓度和实际浓度的差异。
对浓度很稀的真实溶液,一般其溶剂服从拉乌尔定律,其溶质组分i则服从亨利定律,以式(4)表示:
提出
活度概念的引入和发展
活度的概念首先由刘易斯(G.N.Lewis)于1907年提出,迅速被应用于电化学,以测定水溶液中电解质的活度系数。
引用
30年代中期奇普曼(J.Chipman)将活度概念引用于冶金熔体,并提出金属溶液中以1%浓度溶液为活度标准态,此建议迅速为冶金物理化学工作者所接受而推广采用。瓦格纳(C.Wagner)于1952年建议Lnγi按麦克劳林(McLaurin)级数展开,奠定了冶金熔体中多组分活度系数计算的基础。50年代中期图克道根(E. T.Turkdogan)对同一浓度法与同一活度法测定fi进行了比较和研究。50年代末期申克(H.Schenck)及其合作者首先导出e嫶与ε嫶以及e嫶与e嫐准确的相互关系式[即式(16)及(17)]。50~60年代二十年间活度及活度相互作用系数的测定研究工作非常活跃,主要采用化学平衡及溶解度法,已逐步发展自成体系,成为经典的实验方法。60年代末期固体电解质定氧电池开始作为测定黑色及有色金属熔体中氧的活度及相互作用系数的良好手段。70年代,黑色冶金的金属液及熔渣的活度数据已测出不少,但尚不完全。对有色金属、特别对熔锍及熔盐等的活度数据则待做的工作更多。
根据亨利定律计算的活度aH,其标准态为1%浓度(对钢铁溶液,采用重量1%浓度;对有色金属溶液,一般采用摩尔1%浓度)的溶液,即当xi=1,ai=1,因之fi=1。
实验三 甲醇-水二元体系汽液相平衡数据测定
在稳定运行时对EC(平衡室)作物料衡算得:
}
(1)
又因沸点仪可视为封闭系统,故运行前后物料总量不变,所以,
}
(2)
由式(1)和(2)可推得:
(3)
(4)
式中,
:为回流比;
:为滞液量因子;
:为组分的平衡常数。
式(3)和(4)将可测量的非分析量与平衡浓度联系起来,即为沸
点仪在稳定运行时各浓度间函数关系式。
四、实验方法
1. 实验前的准备工作 (1) 试剂的提纯
按照实验要求预先清洗精馏所用的仪器并且充分干燥,待用。精馏 装置主要由电炉、电加热套、可调式变压器、三口烧瓶、精馏柱和分馏 头组成。从下往上依次接好实验仪器,接好循环冷却水。由三口烧瓶加 入待精馏物质,密封后接通电源开始加热。首先可适当提高加热功率, 三口烧瓶中加玻璃珠,待液体沸腾后再控制调压器缓慢加热,防止爆 沸。在收集的过程中,必须先去掉初馏分,再收集沸点恒定的中间馏 分,馏分经气相色谱检测无杂质峰。试剂的提纯是一项复杂、耗时的工
数量级之间,若此时汽液平衡能够保持,我们称之为拟静态。对值不是
很大的体系,由于拟静态法是汽液回流比趋于零并能保持稳定沸点的循
环状态,所以从理论上说,拟静态是沸点仪测定汽液相平衡的最佳条
件。
三、实验装置
1. 设备装置 采用泵式沸点仪,在拟静态条件下,在101.325下测定了液相组成
与沸点的关系。压力控制采用二级自动控制系统,其压力波动不大于3 水柱。压力控制系统由恒压仪、电磁阀及继电器组成。大气压由福丁式 (Fortin)气压计测定,系统压力由U型压差计测出,U型压差计中装 水,计入水的密度校正。为了保证系统温度的稳定性,整个沸点仪用水
的特例。在动态法中,对于上式(3)中给定的,与的相对偏差非但不
应用化工热力学课程设计任务书
应用化工热力学课程设计任务书题目一:设计完全互溶体系低压条件下,气液平衡泡点温度和气相组成的计算程序。
并采用该程序计算甲醇(1)—水(2)体系:1,压力为101.325KPa,液相组成x1=0.40时的泡点温度和气相组成.2,压力为101.325KPa,液相组成x1=0.30时的泡点温度和气息组成.已知该体系液相活度系数满足Wilson方程,A12=0.2972,A21=1.3192。
涉及公式Wilson方程:lnr1=-ln(x1+x2*A12)+x2[A12/(x1+x2*A12)-A21/(x2+x1*A12)];lnr2=-ln(x2+x1*A21)+x1[A21/(x2+x1*A21)-A12/(x1+x2*A21)];其中A12=0.2972,A21=1.3192;r1:甲醇的活度,r2表示水的活度;x1:液相中甲醇的摩尔分数;x2:液相中水的摩尔分数;查得的安托万方程lnP i s=A-B/(T+C),P i s单位是mmHg,T的单位是K。
甲醇安托万方程参数如下:A=18.5875,B=3626.55,C=-34.29,水的安托万方程参数如下:A=18.3036,B=3816.44,C=-46.13y1= x1* r1* P1s/p; y2= x2* r2* P2s/p;P1s:甲醇的饱和蒸汽压,单位:Pa;P2s:水的饱和蒸汽压,单位:Pay1:气相中甲醇的摩尔分数;y2:气相中水的摩尔分数;p:给定环境压力,单位:Pa;T:所求温度,单位:T题目二:有一台并流换热器,燃气的压力为0.1013Mpa,温度为1400K,换热后温度降至810K。
水以1.2吨/h,1Mpa,423K进入换热器,产生1Mpa,533K的过热蒸汽送出,燃气的平均热容C p燃=4.56KJ/Kg· K。
大气环境温度为298K,燃气可视为理想气体,忽略换热过程压降,假设燃气放出的热量全部被水吸收。
甲醇-乙醇-水-离子液体系汽液平衡的测定及热力学模型研究的开题报告
甲醇-乙醇-水-离子液体系汽液平衡的测定及热力学模型研究的开题报告一、研究背景及意义甲醇、乙醇和水是常见的氢氧化合物,在许多化学工业过程中都被广泛应用。
而离子液体是一类特殊的有机盐,在绿色化学、化学工业合成以及生物化学等领域也得到了广泛应用。
甲醇-乙醇-水-离子液体混合物则是一类新型的复杂体系,有着重要的理论和实际应用价值。
使用离子液体可以调节其相行为和物理化学性质,可以增强其分离效果并优化分离工艺,从而实现绿色环保的化学工业过程。
二、研究内容及方法本研究基于气液平衡法,测定甲醇-乙醇-水-离子液体混合物汽液平衡数据,并对数据进行分析和处理,建立热力学模型,研究离子液体对混合物汽液平衡的影响,探索其相行为和物理化学性质。
具体实验过程如下:1. 实验材料:甲醇、乙醇、水和离子液体。
2. 实验仪器:气液平衡仪、恒温水浴、电子天平、离心机等。
3. 实验流程:3.1 前处理:使用电子天平精确称取所需的甲醇、乙醇、水和离子液体。
3.2 实验操作:将混合物加入气液平衡仪中,恒温至特定温度并搅拌均匀,等待平衡达到,通过气液相对质量的变化判断液相成份。
3.3 数据处理:测量数据进行统计分析,建立热力学模型,分析离子液体对混合物的相行为和物理化学性质的影响。
三、预期成果本研究的预期成果为:1. 建立甲醇-乙醇-水-离子液体混合物汽液平衡的测定和热力学模型。
2. 分析离子液体对混合物相行为和物理化学性质的影响,为离子液体在化学工业中的应用提供基础研究数据。
3. 为优化化学工业过程、提高生产效率和实现绿色环保贡献力量。
四、研究进度安排本研究计划于2022年9月开始,预计为期15个月,具体进度安排如下:2022年9月-2023年3月:文献调研和实验前准备;2023年3月-2023年9月:实验数据采集和处理;2023年9月-2024年6月:建立热力学模型和分析离子液体对混合物相行为和物理化学性质的影响;2024年6月-2024年9月:论文撰写和答辩准备。
活度系数
30″72、30″53、30″66 即 30.72s、30.53s、30.66s
取平均得:
则流量为:
30.72 + 30.53 + 30.66
3
= 30.64s
10 ������������ = 30.64 × 10
= 3.26 × 10 7 3 s
2) 校正到柱温、柱压下的载气平均流量计算
计算公式:
112
111
110
109
108
107
106
0
0.2
0.4
0.6
0.8
1
进量/μl
图 4 苯进量与校正保留时间的关系
由图中看出,在进料量趋于零(x→0)时,环己烷的校正保留时间为 67.25s,苯的校正保留 时间为 104.28s。
6
化工专业实验报告
3.计算无限稀释活度系数
溶质 环己烷
苯
表 3 无限稀释活度系数计算结果列表
将(6)、(7)、(8)代入式(5),得:
������������′
=
������������ ������������ ������������������ ���������������������0��� ���������0���
=
������������ ������������������ ���������������������0��� ���������0���
0.6
0.0329 1′11″90
31″06 苯进量 (μl)
0.2 0.2 0.2 0.4 0.4 0.4 0.6 0.6 0.6 0.8 0.8 0.8
苯实验前测量
31″28
31″34
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
甲醇-丙醇-水系统的活度系数计算模型研究
作者:郑启富
作者单位:浙江工业大学浙西分校化工系,浙江,衢州,324006
刊名:
云南化工
英文刊名:YUNNAN CHEMICAL TECHNOLOGY
年,卷(期):2003,30(1)
被引用次数:0次
1.裘元焘基本有机化工过程及设备 1981
2.王利生.郭天民基于MPHC活度系数模型关联烃-水体系液-液平衡 1996(06)
3.Hummels D M.Ahemed W.Musavi M T Adaptive Detection of small Sinrsodial Signals in Non-gaussian Noise using an RBF Neural Network 1995(01)
4.Steve A Billings.X Hong Dual-orthogonal radial basis function networks for nonlinear time series prediction 1998(11)
5.陈德钊多元数据处理 1998
6.许志宏.王乐珊.郑修贵UNIFAC功能团法推算汽-液平衡 1982
本文链接:/Periodical_ynhg200301003.aspx
授权使用:武汉有机实业有限公司(whyjsy),授权号:40bc4d57-aecc-44ea-9989-9e9a00a8415b
下载时间:2011年3月2日。
