大连理工大学884物理化学及物理化学实验专...考研内部资料
大连理工大学有机化学考研2010-2014年真题

大连理工 2010 年有机化学及有机化学实验1.胺的重氮化反应(1)怎么样保持反应温度在5度以下(2)怎么样检测重氮化反应结束(3)为什么溶液要保持为酸性条件,怎么样检测。
2.乙醇与NaBr反应(1)计算理论产量(2)计算产率(3)为什么要加水3关于U型压力计的4.减压蒸馏装置5.水蒸气蒸馏的计算题计算水的质量以前的真题有2011年大连理工大学有机化学及有机化学实验(885)一、命名(共9分,6个小题,每个结构1.5分。
很简单)基本知识点会的话,有一个NBS让你写,烯炔的命名,RS有关命名二、完成反应:(共31分,31个空,每空1分。
考得很细)反正考了很多重要的,有些也蛮细的,弗里斯重排,坎尼扎罗什么的,书上重点的一定要看。
三、填空排序题(共32分,共16小题,每个小题2分错一点可就没分了)四、推断题(共18分,4个小题,每个小题分值不等。
很简单,有一个好像是03真题)考的主要还是特征反应之类的,有一道推断的一部分是红外加核磁,还有一道是物质用碘甲烷之后再氧化银,好像是含氮有机物那章的重点反应。
五、有机合成(共24分,共6个小题,每个4分)千真万确的123456六、写出反应机理(共12分,共四道小题,每个3分)OCOOHOOPhCH 3H 5)2OHO1 2 3 4HOCN-CHOHCOOH+O333H3O+O OOOH七、实验题(共24分,5个小题,每个小题分值不等。
本题几乎都是基础化学实验上的内容)1关于合成乙酰苯胺的实验好像需要作图。
2甲苯中含有苯酚、苯甲酸、苯甲醛、苯甲醚的提纯。
3关于合成乙酸异戊酯的实验怎么提高产率,粗产物怎么提纯,4关于合成乙酰乙酸乙酯(即3-丁酮酸乙酯)的实验制备的原理,需要作图。
5环己烯的制备环己烯的制备怎么提高产率,能不能用浓硫酸代替脱水剂大连理工大学2012年硕士生入学考试一、命名及或写结构式(1.5*10=15)1 OHNO2NH22OO3SBrCHO4HCOOHH3C2H5HBr8 D—葡萄糖9 双酚A 10 阿司匹林二、选择(2*12=24)三、完成反应式(1*30=30)四、推断结构(3+56+5+5=19)大连理工大学885有机化学及有机化学实验2013真题(回忆版)大连理工大学885有机化学及有机化学实验2013真题(回忆版)有机;真题原题型;1 命名不是很难有个糖苷的分子式,记不清了2 选择书上和习题书上的常考知识点,全面认真复习了应该都会,不粗心的前提3补全反应式,大都是常规,是重要的各种人名反应,还是多做些相关习题有助于加深印象4合成,总的不很难,但个别,要费脑子些,关键是平时注意这块练习5机理3道题,最后一个不咋会,其他都还可以6苦逼的推断,感觉有不少人跪了,其实有些是会的,但时间没把握好,就没写完。
大连理工大学2005年物理化学及物理化学实验考研真题

注:答题必须注明题号答在答题纸上,否则试卷作废! 请认真看题,祝好运! 一、是非题(每小题 2 分,共 24 分) ,正确的标“√” ,错误的标“×” : 1. 一定温度下化学反应的 r G m 一定大于 r Am 。
-23 -1 -34 (已知 k=1.3810 J•K ,h=6.6310 J•s) -1
பைடு நூலகம்
十、实验题(15 分): 乙酸乙酯皂化反应的反应式为:
3
七(12 分) 、在 80℃下,有机物 B 溶于水中(摩尔分数 xB=0.10)的稀溶液与其气相平衡共存。如溶液可 视为理想稀溶液,求气相中水的分压。已知水的气化焓为 40.7kJ•mol . 八(14 分) 、气体 A 的分解反应 A(g)=Y(g)+Z(g) 已知反应速率与反应物、产物的浓度均无关。若向真空容器内迅速充入气体 A,初始压力达到 100kPa。在 700K 下恒容反应 10 秒,测得压力变为 150kPa,求该反应在此反应条件下的速率系数。 九、 (8 分)在 298.15K,1mol O2(g)放在体积为 V 的容器中,压力为 p,试计算: (1)O2 分子的平动配分函数 qt (2) O2 分子的平动热力学能 U t 。
2.
(
G ) T , p ,nC ( C B ) nB
既是物质 B 的化学势又是物质 B 的偏摩尔量。
3. 用 G 0 判断变化方向,适用于任何系统的任何变化。 4. 稀溶液的凝固点一定比纯溶剂的凝固点低。 5. 因为溶胶在一定条件下能存在很长时间,所以它是势力学稳定系统。 6. 在大气压下,水银在玻璃毛细管中的沸点高于其正常沸点。 7. NaCl 水溶液在表面层的浓度高于其溶液本体浓度。 8. 物质 B 总是从高浓度相自发转移到低浓度相。 9. 在化学反应中,所有反应物分子实现化学反应都经过反应的最低能量途径。 10. 超电势的存在,使原电池的输出电压变小。 11. NaOH 水溶液的摩尔电导率与其浓度有关。 12. 气体在固体表面的吸附只能是单层的。 二、选择题(包括 8 小题,每小题 2 分,共 16 分) ,选择一个正确答案的编号: 1. Na2CO3 与 H2O 可以生成如下几种化合物 Na2CO3· H2O, Na2CO3*7H2O, Na2CO3*10H2O,在标准压 力下与 Na2CO3 水溶液、冰平衡共存的水合物最多能有几种: A. 1 种; B. 2 种; C. 3 种
大连理工 考研 科目 参考 用书
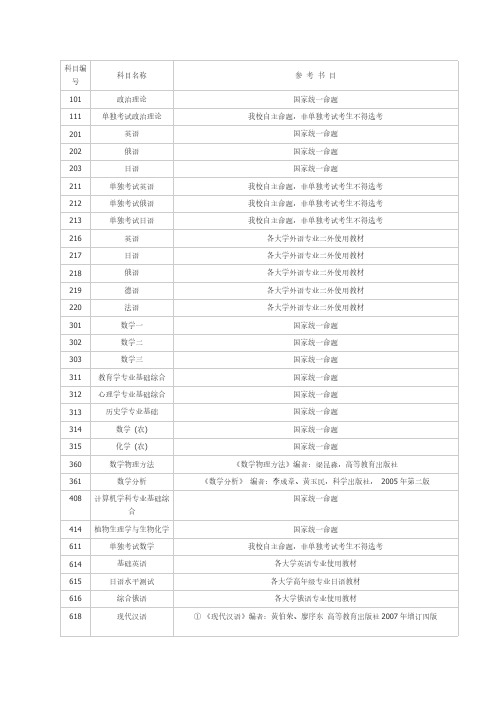
科目编科目名称参考书目号101 政治理论国家统一命题111 单独考试政治理论我校自主命题,非单独考试考生不得选考201 英语国家统一命题202 俄语国家统一命题203 日语国家统一命题211 单独考试英语我校自主命题,非单独考试考生不得选考212 单独考试俄语我校自主命题,非单独考试考生不得选考213 单独考试日语我校自主命题,非单独考试考生不得选考216 英语各大学外语专业二外使用教材217 日语各大学外语专业二外使用教材218 俄语各大学外语专业二外使用教材219 德语各大学外语专业二外使用教材220 法语各大学外语专业二外使用教材301 数学一国家统一命题302 数学二国家统一命题303 数学三国家统一命题311 教育学专业基础综合国家统一命题312 心理学专业基础综合国家统一命题313 历史学专业基础国家统一命题314 数学(农) 国家统一命题315 化学(农) 国家统一命题360 数学物理方法《数学物理方法》编者:梁昆淼,高等教育出版社361 数学分析《数学分析》编者:李成章、黄玉民,科学出版社,2005年第二版408 计算机学科专业基础综国家统一命题合414 植物生理学与生物化学国家统一命题611 单独考试数学我校自主命题,非单独考试考生不得选考614 基础英语各大学英语专业使用教材615 日语水平测试各大学高年级专业日语教材616 综合俄语各大学俄语专业使用教材618 现代汉语①《现代汉语》编者:黄伯荣、廖序东高等教育出版社2007年增订四版②《现代汉语语法研究教程》编者:陆俭明,北京大学出版社,2005年版619 传播学《传播学原理》,编者:张国良复旦大学出版社1995年12月《传播学教程》,编者:郭庆光中国人民大学出版社1999年11月620 民商法原理《民法》编者:魏振瀛,北京大学出版社、高等教育出版社,第三版《商法》编者:范健,北京大学出版社、高等教育出版社,第三版621 马克思主义哲学原理《马克思主义哲学原理》编者:陈先达,中国人民大学出版社,第二版《马克思主义哲学教程》编者赵家祥,聂锦芳,张立波,北京大学出版社,2003年622 管理学基础(1)《管理学》编者:汪克夷等,大连理工大学出版社,2006年第4版(2)《行政管理学》编者:夏书章,高等教育出版社、中山大学出版社,2008年版(3)《教育管理学》编者:陈孝彬,北京师范大学出版社,1999年修订本注:(2)、(3)任选其一623 城市规划历史与理论《中国城市建设史》中国建筑工业出版社《外国城市建设史》中国建筑工业出版社《城市规划原理》中国建筑工业出版社(第3版)624 建筑设计理论综合《中国建筑史》中国建筑工业出版社《外国建筑史(19世纪末叶以前)》中国建筑工业出版社《外国近现代建筑史》中国建筑工业出版社625 中外美术史《中国美术史》洪再新编著,中国美术学院出版社《外国美术简史》中央美术学院美术史系外国美术史教研室编著,高等教育出版社或中国青年出版社626 分析化学及分析化学实《分析化学》编者宫为民等,大连理工大学出版社,2006年第三版验《仪器分析》编者刘志广等,大连理工大学出版社,2007年第二版627 药物化学《药物化学》郑虎主编,第五版,人民卫生出版社《药物化学》,仉文生,李安良主编,高等教育出版社630 无机化学《无机化学》无机化学教研室主编,高等教育出版社,2006 第五版631 分子生物学《现代分子生物学》编者:朱玉贤、李毅,北京高等教育出版社636 体育学专业基础综合《学校体育学》人民体育出版社出版,周登嵩主编,2004《运动训练学》人民体育出版社,体育院校通用教材《运动生理学》人民体育出版社,体育院校通用教材678 社会保障学《社会保障学》编者:陈树文、郭文臣,大连理工大学出版社,第一版501 建筑设计(6小时)《中国建筑史》建工出版社《外国建筑史(19世纪末以前)》建工出版社《建筑空间组合论》编者:彭一刚502 规划设计(6小时)《城市规划资料集》中国建筑工业出版社,第5、6分册,城市设计503 命题创作(手绘)(6小时)801 英语专业综合语言学部分(50分):参考书目:《语言学教程》(修订版),胡壮麟,北京大学出版社。
大连理工大学884物理化学剂物理化学实验2 考研试题

2013年大连理工大学884物理化学剂物理化学实验2 考研试题(回忆版)
物化我感觉有难度,特别是选择和判断,牵扯到界面,胶体,统计热力学的题都不太会,居然连笼效应都考了……统热有个题问定域和离域子系统哪些热力学函数不同,有个温度升高能级的问题…两亲分子为什么能做表面活性剂。
不能润湿毛细管的问题。
证明题比较简单,考了个(偏t比偏p)h的证明。
计算题难度适中一个题是苯蒸汽先定温压缩凝结成液体,再定压降温的过程。
一个利用沸点升高法求富勒烯的分子量,一个动力学一级反应有关阿伦尼乌斯公式的计算,一个动力学平衡态近似法求速率方程以及二级反应的计算。
一个新课本上的原题氧化银的热力学平衡的题。
相图题也不难,一个生成不相合化合物的问题。
实验题13分,四个题,一个是问哪些实验用到了真空装置,一个双液系相图直接测量的物理量,一个非体积功,一个电导法测氯化银的ksp的测定。
总体感觉就是,一定不能信那个新课本太坑了,一些知识考的新课本里根本没有……还是以考研重点热点为主才行呐。
大连理工大学2004年硕士生入学考试物理化学及物理化学实验试题及答案

〔3〕5分A 2B (s),0.351五、计算填空题1.37.5 kJ , 40 kJ , 127.6 J·K -1, -0.75 kJ , 1.75 kJ2.89.02 kJ3.解:〔1〕负极:Zn (s)+2OH -→ZnO (s)+H 2O (l)+2e -〔2〕正极:HgO (s)+H 2O (l)+2e -→Hg (l)+2OH -〔3〕电池反响:HgO (s)+Zn (s)﹦ZnO (s)+Hg (l)〔4〕(ZnO,s)(Hg,l)ln (HgO,s)(Zn,s)MF RT a a E E E zF a a ⋅=-=⋅ (ZnO,s)(HgO,s)r m f m f m G G G ∆=∆-∆﹦(-318.3+58.74) kJ·mol -1 ,259560 1.345V 297485r m M F G E V zF ∆-=-=-=⨯ 4.(211/k k k -)c A c B ;211E E E -+-5. 0.254 , 0.562六、证明题由热力学根本关系式dU TdS pdV =-定温下等式两边同除以d V ,可得T TU S T p T V ∂∂⎛⎫⎛⎫=- ⎪ ⎪∂∂⎝⎭⎝⎭ 由麦克斯韦关系式T V S p V T ∂∂⎛⎫⎛⎫= ⎪ ⎪∂∂⎝⎭⎝⎭,可得:T U T ∂⎛⎫ ⎪∂⎝⎭﹦ Vp T T ∂⎛⎫ ⎪∂⎝⎭-p 对遵守状态方程p (V -a ) ﹦nRT 的气体,有V P nR T V a ∂⎛⎫=⎪∂-⎝⎭ 代入上式0T VU P T p p p T T ∂∂⎛⎫⎛⎫=-=-=⎪ ⎪∂∂⎝⎭⎝⎭,得证。
七、推导题1.非定域,独立子,Z ﹦!N q N , 22,ln(/!)ln ()N V V Nq N q U kT NkT T T ⎛⎫∂∂== ⎪∂∂⎝⎭ 2.q ﹦q t q r q v对单原子理想气体只有平动,而无转动、振动q ﹦q t ﹦(22mkT h π)32V ,代入2ln ()V q U NkT T∂=∂得U m ﹦3RT 2 C v,m ﹦(m U T ∂∂)V ﹦3R 2八、实验题〔1〕天蓝,深绿 ; 〔2〕电位差计 ; 〔3〕防止汞的蒸发扩散 ; 〔4〕温差电势大连理工大学二00四年硕士生入学考试?物理化学?试题一.是非题1. 如某溶质的稀溶液随溶质浓度的加大其外表张力变小,那么在平衡态下该溶质在界面层中的浓度一定大于在溶液本体中的浓度。
大连理工大学考研真题物理化学及物理化学实验2003(有答案)

大 连 理 工 大 学二○○三年攻读硕士学位研究生入学考试物理化学及物理化学实验试题一、判断题( )1.绝热过程Q ﹦0,故必是定熵过程。
( )2.某系统从初态Ⅰ经过一个不可逆过程到终态Ⅱ,此过程环境的熵变一定大于该系统由态Ⅰ→态Ⅱ经历可逆过程时环境的熵变。
( )3.H 2(g)和O 2(g)在绝热钢瓶中反应生成水,反应系统的∆H ﹦0, ∆U ﹦0,∆ p ﹦0。
( )4.理想液体混合物与其蒸气达成气、液两相平衡时,气相总压力p 与液相组成x B呈线性关系。
( )5.如果某一化学反应的0r m H ∆>,则该反应的K 随温度升高而增大。
( )6.任何化学反应的半衰期都与反应物的初始浓度有关。
( )7.对同一反应,活化能一定,则反应的起始温度愈低,反应的速率系数对温度的变化愈敏感。
( )8.用能斯特公式算得电池的电动势为正值,表示该电池反应在定温定压下可正向进行。
( )9.可逆过程中,系统的熵不变;不可逆过程中,熵值增大。
( )10.一定量纯气体定温变压时,其转动配分函数不变化。
( )11.胶束溶液是高度分散的均相热力学稳定系统。
( )12.垂直插入水中一支干净的玻璃毛细管,当在管中水上升至平衡液面处加热时,水柱会上升。
( )13.真实液态混合物中组分B 的活度因子值:0<f B <1( )14.一级反应肯定是单分子反应。
( )15.BET 吸附定温式可用于物理吸附。
二、选择题( )1.298.15 K ,已知气相反应2CO (g)﹢O 2(g)→2CO 2(g)的r m G ∆﹦-514.2。
884物理化学及物理化学实验
大连理工大学2017年硕士研究生入学考试大纲科目代码:884 科目名称:物理化学及物理化学实验试题分为客观题型和主观题型,其中客观题型(是非题、选择填空、一般填空、计算填空题)占40-50%,主观题型(计算、推导与证明、简答或论述题)占40-50%,、实验题占8-10%。
具体复习大纲如下:一、化学热力学1、化学热力学基础热力学第一、第二、第三定律。
热力学能、焓、熵、亥姆霍兹函数、吉布斯函数、标准生成焓、标准生成吉布斯函数、标准熵、热容、相变焓、蒸汽压.热力学基本关系式。
过程自发、平衡和实现非自发过程的亥姆霍兹判据、吉布斯函数判据。
2、相平衡的热力学原理偏摩尔量、化学势,克拉佩龙方程和克拉佩龙-克劳修斯方程。
拉乌尔定律,亨利定律。
理想液态混合物、理想稀溶液、活度和活度因子、逸度和逸度因子。
稀溶液依数性。
相律,单组分系统典型相图,二组分系统典型相图,杠杆规则。
3、化学平衡热力学原理一般化学平衡,同时反应的化学平衡和耦合反应的化学平衡。
二、化学动力学1、简单级数反应一级、二级和零级反应速率方程,通过实验建立反应速率方程的方法。
2、典型复合反应反应机理。
稳态近似法、平衡近似法和反应速率控制步骤,表观反应的级数和活化能。
阿仑尼乌斯方程。
链反应。
气-固相催化反应Langmuir-Hinshelwood机理和Rideal-Elsy机理。
3、光化学反应、溶液中的反应4、元反应的速率理论(简单碰撞理论,过渡态理论)三、统计热力学初步玻尔兹曼分布、粒子配分函数。
配分函数与宏观热力学函数的关系。
四、界面与胶体表面张力、表面能。
附加压力,弯曲液面的饱和蒸汽压,润湿。
溶液的表面吸附。
物理吸附和化学吸附,兰缪尔单分子层吸附理论。
多种胶体系统的性质、稳定和破坏机制、规律。
五、电化学1、热力学电解质溶液的导电性质,电解质溶液的离子平均活度、平均活度因子。
离子强度,德拜-休克尔极限公式。
可逆电池的设计、电极电势、能斯特方程、电池电动势测定的应用。
新版大连理工大学资源与环境专硕考研经验考研参考书考研真题
一年就这样过去了,内心思绪万千。
一年很短,备考的经历历历在目,一年很长,长到由此改变了一个人的轨迹,并且成就一个梦想。
回忆着一年的历程,总想把它记录下来,希望可以给还在考研道路上奋斗的小伙伴们一点帮助。
考研是一个非常需要坚持的过程,需要你不断坚持和努力才能获得成功,所以你必须要想清楚自己为什么要考研,这一点非常重要,因为只有确认好坚定的动机,才能让你在最后冲刺阶段时能够坚持下来。
如果你只是看到自己周围的人都在考研而决定的考研,自己只是随波逐流没有坚定的信心,那么非常容易在中途就放弃掉了,而且现在考研非常火热,这就意味着竞争也会非常激烈,而且调剂的机会都会非常难得,所以备考时的压力也会比较大,所以大家一定要调整好心态,既不能压力太大,也不能懈怠。
既然选择了,就勇敢的走下去吧。
考研整个过程确实很煎熬,像是小火慢炖,但是坚持下来,你就会发现,原来世界真的是美好的。
文章整体字数较多,大家可视自己情况阅读,在文章末尾我也分享了自己备考过程中的资料和真题,大家可自行下载。
大连理工大学资源与环境专硕的初试科目为:(101)思想政治理论(201)英语一(302)数学二(882)环境科学与综合或(101)思想政治理论(201)英语一(302)数学二(884)物理化学及物理化学实验(882)环境科学与综合参考书目:1、《环境化学》,陈景文、全燮编著,大连理工大学出版社;2、《水污染控制工程》(第四版)下册,高廷耀、顾国维、周琪主编,高等教育出版社。
(884)物理化学及物理化学实验参考书目:1、基础物理化学》(第二版),王新平,王旭珍,王新葵主编,高等教育出版社,2016年出版(2017年第三次印刷);2、《基础物理化学解题指导》(第二版),王新葵,王旭珍,王新平主编,高等教育出版社,2018年4月;3、《基础化学实验》(第二版),编者:孟长功、辛剑,高等教育出版社关于英语其实我的英语基础还是比较差的,起码在考研之前,这让我在英语学习中有一个非常大的坎要过,不过好在只要过了这个坎,英语成绩一定会有一个大幅度的提升,为了度过这个坎,我用了整整两个月的时间去看英语,用到的资料就是木糖英语的真题和单词,什么娱乐活动都没有,就只是看英语不停的坎,付出了读文章读到恶心的代价,虽然当时觉得真的很痛苦,但是实际上现在想来还是值得的,毕竟英语的分数已经超乎我的想象。
大连理工大学化学专业真题、初始复试考试科目
育明教育2015年考研指导方案考研最重要的就是方法、规划、模考大连理工大学专业初试考试科目一级学科、专业及隶属院(系、部)二级学科、专业0710703▲化学070305▲▲高分子化学与物理复试考试科目及参考书学科、专业代码及名称考试形式专业综合笔试内容参考书目070301无机化学面试加笔试无机元素化学《无机元素化学》,编者:刘新锦、朱亚先、高飞,科学出版社2005070302▲▲分析化学面试加笔试有机化学《有机化学》(第二版),主编:高占先,高等教育出版社《基础化学实验》(第二版),编者:孟长功、辛剑,高等教育出版社070303有机化学面试加笔试物理化学《多媒体CAI物理化学》(面向21世纪教材,第四版),编者:傅玉普等,大连理工大学出版社.070304▲▲物理化学(含化学物理)面试加笔试化学综合《多媒体CAI物理化学》(面向21世纪教材,第四版),编者:傅玉普等,大连理工大学出版社.070305高分子化学与物理面试加笔试高分子科学及实验(内容包括高分子化学、高分子物理及高分子化学与物理实验和有机化学实验)《高分子化学》,编者:潘祖仁,化学工业出版社《高分子物理》,编者:金日光,化学工业出版社《高分子化学与物理实验》,大连理工大学高分子材料系编《有机化学》(第二版),主编:高占先,高等教育出版社077621▲▲★药物工程面试加笔试药物合成反应《药物合成反应》,闻韧主编,第二版,化学工业出版社077901药物化学面试加笔试《天然药物化学》《天然药物化学》1、《天然药物化学》,吴立军主编,第五版,人民卫生出版社,2007年出版。
2、《天然产物化学》,徐任生主编,科学出版社,2004第二版080520▲▲★高分子材料面试加笔试高分子科学及实验(内容包括高分子化学、高分子物理及高分子化学与物理实验和有机化学实验)《高分子化学》,编者:潘祖仁,化学工业出版社《高分子物理》,编者:金日光,化学工业出版社《高分子化学与物理实验》,大连理工大学高分子材料系编《有机化学》(第二版),主编:高占先,高等教育出版社080704▲▲流体机械及工程080706▲▲化工过程机械081903安全技术与工程面试加笔试综合考试①过程机械、材料力学、化工原理及化工原理实验综合②工程热力学、工程流体力学、化工原理及化工原理实验综合③过程机械、材料力学、机械设计综合三选一《工程流体力学》,编者:黄卫星,化学工业出版社《化工原理》(上册),编者:王世广(下册)编者:樊希山,高等教育出版社《过程机械》,编者:李志义主编,石油化工出版社《工程热力学》,编者:毕明树化工出版社《材料力学》(上、下册),编者:刘鸿文,高等教育出版社,第三版《机械设计》,编者:濮良贵、纪名刚,高等教育出版社081701☆▲▲化学工程面试加笔试①物理化学及实验②化工原理及实验①②任选一,但所选科目不能与初试科目相同《多媒体CAI物理化学》(面向21世纪教材,第四版),编者:傅玉普等,大连理工大学出版社.化工原理及实验同初试科目参考教材081721▲▲★水科学与技术081702☆▲▲化学工艺面试加笔试①物理化学及实验②化工原理及实验①②任选一,但所选科目不能与初试科目相同《多媒体CAI物理化学》(面向21世纪教材,第四版),编者:傅玉普等,大连理工大学出版社.化工原理及实验同初试科目参考教材081724▲▲★能源化工081704☆▲▲应用化学面试加笔试①物理化学及实验②精细化工产品合成原理①②任选一《多媒体CAI物理化学》(面向21世纪教材,第四版),编者:傅玉普等,大连理工大学出版社.《精细化工产品合成原理》,编者:姚蒙正、程侣柏、王家儒,中国石化出版社2000第二版081722▲▲★精细化工081705☆▲▲工业催化面试加笔试物理化学及实验或化工原理及实验或催化三选一(所选科目不能与初试科目相同)《多媒体CAI物理化学》(面向21世纪教材,第四版),编者:傅玉普等,大连理工大学出版社.《化工原理及实验》,同初试科目参考教材《催化剂与催化作用》,编者:王桂茹,大连理工大学出版社,2004年修订版081720▲▲★膜科学与技术面试加笔试①高分子科学及实验(内容包括高分子化学、高分子物理及高分子化学与物理实验和有机化学实验)②物理化学及实验或化工原理及实验任选一(所选科目不能与初始科目相同)报考研究方向1必考①,其余方向必考②《高分子化学》,编者:潘祖仁,化学工业出版社《高分子物理》,编者:金日光,化学工业出版社《高分子化学与物理实验》,大连理工大学高分子材料系编《有机化学》(第二版),主编:高占先,高等教育出版社《多媒体CAI物理化学》(面向21世纪教材,第四版),编者:傅玉普等,大连理工大学出版社;化工原理及实验同初试科目参考教材081723▲▲★功能材料化学与化工面试加笔试材料科学基础《材料科学基础》,编者:潘金生清华大学出版社1998年版083100▲生物医学工程面试加笔试笔试:物理化学及实验或化工原理及实验或生物化学及实验(所选科目不能与初试科目相同)《多媒体CAI物理化学》(面向21世纪教材,第四版),编者:傅玉普等,大连理工大学出版社.化工原理及实验同初试科目参考教材生物化学及实验同初试科目参考教材学科、专业代码及名称考试形式复试笔试内容参考书目080502▲▲材料学(建筑材料部分)面试加笔试建筑材料综合 1.《胶凝材料学》,武汉理工大学出版社,袁润章编著2.《混凝土学》,中国建筑工业出版社,重庆大学等编著081401▲▲岩土工程面试加笔试土力学(60%)基础工程学(30%)工程地质学(10%)《土力学》(第二版),郭莹等编著,大连理工大学出版社,2003;《基础工程设计原理》,袁聚云等编著,同济大学出版社,2001;《工程地质》(第二版),孙家齐编著,武汉理工大学出版社,2003。
大连理工大学考试科目参考书目
大连理工大学考试科目参考书目目编号科目名称参考书目101 政治理论国家统一命题111 单独考试政治理论我校自主命题,非单独考试考生不得选考201 英语国家统一命题202 俄语国家统一命题203 日语国家统一命题211 单独考试英语我校自主命题,非单独考试考生不得选考212 单独考试俄语我校自主命题,非单独考试考生不得选考213 单独考试日语我校自主命题,非单独考试考生不得选考216 英语各大学外语专业二外使用教材217 日语各大学外语专业二外使用教材218 俄语各大学外语专业二外使用教材219 德语各大学外语专业二外使用教材220 法语各大学外语专业二外使用教材301 数学一国家统一命题302 数学二国家统一命题303 数学三国家统一命题311 教育学专业基础综合国家统一命题312 心理学专业基础综合国家统一命题313 历史学专业基础国家统一命题314 数学(农) 国家统一命题315 化学(农) 国家统一命题360 数学物理方法《数学物理方法》编者:梁昆淼,高等教育出版社361 数学分析《数学分析》编者:李成章、黄玉民,科学出版社,2005年第二版408 计算机学科专业基础综合国家统一命题414 植物生理学与生物化学国家统一命题611 单独考试数学我校自主命题,非单独考试考生不得选考614 基础英语各大学英语专业使用教材615 日语水平测试各大学高年级专业日语教材616 综合俄语各大学俄语专业使用教材618 现代汉语①《现代汉语》编者:黄伯荣、廖序东高等教育出版社2007年增订四版②《现代汉语语法研究教程》编者:陆俭明,北京大学出版社,2005年版619 传播学《传播学原理》,编者:张国良复旦大学出版社1995年12月《传播学教程》,编者:郭庆光中国人民大学出版社1999年11月620 民商法原理《民法》编者:魏振瀛,北京大学出版社、高等教育出版社,第三版《商法》编者:范健,北京大学出版社、高等教育出版社,第三版621 马克思主义哲学原理《马克思主义哲学原理》编者:陈先达,中国人民大学出版社,第二版《马克思主义哲学教程》编者赵家祥,聂锦芳,张立波,北京大学出版社,2003年622 管理学基础(1)《管理学》编者:汪克夷等,大连理工大学出版社,2006年第4版(2)《行政管理学》编者:夏书章,高等教育出版社、中山大学出版社,2008年版(3)《教育管理学》编者:陈孝彬,北京师范大学出版社,1999年修订本注:(2)、(3)任选其一623 城市规划历史与理论《中国城市建设史》中国建筑工业出版社《外国城市建设史》中国建筑工业出版社《城市规划原理》中国建筑工业出版社(第3版)624 建筑设计理论综合《中国建筑史》中国建筑工业出版社《外国建筑史(19世纪末叶以前)》中国建筑工业出版社《外国近现代建筑史》中国建筑工业出版社625 中外美术史《中国美术史》洪再新编著,中国美术学院出版社《外国美术简史》中央美术学院美术史系外国美术史教研室编著,高等教育出版社或中国青年出版社626 分析化学及分析化学实验《分析化学》编者宫为民等,大连理工大学出版社,2006年第三版《仪器分析》编者刘志广等,大连理工大学出版社,2007年第二版627 药物化学《药物化学》郑虎主编,第五版,人民卫生出版社《药物化学》,仉文生,李安良主编,高等教育出版社630 无机化学《无机化学》编者:袁万钟,高等教育出版社,2001 第四版631 分子生物学《现代分子生物学》编者:朱玉贤、李毅,北京高等教育出版社636 体育学专业基础综合《学校体育学》人民体育出版社出版,周登嵩主编,2004《运动训练学》人民体育出版社,体育院校通用教材《运动生理学》人民体育出版社,体育院校通用教材678 社会保障学《社会保障学》编者:陈树文、郭文臣,大连理工大学出版社,第一版501 建筑设计(6小时)《中国建筑史》建工出版社《外国建筑史(19世纪末以前)》建工出版社《建筑空间组合论》编者:彭一刚502 规划设计(6小时)《城市规划资料集》中国建筑工业出版社,第5、6分册,城市设计503 命题创作(手绘)(6小时)801 英语专业综合语言学部分(50分):参考书目:《语言学教程》(修订版),胡壮麟,北京大学出版社。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
考研专业课系列辅导之大连理工大学884物理化学及物理化学实验强化讲义全国考研专业课教研中心编光华职业教育咨询服务有限公司目录第一部分强化阶段的“一个目标两项任务” (3)第二部分强化课程主讲内容 (4)第一章化学热力学基础 (4)第二章相平衡热力学 (8)第三章相平衡状态图 (10)第四章化学平衡热力学 (17)第五章统计热力学初步 (20)第六章化学动力学基础 (21)第七章界面层的热力学及动力学 (28)第八章电解质溶液 (29)第九章电化学系统的热力学及动力学 (31)第十章胶体分散系统及粗分散系统 (36)第十一章物理化学实验 (38)第三部分历年真题解析 (39)3.1大连理工大学884物理化学及物理化学实验2010年真题解析 (39)3.2大连理工大学884物理化学及物理化学实验2009年真题解析 (39)3.3大连理工大学884物理化学及物理化学实验2008年真题解析 (41)3.4兄弟院校试题练习 (41)第四部分结束语 (83)第一部分强化阶段的“一个目标两项任务”专业课强化阶段学习时间是9月初至11月初,通过该阶段的学习,学员要达到“一目标”完成“两任务”。
“一个目标”是指做专业课真题自我模拟成绩达到最少120分。
得到这个分数,说明学员已经全面掌握了目标学校的考研基础知识点。
“两项任务”是指掌握教材知识点,研究真题并总结思路。
具体如下:强化阶段任务一:在认真学习完考研专业课公用知识点的基础上,扩展并掌握目标院校目标专业的考研知识点,完成强化、巩固过程,并逐步建立清晰的知识框架图,形成学员自有的知识体系,具体步骤如下(1)通识教材针对指定教材,毫无遗漏的将教材的章节知识点、例题及习题,仔细完整的进行一遍自学,并对把握不准的知识点做好标记;(2)阅读讲义在听课前,先自学一遍强化班讲义,在自学过程中,将讲义中涉及到的知识点标记在教材中。
如果同学还没有完成前面两步,我建议你暂时不要听课,先完成以上两个步骤,然后再听课,这样效果甚佳。
切记,基础最关键最重要;(3)细听课程为保证听课质量,建议同学在听课过程中,关闭各种聊天工具,集中精力细听强化班网络课程,并详细做笔记。
若在听课过程中记笔记的速度赶不上老师讲课的速度,可以手动暂停课程。
强化阶段任务二:科学的拆分真题,通过对比分析,掌握常考的重要知识点,并归纳出命题规律,把握考试方向。
具体步骤如下(1)拆分真题(2分析对比每年的考研知识点,通过考察频率、分值大小辨别出必考知识点、常考知识点,从而把握复习的重点内容,指导考研复习;同时了解知识点的考查形式,寻找命题规律,总结答题技巧,提高答题准确性。
(3)整合兄弟院校真题进行练习“兄弟院校”是指同一档次不同专业相同初试考试书目的高校。
兄弟院校真题的重要性体现在考试内容的重复性、考试形式的多样性,更有助于帮助你从不同角度加深理解专业课知识点。
尤其是对于不提供真题的一些院校,兄弟院校的真题就成为了含金量最高的实战性练习题。
第二部分强化课程主讲内容书中各个章节涉及到的考研知识点侧重点不同,下面我们就通过内容讲解知识点,通过典型例题理解知识点,最后通过课后作业练习真正掌握知识点。
第一章化学热力学基础1.1本章知识点串讲(1)了解系统和环境,系统的状态,系统的宏观性质,相的定义,热力学平衡态,状态方程,系统的变化过程和途径,状态函数的特点,可逆过程,化学反应进度等热力学基本概念。
(2)理解热与功的概念;掌握热与功的正、负号规定;掌握体积功的定义及计算。
(3)理解热力学能的定义及微观解释;掌握热力学第一定律的文字表述和数学式(4)了解热容的定义、摩尔定压和定容热容的概念;掌握理想气体的热力学能、焓只是温度的函数这一重要概念;了解理想气体绝热过程的基本公式和绝热可逆过程方程式。
(5)了解化学反应的热力学能[变]及焓[变]的含义,化学反应的标准摩尔焓[变] 及标准摩热力学能[变] 的关系,热力学的标准态,热化学方程式,盖斯定律等概念;理解反应的标准摩尔焓[变]的定义;理解标准摩尔生产焓[变] 标准摩尔焓,标准摩尔燃烧焓的定义(6)理解什么是节流效应,节流过程有什么特点;了解焦耳-汤姆系数的定义及其实际应用。
(7)理解热力学第二定律的经典表述及其数学式表述和热力学第二定律的实质;掌握熵增加原理、熵判据及其应用条件;掌握从熵的定义式出发计算系统发生单纯变化过程及其相变化(可逆的与不可逆的)过程的熵变(8)了解热力学第三定律的文字表述及其数学式表述,了解标准摩尔熵的概念。
(9)了解亥姆霍茨函数和吉布斯函数的定义;会用亥姆霍茨函数判据和吉布斯函数判据,了解其应用条件;会计算系统发生单纯变化过程及其相变化(可逆的与不可逆的)过程的熵。
(10)理解热力学基本方程,特别是要掌握及其应用条件;了解麦克斯韦关系式、热力学状态方程及吉布斯—亥姆霍茨方程。
(11)理解偏摩尔量的定义;了解不同组分同一偏摩尔量间的关系及其同一组分不同偏摩尔量间的关系。
(12)理解化学势的定义。
(13)理解多组分组成可变的均相系统的热力学基本方程及其应用。
(14)了解偏摩尔量与化学势的区别与联系。
(15)掌握物质平衡判据的一般形式及其相平衡条件和化学平衡条件。
(16)理解理想气体及其混合物中任意组分的化学势表达式;了解化学势的标准态。
(17)理解真实气体化学势表达式及逸度的定义和逸度因子的概念。
1.2本章重难点总结1.2.1重难点知识点总结(1)理想气体变化过程中,热力学量的计算方法等温过程、绝热过程、相变化过程(2)化学变化过程中的ΔU、ΔH、ΔS、ΔG(3) 热力学基本关系式及麦克斯韦关系式意义:它们表达了不做非体积功的热力学过程中热力学特性函数与特征变量间的具体关系。
适用条件:无非体积功的热力学可逆过程和无相变、无组成变化的热力学不可逆过程。
麦克斯韦关系式:1.2.2本章重难点例题讲解 【例题1】1mol 理想气体(1)经定温自由膨胀使体积增加1倍;(2)经定温可逆膨胀使体积 增加1倍;(3)经绝热自由膨胀使体积增加1倍;(4)经绝热可逆膨胀使体积增加1倍。
在下列结论中何者正确?( ) (A)S1= S2= S3= S4 (B)S1=S2,S3= S4=0(C)S1= S4, S2=S3 (D)S1= S2= S3,S4=0解析:D【例题2】从热力学四个基本 方程可导出 =( )解析:B【例题3】 2.00 mol 水在100℃、 101.325kPa 时,计算下面过程的Q 、W 、ΔU 、ΔH 、 ΔS 、 ΔG 和 ΔA 。
(1)定温定压可逆气化为水蒸气;(2)向真空蒸发为同温同压的水蒸汽,此过程是否可逆?( 已知水在100℃时的蒸发热为40.67kJ ·mol-1 ,假定水视水为理气,且Vg 》Vl)解析:定温可逆相变与向真空蒸发(不可逆相变)的终态相同,故两种变化途径的状态函数变化相等,即:G = G ′ = 0VS U ⎪⎭⎫⎝⎛∂∂ )D ( )C ( (B) )A (pS p T T G V U S H V A ⎪⎭⎫ ⎝⎛∂∂⎪⎭⎫ ⎝⎛∂∂⎪⎭⎫ ⎝⎛∂∂⎪⎭⎫ ⎝⎛∂∂H = H ′ = 1mol×40.67 kJ·mol = 40.67 kJS = S ′ =U = U ′ = H ′ -pV = H’-nRT= 40.67 kJ -1 mol×8.314 J·K 1·mol 1×373 K= 37.57 kJA =U -TS = 37.57 kJ -373 K×109×10 3 kJ·K 1 =-3.1 kJQ 和W 不 是 状 态 函 数, 故 应 分 别 计 算 对于可逆相变,有W =-nRT = 1 mol×8.314 J·K -1·mol -1×373 K=-3.1kJ Q = ∆U -W =37.57 -(-3.1)=40.67kJ ∆A T = W 可逆 对于向真空蒸发,有 p ex = 0,故W = 0因 ∆U = Q + W所以 Q = ∆U = 27.82 kJ 由计算结果可知,∆A r < W ,故过程不可逆。
注:本过程是定温但不定压,故而应当用∆A T ≤W 判断. 不能用∆G T ≤0【例题4】4mol 单原子理想气体从始态750K ,150kPa ,先恒容冷却使压力下降至50kPa ,再恒温可逆压缩至100kPa 。
求整个过程的 及 。
解析:题给过程可表示 单原子理想气体解此题的关键应先求出T2。
Q 与W 与途径有关,先求二者之中最易求者,一个可由式ΔU=Q+W 求之。
因途径(1) 所以途径(2)为恒温可逆压缩过程,故13K J 10973K3J 1067.40-•=⨯='∆T H ,,,Q W U H ∆∆S∆4=mol n 2321d 0,d 0,2331750K 50kPa 100kPa 150kPa V T T T T T T p p p 降可逆(1)()====⎧⎧⎧−−−−→−−−−→⎨⎨⎨===⎩⎩⎩2121/750K 50kPa /150kPa 250KT T p p ==⨯=32250KT T ==d 0V =10W =1223232ln(/)ln(/){48.3145ln(100/50)}J 5.763kJW W W W nRT V V nRT p p =+==-==⨯=【例题5】带有活塞的绝热汽缸中有2mol 、25℃、15dm3H2,若活塞上所施加压力(环境压力)突然降到某一数值,则氢气迅速膨胀至最终体积为50dm3,求气体的最终温度T2为( ),该过程的W 为( ),△H 为( ).解析:有题意可知,该过程是绝热可逆过程。
Q=0 ,△U=W . nC v,m (T 2-T 1)=-p(V 2-V 1)=-nRT 2/V 2 (V 2-V 1) 代入数据求得:T 2=232.8K 。
W=-nRT 2/V 2 (V 2-V 1) = -2.71KJ △H=-nC p,m (T 2-T 1)=-3.79KJ 【例题6】证明对于1mol 纯理想气体, 解析:1.3本章典型题库1.3.1作业,m 31(){4 1.58.3145(250750)}J 24.944kJV U nC T T ∆=-=⨯⨯⨯-=-(24.944 5.763)kJ 30.707kJQ U W =∆-=-+=-,m 31(){4 2.58.3145(250750)}J 41.573kJp H nC T T ∆=-=⨯⨯⨯-=-,m 31313131-1-1ln(/)ln(/)(2.5ln(/)ln(/)}48.3145{2.5ln(250/750)ln(100/150)}J K 77.859J K p S nC T T nR p p nR T T p p ∆=-=-=⨯⨯-⋅=-⋅V SC p V T -=⎪⎭⎫⎝⎛∂∂ V SSV V V V TV C p V T pV T C dV V p S T U T C TC T T C V V U T T U U -=⎪⎭⎫⎝⎛∂∂-=⎪⎭⎫ ⎝⎛∂∂-===⨯+=⎪⎭⎫⎝⎛∂∂+⎪⎭⎫ ⎝⎛∂∂=即得除同边下,两熵定又体气想理纯 d d d d d d 0d d d d ,苯的正常沸点353K时摩尔汽化焓是30.75KJ/mol 。
