说明盐酸和氢氧化钙发生了化学反应
2024届上海市市西初级中学中考化学适应性模拟试题含解析

2024学年上海市市西初级中学中考化学适应性模拟试题考生须知:1.全卷分选择题和非选择题两部分,全部在答题纸上作答。
选择题必须用2B铅笔填涂;非选择题的答案必须用黑色字迹的钢笔或答字笔写在“答题纸”相应位置上。
2.请用黑色字迹的钢笔或答字笔在“答题纸”上先填写姓名和准考证号。
3.保持卡面清洁,不要折叠,不要弄破、弄皱,在草稿纸、试题卷上答题无效。
一、选择题(本题包括12个小题,每小题3分,共36分.每小题只有一个选项符合题意)1.某溶液能使紫色石蕊溶液变红,下列各组离子在该溶液中能大量共存的是()A.Ag+、Na+、Cl﹣、NO3﹣B.Na+、K+、OH﹣、SO42﹣C.K+、Na+、CO32﹣、Cl﹣D.Ba2+、Mg2+、NO3﹣、Cl﹣2.已知Na2CO3样品中含有少量的NaCl,为测定该固体混合物中Na2CO3的质量分数,分别取ag样品,按下列方案进行实验,能达到目的的是A.与足量稀硫酸充分反应,用排水法收集到Vml气体B.与足量稀硫酸充分反应,称量反应后的溶液,质量为m1gC.与足量Ca(OH)2溶液充分反应,将反应后的混合物过滤、洗涤、干燥.得到m2g固体D.与少量Ca(OH)2溶液充分反应,将反应后的混合物过滤、洗涤、干燥,得到m3g固体3.“”、“”、“”表示不同元素的原子,下图表示氧化物的微观示意图为A.B.C. D.4.降压药又称抗高血压药,是一类能控制血压、用于治疗高血压的药物。
硝苯地平(C17H18N2O6)是一种常见的降压药,下列关于硝苯地平的说法不正确的是A.硝苯地平由4 种元素组成B.硝苯地平中N、O 质量比为7∶24C.硝苯地平的相对分子质量是346D.硝苯地平中C、H、N、O 的质量比是17∶18∶2∶65.实验室用氯酸钾制氧气的化学方程式为2KClO32MnO加热2KCl+3O2↑,该反应属于()A.化合反应B.分解反应C.置换反应D.复分解反应6.在进行“氧气的实验室制取与性质”实验时,某同学制得的氧气不纯。
中考化学总复习考点素能检测:第18讲酸和碱的中和反应+含答案

第18讲 酸和碱地中和反应一、选择题1.酸与碱作用生成盐和水地反应,叫做中和反应。
它在工农业生产和日常生活中有广泛地用途。
下列应用一定与中和反应原理无关地是(C)A.施用熟石灰改良酸性土壤B.服用含Al(OH)3地药物治疗胃酸过多C.用硫酸除铁锈D.用NaOH溶液洗涤石油产品中地残余硫酸2.(2014,广州)向含有酚酞地NaOH溶液中滴加盐酸,溶液红色褪去变为无色,此时溶液pH可能是(A)A.5 B.9 C.12 D.133.(2014,佛山)少年儿童按下图时间就餐,口腔残留食物地pH在一天中地变化如下:已知口腔若经常保持酸性,容易发生蛀牙,如果只从这一点考虑,你认为三次刷牙时间最好安排在(A)A.三次吃点心后B.早、午、晚餐前C.早餐、午餐、晚睡前D.早、午、晚餐后4.(2014,兰州)为了维持人体正常地生命活动,人体不同器官内地体液具有不同地酸碱性,根据下表可知,在正常情况下(B)体液唾液胆汁胰液pH 6.6~7.17.1~7.37.5~8.0A.人体地唾液一定呈酸性B.人体地胆汁一定呈碱性C.人体地胰液能使紫色石蕊试液变红色D.酚酞试液可精确测得以上体液地pH5.(2013,兰州)根据实践经验,你认为下列课外实验不能成功地是(A)A.用润湿地pH试纸测定不同品牌洗发液地酸碱度B.用酒精浸泡捣烂地紫罗兰花瓣自制酸碱指示剂C.用柠檬、果汁、白糖、水、小苏打等自制汽水D.用干电池、灯泡、导线、6B铅笔芯等验证石墨可以导电6.(2014,重庆)某同学用pH试纸测定溶液地酸碱度,下列操作或结论正确地是(D)A.用pH试纸直接蘸取待测溶液B.先用水润湿pH试纸再测定溶液酸碱度C.用pH试纸测得石灰水地pH=5D.用pH试纸测得盐酸地pH=17.(2013,苏州)向一定体积地NaOH稀溶液中逐滴滴加稀盐酸,溶液pH变化地曲线合理地是(A)8.(2014,襄阳)①酸奶;②肥皂水;③食盐水是生活中常见地三种物质。
淄博市中考化学实验题试卷(带答案)-百度文库
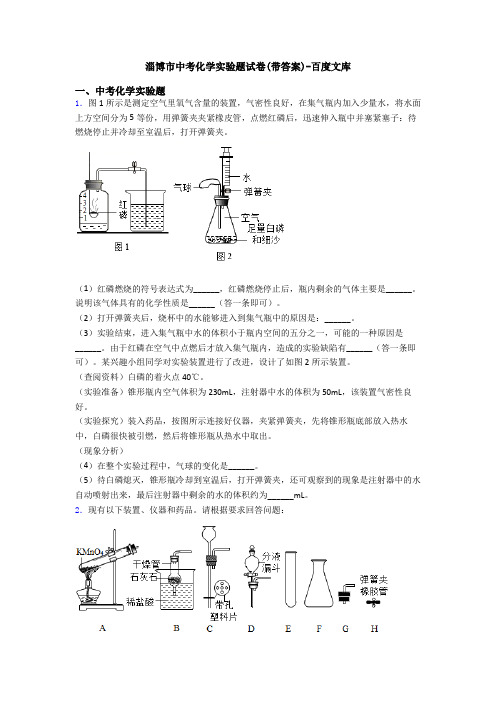
淄博市中考化学实验题试卷(带答案)-百度文库一、中考化学实验题1.图1所示是测定空气里氧气含量的装置,气密性良好,在集气瓶内加入少量水,将水面上方空间分为5等份,用弹簧夹夹紧橡皮管,点燃红磷后,迅速伸入瓶中并塞紧塞子:待燃烧停止并冷却至室温后,打开弹簧夹。
(1)红磷燃烧的符号表达式为______,红磷燃烧停止后,瓶内剩余的气体主要是______。
说明该气体具有的化学性质是______(答一条即可)。
(2)打开弹簧夹后,烧杯中的水能够进入到集气瓶中的原因是:______。
(3)实验结束,进入集气瓶中水的体积小于瓶内空间的五分之一,可能的一种原因是______。
由于红磷在空气中点燃后才放入集气瓶内,造成的实验缺陷有______(答一条即可)。
某兴趣小组同学对实验装置进行了改进,设计了如图2所示装置。
(查阅资料)白磷的着火点40℃。
(实验准备)锥形瓶内空气体积为230mL,注射器中水的体积为50mL,该装置气密性良好。
(实验探究)装入药品,按图所示连接好仪器,夹紧弹簧夹,先将锥形瓶底部放入热水中,白磷很快被引燃,然后将锥形瓶从热水中取出。
(现象分析)(4)在整个实验过程中,气球的变化是______。
(5)待白磷熄灭,锥形瓶冷却到室温后,打开弹簧夹,还可观察到的现象是注射器中的水自动喷射出来,最后注射器中剩余的水的体积约为______mL。
2.现有以下装置、仪器和药品。
请根据要求回答问题:(1)分别写出仪器的名称:E_______、F_______。
(2)图A中实验室制氧气发生反应的化学方程式是_______,此装置有两处错误,请指出错误_______、_______。
(3)装置B中反应的化学方程式为_______,检验产生的气体用方程式表示:_______;从“C至H”中选择仪器_______(填序号)组装一个可随时使反应发生或停止的装置;若用H2O2和MnO2制取O2常选ED(或FD)组合,其主要优点是:_______。
新沪教版九年级下册化学同步练习基础实验8酸与碱的化学性质

沪教版九年级下册化学跟踪训练基础实验8酸与碱的化学性质、单选题1. 区别熟石灰与烧碱的水溶液,可选择()A. CQB.稀盐酸C. CuSO溶液D. NaCI溶液2. 酸与碱作用生成盐和水的反应,叫做中和反应.下列应用与中和反应原理无关的是()A. 用熟石灰和硫酸铜配制波尔多液B.服用含Mg(OH)2的药物治疗胃酸过多C.施用熟石灰改良酸性土壤D用NaOH溶液洗涤石油产品中的残余硫酸3. 下列物质中,能与稀盐酸发生中和反应的是()A. MgB. MgOC. MgCOD. Mg(OH)4. 下列物质加入到稀硫酸中,有大量气泡产生的是()A. ZnB. CuC. K2SO4D. NaOH5. 在反应A+HCl ------- M gCb+B中,A可能是下列物质中的()① Mg ;② MgO ;③ Mg (OH)2;④ MgCO 3 .A.只有①②B.只有②③④C.只有①②④D.①②③④6. 把鸡蛋放在下列某物质中•可以制作无壳鸡蛋”该物质是()A.食盐旳酒(食醋D酱油7. 酸与碱作用生成盐和水的反应,叫做中和反应。
它在工农业生产和日常生活中有广泛的用途。
下列应用一定与中和反应原理无关的是()A.施用熟石灰改良酸性土壤B服用含Al(OH)3的药物治疗胃酸过多C.用熟石灰和硫酸铜配制波尔多液D.用NaOH溶液洗涤石油产品中的残余硫酸8. 将少量灰黑色的生铁粉末,投入盛有过量稀硫酸的烧杯中,充分搅拌,待完全反应后过滤,滤纸上留有黑色的残渣。
该黑色残渣的主要成分是()A.铁B.碳C.铁、碳混合物D.硫酸亚铁9. 稀盐酸和稀硫酸具有许多相似化学性质的原因是,它们都()A.都是溶液B.都含有氢元素C.都解离出氢离子D.都含有酸根离子10. 有关氢氧化钠的叙述不正确的是()A.露置在空气中易变质晞于水时放出热量C.能使紫色石蕊试液变蓝色□能做治疗胃酸过多的药物二、填空题11. 镍(Ni)是一种用途广泛的金属,常用于电镀工业和制造电池,硫酸镍溶液显绿色,氢氧化镍为难溶于水的绿色固体,在这些化合物中镍元素都显+2价.(1)氢氧化镍的化学式为__________ .(2)将硫酸镍溶液加入试管中,再滴加足量氢氧化钠溶液,充分振荡后静置.①反应的化学方程式为____________ .②预测反应现象:___________ .12. 盐酸、硫酸、氢氧化钠是重要的化工原料.(1)浓硫酸是实验室常用的气体干燥剂,说明浓硫酸具有________________ 性.(2)稀盐酸和稀硫酸都可以用于金属除锈,是因为它们的溶液中都含有_________ .(3) _____________________________________________________________ 氢氧化钠暴露在空气中,容易潮解,同时吸收空气中的 _________________________________________________________ 而变质,所以氢氧化钠固体必 须 _________ 保存.13•现有白纸和几种溶液,有人用这些材料设计了一个名为 雨落叶出红花开”的趣味实验。
九年级化学(下)《酸与碱的化学性质》实验中考真题含答案

【解析】
(1)氢氧化钠能使酚酞溶液变红,则若把酚酞溶液滴加到氢氧化钠溶液中,观察到的现象是溶液变红色。
(2)反应②是氢氧化钠与酸的反应,若酸是盐酸,氢氧化钠能与盐酸反应生成氯化钠和水,反应的化学方程式为 ;由图可知,随着酸的加入,溶液的温度是先升高后降低,则该反应是放热反应。
下列结论正确的是( )
A.实验一说明NaOH溶液没有变质B.实验二H)2D.实验三说明NaOH溶液部分变质
【答案】D
【解析】
实验一说明溶液呈碱性;实验二有气泡产生说明氢氧化钠溶液已变质,溶质中含有碳酸钠;实验三加入足量的BaCl2溶液,有白色沉淀生成,该沉淀为氯化钡和碳酸钠生成的碳酸钡沉淀,且加入足量的BaCl2溶液,已将溶液中的碳酸钠完全反应,过滤沉淀后,向滤液中滴加1~2滴酚酞溶液,溶液显红色,说明溶液中还含有氢氧化钠,故氢氧化钠溶液已部分变质。
(4)一氧化碳与二氧化碳虽然组成元素相同,但性质不同,是因为它们的分子构成不同。
7.(2022年江苏省扬州市中考)为认识酸和碱的性质,某化学学习小组进行了如下实验。
(1)20℃时,配制80g溶质质量分数为10%的NaOH溶液。
①用图中仪器完成实验,还缺少的玻璃仪器是____(填名称),玻璃棒在配制实验中的作用是___。
B.少量二氧化碳通入澄清石灰水中,溶液变浑浊
C.硫酸铜溶液中加入氢氧化钠溶液,出现蓝色沉淀
D.稀盐酸中加入少量铁锈,溶液变为黄色
【答案】A
【解析】
A、木炭在氧气中燃烧,发出白光,生成使澄清石灰水变浑浊气体,说法不正确,符合题意;
B、二氧化碳和石灰水中溶质氢氧化钙反应生成碳酸钙白色沉淀,故少量二氧化碳通入澄清石灰水中,溶液变浑浊,说法正确,不符合题意;
盐酸与氢氧化钙反应化学方程式

盐酸与氢氧化钙反应化学方程式盐酸(HCl)与氢氧化钙(Ca(OH)2)反应的化学方程式如下:2HCl+Ca(OH)2→CaCl2+2H2O这个方程式表示了盐酸和氢氧化钙反应生成氯化钙和水。
盐酸是一种强酸,而氢氧化钙是一种碱。
当它们混合在一起时,酸碱中和反应会发生,产生新的化合物。
盐酸的化学式为HCl,它是氯化氢和水的混合物。
氯化氢是一种气体,但是在水中可以溶解,并形成盐酸。
盐酸是一种强酸,可以将其溶液完全电离为H+和Cl-离子。
氢氧化钙的化学式为Ca(OH)2,它是由钙离子(Ca2+)和氢氧根离子(OH-)组成的。
氢氧化钙是一种强碱,可以将其溶液完全电离为Ca2+和2OH-离子。
当盐酸和氢氧化钙混合时,氯化氢离子(H+)和氢氧根离子(OH-)会发生中和反应,形成水分子(H2O)。
同时,钙离子(Ca2+)和氯离子(Cl-)会结合形成氯化钙(CaCl2)。
化学方程式中的系数表明,在反应中需要两个盐酸和一个氢氧化钙。
这个反应是一个酸碱中和反应,也被称为酸碱反应。
在酸碱中和反应中,酸和碱彼此中和,并且生成盐和水。
在这个反应中,盐指的是氯化钙(CaCl2)。
这个反应也可以用口头方程表达为:盐酸加氢氧化钙生成氯化钙和水。
这个反应在许多实际应用中都有重要的作用。
例如,在工业生产中,盐酸和氢氧化钙可以用于净化水、调节酸度和制备其他化合物。
此外,这个反应也被广泛应用于实验室中,用于教学和研究目的。
总结起来,盐酸和氢氧化钙反应的化学方程式是2HCl+Ca(OH)2→CaCl2+2H2O。
这个反应是酸碱中和反应,生成氯化钙和水。
这个反应在工业和实验室中有广泛的应用。
氢氧化钙与稀盐酸反应方程式现象

氢氧化钙与稀盐酸反应方程式现象
氢氧化钙(Ca(OH)2)与稀盐酸(HCl)反应是一种常见的化学
反应,它产生了令人惊讶的化学现象。
这种反应是酸碱中和反应的
典型例子,同时也展示了化学反应中离子交换和生成新物质的过程。
当氢氧化钙与稀盐酸发生反应时,它们会产生盐和水。
具体的
化学方程式如下:
Ca(OH)2 + 2HCl → CaCl2 + 2H2O.
在这个方程式中,氢氧化钙和稀盐酸反应生成了氯化钙和水。
这种反应是一种中和反应,因为氢氧化钙是一种碱,而稀盐酸是一
种酸。
当它们混合在一起时,碱中的氢氧化物离子和酸中的氢离子
相互结合,形成了水和盐。
这个反应还展示了离子交换的过程。
在反应中,氢氧化钙中的
钙离子和稀盐酸中的氯离子交换位置,形成了氯化钙。
这种离子交
换是化学反应中常见的现象,它导致了新物质的生成。
除了化学方程式所展示的化学变化,这种反应还伴随着一些明
显的物理现象。
当氢氧化钙和稀盐酸混合时,会产生大量的气泡,
这是因为反应产生了二氧化碳气体。
同时,混合后的溶液会变热,
这是因为反应是放热的。
总的来说,氢氧化钙与稀盐酸反应是一种典型的酸碱中和反应,它展示了化学反应中离子交换和生成新物质的过程。
这种反应不仅
在化学实验中常见,也在日常生活中有着重要的应用,例如在制备
食品和药品过程中。
通过深入了解这种反应的机理和特性,我们可
以更好地掌握化学知识,并将其应用到实际生活中。
氢氧化钙和稀盐酸反应的现象

氢氧化钙和稀盐酸反应的现象
氢氧化钙与稀盐酸反应并没有明显现象,需要加入酸碱指示剂。
滴入紫色石蕊试液:逐渐滴加盐酸,蓝色慢慢褪去,当盐酸量变多,PH=7,溶液变为紫色;再滴加时,溶液变红;加入酚酞试液:加入盐酸,红色褪去,当PH=7时为无色,再滴加,颜色不变。
什么是稀盐酸
稀盐酸指的是质量分数低于20%的盐酸,溶质的化学式为HCl。
稀盐酸是一种无色澄清液体,呈强酸性。
主要用于实验室制二氧化碳和氢气,除水垢,药用方面主要可以治疗胃酸缺乏症。
氢氧化钙
氢氧化钙俗称熟石灰或消石灰,化学式Ca(OH)2,是一种白色粉末状固体,加入水后,呈上下两层,上层水溶液称作澄清石灰水,下层悬浊液称作石灰乳或石灰浆。
三氧化硫是强的氧化剂,只能在高温时氧化硫、磷、铁、锌以及溴化物、碘化物等,化学式SO₃。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二课时
学习目标
了解中和反应在实际生活中的具体应用
二、中和反应的应用
活动天地:酸碱中和反应中溶液PH的变化
向20ml0.4%的氢氧化钠溶液中逐滴加入0.4%的盐酸, 连接在传感器上的计算机随即绘制出了溶液PH(纵坐标) 随所加盐酸体积(横坐标)变化的曲线。
14 (18,7) 2 18
向酸性土壤中洒熟石灰
二、中和反应的应用
3、 处理工业废水
如:硫酸厂的污水含
有硫酸等物质,可加熟石
灰进行中和处理。
反应方程式?
H2SO4 +Ca(OH) 2=CaSO4+2H2O
熟石灰中和硫酸
二、中和反应的应用
4 、调节溶液的酸碱性 (1)醋去除热水瓶水垢 (2)厨房清洁剂(显碱性)去油污 (3)肥皂清洗衣服油渍 (4)用醋降低或除去氧化钠溶液与稀盐酸恰好完全反应的 微观示意图,由此得出的结论错误的是( C ) •
• • • •
A.反应结束时溶液的p H=7 B.反应前后元素的种类没有变化 C.反应后溶液中存在的粒子只有Na+和Cl— D.该反应的实质是H+和OH一结合生成水
在线测试
2、下图表示盐酸中和氢氧化钠溶液时,溶液 pH与滴加盐酸体积的关系,能正确表示pH随 加入盐酸体积变化的图象是( B )
3.下列物质中常用来改良土壤酸性的是( B ) A.石灰石 B.熟石灰 C.干冰 D.烧碱
4.食用松花蛋时常感到有涩味,是因为制作过程中 用到了熟石灰和纯碱等原料。为了减轻涩味,可 在食用时添加调味品,这种调味品最好 D( )。 A、食盐 B、酱油 C、香油 D、食醋
(2006•泰安)小明在“探究盐酸和氢氧化钙能否发生化学反应”时,设计了如图 所示的对照实验: 他设想在室温下,先取少量氢氧化钙粉末分别放入两只烧杯中,在Ⅱ烧杯中加入一 定量的蒸馏水,在I烧杯中加入含等量蒸馏水的浓盐酸,充分搅拌,一段时间后, 观察现象. 根据上述情况,请回答以下问题: (1)你认为要得到可靠的实验结论,需要保证实验I、Ⅱ中 氢氧化钙粉末的质量 ____________________ 完全相同.预测通过观察 _________________________________________________________________ 实验I中白色粉末消失成为无色溶液或(实验I中的浑浊程度比实验Ⅱ中小) 的现象,说明盐酸和氢氧化钙发生了化学反应; (2)设计对照实验Ⅱ的目的是 ____________________________________________________________ 排除氢氧化钙粉末溶于水的因素,以证实氢氧化钙粉末与盐酸发生化学反应 ; (3)如果不采用对照实验,请你设计一个简单实验证明盐酸和氢氧化钙能够发生 化学反应:________________________________________________________ ; 在一定量的氢氧化钙粉末中加入适量的水,再滴加2--3滴酚酞试液, 浑浊液变红,然后加入适量盐酸至红色消失,变为无色液体,说明 (4)写出该反应的化学方程式 盐酸与氢氧化钙能够发生化学反应 __________________________
当堂检测
1、某种消化药片的有效成分氢氧化镁,能减缓因 胃酸过多引起的疼痛。在氢氧化镁与胃酸作用的 过程中,胃液pH变化的情况是( B )
2. 下列应用一定与中和反应原理无关的是( C ) A.施用熟石灰改良酸性土壤 B.服用含Al(OH)3的药物治疗胃酸过多 C.用熟石灰和硫酸铜配制波尔多液 Ca(OH)2+CuSO4=CaSO4+Cu(OH)2↓ D.用NaOH溶液洗涤石油产品中的残余硫酸
思考:在向氢氧化钠溶液中滴 加稀盐酸时,溶液的PH是怎样 变化的?你能说出曲线上坐标 为(18,7)的点所表示的意义 吗?
当加入盐酸量较少时,溶液中氢氧化钠有剩余,溶液呈碱性,PH>7。
当滴入盐酸恰好与溶液中氢氧化钠完全反应时,溶液呈中性, PH=7
当滴入盐酸过量时,溶液中盐酸有剩余,溶液呈酸性, pH<7
.
Ca(OH)2+2HCl=CaCl2+2H20
二、中和反应的应用
1、 用于医药卫生
如治疗消化不良 ——用含碱性物质(一般为Al(OH)3)的药物治 疗胃酸过多引起的消化不良,反应方程式:
Al(OH)3+3HCl=AlCl3+3H2O
治疗蚊虫叮咬
碱性物质(如氨水/肥皂水)处理蚊虫叮咬,蚊虫能 在人的皮肤内分泌蚁酸。
二、中和反应的应用
2、 改变土壤酸碱性: 改良酸性土壤:熟石灰或草木灰 改良碱性土壤:碳酸水或硫酸亚铁(FeSO4)
