2015版微生物检验记录 (1)
清洁验证微生物检查记录

编号:SMP-09-00702-g
清洁对象名称
供样单位
取样点
检验日期
年 月 日
编号
报告日期
年 月 日
温度
℃
相对湿度
%
检验依据
《中国药典》2015年版四部《非无菌产品微生物限度检查》
标准规定
需氧菌≤100cfu/100cm²;霉菌酵母菌≤100cfu/100cm²
供试液的制备:用棉签擦拭取样点100cm²,将棉签放入无菌具塞玻璃试管中,加入10ml生理盐水中,振摇混匀,作为1:10的供试液。按《非无菌产品微生物限度检查》进行检验。
检查结果
需氧菌
培养箱型号:
培养箱编号:RHBC-ZK-
设定温度:
霉菌、酵母菌
培养箱型号:
培养箱编号:RHBC-ZK-
设定温度:
1
2
阴性
对照
1
2
阴性
Hale Waihona Puke 对照1天1天2天
2天
3天
3天
4天
4天
5天
5天
6天
7天
平均
平均
结果
结果
结论
检验人
复核人
药品的微生物限度检查

24~48h
紫红胆盐葡 萄糖平板
10-1
无菌落
18~24h
有菌落
报告未检出
10g/10ml/ 100cm2供试品
3.耐胆盐革兰阴性菌定量检查操作示意图
以TSB为稀释液制供试液
一定量 肠道增菌肉汤
20~25℃, 2h预增菌
1ml
24~48h
紫红胆盐 葡萄糖平板
报告结果
10-1
18~24h
(六)梭菌的检查
梭菌 增菌 培养 基
供试液的制备
书写检 验记录
哥伦比亚琼脂培养基分离
1.梭菌检查程序
无菌落生长
过氧化氢 酶试验
配培养基和稀释液
最终结果判断
有 菌 落
确证 试验
10g/10ml/ 100cm2供试品
2.供试品梭菌检查操作示意图
各10ml
分别接种
一份80℃保温10min后迅速冷却
10-2
10-31ml10-110-210-3
各管加1ml
查可能菌数表
9ml 稀 释 液
有/无菌落
(二)大肠埃希菌检查
大肠埃希菌作为检验供试品是否受粪便污染的指示菌。
2015年版《中国药典》规定经口及呼吸道服给药的制剂,每1g、1ml或10cm2不得检出大肠埃希菌。
TSB 增菌 培养
30℃~35℃
3~5d
1.平皿法
(1)基本程序:
数据 处理
结果观察与计数
书写检 验记录
平板 接种
需氧菌 的培养
供试液 的制备
配培养基和稀释液
倒置 培养 3~5d
30~35℃
TSA
不少于 0.1ml
微生物限度检查记录 版

表:微生物限度检查记录(通用)三、大肠埃希菌检查胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配制批号:)麦康凯琼脂培养基(配制批号:)微生物限度检查记录(30~35℃,3~5天)20℃~25℃,5~7天)沙氏葡萄糖琼脂培养基(配制批号:)三、控制菌检查(30-35℃)表:胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配制批号:)麦康凯琼脂培养基(配制批号:)(30℃~35℃)胰酪大豆胨液体培养基(配制批号:)、RV沙门增菌液体培养基(配制批号:),木糖赖氨酸脱氧胆酸盐琼脂培养基(配制批号:)、三糖铁琼脂(配制批号:)五、耐胆盐革兰阴性菌检查胰酪大豆胨液体培养基(配制批号:)、肠道菌增菌液体培养基(配制批号:),紫红胆盐葡萄糖琼脂培养基(配制批号:)表:(含药材原粉的片剂)胰酪大豆胨液体培养基(配制批号: )、麦康凯液体培养基(配制批号: )麦康凯琼脂培养基(配制批号: )(30℃~35℃)胰酪大豆胨液体培养基(配制批号: )、RV 沙门增菌液体培养基(配制批号: ),木糖赖氨酸脱氧胆酸盐琼脂培养基(配制批号: )、三糖铁琼脂(配制批号: )五、耐胆盐革兰阴性菌检查胰酪大豆胨液体培养基(配制批号: )、肠道菌增菌液体培养基(配制批号: ),紫红胆盐葡萄糖琼脂培养基(配制批号: )表:微生物限度检查记录(蛇胆川贝液)三、大肠埃希菌检查胰酪大豆胨液体培养基(配制批号:)、RV沙门增菌液体培养基(配制批号:),木糖赖氨酸脱氧胆酸盐琼脂培养基(配制批号:)、三糖铁琼脂(配制批号:)表:微生物限度检查记录(30~35℃,3~5天)20℃~25℃,5~7天)沙氏葡萄糖琼脂培养基(配制批号:)胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配制批号:)麦康凯琼脂培养基(配制批号:)表:微生物限度检查记录(内包材)三、大肠埃希菌检查胰酪大豆胨液体培养基(配制批号:)、麦康凯液体培养基(配制批号:)麦康凯琼脂培养基(配制批号:)。
《2015版《中国药典》微生物检测与洁净室环境检测技术》-1

育
飞
天
教
育
微生物细胞结构示意图
• 细菌细胞结构图 •
教 真菌细胞结构图 天 飞
育
飞
天
教
育
微生物的五大共性
飞
天
教
育
1、体积小,面积大; 2、吸收多,转化快;
3、生产旺,繁殖快;
4、适应强,易变异; 5、分布广,种类多。
飞
天
教
育
细 菌 形 态 特 征
• 革兰氏阳性细菌和革兰氏阴性细菌的细胞壁结构比较
天
教
育
试管
移液管
先用少许棉花塞于吸口端,然后用纸包好或装入金属吸 管筒内,于121℃高压蒸汽灭菌20min后烘干。
飞
天
教
育
培 养 基 的 基 础 知 识
溶
液体培养 基用滤纸 过滤,固 体培养基 用纱布块 中夹薄层 脱脂棉过 滤
化
校正酸碱度
(1)先将卵磷脂加入少量蒸馏水低温加 热溶解溶、再加吐温80混匀,,加入琼 脂,静置15分钟。
细胞壁结构 G+ G-
飞
天
教
育
脂多糖(LPS),包括脂
厚度 强度 糖类含量 脂类含量 磷壁酸 脂多糖
20-80nm 坚韧 约45% 约2% 无
10-15nm 疏松 约15% 约20% 有 有
蛋白A,核心多糖和特异
性多糖三个部分。LPS对 动物具有毒性作用,它 牢固地结合在细胞表面,
只在菌体融解时才释放,
非细胞类:病毒、亚病毒(类病毒、朊病毒)
飞
天
教
育
细菌(bacteria)
• 细菌是单细胞的原核微生物
• 细菌是所有生物中数量最多的一类,据估计,其总数约有 5×10的三十次方个。 • 细菌主要由细胞壁、细胞膜、细胞质、核质体等部分构成 • 根据形状分为三类,即:球菌、杆菌和螺形菌(包括弧菌、 螺菌、螺杆菌)
《中国药典》2015年版微生物计数法实例

SDA
试验二:需氧菌总数、霉菌和酵母菌总数的计数 (薄膜过滤法)
试验组
(样+菌)
• 取10g供试品加pH7.0无菌氯化钠-蛋白胨缓冲液至100mL,制成1:10的供试液,供试 液分装成7支试管,每支9.9mL,每管加0.1mL的菌液,使试管中含菌量不大于 100cfu/mL,吸取1mL进行薄膜过滤,用500mLpH7.0无菌氯化钠-蛋白胨缓冲液冲洗, 100mL/次,滤膜贴在相应的培养基上。每株试验菌每种培养基至少制备一张滤膜。
水不溶性非油脂类供试品
• pH7.0无菌氯化钠-蛋白胨缓冲液,或pH7.2磷酸盐缓冲液,或TSB溶解或稀释成1:10供试液。分散力较差的 供试品可在稀释液中加入表面活性剂如0.1%的聚山梨酯80,使供试品分散均匀。必要时进一步稀释。
油脂类供试品
• 取供试品加入无菌十四烷酸异丙酯使溶解,或与最少量并能使供试品乳化的无菌聚山梨酯80或其他无抑菌 性的无菌表面活性剂充分混匀。必要时进一步稀释。
1107 非无菌药品微生物限度标准(3/3)
1107 非无菌药品微生物限度标准----实例
微生物限度标准:需氧菌总数不得过103cfu/g,霉菌和酵母菌总数 不得过102cfu/g,金黄色葡萄球菌不得检出,铜绿假单胞菌不得检 出,大肠埃希菌不得检出,沙门菌不得检出,耐胆盐革兰阴性菌 应小于102cfu/g。
/
/
T/S
0.92
0.91
0.92
1.07
1.08
被检固体培养基上的菌落平均数与对照培养基上的菌落平均数的比值应 在0.5-2范围内,且菌落形态大小应与对照培养基上的菌落一致。
实例:霉菌和酵母菌总数计数培养基适用性检查结果(SDA)
菌种
被检培养基菌落数 (T)
2015版纯化水微生物限度检查记录
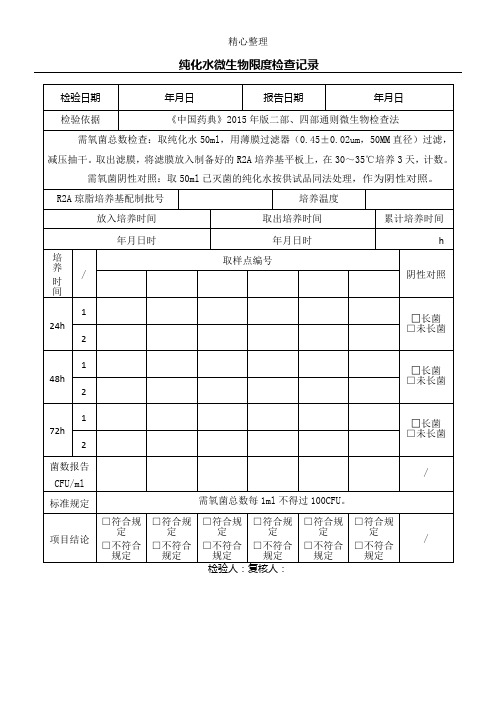
累计培养时间
年月日时
年月日时
h
培养
时间
/
取样点编号
阴性对照
24h
1
□长菌
□未长菌
2
48h
1
□长菌
□未长菌
2
72h
1
□长菌
□未长菌
2
菌数报告
CFU/ml
/
标准规定
需氧菌总数每1ml不得过100CFU。
项目结论
□符合规定
□不符合规定
□符合规定
□不符合规定
纯化水微生物限度检查记录
检验日期
年月日
报告日期
年月日
检验依据
《中国药典》2015年版二部、四部通则微生物检查法
需氧菌总数检查:取纯化水50ml,用薄膜过滤器(0.45±0.02um,50MM直径)过滤,减压抽干。取出滤膜,将滤膜放入制备好的R2A培养基平板上,在30~35℃培养3天,计数。
需氧菌阴性对照:取50ml已灭菌的纯化水按供试品同法处理,作为阴性对照。
□符合规定
□不符合规定
□符合规定
□不符合规定
□符合规定
□不符合规定
□符合规定
□不符合规定
/
检验人:复核人:
药典三部(2015版)-通则-1101微生物检查法
1101 无菌检查法无菌检查法系用于检查药典要求无菌的药品、生物制品、医疗器具、原料、辅料及其他品种是否无菌的一种方法。
若供试品符合无菌检查法的规定,仅表明了供试品在该检验条件下未发现微生物污染。
无菌检查应在无菌条件下进行,试验环境必须达到无菌检查的要求,检验全过程应严格遵守无菌操作,防止微生物污染,防止污染的措施不得影响供试品中微生物的检出。
单向流空气区、工作台面及环境应定期按医药工业洁净室(区)悬浮粒子、浮游菌和沉降菌的测试方法的现行国家标准进行洁净度确认。
隔离系统应定期按相关的要求进行验证,其内部环境的洁净度须符合无菌检查的要求.日常检验还需对试验环境进行监控。
培养基硫乙醇酸盐流体培养基主要用于厌氧菌的培养,也可用于需氧菌培养;胰酪大豆胨液体培养基用于真菌和需氧菌的培养。
培养基的制备及培养条件培养基可按以下处方制备,亦可使用按该处方生产的符合规定的脱水培养基或成品培养基。
配制后应采用验证合格的灭菌程序灭菌。
制备好的培养基应保存在2~25℃、避光的环境,若保存于非封闭容器中,一般在3周内使用;若保存于密闭容器中,一般可在一年内使用。
1. 硫乙醇酸盐流体培养基胰酪胨15.0g 氯化钠2.5g酵母浸出粉5。
0g 新配制的0。
1% 刃天青溶液1。
0ml无水葡萄糖5。
0g 琼脂0.75gL-胱氨酸0.5g 水1000ml硫乙醇酸钠0.5g(或硫乙醇酸) (0。
3ml)除葡萄糖和刃天青溶液外,取上述成分混合,微温溶解,调节pH为弱碱性,煮沸,滤清,加入葡萄糖和刃天青溶液,摇匀,调节pH,使灭菌后在25℃的pH值为7。
1±0.2。
分装至适宜的容器中,其装量与容器高度的比例应符合培养结束后培养基氧化层(粉红色)不超过培养基深度的1/2。
灭菌。
在供试品接种前,培养基氧化层的高度不得超过培养基深度的1/5,否则,须经100℃水浴加热至粉红色消失(不超过20分钟),迅速冷却,只限加热一次,并防止污染。
清洁验证微生物记录
1.方法概述
用4个无菌棉签分别在下料口处按每个棉签100cm2/棉签擦拭取样,先取无菌棉签1支,用无菌的0.9%的氯化钠溶液5ml浸湿,去演时将棉签头按在取样表面上,以30度角与取样表面接触,平稳而缓慢得擦拭取样表面,在向前移动的同时将其一边移到另一边,每支棉签擦拭过程覆盖100cm2整个表面,翻转棉签,用另一面再进行擦拭,方向与前一次垂直,然后将棉签端用无菌剪刀置于100ml的0.9%无菌氯化钠溶液中,左右振摇5min,做好标识。
作为供试品溶液。
2.合格标准
2.1本品阴性对照组均不得有菌生长。
2.2本品细菌、霉菌和酵母菌总数(cfu/ml),每不得过cfu。
3.试液、仪器准备
仪器名称:电热恒温培养箱仪器型号:DH-500A 仪器编号:QC-SB-013 仪器名称:生化培养箱仪器型号:SHP-150 仪器编号:QC-SB-0134 PH7.0 无菌氯化钠-蛋白胨缓冲液配制批号:营养琼脂培养基配制批号:
玫瑰红钠琼脂培养基配置批号:
4. 细菌、霉菌和酵母菌数检查:
4.1供试品制备:取供试品,加pH7.0无菌氯化钠-蛋白胨缓冲液至ml。
混匀后,制备稀释级别为稀释液,备用。
4.5检验结果:本品菌落总数数为。
检验人:复核人:年月日。
2015年版药典微生物修订内容
科
增订了原敷料、中药提取物及饮片的微生物限
度标准。
兴
修订内容
依
1 、菌数计数结果以10n表示;
科
2、 以需氧菌总数取代细菌数。以耐胆盐革 兰
阴性菌取代大肠菌群。
依科制药
分类及其标准
1、制剂通则、品种项下要求无菌的制剂及标示无菌
新 依
的制剂和原辅料应符合无菌检查法规定 2、 用于手术、烧伤或严重创伤的局部给药制剂 应符合无菌检查法规定
新
依
科
2015版药典微生物修订内容
兴
依 科
一综合车间(二车间)
2015.10
依科制药
微生物计数法主要内容
新 2010版
依
科
细菌数—
兴 营养琼脂培养基
依
科
霉菌和酵母菌数 — 玫瑰红钠琼脂培养基
2015版
1、 细菌数修订为 需氧菌总数。 2、 霉菌和酵母菌数修订为 霉菌和酵母菌总数。 3、 需氧菌总数: 是指胰酪大豆胨琼脂培养基 上生长的 总菌落数(包括真菌菌落 数) 。 4、 霉菌和酵母菌总数: 是指沙氏葡萄糖琼脂培养基上 生长的总菌落数(包括细菌菌落数) 。 若为因 沙 氏葡萄糖琼脂培养基上生长的细菌使霉菌和酵母 菌的计数结果不符合微生物限度要求,可使用含 有抗生素的(如氯霉素、庆大霉素)的沙氏葡萄 琼脂培养基或其它选择性培养基(如玫瑰红钠琼 脂培养基)进行霉菌和酵母菌总数测定。
依
霉菌及酵母菌总数 沙氏葡萄糖琼脂( SDA)
科
依科制药
新 修订后
依
耐胆盐的革兰氏阴性菌、大肠埃希菌、沙门菌、
科
铜绿假单胞菌、金黄色葡萄球菌、梭菌、白色
念珠菌
兴
修订前
微生物限度检验记录表 2015版药典
阴性对照
菌落数(cfu)
平皿
1∶1
1∶10
1∶102
1
2
平均
样品编号
平皿编号
各稀释度菌落数
阴性对照
菌落数(cfu)
平皿
1∶1
1∶10
1∶102
1
2
平均
标准规定
纯化水需氧菌总数不超过100cfu/mL
注射用水需氧菌总数不过超过10cfu/100ml
结论
微生物限度□符合□不符合标准要求。
审核:复核:检验-01-0
使用编号
微生物限度检验记录
样品名称:□纯化水□注射用水取样日期:
取样数量:样品编号:
培养开始时间:月日结束培养时间:月日
R2A琼脂培养基批号:培养温度:℃
样品编号
平皿编号
各稀释度菌落数
阴性对照
菌落数(cfu)
平皿
1∶1
1∶10
1∶102
1
2
平均
样品编号
平皿编号
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
微生物限度检验记录(复合膜)
记录编号:JL-QC-084-01
检品名称
批号
检品编号
样品来源
检验日期
报告日期
培养基及批号
胰酪大豆胨琼脂培养基
沙氏葡萄糖琼脂培养基
胰酪大豆胨液体培养基
麦康凯液体培养基
麦康凯琼脂培养基
甘露醇氯化钠琼脂培养基
pH7.0氯化钠-蛋白胨缓冲液
溴化十六烷基三甲铵琼脂培养基
供试品
阳性对照
阴性对照
结果
□检出铜绿假单胞菌□未检出铜绿假单胞菌(规定:不得检出/100cm2)
结论
本品按《中国药典》2015年版第四部非无菌产品微生物限度检查法检查,结果 。
检验人:复核人:第页共页
供试品溶液制备
取供试品,用开孔面积为20cm2的消毒过的金属模板压在内层面上,将无菌棉签用氯化钠注射液稍蘸湿,在板孔范围内擦抹5次,换1支棉签再擦抹5次,每个位置2支棉签共擦抹10次,共擦抹5个位置100cm2。每支棉签抹完后剪断,放入盛有30ml氯化钠注射液的锥形瓶中,将所有棉签放入瓶中后迅速摇晃1分钟,静置10分钟,即得供试品溶液。
麦康凯液体培养基选择培养
(42℃,48h)
麦康凯琼脂培养基分离培养
(33℃,72h)
供试品
阳性出大肠埃希菌□未检出大肠埃希菌(规定:不得检出)
检验人:复核人:第页共页
承德天原药业股份有限公司
微生物限度检验记录(复合膜)
记录编号:JL-QC-003-01
检验项目
四、金黄色葡萄球菌
胰酪大豆胨液体培养基增菌培养
(33℃,24h)
甘露醇氯化钠琼脂培养基选择分离培养
(33℃,72h)
供试品
阳性对照
阴性对照
结果
□检出金黄色葡萄球菌□未检出金黄色葡萄球菌(规定:不得检出/100cm2)
检验项目
五、铜绿假单胞菌
胰酪大豆胨液体培养基增菌培养
(33℃,24h)
溴化十六烷基三甲铵琼脂培养基选择分离培养(33℃,72h)
氧化酶试验
检验项目
一、需氧菌总数(33℃培养5天)
二、霉菌和酵母菌总数(23℃培养7天)
培养时间
原液
10-1
阴性对照
原液
10-1
阴性对照
皿1
皿2
皿1
皿2
皿1
皿2
皿1
皿2
皿1
皿2
皿1
皿2
菌落数
平均值
结果
CFU/100cm2标准规定
CFU/100cm2标准规定
检验项目
三、大肠埃希菌
胰酪大豆胨液体培养基增菌培养
(33℃,24h)
