第三章_酰化反应(1-2节)
合集下载
第三章 酰化反应

N
RCOOH + N S S N
2,2-二吡啶二硫化物
NO2
Ph3P Ph3P=O Et3N
RCOOH +
O N S C Cl
O N S C R
RCOCl + N SH
吡啶硫酚
Et3N
2-吡啶硫醇酯
优点:对仲、叔醇以及有位阻的伯醇效果较好;缺点: 硫醇酯具有特殊气味及毒性,应用受到限制。
CH3 H3C CH3 CH 3 (CH3)3COH/CH3CN/CuCl2 r.t. , 12min (96%) H3C CH3 COCl N SH H3C
CH3 CO CH3 S N
COOC(CH3)3
b.羧酸吡啶酯
OH HO(CH3)nCOOH I N CH3 (CH2)n O C O N CH3 O X Et3N , 7.5~8h I N CH3 O (CH2)n C O
c.羧酸三硝基苯酯 d. 羧酸异丙烯酯
3. 酸酐为酰化剂 酸酐是一个强酰化剂,反应具有不可逆性。酸酐多用 在反应困难或位阻较大的醇羟基的酰化上。 ①催化剂 酸性催化剂:硫酸、对甲苯磺酸、三氟化硼、氯化锌、 氯化钴 碱性催化剂:羧酸钠、吡啶、三乙胺、喹啉、N、N-二 甲基苯胺,作用:a.除掉氯化氢;b.催化作用。
C2H5
喹诺酮类抗菌药依诺沙星中间体 ③转变成其它基团
CH3 AlCl3/CS2 5℃, 3h CH3 COCH3 CH3COCl
CH(CH3)2
CH(CH3)2
(2)药物结构修饰 )
S OAc COO NHCOCH3 F3C N CH2CH2CH2 N (1) CH2OCOCH2CH2COOH CO HO OH NHCOCHCl2 CH OH O (3) O2N (4) CH CH2OCOC15H31 (2) N CH2CH2OCOC6H13
药物合成反应第三章酰化反应

BF3/Et2O
+ CH3OH
O O C(CH2)3CH3
+ H2O
CH=CH-COOCH3
COOH
对甲苯磺酸
TsOH
+ C12H25OH Xylene
HO
OH
OH
COOC12H25
HO
OH
OH
(c) DCC 二环己基碳二亚胺
R-N=C=N-R
CH3-N=C=N-C(CH3)3 CH3CH2-N=C=N-(CH2)3-NEt2 (CH3)2CH-N=C=N-CH(CH3)2
OH O=C-R
+OH R-C-OC(CH3)3
属于SN1机理
-H+
O
R-C-OC(CH3)3
按SN1机理进
行反应,是烷 氧键断裂
* 3oROH按此反应机理进行酯化。 * 由于R3C+易与碱性较强的水结合,不易与羧酸结合,
故逆向反应比正向反应易进行。所以3oROH的酯化 反应产率很低。
该反应机理也 从同位素方法 中得到了证明
②羧酸的结构
R带吸电子基团-利于进行反应;R带给电子不利于反应 R的体积若庞大,则亲核试剂对羰基的进攻有位阻,不利于反应进行 羰基的a位连有不饱和基和芳基,除诱导效应外,还有共轭效应,使酸性增强
③催化剂 i提高羧酸反应活性
(a)质子酸催化法: 浓硫酸,氯化氢气体,磺酸等
O
H+
R C OH
O R''OH + R C OH R'
O R'' HO C R ' - H+
R'' OH
H O
O
C
+ CH3OH
O O C(CH2)3CH3
+ H2O
CH=CH-COOCH3
COOH
对甲苯磺酸
TsOH
+ C12H25OH Xylene
HO
OH
OH
COOC12H25
HO
OH
OH
(c) DCC 二环己基碳二亚胺
R-N=C=N-R
CH3-N=C=N-C(CH3)3 CH3CH2-N=C=N-(CH2)3-NEt2 (CH3)2CH-N=C=N-CH(CH3)2
OH O=C-R
+OH R-C-OC(CH3)3
属于SN1机理
-H+
O
R-C-OC(CH3)3
按SN1机理进
行反应,是烷 氧键断裂
* 3oROH按此反应机理进行酯化。 * 由于R3C+易与碱性较强的水结合,不易与羧酸结合,
故逆向反应比正向反应易进行。所以3oROH的酯化 反应产率很低。
该反应机理也 从同位素方法 中得到了证明
②羧酸的结构
R带吸电子基团-利于进行反应;R带给电子不利于反应 R的体积若庞大,则亲核试剂对羰基的进攻有位阻,不利于反应进行 羰基的a位连有不饱和基和芳基,除诱导效应外,还有共轭效应,使酸性增强
③催化剂 i提高羧酸反应活性
(a)质子酸催化法: 浓硫酸,氯化氢气体,磺酸等
O
H+
R C OH
O R''OH + R C OH R'
O R'' HO C R ' - H+
R'' OH
H O
O
C
第三章 酰化反应

O O
RCOOCOR
R
C
+
R
C
O
H
混合酸酐的应用: ①羧酸-三氟乙酸混合酸酐(适用于立体位阻较大的羧酸的酯化)
O
O C R +CF 3 COOH
(CF 3 CO) 2 O+RCOOH
F 3C
C O
(CF3CO)2O H 2N CH 2OH + CH 3CH 2COOH
H2N
CH 2OCOCH 2CH 3
O RH2C C OR' + RH2C
O C OR'
R'ONa RH2C
O C
O H C COEt R
O RH2C C OR ' + Ar
O C OR '
O EtONa Ar C
O CHC R OR '
影响因素:
i)碱
O H3C C R 用 O CH C O R H2 C C
EtONa
R
用
Ph3CNa NaH NaNH2(强碱) 强
HO
C H 2O A c
NaOH HO 或 C H 3O N a
A cO
C H 2 OH
第三节 碳原子上的酰化反应
一、芳烃的C-酰化
1、Friedel-Crafts(傅-克酰化反应)
O O
+
R
C
Z
Lewis
C
R
(Z= -X,-OCOR,-OH,OR')
(1) 酰化剂的影响:酰卤﹥酸酐﹥羧酸﹥酯
羰基的α位为叔碳时发生烃化反应
AlCl3 AlCl3 O
配位键(增加C的正电性)
O R C OH
RCOOCOR
R
C
+
R
C
O
H
混合酸酐的应用: ①羧酸-三氟乙酸混合酸酐(适用于立体位阻较大的羧酸的酯化)
O
O C R +CF 3 COOH
(CF 3 CO) 2 O+RCOOH
F 3C
C O
(CF3CO)2O H 2N CH 2OH + CH 3CH 2COOH
H2N
CH 2OCOCH 2CH 3
O RH2C C OR' + RH2C
O C OR'
R'ONa RH2C
O C
O H C COEt R
O RH2C C OR ' + Ar
O C OR '
O EtONa Ar C
O CHC R OR '
影响因素:
i)碱
O H3C C R 用 O CH C O R H2 C C
EtONa
R
用
Ph3CNa NaH NaNH2(强碱) 强
HO
C H 2O A c
NaOH HO 或 C H 3O N a
A cO
C H 2 OH
第三节 碳原子上的酰化反应
一、芳烃的C-酰化
1、Friedel-Crafts(傅-克酰化反应)
O O
+
R
C
Z
Lewis
C
R
(Z= -X,-OCOR,-OH,OR')
(1) 酰化剂的影响:酰卤﹥酸酐﹥羧酸﹥酯
羰基的α位为叔碳时发生烃化反应
AlCl3 AlCl3 O
配位键(增加C的正电性)
O R C OH
第三章 酰化反应

Dieckmann分子内酯缩合反应 分子内酯缩合反应
己二酸、 己二酸、庚二酸和辛二酸酯用金属 钠处理时,发生分子内 钠处理时,发生分子内Claisen酯缩合 酯缩合 分别得到5,6,7员环化合物的反应称为 分别得到 员环化合物的反应称为 Dieckmann分子内缩合反应。 分子内缩合反应。 分子内缩合反应
RCOOH + N S S N + Ph3P
+ Ph3P O N S C R O
(2)羧酸吡啶酯 羧酸吡啶酯
+ HOOC N CH3.I CH2 OH n O C O C O + ( CH2 )n O Cl Et3N, CH2 OH 7.5~8h n
N CH3.I
N CH3
O
n=5 (89%) n=11 (69%)
B: PhCOCl
CH3COCHCOOC2H5 COPh
PhCOOH + CH2
X DEPC/Et3N/DMF X PhCOCH Y r.t. Y
X -CN -H -CN
Y -COOC2H5 -NO2 -CN
收率 93.4% 85.5% 92.8% 96.8%
-COOC2H5 -COOC2H5
2.酮及羧酸衍生物的α-位C-酰化 酮及羧酸衍生物的α 位 酰化 酮及羧酸衍生物的
• 烯酮作酰化剂
R2C C O + R'OH OH R2C C OR'
eg:
R2CH
O C OR'
CH3 CH COOC2H5 + CH2 C O OH H2SO4 CH3 CH COOC2H5 OCOCH3 t BuOH + CH2 C O
(98%)
CH3COOBu t
《药物合成反应》第3章酰化反应

回流
CH3
O
C3H7
C CH3
OH +
C C O O
O C O
Et3N TEA
CH3 C C3H7
CH3 C O OH
H3C N CH 3
DMAF:对 二 甲 氨 基 吡 啶
30
混合酸酐的应用 ①羧酸 - 三氟乙酸混合酸酐(适用于立体位阻较大的羧酸的 酯化)
O R C O
H
R
O R C
O
C
O
F3C C O F3C C
HN HN
13
CH3 COOH + H3CO OH
H2C HO CH CH3
CH3
DCC/Et2O R.T.20min
COO CH OH
H2C
CH3
酰化能力弱,因为可形成分子内氢键 CH3 C H3CO OH OH O
H3CO
14
例:
O O
CH2OH
COOH
+
I
DCC/DMAP 25℃
O CH2 O C O O I 96%
(1)增加反应物浓度 (2)不断蒸出反应产物之一 (3)添加脱水剂或分子筛除水。(无水 CuSO4, 无水AI2(SO4)3,(CF3CO)2O,DCC。)
加快反应速率:(1)提高温度 (2)催化剂(降低活化能)
8
醇的结构对酰化反应的影响 立体影响因素:伯醇>仲醇>叔醇
R O
立体效应
R R
C
C
OH
C
R C
28
O N C H
O CH3 + OH C CH3
NH2 H3C C O +
H3C C
O
O
CH3
O
C3H7
C CH3
OH +
C C O O
O C O
Et3N TEA
CH3 C C3H7
CH3 C O OH
H3C N CH 3
DMAF:对 二 甲 氨 基 吡 啶
30
混合酸酐的应用 ①羧酸 - 三氟乙酸混合酸酐(适用于立体位阻较大的羧酸的 酯化)
O R C O
H
R
O R C
O
C
O
F3C C O F3C C
HN HN
13
CH3 COOH + H3CO OH
H2C HO CH CH3
CH3
DCC/Et2O R.T.20min
COO CH OH
H2C
CH3
酰化能力弱,因为可形成分子内氢键 CH3 C H3CO OH OH O
H3CO
14
例:
O O
CH2OH
COOH
+
I
DCC/DMAP 25℃
O CH2 O C O O I 96%
(1)增加反应物浓度 (2)不断蒸出反应产物之一 (3)添加脱水剂或分子筛除水。(无水 CuSO4, 无水AI2(SO4)3,(CF3CO)2O,DCC。)
加快反应速率:(1)提高温度 (2)催化剂(降低活化能)
8
醇的结构对酰化反应的影响 立体影响因素:伯醇>仲醇>叔醇
R O
立体效应
R R
C
C
OH
C
R C
28
O N C H
O CH3 + OH C CH3
NH2 H3C C O +
H3C C
O
O
药物合成反应-第三章---酰化反应

• 二、自由基反应机理 • 产物复杂, 应用有限
第二节 氧原子的酰化反应
O ROH + R' C L
O R' C
OR + HL
• 是一类形成羧酸酯的反应 • 是羧酸的酯化反应 • 是羧酸衍生物的醇解反应
一、醇的氧酰化
•1) 羧酸为酰化剂
R-OH + R'COOH
• 提高收率:
R'COOR + H2O
第三章 酰化反应
Chapter 3
Acylation Reaction
概述
• 1 定义: 有机物分子中O、N、C原子上导入 酰基的反应
O
R C L + Nu-H
酰化剂
被酰化物
O R C Nu + HL
L: X, OCOR, OH, OR', NHR Nu: R'O(O), R''NH(N), Ar(C)
仅有少量空阻大的羧酸按此反应机理进行
(3)影响因素
① 醇结构影响
•醇的结构对酰化反应的影响 •立体影响因素:伯醇>仲醇>叔醇、烯丙醇 •叔碳正离子倾向与水反应而逆转
• 电子效应的影响 • 羟基a位吸电子基团通过诱导效应降低O上
电子云密度, 使亲核能力降低 • 苄醇、烯丙醇由于p-p共轭, 使活性降低
O
I
96%
ii 用来提高醇的反应活性
偶氮二羧酸酯法(活化醇制备羧酸酯)
Mitsunobu reaction.
Mechanism
(4)应用特点
•① 伯醇酯的制备
• ② 仲醇酯的制备 薄荷醇
• ③ 叔醇酯的制备
• 2.羧酸酯为酰化剂 • (1)反应通式
第二节 氧原子的酰化反应
O ROH + R' C L
O R' C
OR + HL
• 是一类形成羧酸酯的反应 • 是羧酸的酯化反应 • 是羧酸衍生物的醇解反应
一、醇的氧酰化
•1) 羧酸为酰化剂
R-OH + R'COOH
• 提高收率:
R'COOR + H2O
第三章 酰化反应
Chapter 3
Acylation Reaction
概述
• 1 定义: 有机物分子中O、N、C原子上导入 酰基的反应
O
R C L + Nu-H
酰化剂
被酰化物
O R C Nu + HL
L: X, OCOR, OH, OR', NHR Nu: R'O(O), R''NH(N), Ar(C)
仅有少量空阻大的羧酸按此反应机理进行
(3)影响因素
① 醇结构影响
•醇的结构对酰化反应的影响 •立体影响因素:伯醇>仲醇>叔醇、烯丙醇 •叔碳正离子倾向与水反应而逆转
• 电子效应的影响 • 羟基a位吸电子基团通过诱导效应降低O上
电子云密度, 使亲核能力降低 • 苄醇、烯丙醇由于p-p共轭, 使活性降低
O
I
96%
ii 用来提高醇的反应活性
偶氮二羧酸酯法(活化醇制备羧酸酯)
Mitsunobu reaction.
Mechanism
(4)应用特点
•① 伯醇酯的制备
• ② 仲醇酯的制备 薄荷醇
• ③ 叔醇酯的制备
• 2.羧酸酯为酰化剂 • (1)反应通式
第三章 酰化反应 -1

O EtO N N OEt O EtO N PPh3 RCOOH N OEt EtO O
PPh3
O N H
PPh3 NH
RCOO
O (DEAD) R1 HO R2
3
R1 Ph3P O
R
R2
3
RCOO
R1 R
3
O O R
R
R
2
叔醇 构型反转
22
(4)应用特点 )
A 伯醇酯的制备:伯醇羟基活性最大,对伯醇进行选择性酰化或保护 伯醇酯的制备:伯醇羟基活性最大, 伯、仲醇的选 择性
(3)影响因素 )
A 羧酸结构的影响
羧酸的酸性越强, 羧酸的酸性越强,其酰化能力越强
O R X OH > R O OH
O R OH
O O OH > R OH
O OH O2N > Cl
O OH >
O OH > H3C
O OH
O OH NO2 > O2N
O OH > NO2
O OH
15
B 醇结构的影响
RCOOCOCF3 + CF3COOH
N OCOPh
N N
OH
OCOPh
r.t., 24h
例:局麻药丁卡因的合成
例:抗胆碱药溴美喷酯(宁胃适)的合成
40
3. 酸酐为酰化剂
(1)反应通式 ) (2)反应机理 )
质子酸催化
O R O R O R O H R OH or R O O R O R OH O C R1OH RCOOR1
L ewis酸催化 O R O R O R O BF3 R O or R O O BF3 R O BF3 R O
PPh3
O N H
PPh3 NH
RCOO
O (DEAD) R1 HO R2
3
R1 Ph3P O
R
R2
3
RCOO
R1 R
3
O O R
R
R
2
叔醇 构型反转
22
(4)应用特点 )
A 伯醇酯的制备:伯醇羟基活性最大,对伯醇进行选择性酰化或保护 伯醇酯的制备:伯醇羟基活性最大, 伯、仲醇的选 择性
(3)影响因素 )
A 羧酸结构的影响
羧酸的酸性越强, 羧酸的酸性越强,其酰化能力越强
O R X OH > R O OH
O R OH
O O OH > R OH
O OH O2N > Cl
O OH >
O OH > H3C
O OH
O OH NO2 > O2N
O OH > NO2
O OH
15
B 醇结构的影响
RCOOCOCF3 + CF3COOH
N OCOPh
N N
OH
OCOPh
r.t., 24h
例:局麻药丁卡因的合成
例:抗胆碱药溴美喷酯(宁胃适)的合成
40
3. 酸酐为酰化剂
(1)反应通式 ) (2)反应机理 )
质子酸催化
O R O R O R O H R OH or R O O R O R OH O C R1OH RCOOR1
L ewis酸催化 O R O R O R O BF3 R O or R O O BF3 R O BF3 R O
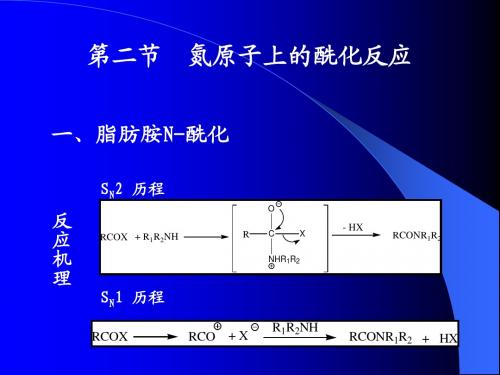
第三章:酰化反应(2节)
RCOHN
NH2
CH3 SO2Cl
RCOHN
NHSO2CH3
H 2O , H +
H3CO H3CO Cl
N H2N NHSO2CH3
HN
NHSO2CH3
N
H2C HO HO
NH2
O
H2C NH2
NHR
O
苄基磺酰氯 DMAP
NH2 RO RO
H2N O HO O O O H2N OH O
NHR
RHN O HO O O O RHN OR O
的合成
S H2N N O O Cl O COCH2C6H4NO2 O CHCOOH S CHCO HN N3 N Cl COCH2C6H4NO2
. HCl
N3
H2 / Pd-C
S CHCO HN NH2 O COOH N Cl
临床用于秘尿道、呼吸道、皮肤、软组织、五官感染,疗效较好
加入缩合剂提高反应活性(一)缩合剂 : DCC、 DIC
O O N O CH3 CH3 O C O C
CH3
(AcO)2 Cu
O C O C O
CH3
H C OH
HO HO
O C O C
H2 H C N
O C O
H2 C
CH3
CH3
O C O C
CH3
O
H2 C
1. H2, Pd/ C 2. CH3COOH
H2 C NH2
酰化
抗溃疡药西曲酸酯(Cetraxate)的合成
慢性关节风湿病的治疗药物布西拉明(Bucillamine) 的合成
CH3 CH2S C CH3 COOH CH3
SOCl2
CH2S C CH3 COCl
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
羰基的α位连有吸电子基团时,活性增强
B 催化剂的影响
(i)酸催化:硫酸、对甲苯磺酸(质子酸);BF3、ZnCl2、 AlCl3(Lewis 酸) 一般用于立体位阻较大的醇的酰化
46
(ii)碱催化:常用吡啶(Py)、对二甲氨基吡啶(DMAP)、4吡咯烷基吡啶(PPY)、三乙胺(TEA)及醋酸钠(CH3COONa) 等。 4-吡咯烷基吡啶对酸酐催化能力强,在有位阻的醇的 酰化中均取得较好效果。
b 用来提高醇反应活性的催化剂 (偶氮二羧酸二乙酯法)
17
(i) 质子酸催化法 ■ 无机酸:浓硫酸、磷酸、氯化氢气体、高氯酸、 四氟硼酸等
■有机酸:苯磺酸,萘磺酸、对甲苯磺酸等
■简单,但对于位阻大的酸及叔醇容易脱水。
18
(ii) Lewis酸催化法
(BF3、AlCl3、FeCl3、CoCl2、SnCl4 等)
70
■ 采用吡啶类碱不仅可以中和反应生成的HCl,还 有催化作用,增强活性
59
C 溶剂的影响 ■ 氯仿、乙醚、THF、DMF、DMSO等作为溶剂 ■ 过量的酰氯或醇作为溶剂
D 温度的影响
通常在低温下将酰氯滴加入反应体系中,室温反应, 较难酰化醇可升温回流反应
60
(4)应用特点
A 选择性酰化
i. 1,2-二醇的酰化反应 :
ii. 非1,2-二醇的酰化反应 :
collidine:2,3,5-三甲基吡啶
61
B 仲醇的酰化
C 叔醇的酰化
当位阻大的叔醇与酰氯反应时,加入Ag+或Li+,可提高产率
62
5. 酰胺为酰化剂
(1)反应通式
63
(2)反应机理
64
(3)应用特点
A 酰基咪唑为酰化剂的反应
B PTT为酰化剂的反应
65 条件温和,适合于对酸、碱均不稳定的醇的酰化。
D 反应温度的影响
通常在低温下将酰化剂滴加入反应体系中,然 后缓慢升温至室温,或加热回流
48
(4)应用特点 A 单一酸酐为酰化剂的酰化反应 ■酸酐多用于反应困难或位阻较大的醇羟基的酰化 ■单一酸酐种类较少,限制了该方法的应用
49
BF3 Et 2O
HO
CH2OH
Ac2O Py
HO
CH2OAc
(68%)
被酰化物:各种伯、仲、叔醇
催化剂:Lewis酸、有机碱
溶剂:醚类、卤代烃类
56
(2)反应机理
57
(3)影响因素 A 酰氯结构的影响 ■ 脂肪族酰氯 > 芳酰氯 ■ 羰基的α位连有吸电子基团时,活性增强
■ 芳酰氯邻位有取代基时,有位阻,活性降低
58
B 催化剂的影响
■ 有机碱:吡啶、三乙胺、N,N-二甲基苯胺、N, N-二甲基吡啶 ■ 无机碱:NaOH、KOH、Na2CO3、K2CO3
53
(iv)羧酸-多取代苯甲酸混合酸酐
54
(iv)其他混合酸酐
羧酸与氯代甲酸酯(ClCOOR)、光气(ClCOCl)、草酰氯 (COCl)2、氧氯化磷(POCl3)等可形成混合酐,从而提高酰 化能力,用于结构复杂的酯化反应。
55
4. 酰氯为酰化剂
(1)反应通式
酰化剂:各种脂肪和芳香族羧酸的酰氯
AcO
CH2OAc (62%)
BF3.Et2O催化选择性酰化醇羟基!
大位阻醇的酰化!
50
B 混合酸酐为酰化剂的酰化反应
(i)羧酸-三氟乙酸混合酸酐
51 适用于位阻较大的羧酸的酯化,对某些酸敏物质不宜采用此法
(ii)羧酸-磺酸混合酸酐
适用于对酸敏感的醇,多用于大位阻的酯及酰胺的制备!
52
(iii)羧酸-磷酸混合酸酐(一锅煮合成法,条件温和)
5
教学内容
1.酰化反应机理
2.氧原子上的酰化反应 3.氮原子上的酰化反应 4.碳原子上的酰化反应
6
第一节 酰化反应的机理
7
一、电子反应机理
1.亲电反应机理: (1) 单分子历程
限速步骤:动力学一级反应
采用酰卤、酸酐等强酰化剂的酰化反应趋向于单分子 历程进行。
8
(2) 双分子历程
限速步骤:动力学二级反应
酰化剂:各种脂肪和芳香族羧酸
被酰化物:各种伯、仲、叔醇
催化剂:质子酸或醇钠
溶剂:醇类、醚类、卤代烃类
29
(2)反应机理
酸、碱催化,酯交换过程均可逆,一般通过不断蒸出生成 的醇R1OH来打破平衡。 30
(3)影响因素
A 羧酸酯结构的影响 ■ R基团的影响:考虑电效应及共轭效应对羰基碳的影响 α位连有吸电子基团或不饱和烃基或芳基时,活性较强
■ R1基团的影响:R1OH的酸性越强,酯的酰化能力越强 RCOOAr > RCOOCH3 > RCOOC2H5
31
B 醇结构的影响
醇羟基的亲核能力越强,其反应活性越强
甲醇 > 伯醇 > 仲醇 > 叔醇、烯丙醇、苄醇
32
C 催化剂的影响
含有碱性基团的醇或叔醇进行酯交换反应,一般适宜采用醇 钠等碱性催化剂。
AlCl3 O R C OH AlCl3 O
配位键(增加C的正电性)
R C OH
19
(iii) Vesley法
采用强酸型离子交换树脂加硫酸钙 催化能力强、收率高、条件温和
Vesley法 10min
CH3COOH + CH3OH
CH3COOCH3 (94%)
20
(iv) DCC法( 二环己基碳二亚胺)
酚羟基所在苯环上取代基的类型及取代基的位置对其参 与酰化反应均有影响。
类型:给电子基有利于反应;吸电子基不利于反应
位置:处于邻、对位的取代基对酚的影响最大。
67
(4)应用特点 A 酰氯为酰化剂
B 酸酐为酰化剂
68
C 其他酰化剂
69
三、醇、酚羟基的保护
• • • • • • • 甲酰化 乙酰化 -卤代乙酰化 -烷氧基乙酰化 取代苯甲酰化 烷氧羰基化 其他酰化保护法
酰化剂:各种脂肪Βιβλιοθήκη 芳香族羧酸 被酰化物:各种伯、仲、叔醇 催化剂:质子酸、Lewis酸 溶剂:醇类、醚类、卤代烃类
14
(2)反应机理
R' C O OH H HOR R' C OH OH OH R' HOR C OH
OR -H 2O R' C OH 2 OH R' C OR OH
-H
R'COOR
提高收率: ■ 增加反应物浓度 ■ 除去反应中生成的水
43
3. 酸酐为酰化剂
酸酐是强酰化剂,可对各种类型的羟基进行酰化, 反应不可逆,无水生成,一般不加脱水剂。 (1)反应通式
酰化剂:各种脂肪和芳香族羧酸的酸酐 被酰化物:各种伯、仲、叔醇
催化剂:质子酸、Lewis酸、有机碱
溶剂:醇类、醚类、卤代烃类
44
(2)反应机理
45
(3)影响因素 A 酸酐结构的影响
第三章 酰化反应
Acylation Reaction
1
概述
1、定义:在有机分子中的碳,氧,氮,硫等原子 上引入酰基的反应
2
• 酰基:从含氧的有机酸或无机酸分子中去掉一个或几个 羟基后所剩余的基团
3
4
• 2、 应用:
• • • • 药物本身有酰基 活性化合物的必要官能团 结构修饰和前体药物 羟基、胺基等基团的保护
1-羟基苯并三唑(HOBt)的羧酸酯
40
羧酸异丙烯酯:
C4H9-n n-C18H37 C COOH + H3C C CH
Zn
2+
C4H9-n n-C18H37 C COO C C7H15-n O
CH2 CH3
175℃
C7H15-n
A
n-C18H37 OH/H+ △ ,6min
C4H9-n n-C18H37 C COO C18H37-n 92% + H3C
■ 减少生成物的浓度 ■ 添加催化剂,增加反应物的活性
15
(3)影响因素
A 羧酸结构的影响
羧酸的酸性越强,其酰化能力越强
16
B 醇结构的影响
醇羟基的亲核能力越强,其反应活性越强
甲醇 > 伯醇 > 仲醇 > 叔醇、烯丙醇、苄醇
C 催化剂的影响 a 用来提高羧酸反应活性的催化剂
质子酸 Lewis酸 Vesley法 DCC
O
O
H3C COCl
CH3
H3C
C S O CH3
N
r.t., 12 min (96%)
H3C
CH3 COOC(CH3)3
金属离子Hg2+、Ag+、Cu+、Cu2+等对反应有催化作用
37
(ii) 羧酸吡啶酯
38
(iii) 羧酸三硝基苯酯( 一锅煮合成法 )
39
(iv) 其他活性酯
羧酸异丙烯酯
羧酸二甲硫基烯醇酯
21
DCC类似物:
CH3-N=C=N-C(CH3)3 R-N=C=N-R CH3CH2-N=C=N-(CH2)3-NEt2 (CH3)2CH-N=C=N-CH(CH3)2 N C N (CH2)2 N
O
22
(v)偶氮二羧酸二乙酯法(DEAD)
23
(4)应用特点
A 伯醇酯的制备:伯醇羟基活性最大,对伯醇 进行选择性酰化或保护 伯、仲醇
34
(i) 羧酸硫醇酯(气味难闻,有毒性)
35
36
N S N (V) OH CH3 O O CH3
N SH
CH3 N S 2 N (VI) OH O O O O (75%) CH3 CH3
B 催化剂的影响
(i)酸催化:硫酸、对甲苯磺酸(质子酸);BF3、ZnCl2、 AlCl3(Lewis 酸) 一般用于立体位阻较大的醇的酰化
46
(ii)碱催化:常用吡啶(Py)、对二甲氨基吡啶(DMAP)、4吡咯烷基吡啶(PPY)、三乙胺(TEA)及醋酸钠(CH3COONa) 等。 4-吡咯烷基吡啶对酸酐催化能力强,在有位阻的醇的 酰化中均取得较好效果。
b 用来提高醇反应活性的催化剂 (偶氮二羧酸二乙酯法)
17
(i) 质子酸催化法 ■ 无机酸:浓硫酸、磷酸、氯化氢气体、高氯酸、 四氟硼酸等
■有机酸:苯磺酸,萘磺酸、对甲苯磺酸等
■简单,但对于位阻大的酸及叔醇容易脱水。
18
(ii) Lewis酸催化法
(BF3、AlCl3、FeCl3、CoCl2、SnCl4 等)
70
■ 采用吡啶类碱不仅可以中和反应生成的HCl,还 有催化作用,增强活性
59
C 溶剂的影响 ■ 氯仿、乙醚、THF、DMF、DMSO等作为溶剂 ■ 过量的酰氯或醇作为溶剂
D 温度的影响
通常在低温下将酰氯滴加入反应体系中,室温反应, 较难酰化醇可升温回流反应
60
(4)应用特点
A 选择性酰化
i. 1,2-二醇的酰化反应 :
ii. 非1,2-二醇的酰化反应 :
collidine:2,3,5-三甲基吡啶
61
B 仲醇的酰化
C 叔醇的酰化
当位阻大的叔醇与酰氯反应时,加入Ag+或Li+,可提高产率
62
5. 酰胺为酰化剂
(1)反应通式
63
(2)反应机理
64
(3)应用特点
A 酰基咪唑为酰化剂的反应
B PTT为酰化剂的反应
65 条件温和,适合于对酸、碱均不稳定的醇的酰化。
D 反应温度的影响
通常在低温下将酰化剂滴加入反应体系中,然 后缓慢升温至室温,或加热回流
48
(4)应用特点 A 单一酸酐为酰化剂的酰化反应 ■酸酐多用于反应困难或位阻较大的醇羟基的酰化 ■单一酸酐种类较少,限制了该方法的应用
49
BF3 Et 2O
HO
CH2OH
Ac2O Py
HO
CH2OAc
(68%)
被酰化物:各种伯、仲、叔醇
催化剂:Lewis酸、有机碱
溶剂:醚类、卤代烃类
56
(2)反应机理
57
(3)影响因素 A 酰氯结构的影响 ■ 脂肪族酰氯 > 芳酰氯 ■ 羰基的α位连有吸电子基团时,活性增强
■ 芳酰氯邻位有取代基时,有位阻,活性降低
58
B 催化剂的影响
■ 有机碱:吡啶、三乙胺、N,N-二甲基苯胺、N, N-二甲基吡啶 ■ 无机碱:NaOH、KOH、Na2CO3、K2CO3
53
(iv)羧酸-多取代苯甲酸混合酸酐
54
(iv)其他混合酸酐
羧酸与氯代甲酸酯(ClCOOR)、光气(ClCOCl)、草酰氯 (COCl)2、氧氯化磷(POCl3)等可形成混合酐,从而提高酰 化能力,用于结构复杂的酯化反应。
55
4. 酰氯为酰化剂
(1)反应通式
酰化剂:各种脂肪和芳香族羧酸的酰氯
AcO
CH2OAc (62%)
BF3.Et2O催化选择性酰化醇羟基!
大位阻醇的酰化!
50
B 混合酸酐为酰化剂的酰化反应
(i)羧酸-三氟乙酸混合酸酐
51 适用于位阻较大的羧酸的酯化,对某些酸敏物质不宜采用此法
(ii)羧酸-磺酸混合酸酐
适用于对酸敏感的醇,多用于大位阻的酯及酰胺的制备!
52
(iii)羧酸-磷酸混合酸酐(一锅煮合成法,条件温和)
5
教学内容
1.酰化反应机理
2.氧原子上的酰化反应 3.氮原子上的酰化反应 4.碳原子上的酰化反应
6
第一节 酰化反应的机理
7
一、电子反应机理
1.亲电反应机理: (1) 单分子历程
限速步骤:动力学一级反应
采用酰卤、酸酐等强酰化剂的酰化反应趋向于单分子 历程进行。
8
(2) 双分子历程
限速步骤:动力学二级反应
酰化剂:各种脂肪和芳香族羧酸
被酰化物:各种伯、仲、叔醇
催化剂:质子酸或醇钠
溶剂:醇类、醚类、卤代烃类
29
(2)反应机理
酸、碱催化,酯交换过程均可逆,一般通过不断蒸出生成 的醇R1OH来打破平衡。 30
(3)影响因素
A 羧酸酯结构的影响 ■ R基团的影响:考虑电效应及共轭效应对羰基碳的影响 α位连有吸电子基团或不饱和烃基或芳基时,活性较强
■ R1基团的影响:R1OH的酸性越强,酯的酰化能力越强 RCOOAr > RCOOCH3 > RCOOC2H5
31
B 醇结构的影响
醇羟基的亲核能力越强,其反应活性越强
甲醇 > 伯醇 > 仲醇 > 叔醇、烯丙醇、苄醇
32
C 催化剂的影响
含有碱性基团的醇或叔醇进行酯交换反应,一般适宜采用醇 钠等碱性催化剂。
AlCl3 O R C OH AlCl3 O
配位键(增加C的正电性)
R C OH
19
(iii) Vesley法
采用强酸型离子交换树脂加硫酸钙 催化能力强、收率高、条件温和
Vesley法 10min
CH3COOH + CH3OH
CH3COOCH3 (94%)
20
(iv) DCC法( 二环己基碳二亚胺)
酚羟基所在苯环上取代基的类型及取代基的位置对其参 与酰化反应均有影响。
类型:给电子基有利于反应;吸电子基不利于反应
位置:处于邻、对位的取代基对酚的影响最大。
67
(4)应用特点 A 酰氯为酰化剂
B 酸酐为酰化剂
68
C 其他酰化剂
69
三、醇、酚羟基的保护
• • • • • • • 甲酰化 乙酰化 -卤代乙酰化 -烷氧基乙酰化 取代苯甲酰化 烷氧羰基化 其他酰化保护法
酰化剂:各种脂肪Βιβλιοθήκη 芳香族羧酸 被酰化物:各种伯、仲、叔醇 催化剂:质子酸、Lewis酸 溶剂:醇类、醚类、卤代烃类
14
(2)反应机理
R' C O OH H HOR R' C OH OH OH R' HOR C OH
OR -H 2O R' C OH 2 OH R' C OR OH
-H
R'COOR
提高收率: ■ 增加反应物浓度 ■ 除去反应中生成的水
43
3. 酸酐为酰化剂
酸酐是强酰化剂,可对各种类型的羟基进行酰化, 反应不可逆,无水生成,一般不加脱水剂。 (1)反应通式
酰化剂:各种脂肪和芳香族羧酸的酸酐 被酰化物:各种伯、仲、叔醇
催化剂:质子酸、Lewis酸、有机碱
溶剂:醇类、醚类、卤代烃类
44
(2)反应机理
45
(3)影响因素 A 酸酐结构的影响
第三章 酰化反应
Acylation Reaction
1
概述
1、定义:在有机分子中的碳,氧,氮,硫等原子 上引入酰基的反应
2
• 酰基:从含氧的有机酸或无机酸分子中去掉一个或几个 羟基后所剩余的基团
3
4
• 2、 应用:
• • • • 药物本身有酰基 活性化合物的必要官能团 结构修饰和前体药物 羟基、胺基等基团的保护
1-羟基苯并三唑(HOBt)的羧酸酯
40
羧酸异丙烯酯:
C4H9-n n-C18H37 C COOH + H3C C CH
Zn
2+
C4H9-n n-C18H37 C COO C C7H15-n O
CH2 CH3
175℃
C7H15-n
A
n-C18H37 OH/H+ △ ,6min
C4H9-n n-C18H37 C COO C18H37-n 92% + H3C
■ 减少生成物的浓度 ■ 添加催化剂,增加反应物的活性
15
(3)影响因素
A 羧酸结构的影响
羧酸的酸性越强,其酰化能力越强
16
B 醇结构的影响
醇羟基的亲核能力越强,其反应活性越强
甲醇 > 伯醇 > 仲醇 > 叔醇、烯丙醇、苄醇
C 催化剂的影响 a 用来提高羧酸反应活性的催化剂
质子酸 Lewis酸 Vesley法 DCC
O
O
H3C COCl
CH3
H3C
C S O CH3
N
r.t., 12 min (96%)
H3C
CH3 COOC(CH3)3
金属离子Hg2+、Ag+、Cu+、Cu2+等对反应有催化作用
37
(ii) 羧酸吡啶酯
38
(iii) 羧酸三硝基苯酯( 一锅煮合成法 )
39
(iv) 其他活性酯
羧酸异丙烯酯
羧酸二甲硫基烯醇酯
21
DCC类似物:
CH3-N=C=N-C(CH3)3 R-N=C=N-R CH3CH2-N=C=N-(CH2)3-NEt2 (CH3)2CH-N=C=N-CH(CH3)2 N C N (CH2)2 N
O
22
(v)偶氮二羧酸二乙酯法(DEAD)
23
(4)应用特点
A 伯醇酯的制备:伯醇羟基活性最大,对伯醇 进行选择性酰化或保护 伯、仲醇
34
(i) 羧酸硫醇酯(气味难闻,有毒性)
35
36
N S N (V) OH CH3 O O CH3
N SH
CH3 N S 2 N (VI) OH O O O O (75%) CH3 CH3
