细胞培养中的支原体污染
支原体污染及其检测

支原体污染及其检测支原体污染在细胞培养中最为常见,培养体系中支原体污染的最可能途径是经已被支原体污染的细胞蔓延和传扬,据报道目前约有11%的二倍体细胞和传代细胞存在支原体污染;支原体污染的另一重要来源是培养液中加入了被支原体污染的血清。
支原体是一种介于细菌和病毒之间的能自立生活的微生物,它无细胞壁,形态呈多形性。
最小的支原体直径约200nm,可通过滤菌器。
支原体污染后培养基普通不发生混浊,细胞形态无显然变幻,但事实上细胞已受到各方面的潜在影响,如影响DNA合成,代谢减慢,生长被抑制等。
这种污染造成的危害较大,但支原体污染不易被发觉,因此对支原体的污染必需引起足够的重视,应严加防范。
支原体污染常用的检查办法如下。
1.形态学检查常用相差显微镜检测取洁净载玻片,滴加少许待检的细胞悬液,压上盖片,用相差显微镜油镜观看。
如有支原体污染,镜下可见暗色极小颗粒,类似布朗运动,可位于细胞表面或细胞之间。
要注重支原体与细胞破裂后溢出的内容物如线粒体等相区分。
电镜检测:用普通染色办法难以确定时,可用电镜检查。
详见电子显微镜技术一节。
2.支原体染色镜检支原体经低张处理后用地衣红染色观看,本法简便易行,不仅适用于检测支原体,亦可用于检查真菌和细菌。
【材料】 (1)待检疑有支原体污染的培养物; (2)检测用试剂:低张处理液(0.45%),Carnoy固定液(配方:60ml纯加30ml和10m1),2%的地衣红染液(配方:2g地衣红,60ml加蒸馏水至100m1 )。
【办法】 (1)取材:吸取待检培养液1 ml, 500~800r/min,离心5分钟后去上清液,余留0.2m1备用。
(2)低张处理:用新奇配制的0.45%溶液0.2m1,加入上述待检标本中,静止低张处理10分钟,然后离心去上清液,留取沉淀物0. 2m1,涂片2~3张,晾干。
(3)固定:用新配制的Carnoy液固定2次,共10分钟。
(4)染色:将晾干的涂片用2%的地衣红染5分钟。
细胞培养中支原体污染

细胞培养中的支原体污染的预防及处理Mycoplasma国内主要有三种译名,医学文献译为“支原体”(分枝原体,枝原体,类菌质体),动物医学文献译为“霉形体”或“支原体”,台湾、香港则译为微浆菌。
支原体是目前已知一类能在无生命培养基上生长繁殖的最小的原核细胞型微生物。
自然界分布广泛,种类多,有80余种,分为两个属:一为支原体属(Mycoplasma),有几十个种;另一为脲原体属(Ureaplasma),仅有一种。
与人类感染有关的主要是肺炎支原体和解脲脲原体。
支原体无细胞壁,多呈不规则球状、长丝状,可分枝,营寄生共生或腐生。
一般侵害对象为动植物,可造成多种疾病。
细胞培养(特别是传代细胞)被支原体污染是个世界性问题。
国内外研究表明,95%以上是以下四种支原体:口腔支原体(M.orale)、精氨酸支原体(M.arginini)、猪鼻支原体(M.hyorhinis)和菜氏无胆甾原体(idlawii),为牛源性。
国外调查证明,大约有二十多种支原体能污染细胞,有的细胞株可以同时污染两种以上的支原体。
支原体污染的来源包括工作环境的污染、操作者本身的污染(某些支原体在人体是正常菌群)、培养基的污染、被污染细胞造成的交叉污染、实验器材的污染、制备细胞的原始组织或器官的污染,等等。
体外生长的细胞对微生物及一些有害有毒物质没有抵抗能力,因此培养基应达到无化学物质污染、无微生物污染(如细菌、真菌、支原体、病毒等)、无其他对细胞产生损伤作用的生物活性物质污染(如抗体、补体)。
对于天然培养基,污染主要来源于取材过程及生物材料本身,应当严格选材,严格操作。
对于合成培养基,污染主要来源于配制过程,配制所用的水,器皿应十分洁净,配制后应严格过滤除菌。
由于体外培养细胞自身没有抵抗污染的能力,而且培养基中的抗生素抗污染能力有限,因而培养细胞一旦发生污染多数将无法挽回。
支原体污染后,因为它们不会使细胞死亡可以与细胞长期共存,培养基一般不发生浑浊,细胞无明显变化,外观上给人以正常感觉,实则细胞手到多方面潜在影响,如引起细胞变形,影响DNA合成,抑制细胞生长等。
支原体清除实验

支原体清除实验支原体污染是细胞培养过程中的常见现象。
细胞被支原体污染之后,在显微镜下无法直接观察到,生长状态可能发生或不发生改变,因此一般不易被察觉。
但是支原体会改变细胞的很多生长参数,因而极易对后续实验造成影响,所以对支原体污染的检测和清除非常重要。
以下为一次支原体检测和清除的实例。
材料:细胞系:SH-SY5Y支原体PCR检测试剂盒:Myco-P-20 (上海炎熙生物 )支原体清除剂:Myco-E-1 (上海炎熙生物 )方法与结果:1,将已检测出有支原体污染的SH-SY5Y细胞以正常传代密度铺到6孔板中,一个孔加清除剂,作为测试孔,另一孔不加清除剂,作为阴性对照孔。
两孔之间间隔一个孔,以免互相污染。
2,在清除支原体的过程中细胞以常规方法传代培养,并使细胞在培养过程中一直处于清除剂的作用下。
在加清除剂后第4、8、9、11天各取1毫升培养上清。
每份上清与细胞已共培养48小时,除第9天的上清只共培养了24小时。
3,将这些培养上清在16000g离心5分钟,小心去除离心上清,将沉淀用无菌PBS洗三次,每次以16000g离心5分钟。
最后获得的沉淀用100微升纯水重悬,在100℃水浴中孵育5分钟,然后用于PCR反应。
4,按照支原体检测试剂盒Myco-P-20的说明书进行PCR检测操作,结果如下:4.1,与对照样品共同反应,用这种方式可以判断是否出现了假阴性结果。
在加清除剂后第4天的样品中仍可见到支原体阳性条带(约440bp),在第8、9、11天的样品中,已看不到支原体阳性条带。
4.2,不加对照样品,检测样品单独反应,用这种方式可以提高测试灵敏度。
可见在第8天和第9天的样品中,支原体阳性条带仍然出现,但是弱于第4天的样品。
在第11天的样品中,有明显的200bp以下的非特异的条带,且亮度高于阳性条带,所以判断此时的PCR产物是非特异反应的产物,样品中已没有支原体DNA。
注释:由于PCR是一种非常灵敏的检测方法,所以很容易出现假阳性条带。
细胞支原体污染怎么办?该怎么处理?

甲:细胞里突然出现小黑点,问君能有几多愁?乙:珍贵的细胞萎靡不振,扔了重买?相顾无言,惟有泪千行。
丙:细胞转染效率极低,实验结果遥遥无期,我的课题前功尽弃!但见泪恨湿,不知心恨谁!细胞培养中,最怕的就是生物污染,支原体污染就是其中的一种。
支原体这种微小的微生物,是细胞培养中令人头疼的大问题。
支原体结构也比较简单,多数呈球形,没有细胞壁,只有三层结构的细胞膜,故具有较大的可变性。
支原体污染可能来自培养基、血清或实验操作者,会影响细胞生长率、细胞形态、基因表达、细胞代谢和细胞活力。
支原体感染不易察觉,因此对培养细胞定期进行支原体检测就非常重要。
污染实验室培养细胞的支原体主要有八种,但还没有哪种检测方法能够单枪匹马把这八种支原体都检测出来。
支原体非常顽强,通常用于细胞培养的绝大多数抗生素都对其无效。
例如青霉素主要作用于细菌细胞壁,但支原体没有细胞壁因此就不受影响。
无懈可击的细胞培养技术始终是预防支原体感染的最佳方式,另外及时找出受到支原体感染的培养物也很重要,这样才能在感染扩散前快速采取有效措施。
支原体污染在细胞培养中实际上是比较常见的,可达30%甚至更高。
支原体污染时细胞表现为长得不好,也不死亡,同时,培养基又是清亮的,时间长达一周也没有什么变化,这时基本上可以判断出是支原体污染了。
定期检测支原体感染会使培养细胞慢慢枯萎,因此对培养细胞定期进行支原体检测非常重要。
一般来说每1至3个月就应该进行一次支原体检测。
将定期支原体检测常规化坚持下去,是细胞培养实验室应对支原体感染的关键。
预防支原体污染的建议:细胞培养工作中,主要从以下几个方面来预防支原体的污染:控制环境污染;严格实验操作;细胞培养基和器材要保证无菌;在细胞培养基中加入适量的抗生素。
支原体污染细胞后,特别是重要的细胞株,有必要清除支原体,常用方法有:抗生素处理抗血清处理抗生素加抗血清和补体联合处理支原体最突出的结构特征是没有细胞壁,一般来讲,对作用于细胞壁生物合成的抗生素,如内酰胺类、万古霉素等完全不敏感;对多粘菌素(polymycin)、利福平、磺胺药物普遍耐药。
细胞培养中支原体污染

细胞培养中的支原体污染的预防及处理Mycoplasma国内主要有三种译名,医学文献译为“支原体”(分枝原体,枝原体,类菌质体),动物医学文献译为“霉形体”或“支原体”,台湾、香港则译为微浆菌。
支原体是目前已知一类能在无生命培养基上生长繁殖的最小的原核细胞型微生物。
自然界分布广泛,种类多,有80余种,分为两个属:一为支原体属(Mycoplasma),有几十个种;另一为脲原体属(Ureaplasma),仅有一种。
与人类感染有关的主要是肺炎支原体和解脲脲原体。
支原体无细胞壁,多呈不规则球状、长丝状,可分枝,营寄生共生或腐生。
一般侵害对象为动植物,可造成多种疾病。
细胞培养(特别是传代细胞)被支原体污染是个世界性问题。
国内外研究表明,95%以上是以下四种支原体:口腔支原体(M.orale)、精氨酸支原体(M.arginini)、猪鼻支原体(M.hyorhinis)和菜氏无胆甾原体(idlawii),为牛源性。
国外调查证明,大约有二十多种支原体能污染细胞,有的细胞株可以同时污染两种以上的支原体。
支原体污染的来源包括工作环境的污染、操作者本身的污染(某些支原体在人体是正常菌群)、培养基的污染、被污染细胞造成的交叉污染、实验器材的污染、制备细胞的原始组织或器官的污染,等等。
体外生长的细胞对微生物及一些有害有毒物质没有抵抗能力,因此培养基应达到无化学物质污染、无微生物污染(如细菌、真菌、支原体、病毒等)、无其他对细胞产生损伤作用的生物活性物质污染(如抗体、补体)。
对于天然培养基,污染主要来源于取材过程及生物材料本身,应当严格选材,严格操作。
对于合成培养基,污染主要来源于配制过程,配制所用的水,器皿应十分洁净,配制后应严格过滤除菌。
由于体外培养细胞自身没有抵抗污染的能力,而且培养基中的抗生素抗污染能力有限,因而培养细胞一旦发生污染多数将无法挽回。
支原体污染后,因为它们不会使细胞死亡可以与细胞长期共存,培养基一般不发生浑浊,细胞无明显变化,外观上给人以正常感觉,实则细胞手到多方面潜在影响,如引起细胞变形,影响DNA合成,抑制细胞生长等。
细胞培养中常见的污染及处理@麦粒

常见细胞污染及其处理方法麦~粒(2012级生物化学与分子生物学专业)摘要:细胞培养是生命科学实验及生物医药产业化中的一项关键技术,细胞污染问题一直是细胞培养中的大敌。
本文综述了细胞培养中污染的类型、处理方法和预防措施等,以期为实验室细胞培养中遇到的细胞污染的解决提供参考。
关键词:细胞培养,细胞污染,支原体污染细胞培养技术是现代生命科学研究中不可缺少的一项基本实验技术,同时也是细胞工程中的核心技术之一。
细胞培养的质量好坏直接关系到实验结果的可靠性与否以及产品质量的合格与否。
在细胞培养中,最基本的原则就是无菌操作,污染是细胞培养最致命的大敌,预防和避免污染是细胞培养成功的关键之一。
特别是对于一些珍贵的细胞株,一旦污染对实验可能就是毁灭性的。
1 污染的类型细胞污染的类型可分为物理、化学、生物三类。
其中化学、生物因素最为常见,物理因素最易被忽视。
1.1物理污染物理性污染通过影响细胞培养体系中的组分,从而影响了细胞的代谢。
最为常见的是温度和辐射(紫外线照射)。
过冷或过热的温度对细胞可引起细胞生理状态的改变,如从冰箱中取出的培养液直接加至37℃培养的细胞中可能会造成细胞应激,影响某些实验现象的观察。
在生物安全柜紫外灭菌时,应当遮蔽对紫外线敏感的试剂,同时普通操作中也要注意对见光易分解的物质进行避光处理。
对于需要使用同位素标记的某些实验,应当注意细胞、试剂周围不能放同位素。
除此之外,有时操作过程中偶尔有异物落入,极易造成污染。
一些小的颗粒状异物作为是微生物污染的载体进入培养液中造成细胞污染。
另外,实验过程中酒精棉球的棉絮、移液器枪头上的某些塑料碎屑等都有可能增加染菌的概率。
1.2化学污染细胞培养中的化学污染大多是由于实验准备或实验过程中造作不当造成的。
在实验准备阶段,细胞培养室中的器皿应做到专用,避免与常用器皿混用。
此外,细胞用器皿洗刷过程中要注意洗刷彻底,不可有洗涤剂等残留。
高压灭菌时应灭菌彻底,并在灭菌后的生物安全柜中打开使用。
细胞培养污染的途径、危害及预防措施

细胞培养污染的途径、危害及预防措施污染是细胞培养技术中面临的主要问题。
由于每一种细胞有其独特的培养体系,因此污染造成的后果也不尽相同。
某些污染的发生往往难以察觉和检测,而且污染源能长期共存于培养体系中,这类污染事实上大部分被人们忽视了。
培养的细胞作为一个生物体,会对培养环境以及环境中的污染物作出相应的反应,造成培养细胞生物学特性的改变,而对实验结果造成潜在的威胁,而且随着污染时间的延长而增加。
培养环境中的物理、化学及生物因素都可能侵入培养环境造成污染。
由于入侵的微生物在培养体系中不断增殖、代谢,因此生物性的污染对细胞的危害最大。
随着污染微生物的不断增殖,交叉污染的可能性也不断增加。
此外,微生物代谢消耗大量必需的养分,同时产生多种有毒的代谢产物,如酶、抗原及毒素等,进一步对细胞产生毒害作用。
因此,熟悉细胞培养污染的途径及其危害性,建立细胞培养规范的操作方法及规章制度,可以有效地防止污染,保证实验体系的稳定性和可靠性。
1细胞培养基本技术为了减少污染对细胞培养的影响,必须建立细胞冻存库。
细胞冻存库应该分主细胞库和工作细胞库,当需要做实验时从主细胞库中复苏细胞建立工作细胞库。
每一个冻存标本都应明确记录细胞的性质、代数及有无污染。
同时还应建立规范的检测程序进行菌检及细胞鉴定[1]。
为了保证培养细胞系的完整性,必须进行具体的实验记录,应包括以下内容:细胞系的种类及来源、有无污染、细胞代数和倍增时间、以及选择性突变。
具体的记录有利于对细胞的遗传及生理特性在常规传代培养中因突变、污染及各种原因导致的改变进行分析。
经过连续传代培养的细胞与它较早代数的冻存细胞相比,随着培养时间的延长,细胞在适应环境的过程中,其生物特性已发生了改变。
培养的细胞由若干生长速度及活力各异的亚群组成。
随着培养时间的延长,生长速度快及活力高的细胞亚群逐渐占优势,这种选择性趋势会影响整个细胞群的生物特性。
应用不同代数的细胞连续进行实验则结果会发生偏差。
细胞支原体污染的图片、危害、表现和怎么办
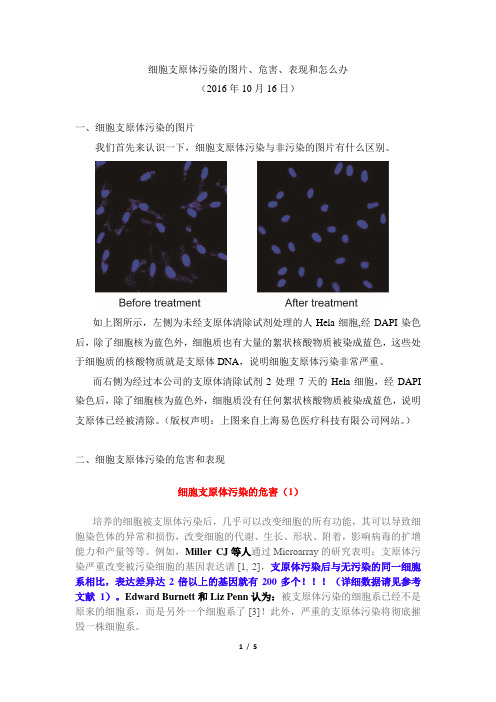
细胞支原体污染的图片、危害、表现和怎么办(2016年10月16日)一、细胞支原体污染的图片我们首先来认识一下,细胞支原体污染与非污染的图片有什么区别。
如上图所示,左侧为未经支原体清除试剂处理的人Hela细胞,经DAPI染色后,除了细胞核为蓝色外,细胞质也有大量的絮状核酸物质被染成蓝色,这些处于细胞质的核酸物质就是支原体DNA,说明细胞支原体污染非常严重。
而右侧为经过本公司的支原体清除试剂2处理7天的Hela细胞,经DAPI 染色后,除了细胞核为蓝色外,细胞质没有任何絮状核酸物质被染成蓝色,说明支原体已经被清除。
(版权声明:上图来自上海易色医疗科技有限公司网站。
)二、细胞支原体污染的危害和表现细胞支原体污染的危害(1)培养的细胞被支原体污染后,几乎可以改变细胞的所有功能,其可以导致细胞染色体的异常和损伤,改变细胞的代谢、生长、形状、附着,影响病毒的扩增能力和产量等等。
例如,Miller CJ等人通过Microarray的研究表明:支原体污染严重改变被污染细胞的基因表达谱 [1, 2],支原体污染后与无污染的同一细胞系相比,表达差异达2倍以上的基因就有200多个!!!(详细数据请见参考文献1)。
Edward Burnett 和 Liz Penn认为:被支原体污染的细胞系已经不是原来的细胞系,而是另外一个细胞系了 [3]!此外,严重的支原体污染将彻底摧毁一株细胞系。
从2013年开始,《Nature》期刊已正式要求投稿的文章,如涉及细胞培养都要进行支原体检测。
相信会有越来越多的高水平期刊将做出同样的支原体检测要求。
总之,在细胞系上进行生物医学方面的科学研究,如果不能保证所用的细胞系无支原体污染(Mycoplasma-free),则所得出的结论是极端不可靠甚至是完全错误的!可以想象:全球范围内,每年因支原体污染导致白白浪费的科研经费的数量是多么的巨大,有人估计至少高达数十亿美金!细胞支原体污染的危害(2)1. 细胞生物学:支原体污染将直接导致最常用的MTT细胞毒性实验结果的严重错误!●结果:由于支原体对MTT的额外还原作用,对阿霉素(Doxorubicin, 一种抗肿瘤药物)的抗性,支原体污染和非污染的细胞二者相差15倍!(Due to an additional reduction of tetrazolium by mycoplasmas, contaminated cells appeared up to 15 fold resistant to doxorubicin.)●参考文献:Falsification of tetrazolium dye (MTT) based cytotoxicity assayresults due to mycoplasma contamination of cell cultures. Anticancer Res. 1999 Mar-Apr; 19(2A):1245-8.2. 免疫学:支原体污染本身将可以直接诱导树突状细胞的成熟!这对于目前国内外普遍开展的人体免疫细胞的肿瘤治疗将是灾难性的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
生物特性:
无细胞壁,形态呈高度多形性,可为圆形、丝状或梨形,其直径仅有 0.13~0.18μm,是目前发现的最小细胞,并且变形能力大,故能通过滤菌 器。 革兰氏染色不易着色或呈阴性。 胞膜中含有胆固醇或其他甾醇,这种特性使支原体膜更具柔顺性,对于物 理因素,如压力、渗透压、脱水的抵抗力很大。 多数支原体适合在偏碱性条件下生存(pH值7.6~8.0),对酸耐受性差。
原体是没有作用的。
支原体污染应对策略
新一代支原体抗生素M-Plasmocin 其含有两种杀菌成分,一种成分通过干扰核糖体的翻译功能而使蛋白合 成受阻。另一种成分则通过干扰复制叉的形成而阻止DNA的复制。 可以强效对抗支原体及相关的无胞前对抗支原体最理想的 方法。
支原体污染来源
工作环境的污染
操作者本身的污染(包括操作者操作不当以及某些支原 体在人体是正常菌群) 实验器材的污染 培养基等试剂的污染
被污染细胞造成的交叉污染
制备细胞的原始组织或器官的污染
支原体污染的类型
口腔支原体(M.orale) 精氨酸支原体(M.arginini) 猪鼻支原体(M. hyorhinis) 发酵支原体(M.fermentans)
梨支原体(M. pirum)
莱氏无胆甾原体(idlawi)
支原体污染有时易被忽视!
1.培养液可不发生混浊
2.细胞病理变化轻微或不显著
3.细微变化也可由于传代,换液而缓解。 4.个别严重者,可致细胞增殖缓慢,甚至从 培养器皿脱落
但支原体污染对细胞的影响却是极大的!!!
1、影响细胞的生长状态及形态 支原体可使培液中支持细胞生长的营养物质含量减少,造成细胞生长缓慢甚至 停止;另外还会导致细胞微管解聚,引起细胞一系列病变,表现为细胞收缩、 贴壁细胞脱落、裂解等。
些重要实验室的经验。一旦发现已经污染支原体的 培养物,灭活后弃之。更换新的培养物。避免支原体的进一 步播散。
3、其他 此外,支原体污染还会影响一些病毒在细胞中的产量、使恶性细胞致癌能力下降、 影响淋巴细胞分化等。
支原体污染的检测方法
培养法 DNA荧光染色法 聚合酶链反应(PCR)法 电子显微镜法 相差显微镜检测
3-H胸腺嘧啶掺入法
酶联免疫吸附试验、免疫荧光法 低张处理地衣红染色观察
培养法:
原理:利用营养丰富的培养基,直接对待检细胞、血清等进 行支原体培养。 局限性:灵敏度低,试验周期长,不能检测到种且不适用于 检测所有支原体
细胞培养中的支原体污染
支原体简介
概念:支原体又称“霉形体”,是目前已知一类能在无生
命培养基上生长繁殖的最小的原核细胞型微生物。自然界分 布广泛,种类多,有80余种,分为两个属:一为支原体属 (Mycoplasma),有几十个种;另一为脲原体属 (Ureaplasma),仅有一种。与人类感染有关的主要是肺炎 支原体和解脲脲原体。
支原体集落呈“油煎蛋”形
DNA荧光染色法
原理:利用荧光Hoechst33258标记细胞和支原体DNA,在紫外光 (波长为630 nm)激发下产生黄绿色荧光,利用荧光显微镜观察 支原体是否存在。 局限性:有时易出现假阴性和假阳性。
聚合酶链反应(PCR)法
原理:通过扩增被检测标本中的支原体DNA ,再进行琼脂糖 凝胶电泳。电泳完毕,将电泳胶在紫外投射仪下观察,根据标 准分子量及阳性对照、内对照条带,观察待测样品中是否有 阳性条带。
支原体对热抵抗力差,通常55℃经15分钟处理可使之灭活。
对影响细胞壁合成的抗生素不敏感,但红霉素、四环素、链霉素及氯霉素 等作用于支原体核蛋白体的抗生素,可抑制或影响蛋白质合成,有杀灭支
原体的作用。
支原体高污染率
国内外研究表明,在细胞培养中,支原体感 染率达到30%-60%
支原体污染已成为世界问题!
支原体污染应对策略
细胞一旦发生了支原体污染,应当弃之。虽然已有了针对支
原体的抗生素及最近出现的所谓支原体清除剂,这些方法只能
杀灭细胞外的支原体。 除非是不可替代或无法重新获得的细胞,一般没有必要进行 支原体清除工作。
常用方法有:抗生素处理、抗血清处理、抗生素加抗血清和补体联合处理等等。 要注意的是:支原体没有细胞壁,故作用于细胞壁生物合成的抗生素,如内酰胺 类、万古霉素等是不敏感的;对多粘菌素、利福平、磺胺药物普遍耐火药。对支 原体最有抑制活性抗生素是四环素类、大环内酯类等,氨基糖苷类、氯霉素对支 原体有较小的抑制作用。必要时更换所有培养用物。通常,滤过除菌的方法对支
支原体污染的细胞
经M-Plasmocin处理 过的细胞
支原体污染应对策略
1、从可靠来源引进、使用细胞,特别是知名的信誉良好 的专门机构,如ATCC、基础医学细胞中心等。 2、预防为主:细胞培养实验室应制定严格的管理制度, 按照规范的实验程序操作。
3、定期对实验室中的培养物进行支原体检测。这也是国外一
2、影响细胞的代谢和功能 (1)培液中的精氨酸被支原体大量消耗,引起细胞蛋白质、DNA、rRNA、mRNA的 合成障碍; (2)支原体活动使培液成分发生改变(如发酵型支原体降解糖类产生酸性物质), 影响细胞代谢。 (3)支原体吸附在细胞表面,破坏细胞膜的完整性,影响细胞信号传递; (4)支原体消耗细胞的核苷库—染色体异常
