计算化学实验二
2020有机化学实验2-6对氨基苯甲酸乙酯制备

实验步骤
3.硝基还原为氨基 方法二: 在装有搅拌磁子及冷凝管的50mL圆底烧瓶中,加入5mL水,1mL冰醋酸和 锌粉3g,对硝基苯甲酸乙酯2g和95%乙醇15mL,在激烈搅拌下,回流反 应45分钟。稍冷,在搅拌下,分次加入温热的饱和碳酸钠溶液至反应液为 碱性。搅拌片刻,立即热抽滤,滤液转移至烧杯中冷却析出结晶。抽滤, 产品用稀乙醇洗涤,抽干得到粗产品,称重。
问题及讨论
1. 如何提高酯化反应转化率?应采取哪些措施? 2. 重结晶时为什么要进行热抽滤?不溶物是什么? 3. 混合溶剂重结晶的方法是什么?
实验步骤
4、精制:将粗品置于装有冷凝管的50mL圆底烧瓶中,加入固体 重量的10-15倍(mL/g)的50%乙醇,水浴加热使固体全部溶解 。稍冷,加活性炭脱色(活性炭用量视粗品颜色而定),加热回流 20分钟,趁热热过滤(抽滤漏斗和抽滤瓶应预热至110℃)。将滤 液趁热转移至烧杯中,自然冷却,待结晶完全析出后,抽滤,用少 量50%乙醇洗涤两次,压干,干燥,测熔点。计算收率。
3、 硝基还原为氨基----方法一: 在装有,1mL冰醋酸和已处理过的还原铁粉2.8g, 开动电磁搅拌,加热至95-98℃,反应5分钟。
实验步骤
3、 硝基还原为氨基----方法一: 稍冷,加入对硝基苯甲酸乙酯2g和95%乙醇12mL,在激烈搅
拌下,回流反应45分钟。稍冷,在搅拌下,分次加入温热的饱和 碳酸钠溶液至反应液为碱性。搅拌片刻,立即热抽滤,滤液转移 至烧杯中冷却析出结晶。抽滤,产品用稀乙醇洗涤,抽干得到粗 产品,称重。
4、还原反应中,因锌粉(铁粉)比重大,沉于瓶底,必须将其搅 拌起来,才能使反应顺利进行,故充分激烈搅拌是铁酸还原反应的 重要因素。
• 方法二中制备的产品后处理也可采用如下方法:
化学反应中的酸碱滴定计算实例

化学反应中的酸碱滴定计算实例酸碱滴定是化学实验中常用的一种定量分析方法,它通过加入一种已知浓度溶液到另一种待测溶液中,以确定待测溶液中酸碱的浓度。
本文将介绍几个化学反应中的酸碱滴定计算实例。
实例一:酸碱滴定计算浓度假设有一种硫酸溶液(A)的浓度为0.1 mol/L,想知道其中含有多少硫酸。
首先,用一个滴定管取一定体积的A溶液,加入少量的酚酞指示剂,颜色变成粉红色。
然后,用另一个滴定管滴加氢氧化钠溶液(B)到A溶液中,当颜色由粉红色变为无色时,滴定停止。
滴定完成后记录滴定所需的氢氧化钠溶液B的体积为V mL。
根据酸碱滴定反应的化学方程式:H2SO4 + 2NaOH → Na2SO4 + 2H2O根据化学方程式的配比,可以得到摩尔比为1:2,即每1 mol的硫酸对应2 mol的氢氧化钠。
因此,滴定所需的氢氧化钠溶液B的摩尔数可以表示为:n = V × C(V为体积,C为氢氧化钠的浓度)。
假设滴定所需的氢氧化钠溶液B的摩尔数为n1 mol,则硫酸溶液A 中硫酸的摩尔数为2n1 mol。
由于硫酸溶液A的体积未知,所以无法直接计算出硫酸的质量。
实例二:酸碱滴定计算相对分子质量假设有一种含有未知酸的溶液,需要确定该酸的相对分子质量。
首先,用一个滴定管取一定体积的该溶液,加入酚酞指示剂,颜色变成粉红色。
然后,用氢氧化钠溶液滴定该酸溶液,当颜色由粉红色变为无色时,滴定停止。
滴定完成后记录滴定所需的氢氧化钠溶液的体积为V mL。
根据酸碱滴定反应的化学方程式:HnX + nNaOH → NaX + nH2O其中,HnX表示待测酸溶液,n为酸的酸度。
根据化学方程式的配比,可以得到摩尔比为1:1,即每1 mol的酸对应1 mol的氢氧化钠。
因此,滴定所需的氢氧化钠溶液的摩尔数可以表示为:n = V × C。
假设滴定所需的氢氧化钠溶液的摩尔数为n2 mol,则待测酸溶液中酸的摩尔数为n2 mol。
由于该酸的体积未知,所以无法直接计算出该酸的质量。
计算化学实验报告

实验名称:分子轨道理论在有机化合物性质预测中的应用实验日期:2023年4月10日实验地点:化学实验室实验目的:1. 理解分子轨道理论的基本概念。
2. 学习如何使用计算化学软件进行分子轨道计算。
3. 应用分子轨道理论预测有机化合物的性质。
实验原理:分子轨道理论(Molecular Orbital Theory,MOT)是现代量子化学中的一个重要理论,它描述了分子中电子的运动状态。
通过分子轨道理论,可以计算分子的能量、键长、键角等性质,并预测分子的稳定性。
实验仪器与试剂:1. 仪器:计算机、计算化学软件(如 Gaussian、MOPAC等)、分子结构编辑软件(如 ChemDraw等)。
2. 试剂:无特殊试剂。
实验步骤:1. 分子结构构建:使用ChemDraw软件构建目标有机化合物的分子结构。
2. 分子轨道计算:- 打开计算化学软件,输入分子结构。
- 设置计算参数,包括基组、密度矩阵等。
- 运行计算,获取分子轨道能量、键长、键角等数据。
3. 结果分析:- 分析分子轨道能量,确定分子中电子的排布。
- 计算键长、键角,与实验值进行比较。
- 分析分子的稳定性,预测分子的反应活性。
实验结果:以甲烷(CH4)为例,进行分子轨道计算。
1. 分子结构构建:使用ChemDraw软件构建甲烷分子结构。
2. 分子轨道计算:- 使用 Gaussian 软件进行计算,选择 STO-3G 基组。
- 计算结果如下:- 最小能量轨道:σ1s(-4.598 eV)- 第二能量轨道:σ2s(-0.805 eV)- 第三能量轨道:σ2p(-0.073 eV)- 键长:C-H 键长为 1.09 Å。
- 键角:H-C-H 键角为109.5°。
3. 结果分析:- 甲烷分子中,电子主要填充在σ1s、σ2s 和σ2p 轨道中。
- C-H 键长与实验值基本吻合,说明计算结果可靠。
- H-C-H 键角与实验值相符,进一步验证了计算结果的准确性。
无机化学II实验

实验一 银氨配离子配位数及稳定常数的测定一、实验目的1.应用配位平衡和沉淀平衡等知识测定银氨配离子[Ag(NH 3)n+的配位数n 及稳定常数。
二、实验前应思考的问题1. 测定银氨配离子配位数的理论依据是什么?如何利用作图法处理实验数据?2. 在滴定时,以产生AgBr 浑浊不再消失为终点,怎样避免KBr 过量?若已发现KBr 少量过量,能否在此实验基础上加以补救?3. 实验中所用的锥形瓶开始时是否必须是干燥的?在滴定过程中,是否需用蒸馏水洗锥形瓶内壁?为什么?三、实验原理在AgNO 3溶液中加入过量氨水,即生成稳定的[Ag(NH 3)n ]+。
Ag + + nNH 3[Ag(NH 3)n ]+ (1)K f Θ=[ Ag(NH 3)n ]+/[ Ag +][ NH 3]n再往溶液中加入KBr 溶液,直到刚刚出现Br 沉淀(浑浊)为止,这是混合溶液中同时存在着以下的配位平衡和沉淀平衡:Ag ++Br -AgBr(s) (2)[Ag +][ Br -] = K sq Θ反应(1)-反应(2)得AgBr(s) + nNH 3 [Ag(NH 3)n ]+ + Br -式中[ Br -], [ NH 3], [Ag(NH 3)n ]+都是相应物质平衡时的浓度(单位:mol·L -1),它们可以近视地按以下方法计算。
设每份混合溶液最初取用的AgNO 3溶液的体积为V(Ag +)(各份相同),浓度分别为[Ag +]0,每份中所加入过量氨水和KBr 溶液的体积分别为V(NH 3)和V(Br -),其浓度分别为[NH 3]0和[Br -]0,混合液总体积为V 总,则混合后并达到平衡时:(5) (6) ])([][][][]][)([3333+--+⋅==n n f f nn NH Ag NH K Br K NH Br NH Ag θθ总总总V V NH NH V V Ag NH Ag V V Br Br NH Ag n Br 3033030][][][])([][][⨯=⨯=⨯=+-++--(7)将式(5) ~ (7)带入(4)并整理得以lgV(Br -)为纵坐标,nlgV(NH 3)为横坐标作图,所得直线斜率即为[Ag(NH 3)n ]+的配位数n 。
实验二化学吸收系统气液平衡数据的测定

实验二化学吸收系统气液平衡数据的测定A 实验目的化学吸收是工业气体净化和回收常用的方法,为了从合成氨原料气、天然气、热电厂尾气、石灰窑尾气等工业气体中脱除CO2 、H2S、SO2等酸性气体,各种催化热钾碱吸收法和有机胺溶液吸收法被广泛采用。
在化学吸收过程的开发中,相平衡数据的测定必不可少,因为它是工艺计算和设备设计的重要基础数据。
由于在这类系统的相平衡中既涉及化学平衡又涉及溶解平衡,其气液平衡数据不能用亨利定律简单描述,也很难用热力学理论准确推测,必须依靠实验。
本实验采用气相内循环动态法测定CO2—乙醇胺(MEA)水溶液系统的气液平衡数据,拟达到如下目的:(1)掌握气相内循环动态法快速测定气液相平衡数据的实验技术。
(2)学会通过相平衡数据的对比,优选吸收能力大,净化度高的化学吸收剂。
(3)加深对化学吸收相平衡理论的理解,学会用实验数据检验理论模型,建立有效的相平衡关联式。
B 实验原理气液相平衡数据的实验测定是化学吸收过程开发中必不可少的一项工作,也是评价和筛选化学吸收剂的重要依据。
气液平衡数据提供了两个重要的信息,一是气体的溶解度,二是气体平衡分压。
从工业应用的角度看,溶解度体现了溶液对气体的吸收能力,吸收能力越大,吸收操作所需的溶液循环量越小,能耗越低。
平衡分压反映了溶液对原料气的净化能力,平衡分压越低,对原料气的极限净化度越高。
因此,从热力学角度看,一个性能优良的吸收剂应具备两个特征,一是对气体的溶解度大,二是气体的平衡分压低。
由热力学理论可知,一个化学吸收过程达到相平衡就意味着系统中的化学反应和物理溶解均达到平衡状态。
若将平衡过程表示为:A(气)‖A(液)+ B(液)= M(液)定义:m 为液相反应物B的初始浓度(mol/l);为平衡时溶液的饱和度,其定义式为:mB A M 的初始浓度液相反应物组分的浓度形式存在的以反应产物=θa 为平衡时组分A 的物理溶解量。
则平衡时,被吸收组分A 在液相中的总溶解量为物理溶解量a 与化学反应量θm 之和,由化学平衡和溶解平衡的关系联立求解,进而可求得气相平衡分压mp A 和与θ*的关系: 在乙醇胺(MEA )水溶液吸收CO 2系统中,主要存在如下过程:溶解过程: CO 2(g )= CO 2(l ) (1)反应过程: 5.0<θ时, -++=+R N C O O R N H R N H l CO 222)( (2) 5.0>θ时, -+-+=++322222H C O R N H O H CO RNCOO (3)本实验仅讨论5.0<θ时的情况。
初三化学实验探究和综合计算题2
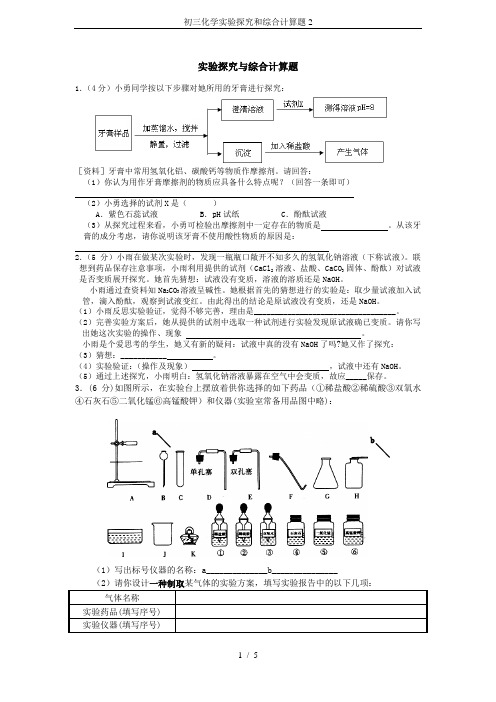
实验探究与综合计算题1.(4分)小勇同学按以下步骤对她所用的牙膏进行探究:[资料]牙膏中常用氢氧化铝、碳酸钙等物质作摩擦剂。
请回答:(1)你认为用作牙膏摩擦剂的物质应具备什么特点呢?(回答一条即可)(2)小勇选择的试剂X 是( )A .紫色石蕊试液B .pH 试纸C .酚酞试液(3)从探究过程来看,小勇可检验出摩擦剂中一定存在的物质是 。
从该牙膏的成分考虑,请你说明该牙膏不使用酸性物质的原因是:2.(5分)小雨在做某次实验时,发现一瓶瓶口敞开不知多久的氢氧化钠溶液(下称试液)。
联想到药品保存注意事项,小雨利用提供的试剂(CaCl 2溶液、盐酸、CaCO 3固体、酚酞)对试液是否变质展开探究。
她首先猜想:试液没有变质,溶液的溶质还是NaOH 。
小雨通过查资料知Na 2CO 3溶液呈碱性。
她根据首先的猜想进行的实验是:取少量试液加入试管,滴入酚酞,观察到试液变红。
由此得出的结论是原试液没有变质,还是NaOH 。
(1)小雨反思实验验证,觉得不够完善,理由是__________________________________。
(2)完善实验方案后,她从提供的试剂中选取一种试剂进行实验发现原试液确已变质。
请你写出她这次实验的操作、现象 。
小雨是个爱思考的学生,她又有新的疑问:试液中真的没有NaOH 了吗?她又作了探究:(3)猜想:___________ 。
(4)实验验证:(操作及现象) ,试液中还有NaOH 。
(5)通过上述探究,小雨明白:氢氧化钠溶液暴露在空气中会变质,故应_____保存。
3.(6分)如图所示,在实验台上摆放着供你选择的如下药品(①稀盐酸②稀硫酸③双氧水④石灰石⑤二氧化锰⑥高锰酸钾)和仪器(实验室常备用品图中略):(1)写出标号仪器的名称:a______________b_______________(2)请你设计一种制取某气体的实验方案,填写实验报告中的以下几项:a b4.(5分)小明同学在学习酸的性质时,他用大小,外形均相同的铝片分别和H+浓度相同的稀盐酸、稀硫酸反应。
如何进行化学实验的计算

如何进行化学实验的计算化学实验的计算是化学实验过程中不可或缺的一部分,它能够帮助我们预测实验结果、分析实验数据以及优化实验条件。
在进行化学实验的计算时,我们需要掌握相关的计算方法和技巧,并且要进行正确的单位转换和数据处理。
本文将介绍常见的化学实验计算方法,并提供一些实用的示例。
1. 摩尔计算在化学实验中,我们经常需要计算物质的摩尔数。
摩尔是物质的质量与其相对分子质量之间的比例关系。
计算摩尔数的方法是将物质的质量除以其相对分子质量。
例如,计算10克氯化钠的摩尔数,可以使用下列公式:摩尔数 = 质量 / 相对分子质量假设氯化钠的相对分子质量为58.44克/摩尔,则:摩尔数 = 10克 / 58.44克/摩尔 = 0.171摩尔2. 反应计算在化学实验中,我们还需要根据反应方程式计算反应物和生成物的摩尔比例,从而预测实验结果或计算实验中需要使用的物质量。
例如,假设我们有如下反应方程式:2 H2 + O2 → 2 H2O要计算当有8摩尔氢气参与反应时,所生成的水的摩尔数,可以使用下列公式:摩尔数(水) = 摩尔数(氢气) ×反应物与生成物的摩尔比例根据反应方程式可知,氢气与水的摩尔比例为2:2,即1:1。
因此,摩尔数(水) = 8摩尔。
这意味着当8摩尔的氢气参与反应时,会生成8摩尔的水。
如果我们需要计算生成水的质量,可以使用下列公式:质量(水) = 摩尔数(水) ×相对分子质量(水)假设水的相对分子质量为18.02克/摩尔,则:质量(水) = 8摩尔 × 18.02克/摩尔 = 144.16克3. 体积计算化学实验中,有时候需要根据气体的状态方程计算气体的体积。
最常用的气体状态方程是理想气体状态方程 PV = nRT,其中 P 表示气体的压强,V 表示气体的体积,n 表示气体的摩尔数,R 是气体常数,T 表示气体的温度。
举个例子,假设我们需要计算100摩尔气体在常温常压下的体积,常温常压下的气体温度为298K,气体常数 R 为8.31 J/(mol·K),则可以使用下列公式:V = (n × R × T) / P假设常压下的压强 P 为1 atm,则:V = (100摩尔 × 8.31 J/(mol·K) × 298K) / 1 atm根据上述公式计算得出的结果为V = 24669.3 L。
化学中的计算化学

化学中的计算化学计算化学是一种利用计算机、数学和化学理论模型,进行化学研究的交叉学科。
在此过程中,我们可以使用数学算法来解决化学模型中的各种化学问题。
这个过程是很重要的,因为它通过使用计算机来协助实验化学家在研究中发现规律、预测结果、优化实验条件等等方面提供了无限的可能性。
在计算化学中,我们可以运用许多方法来解决化学问题,其中最常见的包括量子化学、分子动力学模拟和分子排列方案等。
这些方法各自有自己独特的用处和优势,让我们一一探讨。
量子化学是计算化学领域中最常用的方法之一。
具体来说,它是通过考虑原子和分子内的电子云的波动特性和量子力学计算的基础上,对分子光谱、反应机理、电子物性和溶解性等问题进行研究。
这种方法的应用范围非常广泛,从普通无机化学到有机化学、生物化学和材料科学都可以用到。
有了它,我们可以更加准确地描述分子中的基本物理及化学现象。
分子动力学模拟也是计算化学中一个重要的方法。
在研究中,我们需要将分子运动使用计算机进行模拟。
这个过程不仅可以帮助我们了解分子的结构和化学性质,同时还可以为分子设计和构建提供重要信息。
这种方法主要应用于材料科学和有机化学领域,例如蛋白质折叠、纳米材料计算和捕捉燃料电池等方面都有着广泛的应用。
再看分子排列方案这个方法,它是通过计算所有可能的分子结构,在最优方案之中寻找一个特定的分子排列模型。
这个方法在药物设计中非常有用,因为药物的效果与它们的分子结构有着密切的关系。
借助这种方法,我们可以预测化合物的生物活性和药物稳定性等特性,为新药的开发提供重要指导意义。
除上述方法外,计算化学中还有许多其他工具和技术,例如,分子轨道理论、本质缺陷计算和量子点计算等。
借助这些手段,我们可以全面解析、优化和理解分子和物质的性质和结构,为进一步深入研究和开发中提供重要的基础。
总之,化学中的计算化学是一种极为重要的工具和研究方向。
通过数学算法和计算机,我们可以快速地模拟、预测和优化实验结果,为实验研究提供重要的基础和指导。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1 1 1 1 1 1 2 3 4 5 6 7
a a a a a a b b b b b b
2 3 4 4 5 3 2 3 4 5 6
60. 60. 2 180.0 60. 3 180.0 120. 2 180.0 120. 3 180.0 120. 7 180.0 120. 4 180.0 120. 5 180.0 120. 6 180.0 120. 7 180.0 120. 2 180.0
%rwf=aa,2000MB,bb,2000MB…… .rwf文件是主要读写文件, 随体系增大, 32位机上单个不能超过2GB, 可以分割 为2000MB文件, 总体不能超过16GB。 %mem=600MB PC机上,WinXP系统总内存减去400MB;Linux系统减200MB ������ %nproc=8 指定并行计算使用的cpu核的数目
IR光谱 Raman光谱
•光谱计算
吸收/发射光谱以及二阶或 三阶非线性光学性质 NMR
电荷分布和电荷密度
•其它功能 偶极矩和超极矩 热力学参数 适用体系:气相和溶液
2.程序结构: a.由主引导模块(g09.exe)和 各分模块(l????.exe)组成:
说明: 1.根据不同的任务,某些模块需重复调用多次; 2.通常耗时较多的模块有:L5,L7,L8,L9,L10,L11等,此外,L8~L11这些模块的执行对内存和硬 盘的需求较大; 3.若L9999未能正常执行完毕,则表明计算过程存在问题,需检查之; 4.可根据各个模块的功能,对g09程序进行简化,例如如果用户通常只用g09进行能量计算,则可 只保留L1~6和L9999模块其它模块可以删除去。
实验二、分子结构的优化、频率计算及分子轨道图显示
G09的主要功能和程序结构
1. 主要功能: 基态(Ground state) •分子构型的优化 激发态(Excited state) 反应过渡态(Transition state) 基态和激发态能量 •能量计算 化学键的键能 电子亲合能和电离能 化学反应途径和势能面
1X
注:在本例中N-X和H-X不能任给 说明:1)根据需要,有时可同时用到多个虚原子; 2)在大多数场合,虚原子通常取在对称元素所处位置 或它们相交处;
c.直角坐标和内坐标混合输入方法: 对于该方法,只需在采用直角坐标方法输入的原子的元素 符号后加一个整数0即可,例如: X 0 1.0 1.0 1.0 N 1 2.0 H 1 1.0 2 90.0 H 1 1.0 2 90.0 3 120.0 H 1 1.0 2 90.0 3 -120.0 d.分子构型的输入准确性是保证计算结果可靠性的前提,对 于复杂体系,在计算前均需对所输构型进行检查,具体包 括: 构型的可视化处理,即采用一些分子构型软件(例如 Gaussview和Chem3D)观察所给构型是否合理; 在g09运行到L2模块,会给出所输入分子所属点群,此 时,可检查点群是否合理。
B3LYP (用B3LYP杂化泛函做DFT计算)������ MPx(在HF计算结果的基础上做MPx微扰校正,x=2、3、4、5) ������ CCD (双取代耦合簇方法)������
CCSD (单、双取代耦合簇方法)������
CID (双取代组态相互作用)������ CISD (单、双取代组态相互作用)������
# MP2/cc-pvtz maxdisk=12gb������
# HF/6-311g(d,p) freqscf=direct nosymm opt������ # CCSD=(T,maxcyc=200)/6-31G* opt=ts
a.G09任务类型、理论方法及基组
任务类型: 单点能计算(sp),几何优化(opt),频率(freq),反应过渡 态(irc) 理论方法: HF,MP2,B3LYP,CCSD(T),CASSCF 基组: STO-3g,6-31G(d,p),6-31++G(d,p),LanL2dz,Augcc-pVTZ,…
c.g09运行过程所使用的文件:
在scratch目录/或工作目录下有下列文件: (1)gxx-打头的文件为临时文件,计算结束后将自动删除,其中对于结尾为inp 的文件,记录了当前g09所执行的输入文件内容,有时可通过该文件确定当 前运行作业; (2)chk文件,该文件记录了g09运行的结果,包括分子结构、基组、分子轨道、 电荷密度以及偶极矩等,通常该文件在计算结束后要保留,便于以后作补充 计算或计算结果处理; (3)rwf文件,该文件记录了计算的中间结果,以便在计算过程非正常中断后 用于续算,该文件通常较大,当作业正常结束后,可删除之。 (4)Default.Rou文件,该文件设置一些系统默认参数,例如 g09运行时内存和硬盘的大小,其内容如下: -M- 256MB(内存大小) -#- MaxDisk=2000MB(硬盘大小)
说明: 1).对于chk文件并不自动产生,需用户自行指定,在大多数情况下,最好给定chk文件,并在计 算结束后保留,以便后续处理(例如计算结果的图像化等); 2).对于rwf文件,在运行过程中,g09会自行产生gxx打头的rwf文件,当计算非正常 中断后,可 通过更改该文件来续算。但用户在编写输入文件时,最好还是指定rwf文件,在计算结束后, 再删除。
表示三: O H,1,r1 O,1,r2,2,a1 H,3,r1,1,a1,2,d1 Variables:(本行内容可省) r1=1.0 r2=1.2 当对分子的构型进行局部优化时, a1=104.0 需采用该表示方法 d1=170.0
例2:乙烯 3 1 C 4 2 C 6 5
共面但不同侧 C C 1 1.3 H 1 1.0 2 120.0 H 1 1.0 2 120.0 3 180.0 H 2 1.0 1 120.0 3 0.0 H 2 1.0 1 120.0 3 180.0
b.G09常见的任务类型
SP Opt Freq IRC Scan
(单点能计算,默认)������ (几何构型优化.)������ (频率分析,IR.)������ (内反应坐标.)������ (势能面扫描.)
c.G09常见的理论方法 HF (Hartree-Fock方法, 默认)������
b.常用模块的功能: •L0—初始化模块; •L1—读入输入文件,根据所给关键词确定将要使用的模块; •L101,102,…—与构型优化和反应过渡态相关的模块; •L202—输出距离矩阵、判断化合物点群及确定新的坐标系; •L301,302…309—与基组和赝势有关模块; •L310,…319—计算单电子及双电子积分模块; •L401,402—SCF初始猜测模块; •L502,503,508—SCF模块; •L601,608—Mulliken布居以及自然键轨道(NBO)分析模块; •L701,702…—计算能量一阶和二阶导数模块; •L8??,9??,10??,11??—与Post-SCF方法有关模块; •L9999—进程结束模块;
%nproclinda=2 指定并行计算使用的cpu的数目
(2)关键词部分:
该部分内容由一个或多个关键词组成,用于指定任务 类型、理论方法、基组和计算输出的控制等。
#[p] method/basis [keyword=(opt1,opt2)] [keyword2=(opt1[,opt2])]
# hf/6-31g*������ #p B3LYP/cc-pvdz opt������
对同一构型,内坐标的表示并不唯一
5 2 4
在同侧共面
1
C
3
C
6
H C,1,1.0 H,2,1.0,1,120.0 C,2,1.3,1,120.0,3,180.0 H,4,1.0,2,120.0,1,0.0 H,4,1.0,2,120.0,1,180.0
虚原子的使用: 有时为了保证所描述的构型符合特定的点群,利用虚原子 便于做到这一点。 虚原子的符号为X。 例1:CO2 1 O 3 O 2 C 2 C X1 3 O 4 O
(6) g09输入文件编辑时的注意事项: 除了可采用g09所提供的输入文件编辑器来编写输入文件外, 在更多场合下,是采用其他文本编辑器来编写,此时应注意 到,在标题部分的前后各有一空行,例如: %chk=h2o # HF/6-31G(d) (此处为空行) water energy (此处为空行) 0 1 O -0.464 0.177 0.0 H -0.464 1.137 0.0 H 0.441 -0.143 0.0 练习:采用内坐标方法输入苯和甲烷的构型。
b.内坐标(z-matrix)方法:(适用于构型的局部优化) 内坐标与直角坐标之间的区别在于,它侧重于从原子之间的 键连角度来描述原子间的相对位置,具体参数包括: 1)键长:( 需用两个原子描述) 即两个原子间的距离,注:该两个原子并非要具有化学直 观意义上的成键。此外,在默认情况下,键长单位为埃。 2)键角:(需用三个原子描述) 确定了二根键之间的夹角,默认单位为度,范围为-180~ 180deg之间。 3)二面角:(需用四个原子描述) 二面角加上键长和键角就确定了四个原子的位置,其默认 单位为deg,范围为-360~360deg。当二面角等于0,±180 和±360deg时四个原子共面。
G09输入文件的编写与使用
L0命令部分(可无) 关键词部分 标题部分 体系电荷和自旋多重度
分子பைடு நூலகம்型
(1) L0命令部分: 该部分内容均以%打头,主要用于指定计算过程所需 软硬件的参数,chk以及rwf文件名,其典型内容是:
%chk=aa.chk .chk文件包含了所有计算结果, 是GaussView分析结果的主要文件
X C,1,1.0 O,2,1.1,1,90.0 O,2,1.1,1,90.0,3,180.0
该键长值可任意
例2:NH3 2N 5 H H3 要使输入的构型满足C3v点群,需要 准确提供H-N-H键角以及四面体相邻 两个平面间的二面角。为此,在3个 H所在三角形中心引入一个虚原子X, 则: X N 1 2.0 4 H H 1 1.0 2 90.0 H 1 1.0 2 90.0 3 120.0 H 1 1.0 2 90.0 3 -120.0
