破伤风杆菌(TETANUS) IgM抗体检测试剂盒(酶联免疫法)
体外诊断试剂产品分类分类目录

体外诊断试剂产品分类分类目录按医疗器械受理和审评的体外诊断试剂一、临床血液学和体液学检验试剂 1.1 血液学检验试剂(盒)1.1.1血液一般检验试剂(盒) 1.1.2溶血试验试剂(盒)1.1.3血栓与止血检验试剂(盒) 1.2 组织配型类试剂(盒)1.3尿液检验试剂(盒)、试纸1.4 粪便检验试剂(盒)、试纸 1.5其他体液及排泄物检验试剂(盒)二、临床化学检验试剂2.1无机离子检验试剂(盒)2.2蛋白质检验试剂(盒)2.3 糖类检验试剂(盒)、试纸 2.4 酶类检验试剂(盒)2.4.1 肝脏疾病诊断试剂(盒) 2.4.2 肾脏疾病诊断试剂(盒) 2.4.3 心肌疾病诊断试剂(盒) 2.4.4 体液和其他酶测定试剂(盒) 2.5 非蛋白含氮类化合物检测试剂(盒) 2.6 脂类检验试剂(盒)2.7血气与电解质分析试剂(盒) 2.8内分泌检验试剂(盒)2.8.1 下丘脑垂体激素测定试剂(盒) 2.8.2 甲状腺激素测定试剂(盒) 2.8.3 肾上腺激素测定试剂(盒) 2.8.4 性腺激素测定试剂(盒) 2.8.5 胰腺和肠胃激素测定试剂(盒)2.8.6 其他激素测定试剂(盒)2.9维生素和药物及代谢物类检验试剂(盒) 2.9.1维生素测定类试剂(盒)2.9.2药物和药物代谢物检测试剂(盒)三、临床免疫学检验试剂3.1 传染病免疫学诊断检验试剂(盒) 3.1.1 肝炎病毒血清学标志物检验试剂(盒) 3.1.2 其他病毒血清学标志物检验试剂(盒) 3.1.3 细菌血清学检验试剂(盒)3.1.4其他微生物血清学检验试剂(盒) 3.2肿瘤标志物类试剂(盒)3.3细胞免疫检验测定试剂(盒)四、微生物学检验试剂4.1 培养基4.2微生物学检验类试剂(盒)4.3微生物抗原、抗体及核酸检测类试剂(盒) 4.4药敏试剂4.5生化鉴定培养基4.6染色液五、组织细胞学检验试剂5.1 细胞、组织化学染色剂类试剂5.2 免疫组化与人体组织细胞类试剂(盒)六、变态反应、自身免疫诊断检验试剂(盒)七、遗传性疾病检验试剂八、分子生物学检验试剂8.1分子诊断试剂(盒)8.1.1 分子杂交诊断试剂(盒)8.1.2 PCR试剂(盒)8.2人类基因检测类试剂(盒)8.3 生物芯片类试剂(盒)8.3.1 基因芯片类检测试剂(盒)8.3.2 蛋白质芯片类检测试剂(盒) 8.3.3 其他生物芯片类检测试剂(盒)九、其它检验试剂(盒)按药品受理和审评的体外诊断试剂*1.ABO血型定型试剂(盒)*2.乙型肝炎表面抗原(HBsAg)试剂(盒) *3.丙型肝炎病毒(HCV)抗体试剂(盒) *4.人类免疫缺陷病毒HIV(1,2型)抗体试剂(盒)人类免疫缺陷病毒抗原/抗体诊断试剂(盒) *5.梅毒螺旋体抗体试剂(盒) *6.放免试剂(盒)注:以上带*号的五个品种,预期用途为血源筛查时按药品受理和审评,为临床诊断时,按第三类医疗器械进行管理。
口蹄疫O型抗体检测试剂盒(酶联免疫法) 使用说明书
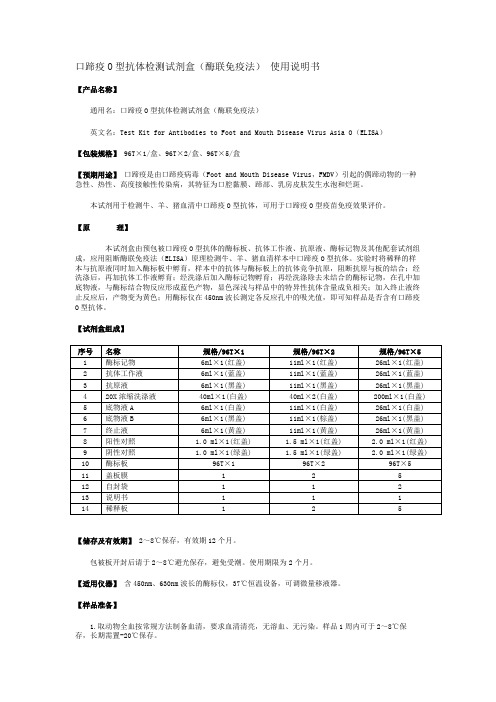
口蹄疫O型抗体检测试剂盒(酶联免疫法)使用说明书【产品名称】通用名:口蹄疫O型抗体检测试剂盒(酶联免疫法)英文名:Test Kit for Antibodies to Foot and Mouth Disease Virus Asia O(ELISA)【包装规格】96T×1/盒、96T×2/盒、96T×5/盒【预期用途】口蹄疫是由口蹄疫病毒(Foot and Mouth Disease Virus,FMDV)引起的偶蹄动物的一种急性、热性、高度接触性传染病,其特征为口腔黏膜、蹄部、乳房皮肤发生水泡和烂斑。
本试剂用于检测牛、羊、猪血清中口蹄疫O型抗体,可用于口蹄疫O型疫苗免疫效果评价。
【原理】本试剂盒由预包被口蹄疫O型抗体的酶标板、抗体工作液、抗原液、酶标记物及其他配套试剂组成,应用阻断酶联免疫法(ELISA)原理检测牛、羊、猪血清样本中口蹄疫O型抗体。
实验时将稀释的样本与抗原液同时加入酶标板中孵育,样本中的抗体与酶标板上的抗体竞争抗原,阻断抗原与板的结合;经洗涤后,再加抗体工作液孵育;经洗涤后加入酶标记物孵育;再经洗涤除去未结合的酶标记物,在孔中加底物液,与酶标结合物反应形成蓝色产物,显色深浅与样品中的特异性抗体含量成负相关;加入终止液终止反应后,产物变为黄色;用酶标仪在450nm波长测定各反应孔中的吸光值,即可知样品是否含有口蹄疫O型抗体。
【试剂盒组成】【储存及有效期】2~8℃保存,有效期12个月。
包被板开封后请于2~8℃避光保存,避免受潮。
使用期限为2个月。
【适用仪器】含450nm、630nm波长的酶标仪,37℃恒温设备,可调微量移液器。
【样品准备】1.取动物全血按常规方法制备血清,要求血清清亮,无溶血、无污染。
样品1周内可于2~8℃保存,长期需置-20℃保存。
2.用工作洗涤液将待检牛、羊血清先按32倍稀释(如5μl 血清加入155μl 工作洗涤液中,混匀),待检猪血清按16倍稀释(如5μl 血清加入75μl 洗涤液中,混匀),阴、阳性对照不用稀释。
试剂报价单3

三明博峰
多胺法
分泌物
50T
155
爱滋病检测试剂(HIV)
爱滋病试剂盒
北京金豪
金标层析
血清
50T
295
爱滋病试剂盒
北京金豪
酶免Biblioteka 血清96T200优生优育系列
巨细胞病毒(CMV)
博峰
金标
血清
24T/48T
70/140
弓型虫(TOX)
博峰
金标
血清
24T/48T
70/140
风疹病毒(RV)
博峰
金标
博峰
金标
血清
24T/48T
115/230
消化道系列
胃幽门螺旋杆菌(HP)
三明博峰
金标
血清
50T
150
其它产品
抗A.B血型
北京金豪
100T
血
盒
40
早早孕试纸条
*美国艾康
100T
尿液
盒
43
试纸系列
尿仪试纸
*桂林优力特
10/11项
尿液
100T
105/110
液基细胞涂片试剂(TCT)
珠海
手工
分泌物
T
18
肝病试剂
乙肝两对半(HBV)
北京金豪
酶联免疫
血清
96T
235
乙肝两对半(HBV)
厦门新创
金标层析
血清
25T
130
乙肝表面抗原(HBsAg)
*广州万孚
金标层析
血清
200T
170
试剂报价单
产品名称
产地
方法
检测物质
风疹病毒(IgMIgG)抗体检测试剂盒(酶联免疫法)国产进口注册情况一览表

风疹病毒(IgM/IgG)抗体检测试剂盒(酶联免疫法)国产/进口注册情况一览表厂家/代理商名称/注册号注册规格/有效期/适用范围北京健安生物科技有限公司风疹病毒抗体(IgM)检测试剂盒(酶联免疫法)国食药监械(准)字2013第3400923号48/96人份/盒批准日期:2012.07.20 有效期至:2016.06.19利用酶联免疫吸附法(ELISA)定性检测人血清或血浆中的风疹病毒抗体(IgM)。
风疹病毒抗体(IgG)检测试剂盒(酶联免疫法)国食药监械(准)字2013第3400172号48/96人份/盒批准日期:2013.02.01 有效期至:2017.01.31利用酶联免疫吸附法(ELISA)定性检测人血清或血浆中的风疹病毒抗体(IgG)。
郑州安图生物工程股份有限公司风疹病毒IgM抗体测定试剂盒(酶联免疫法)国食药监械(准)字2013第3401959号48人份/盒、96人份/盒、288人份/盒批准日期:2013.12.09有效期至:2017.12.08该产品用于定性检测人血清或血浆中风疹病毒IgM抗体。
风疹病毒IgG抗体测定试剂盒(酶联免疫法)国械注准2015340077848人份/盒、96人份/盒、288人份/盒批准日期:2015.05.19有效期至:2020.05.18该产品用于定性检测人血清或血浆中风疹病毒IgG抗体。
风疹病毒IgG抗体亲和力检测试剂盒(酶联免疫法)国械(准)标准2015340076948人份/盒准日期:2015.05.19有效期至:2020.05.18该产品用于定性检测人血清或血浆中风疹病毒IgG抗体亲和力。
北京现代高达生物技术有限责任公司风疹病毒IgM抗体诊断试剂盒(酶联免疫法)(国食药监械(准)字2013第3400680号)48人份/盒,96人份/盒批准日期:2013.05.15有效期至:2017.05.14体外定性检测人血清或血浆中的风疹病毒IgM抗体。
风疹病毒IgM抗体检测试剂盒(酶联免疫法)(国食药监械(准)字2014第3400269号)48人份/盒,96人份/盒批准日期:2014.01.27有效期至:2018.01.26体外定性检测人血清或血浆中的风疹病毒IgM抗体。
《中国药典》2020版—马破伤风抗毒素 F(ab’)2 国家标准草案公示稿

附件 2:马破伤风抗毒素F(ab’)2 国家标准草案公示稿马破伤风免疫球蛋白F(ab’)2Ma Poshangfeng MianyiqiudanbaiF(ab’)2Tetanus Immunoglobulin F(ab’)2, Equine本品系由破伤风类毒素免疫马所得的血浆,经胃酶消化后采用硫酸铵盐析、超滤和柱层析等工艺纯化制成的液体免疫球蛋白F(a b’)2制剂。
用于预防和治疗破伤风梭菌引起的感染。
1基本要求生产和检定用设施、原材料及辅料、水、器具、动物等应符合“凡例”的有关要求。
2制造2.1抗原与佐剂应符合“人用马免疫血清制品总论”的规定。
2.2免疫动物及血浆2.2.1免疫动物免疫用马匹必须符合“人用马免疫血清制品总论”的规定。
2.2.2采血与分离血浆按“人用马免疫血清制品总论”的规定进行。
用动物法或其他适宜的方法测定免疫血清效价,不低于 1200IU/ml 时,即可采血。
分离之血浆可加入适宜防腐剂。
2.3胃酶用生理氯化钠溶液将胃酶配制成 1mg/ml 溶液,进行类 A 血型物质含量测定(通则3415),应不高于1.0μg/ml。
2.4原液2.4.1原料血浆原料血浆的破伤风抗毒素效价应不低于1000IU/ml(通则3508)。
血浆在保存期间,如发现有明显的溶血、染菌及其他异常现象,不得用于制备。
2.4.2制备2.4.2.1消化将免疫血浆稀释后,加入适量胃酶,如果必要还可加入适量甲苯,调整适宜pH 值后,在适宜温度下消化一定时间。
2.4.2.2纯化采用加温、硫酸铵盐析、明矾吸附、柱层析等步骤进行纯化。
2.4.2.3浓缩、澄清及除菌过滤浓缩可采用超滤或硫酸铵沉淀法进行。
可加入适量间甲酚作为防腐剂,可加入适量甘氨酸作为保护剂,然后澄清、除菌过滤。
纯化后的马破伤风免疫球蛋白F(a b’)2原液应置于2~8℃避光保存至少1个月作为稳定期。
2.4.3原液检定按 3.1 项进行。
2.5半成品2.5.1配制将检定合格的原液,按成品规格以灭菌注射用水稀释,调整效价、蛋白质浓度、pH 值及氯化钠含量,除菌过滤。
抗M2型线粒体抗体(IgG)测定试剂盒(酶联免疫吸附法)产品技术要求万泰

抗M2型线粒体抗体(IgG)测定试剂盒(酶联免疫吸附法)适用范围:本试剂盒用于体外定量检测人血清样品中的抗M2型线粒体IgG抗体。
1.1 产品规格包装规格:48人份/盒,96人份/盒。
1.2 主要组成成分表1 试剂盒主要组成成分各组份主要组成:酶标板:包被有M2抗原;酶标试剂:辣根过氧化物酶标记的抗人IgG抗体;样品稀释液:含PBS的缓冲液;M2-IgG校准品:含4水平的M2-IgG;浓缩洗涤液:含表面活性剂的缓冲液;显色剂A液:含浓度不低于0.3g/L的过氧化物溶液;显色剂B液:含浓度不低于0.2g/L的TMB溶液;终止液:含浓度不高于2mol/L的硫酸溶液。
2.1 外观试剂(盒)各组份应齐全、完整,液体无渗漏;标签应清晰,易识别。
2.2 准确度回收实验:回收率应在100%±20%范围内。
2.3 空白限应不高于5.0 RU/mL。
2.4 测量系统的线性本检测系统的线性范围为[10,159]RU/mL,在[10,159]RU/mL范围内,线性相关系数r应不低于0.9900。
2.5 重复性检测低、高两个浓度重复性参考品CV1和CV2,变异系数CV(%)应均不超过15%。
2.6 批间差用3个批号试剂盒检测重复性参考品CV2,变异系数CV(%)应不超过20%。
2.7 稳定性效期稳定性:将2℃~8℃放置6个月的试剂盒检测2.1~2.5各项,应符合各项目规定的要求。
2.8 溯源性校准品溯源性应符合GB/T 21415-2008有关规定,可溯源至企业的工作校准品,并经与已上市产品比对赋值。
Toxoplasma IgG ELISA测试产品说明书

Toxoplasma IgG ELISA Catalog Number SE120126Storage Temperature 2–8 °CTECHNICAL BULLETINProduct DescriptionToxoplasma gondii causes toxoplasmosis, a common disease that affects 30–50 of every 100 people in North America by the time they are adults. The mean source of infection is direct contact with cat feces or from eating undercooked meats. Toxoplasmosis generally presents with mild symptoms in immunocompetent individuals. In the immunocompromised patient,however, the infection can have serious consequences. Acute toxoplasmosis in pregnant women can result in miscarriage, poor growth, early delivery, or stillbirth. Treatment of an infected pregnant woman may prevent or lessen the disease in her unborn child. Treatment of an infected infant will also lessen the severity of the disease as the child grows. IgG and IgM antibodies to Toxoplasma can be detected with 2–3 weeks after exposure. IgG remains positive, but the antibody level drops overtime. ELISA can detect Toxoplasma IgM antibody one year after infection in over 50% of patients. Therefore, IgM positive results should be evaluated further with one or two follow up samples if primary infection is suspected.The Toxoplasma IgG ELISA Kit is intended for the detection of IgG antibody to Toxoplasma in human serum or plasma. Diluted serum is added to wellscoated with purified Toxoplasma antigen. Toxoplasma IgG specific antibody, if present, binds to the antigen. All unbound materials are washed away and the enzyme conjugate is added to bind to the antibody-antigen complex, if present. Excess enzyme conjugate is washed off and substrate is added. The plate isincubated to allow the oxidation of the substrate by the enzyme. The intensity of the color generated isproportional to the amount of IgG specific antibody in the sample.ComponentsReagents and Equipment Required but Not Provided.1.Distilled or deionized water2.Precision pipettes3.Disposable pipette tips4.ELISA reader capable of reading absorbance at450 nm5.Absorbent paper or paper towel6.Graph paperPrecautions and DisclaimerThis product is for R&D use only, not for drug,household, or other uses. Please consult the Safety Data Sheet for information regarding hazards and safe handling practices.Preparation Instructions Sample Preparation1. Collect blood specimens and separate the serum.2.Specimens may be refrigerated at 2–8°C for up toseven days or frozen for up to six months. Avoid repetitive freezing and thawing.20x Wash Buffer ConcentratePrepare 1x Wash buffer by adding the contents of the bottle (25 mL, 20x) to 475 mL of distilled or deionized water. Store at room temperature (18–26 °C).2Storage/StabilityStore the kit at 2–8 °C.ProcedureNotes: The components in this kit are intended for use as an integral unit. The components of different lots should not be mixed.Optimal results will be obtained by strict adherence to the test protocol. Precise pipetting as well as following the exact time and temperature requirements is essential.The test run may be considered valid provided the following criteria are met:1.If the O.D. of the Calibrator is >0.250.2.The Ab index for Negative control should be <0.9.3.The Ab index for Positive control should be >1.2. Bring all specimens and kit reagents to room temperature (18–26 °C) and gently mix. 1.Place the desired number of coated strips into theholder.2.Negative control, positive control, and calibrator areready to use.Prepare 21-fold dilution of testsamples, by adding 10 µL of the sample to 200 µLof Sample Diluent. Mix well.3.Dispense 100 µL of diluted sera, calibrator, andcontrols into the appropriate wells. For the reagent blank, dispense 100 µL of Sample Diluent in 1Awell position. Tap the holder to remove air bubbles from the liquid and mix well. Incubate for20 minutes at room temperature.4.Remove liquid from all wells. Wash wells threetimes with 300 µL of 1x wash buffer. Blot onabsorbent paper or paper towel.5.Dispense 100 µL of enzyme conjugate to each welland incubate for 20 minutes at room temperature. 6.Remove enzyme conjugate from all wells. Washwells three times with 300 µL of1x wash buffer.Blot on absorbent paper or paper towel7.Dispense 100 µL of TMB substrate and incubate for10 minutes at room temperature.8.Add 100 µL of stop solution.9.Read O.D. at 450 nm using ELISA reader within15 minutes. A dual wavelength is recommendedwith reference filter of 600–650 nm.3ResultsCalculations1.Check Calibrator Factor (CF) value on thecalibrator bottle. This value might vary from lot tolot. Make sure the value is checked on every kit. 2.Calculate cut-off value: Calibrator OD x CalibratorFactor (CF).3.Calculate the Ab (Antibody) Index of eachdetermination by dividing the mean values of each sample by cut-off value.Example of typical results:Calibrator mean OD = 0.8Calibrator Factor (CF) = 0.5Cut-off Value = 0.8 x 0.5 = 0.400Positive control O.D. = 1.2Ab Index = 1.2/0.4 = 3Patient sample O.D. = 1.6Ab Index = 1.6/0.4 = 4.0Note:Lipemic or hemolyzed samples may cause erroneous results.InterpretationThe following is intended as a guide to interpretation of Toxoplasma IgG antibody index (Ab Index) test results; each laboratory is encouraged to establish its own criteria for test interpretation based on sample populations encountered.<0.9 –No detectable IgG antibody to Toxoplasma byELISA0.9–1.1 –Borderline positive. Follow-up testing isrecommend if clinically indicated.>1.1 –Detectable IgG antibody to Toxoplasma by ELISA References1.Wilson, M. et al., Evaluation of six commercial kitsfor detection of human immunoglobulin Mantibodies to Toxoplasma gondii. The FDAToxoplasmosis Ad Hoc Working Group.2.Obwaller, A. et al., An enzyme-linkedimmunosorbent assay with whole trophozoites ofToxoplasma gondii from serum-free tissue culturefor detection of specific antibodies. Parasitol. Res., 1995;81(5):361-4.3.Loyola, A.M. et al., Anti-Toxoplasma gondiiimmunoglobulins A and G in human saliva andserum. J. Oral Pathol. Med., 1997; 26(4):187-91. 4.Doehring, E. et al., Toxoplasma gondii antibodies inpregnant women and their newborns in Dar esSalaam, Tanzania. Am. J. Trop. Med. Hyg., 1995;52(6):546-8.5.Cotty, F. et al., Prenatal diagnosis of congenitaltoxoplasmosis: the role of Toxoplasma IgAantibodies in amniotic fluid [letter]. J. Infect. Dis.,1995;171(5):1384-5.6.Altintas, N. et al., Toxoplasmosis in last four yearsin Agean region,Turkey. J. Egypt. Soc. Parasitol.,1997;27(2):439-43.RGC,CH,MAM 10/14-1©2014 Sigma-Aldrich Co. LLC. All rights reserved. SIGMA-ALDRICH is a trademark of Sigma-Aldrich Co. LLC, registered in the US and other countries. Sigma brand products are sold through Sigma-Aldrich, Inc. Purchaser must determine the suitability of the product(s) for their particular use. Additional terms and conditions may apply. Please see product information on the Sigma-Aldrich website at and/or on the reverse side of the invoice or packing slip.。
酶联免疫吸附试验法检测基础免疫儿童破伤风抗体水平

酶联免疫吸附试验法检测基础免疫儿童破伤风抗体水平罗君;朱路平;李东丽【摘要】目的了解0~7岁基础免疫儿童破伤风 IgG保护性抗体产生情况.方法采用两种定量酶联免疫吸附试验(ELISA)试剂盒分别检测262份0~7岁基础免疫儿童血清破伤风 IgG抗体水平,IgG抗体≥0.1 U/ml为阳性.结果 "安图试剂" IgG 抗体阳性146份,阳性率为55.73%;"MP试剂" IgG抗体阳性154份,阳性率为58.78%,两种试剂盒的检测结果间差异无统计学意义(P>0.05).结论本地区 0~7岁基础免疫儿童血清破伤风 IgG抗体保护率较低,加强人群破伤风类毒素免疫很有必要.【期刊名称】《中国全科医学》【年(卷),期】2012(015)018【总页数】2页(P2118-2119)【关键词】酶联免疫吸附测定;抗体;破伤风【作者】罗君;朱路平;李东丽【作者单位】450000,河南省郑州市,河南省疾控中心;450000,河南省郑州市,河南省疾控中心;450000,河南省郑州市,河南省疾控中心【正文语种】中文【中图分类】R726.331破伤风是由破伤风杆菌 (clostridium tetani)侵入伤口生长繁殖产生毒素而引起的一种急性特异性感染。
破伤风可在任何年龄发病,病死率高。
为了解0~7岁儿童破伤风疫苗全程足量免疫后抗体水平,本研究收集了郑州市262份0~7岁基础免疫儿童血清样品,用国内和国外两种酶联免疫吸附试验 (ELISA)试剂盒进行破伤风IgG抗体定量检测,并且评价破伤风IgG ELISA试剂的检测效率和可靠性。
1 对象与方法1.1 研究对象收集2010年8月—2011年3月郑州大学第三附属医院0~7岁基础免疫儿童血清样本262份,其中男140份,女122份。
检测前所有标本-20℃保存。
1.2 样本采集1.2.1 免疫程序根据我国2005年《预防接种工作规范》中规定[1],百白破疫苗为国家免疫规划中基础免疫疫苗,常规免疫程序为百白破疫苗接种5剂次,前3剂次为基础免疫,第4剂次为加强免疫,第5剂次使用疫苗加强免疫1剂次。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
破伤风杆菌(TETANUS)IgM抗体检测试剂盒(酶联免疫法)
使用说明(96T/48T)
[原理]
本试剂盒采用亲和素-生物素化破伤风纯化抗原预包被板ELISA 原理,检测人血清/血浆中存在的破伤风IgM 抗体,并配以酶标记抗人IgM单克隆抗体作为标记物。
加入底物TMB显色后终止反应,在450nm波长测各孔O.D值,O.D值的大小与待检抗体含量成正比。
生物素系统(biotin-avidin system)的稳固级联放大作用,使试剂的特异性、灵敏度、稳定性极大地提高是本试剂含有的独特优点。
[用途]
本试剂盒用于定性检测人血清/血浆中的破伤风(TETANUS)IgM抗体,用于百白破菌苗接种后的效果监测和新伤口感染的早期诊断。
适应范围:
疫苗接种后效能监测。
早期诊断。
[试剂盒组成]
1、生物素化抗原预包被板1块(8X12/4X12)
2、阴性对照1瓶(直接使用)
3、阳性对照1瓶(直接使用)
4、标本稀释液
1瓶(20/10 ml,直接使用)
5、酶结合物1瓶(12/5ml,直接使用)
6、30X浓缩洗液
1瓶(20/10ml,加蒸馏水1:30稀释使用)
7、显示剂A、B液各1瓶
8、终止液(2M H2SO4)1瓶
9、说明书1份
[操作步骤]
1、将试剂盒平衡至室温后取出反应板拆封。
2、标本稀释:用标本稀释液以1:101(5ul—500ul)稀释标本。
于反应板中加已稀释待检标本及阴阳性对照(100ul)
各一孔,设空白对照一孔(加100ul标本稀释液)轻拍混匀。
37℃温育30分钟。
甩去孔内液体,用洗涤液洗板3次并在吸水纸上拍干。
3、加酶结合物:每孔2滴,混匀后置37℃温育30分钟。
同上法洗涤3次并拍干。
4、显色:每孔加显色剂A、B各一滴,轻拍混匀(或震荡器混匀)后置37℃10分钟。
[结果判断]
1、目测:在白色背景下观察各孔显色情况,蓝色者为阳性,无色者为阴性。
2、酶标仪测定:每孔加终止液一滴,混匀后在450nm下测定各孔O.D值。
①S/N=标本O.D值/ 阴性对照O.D值。
②S/N≥2.1为阳性;
③ 1.5≤S/N<2.1为可疑标本; S/N<1.5为阴性。
④阴性对照(NC)小于0.10时以0.10计, 大于0.1小于0.21时以实际O.D值计算;若大于0.21时,实验
可能出现了较大误差,需重复实验。
⑤阳性对照(PC)值通常≥0.4,实验成立,否则需重做。
[注意事项]
1、微孔板须密封防潮,从冷藏环境中取出时,应置室温平衡至潮气尽干后方可开启使用,余者
封存置2-8℃。
2、滴加试剂前应将液体翻转数次混匀,滴加时保持瓶身垂直。
3、洗涤时每孔均须加满,防止孔内有游离酶不能洗净。
4、试剂置2-8℃存放,不能冻结,有效期10个月。
5、避免用溶血、混浊或脂血标本。
6、最好用新鲜标本,如需保存,可于2-8℃冷藏48小时或-20℃冻存4周(样本应避光)。
