碳碳双键的加成.ppt
合集下载
亲核加成

_ + CH3
NO2
_ + CH3
H H H C C NO2 CH3 NO2
2
碳-碳双键的亲核加成反应
• 亲核试剂对碳-碳双键加成的反应历程: • 反应的第一步是亲核试剂带着一对电子进攻双键 上的一个碳原子,而电子则被集中到另一个双键 碳原子上形成碳负离子,这是慢的一步。第二步 是碳负离子与质子或带正电荷的物质结合形成产 物。
+ E+ C C Nu E C C Nu
3
C C
+ E Nu
• 一些常见得促进亲核加成反应的取代基有: CHO、 COR、COOR、 CN、NO2、 CONH2、SO2R等。 它们通过降低碳-碳双键碳原子上的p电子云密度 来促进亲核试剂的进攻,但更重要的是,这样的 取代基能使生成的碳负离子中间体的负电荷分散 而得到稳定。
C2H5O
-
H O C C C CH3
1)水解 2)加热
O
7
碳-碳三键的亲核加成反应
• 碳-碳三键通常比双键更容易被亲核试剂进攻,而较难被 亲电试剂进攻。这是因为碳-碳三键之间的距离较短,三 键中的电子被束缚的比双键中的紧,所以进攻的亲电试剂 夺取三键中的一个电子较困难。从杂化角度来考虑,三键 碳原子(sp杂化)比双键碳原子(sp2杂化)具有较多的s成分, 因此它与电子的结合力较强,表现出较强的亲电性。
O
NH2NH2
NNH2
NH2NHCONH2
NNCONH2
RSH
• 羰基化合物与醇的反应
• 醛(酮)能与一分子醇加成生成半缩醛(酮)。半缩醛(酮)不稳 定,容易分解成醛(酮)和醇或与另一分子醇进一步缩合, 生成缩醛(酮)。 • 由于缩醛(酮)生成后又可水解成原来的化合物,故可利用 缩醛(酮)生成还保护醛(酮)基。 • 环状缩醛(酮):最常见的是利用羰基化合物和乙二醇反应, 生成二氧戊环化合物,该化合物比烷基缩醛(酮)更加稳定, 可耐大多数碱性及中性的反应条件。
NO2
_ + CH3
H H H C C NO2 CH3 NO2
2
碳-碳双键的亲核加成反应
• 亲核试剂对碳-碳双键加成的反应历程: • 反应的第一步是亲核试剂带着一对电子进攻双键 上的一个碳原子,而电子则被集中到另一个双键 碳原子上形成碳负离子,这是慢的一步。第二步 是碳负离子与质子或带正电荷的物质结合形成产 物。
+ E+ C C Nu E C C Nu
3
C C
+ E Nu
• 一些常见得促进亲核加成反应的取代基有: CHO、 COR、COOR、 CN、NO2、 CONH2、SO2R等。 它们通过降低碳-碳双键碳原子上的p电子云密度 来促进亲核试剂的进攻,但更重要的是,这样的 取代基能使生成的碳负离子中间体的负电荷分散 而得到稳定。
C2H5O
-
H O C C C CH3
1)水解 2)加热
O
7
碳-碳三键的亲核加成反应
• 碳-碳三键通常比双键更容易被亲核试剂进攻,而较难被 亲电试剂进攻。这是因为碳-碳三键之间的距离较短,三 键中的电子被束缚的比双键中的紧,所以进攻的亲电试剂 夺取三键中的一个电子较困难。从杂化角度来考虑,三键 碳原子(sp杂化)比双键碳原子(sp2杂化)具有较多的s成分, 因此它与电子的结合力较强,表现出较强的亲电性。
O
NH2NH2
NNH2
NH2NHCONH2
NNCONH2
RSH
• 羰基化合物与醇的反应
• 醛(酮)能与一分子醇加成生成半缩醛(酮)。半缩醛(酮)不稳 定,容易分解成醛(酮)和醇或与另一分子醇进一步缩合, 生成缩醛(酮)。 • 由于缩醛(酮)生成后又可水解成原来的化合物,故可利用 缩醛(酮)生成还保护醛(酮)基。 • 环状缩醛(酮):最常见的是利用羰基化合物和乙二醇反应, 生成二氧戊环化合物,该化合物比烷基缩醛(酮)更加稳定, 可耐大多数碱性及中性的反应条件。
碳碳双键的加成

Grubbs.R.H.Tetrahetron,1998,54,4413
RCM的研究进展
RCM 早期的发展
WCl6+Me4Sn 低收率
适用含S,Si,P,Sn底物,二烯丙基 成五元环反应 不适用双键二取代和烯丙基位 有取代基底物
W 系催化剂
适用5,6元环的合成
+ PbEt4 缺点:需要高温完成从5
到卡宾中间体的转变, 耐官能团性差
① 环状非共轭烯烃
② 正电荷能够离域在碳骨架的体系
2) 重排产物的生成
2. 翁型离子的机理
C C
Br Br
δ
δ
C C
Br + Br
C Br C
Br Br
C C
反式加成
Br
按翁型离子机理进行反应的事实:
Br Br CH3 C C
SbF5 CH3 SO 60 .C 2
H3C H3C
Br CH3 C C CH3
CH3CH CH2 > CH2 CH2 > BrCH CH2 > CH2 CHCOOH
CH CH2 > CH2 CH2 >
CH CH
芳基的+C效应使正碳离子稳定
CH CH2
H
Ph CH CH3
对称二芳基烯烃,芳基使双键稳定, 使亲电加成反应活性降低。 当吸电子基团与双键上C原子直接相连时,亲电 加成反应活性明显减小。
RCM的研究进展
Schrock 催化剂的应用
氧杂环的合成
适用底物: 烯醇醚和缩醛等
Fu,G.C. J.Am.Chem.Soc.1992,114,5426;Shon,Y.S Tetrahedron Lett.1997,38,1283
RCM的研究进展
RCM 早期的发展
WCl6+Me4Sn 低收率
适用含S,Si,P,Sn底物,二烯丙基 成五元环反应 不适用双键二取代和烯丙基位 有取代基底物
W 系催化剂
适用5,6元环的合成
+ PbEt4 缺点:需要高温完成从5
到卡宾中间体的转变, 耐官能团性差
① 环状非共轭烯烃
② 正电荷能够离域在碳骨架的体系
2) 重排产物的生成
2. 翁型离子的机理
C C
Br Br
δ
δ
C C
Br + Br
C Br C
Br Br
C C
反式加成
Br
按翁型离子机理进行反应的事实:
Br Br CH3 C C
SbF5 CH3 SO 60 .C 2
H3C H3C
Br CH3 C C CH3
CH3CH CH2 > CH2 CH2 > BrCH CH2 > CH2 CHCOOH
CH CH2 > CH2 CH2 >
CH CH
芳基的+C效应使正碳离子稳定
CH CH2
H
Ph CH CH3
对称二芳基烯烃,芳基使双键稳定, 使亲电加成反应活性降低。 当吸电子基团与双键上C原子直接相连时,亲电 加成反应活性明显减小。
RCM的研究进展
Schrock 催化剂的应用
氧杂环的合成
适用底物: 烯醇醚和缩醛等
Fu,G.C. J.Am.Chem.Soc.1992,114,5426;Shon,Y.S Tetrahedron Lett.1997,38,1283
形成碳碳双键的反应

磷内翁盐与醛或酮的反应即Wittig 反应是按下述过程进行的:
Wittig反应的难易程度取决于反应物内翁盐及醛 或酮的结构。 对于稳定的磷内翁盐,由于R1和R2为拉电子基, 内翁盐α-碳上的负电荷因分散而降低了亲核活性, 在一般情况下不利于Wittig反应的进行。 在不稳定的内翁盐中,R1和R2为推电子基,因而 可以增强内翁盐α-碳上的负电荷而使亲核活性增 加,使之与醛酮的反应容易进行。对于羰基化合 物来说,R3和R4如果是推电子基,羰基碳上的电 子云密度相对增高,不利于内翁盐对羰基进行亲 核反应;R3或R4为拉电子基时,可降低羰基碳上 的电子云密度,因而容易接受亲核试剂的进攻, 有利于反应的进行。一般情况下,醛的反应活性 比酮高,有时脂也能进行Wittig反应,但活性较 酮低。利用羰基不同的活性,可进行选择性的羰 基烯化反应。
Wittig反应所得烯烃可能存在Z、E两种立体异构 体。决定产物中两种异构体比例的因素很多,通 过选择适当的磷内翁盐及改变反应条件(如温度、 溶剂性质、有无盐存在等),可获得一定构型的 产物。一般规律是:较稳定的活性低的磷内翁盐, 生成以E型烯烃为主的产物,但在质子溶剂或含 盐的非极性溶剂中进行反应,可增加产物中Z型 烯烃的比例;而不稳定的活性较高的磷内翁盐立 体选择性较差,一般情况下生成E、Z两种异构体 的混合物。若选用非极性溶剂,可高选择性的生 成Z型产物,而在含盐的非极性溶剂中,E型烯烃 的比例增加。例如:
例如,在丙酮的缩合中,将固体催化剂氢 氧化钡加入Soxhlet抽提器内,反应器中的 丙酮不断回流,在提取器内与催化剂接触 发生缩合反应,然后溢流到反应器内,产 物二丙酮醇脱离催化剂,从而避免了可逆 反应的发生。二丙酮醇经碘或磷酸催化脱 水,可得71%产率的异丙叉丙酮。
碳碳双键发生的化学反应

碳碳双键发生的化学反应
碳碳双键是由两个碳原子共享四个电子而形成的共轭键。
它们可以参与许多化学反应,下面是一些常见的碳碳双键反应:
1. 加成反应:在加成反应中,一个或多个试剂添加到碳碳双键上,形成新的化学键。
例如,在氢化反应中,氢气(H2)可以加成到碳碳双键上,生成饱和的碳碳单键。
2. 消除反应:消除反应是碳碳双键断裂的反应,通常伴随着新的化学键的形成。
一个常见的消除反应是脱水反应,在这个反应中,碳碳双键上的一个碳原子失去一个水分子(H2O),形成一个新的双键。
3. 氧化反应:碳碳双键可以被氧化剂氧化,形成含有更多氧原子的化合物。
例如,碳碳双键可以被酸性高锰酸钾(KMnO4)氧化为羧酸。
4. 还原反应:碳碳双键可以被还原剂还原,减少为含有更少氧原子的化合物。
一个常见的还原反应是烷基化反应,其中碳碳双键上的一个碳原子被氢原子取代。
这只是碳碳双键可以发生的一些典型化学反应的例子,实际上有许多不同类型的反应都可以涉及到碳碳双键。
具体的反应类型和机理取决于反应条件和试剂的选择。
碳碳双键的加成反应ppt课件

亲核取代
CHO
CH3
O
CH3CH2CCH=CH2 (CH3)3CO-
O CH2CHO
Michael加成
CH3 CH2 C CH2
O CH3
OH-
CH3
Robinson反应
O 36
课外作业
• P78: 5, • 6, (1) (2) (6) •7
37
H+ (CH3)2C CH(CH3)2 重排
OH
①Hg(OAc)2, H2O
② NaBH4, OH-
(CH3)3CCHCH3 OH 94%
20
4.2.5 硼氢化反应
顺式的反马氏加成(形式与结果),事实上是马氏
加成。
δ +δ CC
+
δ-δ+ H BH2
H
H BH2
CC H
π-络合物
H BH2 CC
H BH2 CC
价碳原子,它是一种亲电试剂,与烯烃反应得环丙烷
衍生物,分为单线态和三线态。
23
H
C H
p轨道 sp2杂化轨道
sp2杂化 单线态卡宾
pp轨轨道道
H
C
H
三线态卡宾
(双自由基形式)
sp杂化
24
单线态与烯烃加成时的立体化学为顺式加成(立体
专一性反应)。
Et
H
C=C
+ CCl2
H
Et
反式
Cl Cl
C
Et
H
8
OH
H2/PtO2 AcOH
O
COOEt
H2/PtO2 CH3OH
4.2 亲电加成反应
H COOEt
H
第四章碳氧双键的加成反应2
OH 90%
CH3
C6H5 1%
+ CH3CH=CH-C-C6H5 CH3CH-CH-CO-CH3
OH <1%
C6H5 37%
b)亲核试剂:
O C6H5-CH=CH-C-C6H5
OH
O
+ C6H5-CH=CH-C-(C6H5)2 C6H5-CH-CH2-C-C6H5
1,2加成
C6H5 1,4加成
C6H5MgBr
2.历程:
Wittig 反应经由两个阶段,(1)Wittig 试剂对羰基进行亲核
加成,(2)中间产物受热消除Ph3PO,生成烯烃。
如:
+
+ R1R2C O
Ph3P
-
CHR
R1 R2
C
CHR +
Ph3PO
R1 O
C R2 HC
P+Ph3
R
R1 O C
R2 HC R
PPh3
O
+-
加成
+ Ph3P CHR
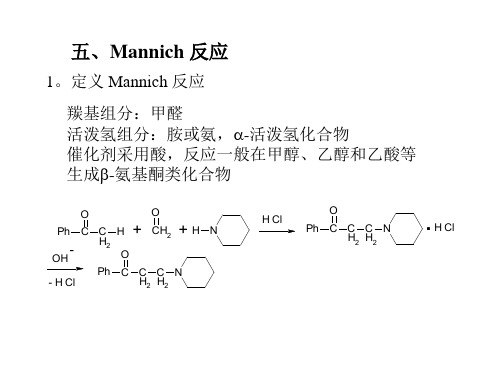
1.羟醛缩合是醛酮自身作为活泼氢组分。 2.Knoevenagel反应是以活泼亚甲基化合物为活泼氢组分 3.Stobbe 反应以丁二酸酯为活泼氢组分 4.Darzens缩合以-卤代酸酯为活泼氢组分 5.Mannich反应是但对羰基的亲核进攻,羰基为醛 6.Micheal 反应是,-不饱和羰基化合物为羰基组分,碳 负离子对它的亲核进攻(加成)
H2 H2
CH2 + HN.R2'
H Cl
水解
O
R
C
C H2
C H2
CH2COOH
所以,Mannich反应可以生成比原来酮多一个碳的,- 不 饱和酮,生成氨基醇,生成酮酸。
碳氧双键的加成反应

为Perkin(浦尔金)反应
反应一般式如下:
OO
ArCHO + RCH2COCCH2R RCH2COO
H COOH C C + RCH2COOH
Ar R
反应机理:
-B RCH2COCCH2R
OO
ArCHO
OO
RCH2COCCHR
RCH2COCCHCHAr
OR
13
Ar
H2CR O CH
C
CHR
O OC
反应机理如下:
8
半缩醛或半缩酮继续与一分子醇反应形成缩醛或缩酮
9
3、羟醛缩合反应 含有α氢的羰基化合物在酸或碱的催化作用下,
缩合形成β-羟基醛或β-羟基酮的反应称为羟醛缩合 反应
H
O C CH2 H
CH3CH O
O C CH2 H
OO CH3CHCH2CH3
H2O
OH
H2C
C H
CH
22
OH
H2C
C H
CH
+ Cl
OH
ClH2C
C H
CH
O H2 ClH2C C CH
一般只进行1,4-亲电加成反应,因为其产物具有不稳定的烯醇 结构,经重排得到稳定的酮式结构,而1,2-加成产物不稳定
一般情况下,α, β-不饱和羰基化合物在进行1,4-亲电加成时, 正性基团加到α-碳原子上,负性基团加到β-碳原子上 例如:
1、羧酸衍生物与亲核试剂的加成反应
反应机理如下:
R CO
L
H
Nu
Nu H
RCO
L
Nu RCO HL
Nu C O + HL
R
18
反应活性:
反应一般式如下:
OO
ArCHO + RCH2COCCH2R RCH2COO
H COOH C C + RCH2COOH
Ar R
反应机理:
-B RCH2COCCH2R
OO
ArCHO
OO
RCH2COCCHR
RCH2COCCHCHAr
OR
13
Ar
H2CR O CH
C
CHR
O OC
反应机理如下:
8
半缩醛或半缩酮继续与一分子醇反应形成缩醛或缩酮
9
3、羟醛缩合反应 含有α氢的羰基化合物在酸或碱的催化作用下,
缩合形成β-羟基醛或β-羟基酮的反应称为羟醛缩合 反应
H
O C CH2 H
CH3CH O
O C CH2 H
OO CH3CHCH2CH3
H2O
OH
H2C
C H
CH
22
OH
H2C
C H
CH
+ Cl
OH
ClH2C
C H
CH
O H2 ClH2C C CH
一般只进行1,4-亲电加成反应,因为其产物具有不稳定的烯醇 结构,经重排得到稳定的酮式结构,而1,2-加成产物不稳定
一般情况下,α, β-不饱和羰基化合物在进行1,4-亲电加成时, 正性基团加到α-碳原子上,负性基团加到β-碳原子上 例如:
1、羧酸衍生物与亲核试剂的加成反应
反应机理如下:
R CO
L
H
Nu
Nu H
RCO
L
Nu RCO HL
Nu C O + HL
R
18
反应活性:
第四章 加成反应

②
4.2.3. 亲核加成反应的实例 1. Wittig 反应
Wittig 试剂与羰基发生亲核加成反应,生成烯烃:
C O
Ph3P C
R R'
R C C R'
2. 羟醛缩合
CH3CHO + CH3CHO
OH
O CH3CHCH2C H OH
3. Claisen 酯缩合反应及相关反应
两个酯分子至少有一个酯分子是含有α-氢,在 强碱的作用下,相互缩合成β-羰基酯。
例如溴与烯烃的加成反应。烯烃与溴首先生成π络合物, 然后Br+对π键进行亲电加成生成三元环状正离子中间体-溴 鎓离子,最后Br-从体积较大的溴鎓离子反面进攻原双键碳 原子之一,生成1,2-二溴化物。
H CH3 Br2 H CH3 Br Br- H CH3 H Br CH3 Br Br H CH3 H CH3 H CH3 H CH3 H Br H Br CH3 -Br- Br CH3
典型代表:Cl2、Br2、I2、HOCl、HOBr等与烯烃的亲 电加成反应。
2、三分子亲电加成
Y
2E
E
Y
C C
+ Y
Y+ C C Y
C C E
E
E
一般来说,烯烃与卤化氢的加成,若生成比较不稳定的 正碳离子时,则倾向于按AdE3历程进行,加成的立体化学 特征是反式加成。
4.1.2 亲电加成反应立体化学
Nu E 顺和反异构体
(1)正碳离子历程
a、若生成的正碳离子中间体的正电荷能够在碳骨架中发生 离域,则有利于按正碳离子历程进行; 典型代表:卤化氢、溴和氯与双键碳原子上连有苯基的烯烃 所进行的加成反应。
解释3,3-二甲基-1-丁烯与卤化氢的加成得到2,3-二甲基2-卤丁烷的历程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
炔烃的亲电加成
CH3 C C CH3 HCl 反式加成
H3C C
Cl C
H
CH3
HOOC C C COOH Br2
HOOC
Br
Br
Br
CC
Br
COOH
CC
HOOC
COOH
70%
30%
C2H5 C
Br
C C2H5 H5C2 C Br
Br2 CH3COOH
Br
CC
H5C2
C2H5
Br
C C2H5 ( )
二. 亲电加成反应活性 (Reactivity)( )
1. 底物 2. 试剂 ( )
3. 溶剂 ( ) (三).亲电加成反应的定向 (Orientation) ( )
区域选择性 (Regioselective) (五). 共轭二烯烃的亲电加成 ( )
二. 亲核加成反应
1. 碳碳双键的加成 ( ) 氰乙基化反应 Micheal reaction ( )
烯烃的复分解 Olefin Metathsis
2005 Nobel Prize
实现了C=C 增
长的普遍适用
的方法—烯烃
复分解反应
R
R'
第二步:
E
C C + Nu
E
Nu
CC
反应特点:
1) 产物是大约定量的顺反异构体:
CH3 CH3
+
H2O
H+
CH3
H CH3
E
CC
Nu
H2O
OH HCCHH33 +
COHH3 HCH3
Ph H
H CH3 Cl
H
+ DCl CH3
D Ph H
H Cl
CH3
D
+
H CH3 Ph D
H
Ph H
Cl
按正碳离子机理进行反应的底物结构是: ① 环状非共轭烯烃 ② 正电荷能够离域在碳骨架的体系 2) 重排产物的生成
第六章 碳碳重键的加成反应 (Addition to Carbon - Carbon Multiple Bonds)
试剂进攻碳碳重键的途径 ( )
一. 亲电加成反应 ( )
(一). 亲电加成反应 (Electrophilic Addition) 1. 正碳离子机理 ( ) 2. 翁型离子机理 ( ) 3. 三分子加成机理 ( ) 4. 炔烃的亲电加成 ( )
2) 亲电试剂的进攻原子是第二周期以上的元素。
ArSCl
SAr Cl
SAr
Cl
3. 三分子亲电加成机理
亲电试剂为H-X
2E Nu + C C
E Nu CC E Nu
E CC Nu
H Cl
H
CH3
CC
H3C H Cl CH3
HH H3C C C CH3
Cl CH3
常见的亲电试剂:Cl2,Br2,ICl,IBr, HOCl, RSCl,卡宾 ,
• 有机铜试剂与炔烃进行顺式加成,得到的负中心烯基铜, 直接与各种亲电试剂反应。
R'Cu,MgX2
R
H
E, MgX2
R CH
R'
Cu
R
H
R'
E
R2CuLi H CH
H
H
2 E,
R 2 CuLi
2H
H
R
E
卡宾和氮烯对C=C的加成
• Carbene 卡宾
• 制备:a-消除、重氮化合物分解、乙烯酮光 分解
2. 翁型离子的机理
C
δ
δ
C
C
Br Br
Br + Br C
Br
C
C
Br
Br C
C Br
反式加成
按翁型离子机理进行反应的事实:
CH3
Br Br
C
C
CH3
3
H3C Br CC
H3C
CH3 CH3
按翁型离子机理进行反应的体系结构特点:
1) 底物是简单的烯烃或非共轭链的烯烃, 即C + 不稳定的体系;
二. 亲电加成反应的活性
底物
a. 双键上的电子云密度越大,越利于亲电试剂 的进攻。
CH3 2C C CH3 2 > CH3 2C CHCH3 > CH3 2C CH2
CH3CH CH2 > CH2 CH2 > BrCH CH2 > CH2 CHCOOH
CH CH2 > CH2 CH2 >
CH CH
H
H3C
H
H
CH3
氮烯 Nitrene
• a-消除 • 叠氮化合物的分解 • 氧化还原反应
N3CO2Et
O R N O S Ar
HO
NCO2Et R-N
Ph3P
NO2
N
NCO2Et
与其他亲电试剂的加成
NOCl
NO Cl
OH N
Cl
HCl, H2O
O Cl
PhSeOAc
SePh OAc H2O2
OAc
RCO, B2H6.
X-N3, X=Br, I Cl-NO
PhSe-X, X=Br, OH
Br
H3C
H
H3C
H
CC
H
CH3
CH3 H
H CH3
HOAc HAc
Br2
Br
H
CH3
H Br CH3
Br
H
CH3
H Br CH3
H
CH3 Br2
H Ph
H Br Ph
Br
H3C
H
H Ph Br
Ph CH CH
CHCl3
KOH
CCl2
Hv, CH2N2
CH2 + N2
2HC C O
CH2 + CO
• 结构: 单线态和三线态 • 液相得到的主要是单线态 • 在惰性溶剂或气相中直接得到的是三线态
CCl2
CCl2
H
H
CCl2
H
H
H3C
CH3
H3C
CH3
H H3C
H
CCl2
CH3
H H3C
H
H
CH3
CH3
H3C
2. 碳碳叁健的加成 ( )
碳碳重键的加成
π电子易于极化, 利于亲电试剂的进攻, 容易发生亲电加成反 应。
CC
Y
叁键可以发生 亲电加成反应, 但更易发生亲 核加成反应。
一. 亲电加成反应
反应机理:
1. 正碳离子机理
E Nu
E+ Nu-
第一步:
试剂
亲电部分E+ 亲核部分Nu-
E
CC
E Nu
C C + Nu
芳基的+C效应使正碳离子稳定
CH CH2 H Ph CH CH3
对称二芳基烯烃,芳基使双键稳定, 使亲电加成反应活性降低。
当吸电子基团与双键上C原子直接相连时,亲电 加成反应活性明显减小。
试剂:与HX的酸性顺序一致, 给出质子能力越大, 亲电性越强。
HI > HBr > HCl > HF
同理: ICl > IBr > I2
C C C C Nu E
CC C C E Nu
C C CC
E
Nu
Ph CH CH CH CH2 H
Ph CH CH CH CH3 Ph CH2 CH CH CH2
Ph CH CH CH CH3 Cl
Ph CH2 CH CH CH2 Cl
重排反应
H2O H
CH3
CH3
OH2 HO
CH3
H HO
Normant 反应
溶剂:
溶剂极性越强,①利于E-Nu的异裂;
三. 亲②电利加于成C+、反翁应型的离定子的向生成。静态哪:个C原子上电
子云密度较大;
R CH CH2 E
R CH CH2 动态:
E
哪个C+稳定。
R CH CH2 空间效应 E
共轭二烯烃的亲电加成反应
C C C C E Nu
X2 Cl2, Br2 X CCC C
