第八章醇酚醚
合集下载
有机化学8醇酚醚

邻羟基苯甲酸 (水杨酸)
邻苯二酚 2,4,6-三硝基苯酚 (儿茶酚) (苦味酸)
NO2
有机化学实用基础
OH CH3
OH OH
OH
OH
邻甲基苯酚 邻苯二酚
对苯二酚
OH OCH3
4-烯丙基-2-甲氧基苯酚
CH2CH
CH2
8.2.2
酚物理性质
大多酚在室温下为结晶性固体,少数取代的酚为
液体。沸点比分子量相当的烃类高得多。
C H C H3
+
C H3 C H3 C
+
2° 碳正离子
C H C H3 H
Br
3° 碳正离子
Br
C H3 C H3 C H C H C H3 Br
C H3 C H3 C Br C H2 C H3
有机化学实用基础
新戊醇这一伯醇与HCl的作用却是按SN1历程进行的, 且几乎都是重排产物。
C H3 C H3 C C H3 C H2 O H
CH3CH2CH2CH2OH + SOCl2
醇与PX3作用生成卤代烃的反应,通常是按SN2历程进 行的。由于反应中并不生成碳正离子中间体,故一般不 发生重排。反应的立体化学特征:构型反转。
有机化学实用基础
3. 与含氧酸的反应 醇可与H2SO4、HNO3、H3PO4等无机含氧酸发生分子 间脱水,生成无机酸酯。
H
1.与碱金属反应
C2H5OH
+
Na
C2H5ONa
+
1 H 2 2 1H + 12 2
3 (CH3)2CHOH + Al
(CH3)2CHO 3Al
ROH的反应活性1°>2°>3°
08第八章醇酚醚-chy
1.2.1.2 氢键对溶解度的影响
O H H
R OH
相似
★ C3 以下无限溶解
R O H R O H R O H
形成氢键
n – 丁醇 n – 戊醇
8g / 100g 水 2g / 100g 水
∵ 随烷基的增大, 占的比例小
相似相溶原理
1.3 醇的反应 极性键的断裂
H R C H O H
酸性、酯化
78.5 ℃
-44.5 ℃ 256 ℃
十三烷
184
235.4 ℃
1. 醇比烷 bp 高的多
2. 随 M 的增大,Δbp → 0
bp
ROH RH
C 原子数
bp
CH3CH2CH2CH2OH
CH3 CH3 CH3 CH3 CH CH2 CH3 C CH3
C2H5OH CH2 OH CH2 OH CH2 OH CH CH2 OH OH
H H C OH OH
H 4 IO
HCOH + H O + NH3 + H COOH + CO2 2
断开的地方加羟基
H HO C NH2 OH
∵
HO C O
OH
脱H2O
HC O H + H2O
HC O + NH3 OH
CO2 + H2O
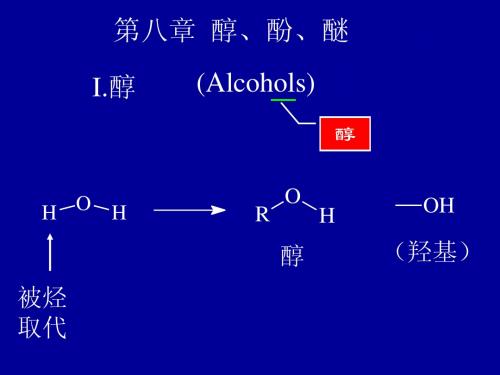
II. 酚 (Phenols)
OH
CH2OH
酚
醇
1 结构、命名(书中例子 p141) 、性质 1 命名:
CH3 CH3-C-CH2+OH2 CH3
-H2O
CH3 CH3-C +CH2 ( 。 +) 1 C CH3
CH3 CH3-C +CH2 CH3 。 1 C+
有机化学-第八章 醇酚醚考点

1,2-丙二醇
OH OH CH3 CH3 CH CH CH CH3
4-甲基-2,3-戊二醇
二、醇的物理性质
醇的沸点高于分子量接近的烷烃,因为:(1)醇的极性大于烷烃; (2)醇可形成分子间氢键。
CH3
δ+ δ-O
δ+
H
H
氢键
CH3
CH3
O
δ- H
O
O
H
H
O
CH3
氢键
氢键 CH3
醇分子间形成氢键示意图
2、酚与三氯化铁的反应(酚的鉴定)
OH
6
+ FeCl3
3-
O
Fe 6
紫色
多数酚可以与三氯化铁溶液作用生成有色物质,其颜色随酚结 构的不同而不同。
三氯化铁溶液可作为具有烯醇式结构化合物的定性鉴定试剂。
3、苯酚的取代反应
C–O键加强,–OH难取代
苯环被活化,邻对位易亲电取代
(苯环亲电取代反应无需催化剂)
CH3
+ C H 3 C OH
CH3
CH3
CH3
+ + C+
X-
H2O
CH3
CH3
CH3 C XCl CH3
决定亲核取代反应速度快慢的因素:
(1)X- 的亲核能力:I- > Br - > Cl所以反应活性:HI- > HBr - > HCl-
HI可以直接与醇反应, HBr需要在硫酸催化下发生反应,HCl 则在 无水ZnCl2的作用下发生反应。
发生酯化反应时,酸脱-OH,醇脱 – H。
CH3 O-H + HO-SO2OH
H2C OH
HC OH + HO-NO2
OH OH CH3 CH3 CH CH CH CH3
4-甲基-2,3-戊二醇
二、醇的物理性质
醇的沸点高于分子量接近的烷烃,因为:(1)醇的极性大于烷烃; (2)醇可形成分子间氢键。
CH3
δ+ δ-O
δ+
H
H
氢键
CH3
CH3
O
δ- H
O
O
H
H
O
CH3
氢键
氢键 CH3
醇分子间形成氢键示意图
2、酚与三氯化铁的反应(酚的鉴定)
OH
6
+ FeCl3
3-
O
Fe 6
紫色
多数酚可以与三氯化铁溶液作用生成有色物质,其颜色随酚结 构的不同而不同。
三氯化铁溶液可作为具有烯醇式结构化合物的定性鉴定试剂。
3、苯酚的取代反应
C–O键加强,–OH难取代
苯环被活化,邻对位易亲电取代
(苯环亲电取代反应无需催化剂)
CH3
+ C H 3 C OH
CH3
CH3
CH3
+ + C+
X-
H2O
CH3
CH3
CH3 C XCl CH3
决定亲核取代反应速度快慢的因素:
(1)X- 的亲核能力:I- > Br - > Cl所以反应活性:HI- > HBr - > HCl-
HI可以直接与醇反应, HBr需要在硫酸催化下发生反应,HCl 则在 无水ZnCl2的作用下发生反应。
发生酯化反应时,酸脱-OH,醇脱 – H。
CH3 O-H + HO-SO2OH
H2C OH
HC OH + HO-NO2
第八章醇酚醚

CH3
CH3
CH3
CH3
C CH2OH + HBr
CH3 C CH2Br + CH3 C CH2CH3
CH3
廊坊师范学院化学与材C料H科3学学院-有机教重研室排产B物r (主要产物)
3.脱水反应(碳氧键的断裂C-O)
(1)分子内脱水
β
CH2
H
α
CH2
OH
浓H2SO4 170℃
CH2 CH2 + H2O
2.沸点: 1)比相应的烷烃的沸点高(形成分子间氢键的原因), 如
乙烷的沸点为-88.6℃,而乙醇的沸点为78.3℃。 2) 比分子量相近的烷烃的沸点高,如乙烷(分子量为30)的沸
点为-88.6℃,甲醇(分子量32)的沸点为64.9℃。 3)含支链的醇比直链醇的沸点低,如正丁醇(117.3)、仲
丁醇(99.5)、叔丁醇(88.2)。
CH=CHCH 2OH
3-苯基-2-丙烯醇(肉桂醇)
廊坊师范学院化学与材料科学学院-有机教研室
多元醇的命名,要选择含-OH尽可能多的碳链为 主链,羟基的位次要标明。例如:
CH2-CH2-CH2
OH
OH
1,3 丙二醇
CH3
OH OH 顺 1 甲基 1,2 环己二醇
有特定构型的醇需要用R/S标记它们的构型,如:
异戊醇
CH3 CH3 C CH2OH
CH3 新戊醇 廊坊师范学院化学与材料科学学院-有机教研室
CH2OH Cl
邻氯苯甲醇
CH3 CH3 CH CH2OH
异丁醇
CH3 CH3 C OH
CH3
叔丁醇
OH 环己醇
CH2OH 苄醇
CH2=CHCH2OH
8章-醇酚醚

H2O + Na C2H5OH + Na
反应随R基团的增大而减慢
NaOH + 1/2 H2 C2H5ONa + 1/2 H2
HOH > CH3OH >1o醇 > 2o 醇 > 3o醇
2. 与氢卤酸的反应,断裂醇分子中的 C-OH 键
R-OH
A 活性
HX
RX + H2O
HI > HBr > HCl 这主要是依卤原子的原子半径所致,I 是最大,依次减小,
第八章 醇、 酚、 醚
1
醇 酚 醚可看成是水分子中的 H 被烷基,芳基取代的产物
如下图所示
R H O H Ar 2R
ROH ArOH ROR
醇 酚 醚
8.1
醇
醇的代表物,醇的分类及命名
醇的制备
醇的物理性质 醇的化学性质
硫醇(十二章部分内容)
3
一. 醇的代表物,分类及命名
CH3CH2OH
乙醇
CH3OH
OH OH OH
+ HO NO2 - 3 H2O HC H2C
H2SO4
三硝酸甘油酯是一种炸药,也是人药,治疗心肌病 从上面的例子中可以看出,醇出H,酸出OH。
例 2 烷基磷酸酯
HO ROH + HO P HO RO O HO P HO RO O + RO P HO RO O + RO P RO O
因此,实验室不能用氯化钙干燥醇类化合物。
四. 醇的化学性质
由于电负性的不同,如 O: 3.5; C: 2.5; H: 2.1
因而,在醇分子中,C-O 和 O-H 两种键均有极性,可发 生两种反应形式
第八章醇酚醚

己酮)氧化成酮,丙酮被还原成异丙醇,这一反应称为欧芬脑尔 (Oppenauer,R.V)氧化法,其逆反应称为麦尔外因-彭道夫(MeerweinPonndorf)还原。
O R2CHOH + CH3CCH3
Al(OCMe3)3 欧芬脑尔氧化法
麦尔外因-彭道夫还原
OH R2CH=O + CH3CHCH3
反应方向的控制
减压蒸餾
-H2SO4
CH3OSO2OCH3 硫酸二甲酯
C2H5OH NaOH
甲基化反应
C2H5OCH3 + CH3OSO3Na + H2O
2oROH , 3oROH在硫酸作用下消除。
五 氧化反应
ROH
氧化剂 反应条件
产物
氧化剂
氧化剂
RCH2OH
RCHO
RCOOH
O
氧化剂
R2CHOH
RC R
O
H+
氧化剂
反应机理
C OH C OH
OH
CO
OH
C O I O-
O
OH
HO HO
I
OH O-
O
-2H2O
I = +7
-H2O
C=O + C=O + IO3-
I = +5
邻二醇被高碘酸氧化的分析
OH OH
OH
OH OH
OH
OH OH
?
OH
(CH3)3C
OH
OH
OH
-羟基酸、 -二酮、 -氨基酮、1-氨基2-羟基化合物也能发生类似的反应。
100%
Br
3oROH 、大多数2oROH和空阻大 的 1oROH按SN1机理进行反应。
O R2CHOH + CH3CCH3
Al(OCMe3)3 欧芬脑尔氧化法
麦尔外因-彭道夫还原
OH R2CH=O + CH3CHCH3
反应方向的控制
减压蒸餾
-H2SO4
CH3OSO2OCH3 硫酸二甲酯
C2H5OH NaOH
甲基化反应
C2H5OCH3 + CH3OSO3Na + H2O
2oROH , 3oROH在硫酸作用下消除。
五 氧化反应
ROH
氧化剂 反应条件
产物
氧化剂
氧化剂
RCH2OH
RCHO
RCOOH
O
氧化剂
R2CHOH
RC R
O
H+
氧化剂
反应机理
C OH C OH
OH
CO
OH
C O I O-
O
OH
HO HO
I
OH O-
O
-2H2O
I = +7
-H2O
C=O + C=O + IO3-
I = +5
邻二醇被高碘酸氧化的分析
OH OH
OH
OH OH
OH
OH OH
?
OH
(CH3)3C
OH
OH
OH
-羟基酸、 -二酮、 -氨基酮、1-氨基2-羟基化合物也能发生类似的反应。
100%
Br
3oROH 、大多数2oROH和空阻大 的 1oROH按SN1机理进行反应。
【课件】第八章醇酚醚10-11学年1PPT

酸性序: H2O > R-OH > HC≡CH > NH3 > R-H 碱性序:OH- < RO- < HC≡C- < NH2- < R-
Li、K等碱金属和Mg、Ca、Ba等碱土金属也能和 C1 ~ C8的醇类反应,生成相应的醇的金属化合物
问题:比较CH3CH2CH2OH、
(CH3)2CHOH及(CH3)3COH与 Na反应的活性以及相应醇钠的 碱性大小
问题:氯化钙能用作干燥剂,是因为它能与水形成 CaCl2 ·6H2O。能否用氯化钙来干燥醇类?
某些醇具有特殊的
香味,多用来配制 香精。如苯乙醇具 有玫瑰香气
8.1.4 醇的化学性质
氧化反应
H CC H
形成氢键 形成金羊盐
酸性(被金属取代)
O
H
取代反应 脱水反应
1. 与活泼金属反应——似水
H—O-H + Na ——> Na OH + H2 (反应激烈) R—O-H + Na ——> RO Na + H2 (反应和缓)
2、由于醇分子与水分子之间能形成氢键,三个碳的醇和叔丁醇 能与水混溶。
从丁醇开始,在水中的溶解度随相对分子量的增加而减小。
R
O HH O
H
R
O HH O
H
R
O HH O
H
醇与水之间形成的氢键
3、醇合物 醇与水的另一相似之处:能形成象水合物那 样的醇合物,称为结晶醇。如:
MgCl2 ·6CH3OH
CaCl2 ·4CH3OH
或: Al2O3,250 ℃
+ H2O
Lewis酸如Al2O3,也能催化醇的脱水反应。
醇的脱水是质子化的醇作为脱水物的单分子消除反应(E1)。
Li、K等碱金属和Mg、Ca、Ba等碱土金属也能和 C1 ~ C8的醇类反应,生成相应的醇的金属化合物
问题:比较CH3CH2CH2OH、
(CH3)2CHOH及(CH3)3COH与 Na反应的活性以及相应醇钠的 碱性大小
问题:氯化钙能用作干燥剂,是因为它能与水形成 CaCl2 ·6H2O。能否用氯化钙来干燥醇类?
某些醇具有特殊的
香味,多用来配制 香精。如苯乙醇具 有玫瑰香气
8.1.4 醇的化学性质
氧化反应
H CC H
形成氢键 形成金羊盐
酸性(被金属取代)
O
H
取代反应 脱水反应
1. 与活泼金属反应——似水
H—O-H + Na ——> Na OH + H2 (反应激烈) R—O-H + Na ——> RO Na + H2 (反应和缓)
2、由于醇分子与水分子之间能形成氢键,三个碳的醇和叔丁醇 能与水混溶。
从丁醇开始,在水中的溶解度随相对分子量的增加而减小。
R
O HH O
H
R
O HH O
H
R
O HH O
H
醇与水之间形成的氢键
3、醇合物 醇与水的另一相似之处:能形成象水合物那 样的醇合物,称为结晶醇。如:
MgCl2 ·6CH3OH
CaCl2 ·4CH3OH
或: Al2O3,250 ℃
+ H2O
Lewis酸如Al2O3,也能催化醇的脱水反应。
醇的脱水是质子化的醇作为脱水物的单分子消除反应(E1)。
高教版 有机化学 第八章 醇 酚 醚

C2H5ONa+H2
(C 2H 5O)2Mg+H 2
6CH 3CHCH 3 + 2 Al OH
[HgCl2或 AlCl3]
[(CH 3)2CHO] 3Al + 3 H 2 异丙 醇 铝
7
说明 R—OH H—OH 1)醇与金属反应比水与金属反应缓和一些。 2)醇(如甲醇的pKa=16) 的酸性比水的酸性 (pKa=15.4)稍弱,故醇不能使石蕊变红。和氢氧化钠 的作用也很难,是一个可逆反应。
OH OH Ph C C CH3 Ph CH3 Ph CH3 C C Ph CH3
+ H3O
Ph CH3 C C
O
Ph CH3
+ H3O O
25
O + H3O OH OH
Ph Ph OH OH + H 3O
O Ph Ph
26
5 欧芬脑尔(Oppenauer, R.V.)氧化
OH CH R1 R2 Al[OC(CH3)3]3 CH3COCH3 R1 O C OH
36
酚的命名
OH OH OH
Me CH3
间甲酚
CH3
C(CH3)3
对甲酚
3-甲基-4-叔丁基苯酚
O2N HO
OH
Cl H3CO
OH
HO
CO2H 对羟基苯甲酸
4-硝基间苯二酚 or 4-硝基-1,3-苯二酚
6-甲氧基-7-氯-2-萘酚 or 6-甲氧基-7-氯--萘酚
or 4-羟基苯甲酸
37
二、酚的物理性质
13
3)、与SOCl2、PCl3、PBr3、PCl5的反应
SOCl2
RCl + SO2 + HCl RX + H3PO3 (Br2 / P, I2 / P) RCl + POCl3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
NaCl + H2 NaOH + H2 RONa + H2
反应猛烈 反应剧烈 反应缓和
弱酸的电离平衡:
H2O + H2O
H3O+ + OH-
Hale Waihona Puke ROH + H2O
H3O+ + OR-
任何能使负离子稳定的因素,都有利于弱
酸的电离,达平衡时[H3O+]↑→ 酸性↑,其影 响因素包括电子效应和溶剂化效应。
烷基上所连的基团-I效应↑ 数目↑
醇的主要特性 醇主要在四个部位发生反应:氧-氢键断裂, 氢原子被取代的反应;碳-氧键断裂,羟基被 取代的反应;α-位C-H键断裂的氧化反应以及 β位C-H键断裂的消除反应。 氧-氢键断裂的反应,如与金属钠的反应,其 反应活性次序为:伯醇>仲醇>叔醇。这是因为 烷基的+I效应增加氧原子上的电子云密度,而 且烷基体积越大,相应的RO-溶剂化程度越弱, 从而使得酸性减弱。 醇可发生两种形式的脱水反应,分子内脱水 生成烯烃,分子间脱水生成醚。
与—OH间的距离↓
RO-负电荷 分散程度↑
③不饱和醇
CH3
OH 2-环己烯醇
OH
3-甲基环己醇
CH3C CHCH2CHCH3
CH3
OH
④芳香醇
5-甲基-4-己烯-2-醇 CH2OH 苯甲醇
(1R,2Z)-1-苯基-2-丁烯-1-醇 ⑤多元醇
C6H5 H OH H C C CH3
H
CH3CHOH
CH2OH
CH3CH2CH2CHCHCH2OH CH2 CH CH2
OH
OH
OH
3-丙基-1,2,4-戊三醇 2-羟甲基-1,3-丙二醇
⑥多官能团化合物 多官能团化合物命名 时应选择优先官能团为主。主要官能团的优先 次序为: —COOH,—SO3H,—CN,—CHO, C O
—OH(醇),—OH(酚), —NH2,
CC,CC
例:
CH2OH
2-羟基苯甲醇
OH (不叫羟甲基苯酚)
内容提要
§8-3 醚 一、分类和命名 二、物理性质 三、化学性质 四、环醚和冠醚
第八章 醇、酚、醚
醇(Alcohol) —OH RCH2OH
酚(Phenol) —OH
OH
CH2OH
OH
醚(Ether) —O— R1—O—R2 Ar1—O—Ar2
§8-1 醇
一、分类和命名(p175) 1.分类 同卤代烃 (1)按烃基种类 (2)按羟基个数 (3)按羟基所连碳原子种类
由不等性sp3杂化氧原子 形成的水分子
醇的结构特点
饱和醇中,氧的两个sp3杂化轨道分别与 碳原子的sp3及氢的s轨道重叠形成两个σ键, 剩下的两个sp3轨道被两对未共用电子对占 据。 醇中氢-氧键与碳-氧键均为极性键。 与卤代烃类似,醇中与官能团相连的烃 基有各种不同的结构,形成伯、仲、叔醇 及烯丙醇、苄醇等不同类型及不同活性的 醇,羟基与碳碳双键直接相连的烯醇,一 般不稳定,易发生互变异构生成醛或酮。
醇与氢卤酸反应合成卤代烃,其反应速度与氢 卤酸的性质和醇的结构有关。对于氢卤酸,其活 性次序为:HI>HBr>HCl,对于不同类型的醇, 其活性次序为:烯丙醇>叔醇>仲醇>伯醇。实验 室常用Lucas试剂(无水氯化锌的浓盐酸溶液)鉴 别六个碳以下的伯、仲、叔醇,因为低分子量的 醇与酸生成钅羊盐,溶于Lucas试剂,而生成的卤 代烃不溶,可根据出现浑浊的快慢进行区别。 ZnCl2的作用是增加介质的酸性: 2HCl+ZnCl2→2H++ZnCl2-4,因为盐酸反应活性 较小。除与氢卤酸反应外,醇还能同SOCl2、PX3 等卤化剂反应生成相应的卤代烃。
二、物理性质(p180) 醇分子间能形成氢键,分子有极性,能与
水分子形成氢键。 1.沸点 (1)醇的 b.p. 相应的烃和卤代烃,尤其是
低级醇 M↑→ b.p.↑,但随着碳链的增长,醇与相对分 子质量相近的烷烃的沸点差距逐渐缩小。
例如:
化合物 乙醇 丙烷 十二醇 十三烷
M 46 44 186.38 184.41
一般情况下,高温有利于分子内脱水形成烯 烃,较低温度有利于分子间脱水形成醚。仲醇、 叔醇分子内脱水形成烯烃的取向,遵守查依采夫 规律,主要生成碳碳双键上连有烃基数目最多的 烯烃。 醇脱水生成烯烃的反应活性为叔醇>仲醇>伯醇。 醇羟基可以与无机酸或有机酸反应脱水生成无 机或有机酸酯。醇的反应活性为伯醇>仲醇>叔醇。
-氢原子的氧化
R CH H
O—H 键 异 裂 : 弱 酸
H 性,与活泼金属的反
应;1°和2°醇与酸 的成酯反应;分子间
CH 脱水
OH
C—O 键 和 -C— H同时断裂:分 子内脱水
弱碱性 C—O键异裂:—OH 被其它亲核试剂取代
2.酸碱性(p182) (1)酸性
OH
HCl + Na HOH + Na ROH + Na
b.p. (℃) 78.4
-42.1 255~259 235.43
(2)同系列 直链 b.p. 支链
例如:正丁醇(118℃)和异丁醇(108.1℃);
直链:羟基在链端 b.p. 羟基不在链端
例如:正丁醇(118℃)和仲丁醇(99. 5℃)。
(3)—OH数目↑→ b.p.↑ 例如:丙醇(97.4℃)和丙三醇(290℃)
醇分子中,α-碳上的氢受羟基影响显示出较 高的活泼性,易发生氧化反应,其规律为:伯 醇氧化生成醛,进一步氧化生成酸;仲醇氧化 生成酮,叔醇在一般情况下不被直接氧化。利 用该方法由伯醇制备醛时,由于醛分子间不形 成氢键,沸点比相应醇低,常采用边反应边把 醛(一般沸点小于 100℃)蒸馏出来的方法, 以避免进一步被氧化为酸。
2.在水中的溶解度 —OH数目↑,碳原子数目↓→ S↑ 3.与无机盐生成结晶配合物 低级醇能与CaCl2、MgCl2、CuSO4等无机 盐生成结晶配合物,称为结晶醇。 例如:CaCl2 ·4C2H5OH
三、化学性质 1.结构与性质(p177) 醇分子相当于H2O分子中的一个—H被—R 取代,其中氧原子为不等性sp3杂化。
伯 1° 仲 2° 叔 3°
2.命名 (1)普通命名法 同卤代烃
(CH3)3COH
叔丁醇
CH2OH
CH2 CH CH2OH
苄醇
烯丙基醇
(2)系统命名法 ①饱和一元醇
CH3 CH3 CH3CH CH CHCHCH2OH
5
43
21
CH2OH
CH2CH3
Cl
6
Cl
7
2,4,5-三甲基-3-氯-1-庚醇
②饱和脂环醇
