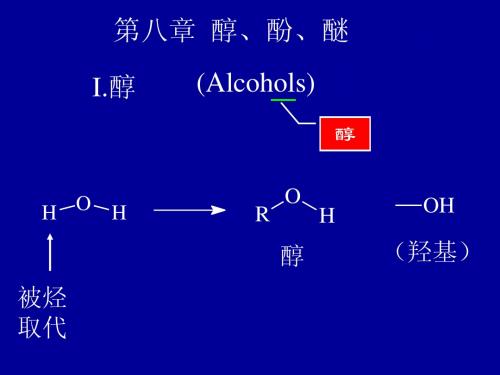
8第八章 醇酚醚
合集下载
第八章醇酚醚

pKa
17 OH
10.00
6.37
4.75
G
G: 给电子基,酸性减弱; 吸电子基,酸性增强
廊坊师范学院化学与材料科学学院-有机教研室
OH OH CH3
pKa 10.28
OH NO2
10.00 8.4
OH
OH NO2
7.23
NO2
7.15
2、 酚与FeCl3的反应 绝大多数酚都能与FeCl3溶液作用,生成有色的配合物。
下不被氧化 。
廊坊师范学院化学与材料科学学院-有机教研室
Cu 高温
不反应
5.与过碘酸(HIO4)反应
R' R C H C R'' + HIO4
R' R R' R
C O +
R'' H H
C O + HIO3 + H2O
OH OH R' H R C C H + HIO4 OH OH
C O +
H
C O + HIO3 + H2O
CH2OH
廊坊师范学院化学与材料科学学院-有机教研室
(2)根据羟基所连的碳原子的种类,醇可分为: 伯、仲、叔醇。
CH 3CH 2CH 2CH 2OH
正丁醇(伯醇)
CH3CHCH2OH CH3 异丁醇(伯醇)
CH3CHCH2CH3 OH
仲丁醇(仲醇)
CH3 CH3 C CH3 OH
叔丁醇(叔醇)
廊坊师范学院化学与材料科学学院-有机教研室
CH3 OCH3
CHO
邻甲苯酚
OH OCH3 CH2CH CH2
2-甲基-4-甲氧基苯酚
第八章 醇、酚、醚

2-丁醇(仲丁醇)
CH3 CH CH CH2 CH2 OH CH2 CH2 CH
2-甲基-1-丙醇(异丁醇)
CH3
3-丙基-2-己醇
9
2-甲基-2-丙醇 (叔丁醇)
芳醇的命名,把芳基作为取代基。 多元醇的命名,要选择含-OH尽可能多的碳链为主链,羟基的位次要标明。 例如:
H2C CH2 CH3 CH CH2 OH OH CH2 CH2 CH2 OH OH CH2 CH CH2 OH OH OH OH OH
H R sp3 C H
10 8.9 ° H
sp3 O
3 sp 杂化 O 原子为 3 由于在 sp 杂化轨道上有未共用电子对,
两对之间产生斥力,使得∠ C-O-H 小于 109.5 °
碳原子上电子密度较低,分子呈极性。
饱和一元醇通式
CnH2n+1OH,简写 ROH
4
命
名
根据分子中烃基的类别分为:脂肪醇、不饱和醇、脂环醇、芳香醇 (芳环侧链有羟基的化合物,羟基直接连在芳环上的不是醇而是酚)。
17
2) 醇与HX的反应为亲核取代反应,伯醇为SN2历程,叔醇、烯丙醇 为SN1历程,仲醇多为 SN1历程。
CH3 CH 3 OH + + HX CH3 C CH 3 质子化的醇 CH3 CH3 C CH3 CH3 CH3 C + + CH3 X 快 + OH2 慢 CH3 CH3 C + CH3 CH3 CH3 C CH3 X + H 2O + OH 2 + X -
CH 3 CH CH 2OH 异丁醇 CH 3 C OH CH 3 环己醇 OH 苄醇 CH 2OH
CH 3
CH 3
08第八章醇酚醚-chy
1.2.1.2 氢键对溶解度的影响
O H H
R OH
相似
★ C3 以下无限溶解
R O H R O H R O H
形成氢键
n – 丁醇 n – 戊醇
8g / 100g 水 2g / 100g 水
∵ 随烷基的增大, 占的比例小
相似相溶原理
1.3 醇的反应 极性键的断裂
H R C H O H
酸性、酯化
78.5 ℃
-44.5 ℃ 256 ℃
十三烷
184
235.4 ℃
1. 醇比烷 bp 高的多
2. 随 M 的增大,Δbp → 0
bp
ROH RH
C 原子数
bp
CH3CH2CH2CH2OH
CH3 CH3 CH3 CH3 CH CH2 CH3 C CH3
C2H5OH CH2 OH CH2 OH CH2 OH CH CH2 OH OH
H H C OH OH
H 4 IO
HCOH + H O + NH3 + H COOH + CO2 2
断开的地方加羟基
H HO C NH2 OH
∵
HO C O
OH
脱H2O
HC O H + H2O
HC O + NH3 OH
CO2 + H2O
II. 酚 (Phenols)
OH
CH2OH
酚
醇
1 结构、命名(书中例子 p141) 、性质 1 命名:
CH3 CH3-C-CH2+OH2 CH3
-H2O
CH3 CH3-C +CH2 ( 。 +) 1 C CH3
CH3 CH3-C +CH2 CH3 。 1 C+
第八章醇酚醚

C-O键断裂 取代或消除
碱性
孤对电子
1. 氧孤对电子导致的化学性质——Lewis碱
①溶于强酸
ROH 浓H2SO4 ROH H
应用: 钼羊盐
稀释或受热
ROH
▪除去烷烃或卤代烃中的少量醇 ▪区分醇与烷烃、卤代烃
②与金属离子的络合
MgCl2•6ROH CaCl2•4ROH
结晶醇 (溶于水不溶于有机溶剂)
第八章:醇、酚、醚
一. 醇的分类与命名
1. 分类
①按羟基所连碳原子的类型分:
10 伯醇( RCH2OH ): CH3CH2OH
20 仲醇( R CH OH ): CH 3CHCH 2CH 3
OH
R'
OH
R
30 叔醇( R' C OH ):
R''
(CH3)3COH
②按羟基所连的烃基分:
饱和醇:
CH3CH2OH (CH3)3COH
不饱和醇:CH2=CHCH2OH
CH3C≡ CCH2OH
芳香醇:
CH OH 2
OH OH
CH OH 2
③按羟基的数目分:
一元醇C:H3CH2CH2OH
OH
二元醇:H2C CH CH3 OH OH
OH OH
三元醇:H2C CH CH 2 OH OH OH
2. 命名
①普通命名法
CH3CH2CH2OH 正丙醇
R C OH
*源自格式试剂
H3C C O + R MgX 干醚
H
H3C C OMgX H R
H2O
*源自羰基碳
R
*源自格式试剂
H
C CH3 OH
3. 醛、酮还原制醇
醇酚醚

CH3CH£CHCH3 CH3CH2CH=CH2
CH3 CH3-C CH-CH 3
CH3 OH
Al2O3 气相,
CH3 CH3-C CH=CH 2
CH3
(主要产物)
+ H2O
(2) 分子间脱水
醇分子间脱水得到醚。常用的脱水剂有:硫酸、对甲苯磺酸、Lewis 酸、硅胶、多聚磷酸和硫酸氢钾等。例如:
较强碱 较强酸
(1) R斥电子 (2) 酸性:HOH>ROH
Na+OH- + ROH
较弱碱 较弱酸
可见,水的酸性 大于醇!
醇和酚的共性
问题2:不同的醇,其酸性大小如何?
化合物: CH3OH pKa 15.5
CH3CH2OH 15.9
CH3CHCH3 OH ~18
CH3 CH3 C OH
CH3 19
磷酸三丁酯
消泡剂、增塑剂、萃取剂
醇和酚的共性
(4) 磺酸酯的生成及应用
差的离去基团
好的离去基团
O
吡啶
O
CH3CH2 OH + Cl S
CH3 72% CH3CH2 O S
CH3
O
O
O
缩写为TsCl ,Ts = S
CH3
O
利用–OTs的离去能力,可使某些取代或消除反应顺利进行 :
CH3CH2CHCH2CH3
(Ar)
R
H
H-O H-O
(Ar)
R
H
H-O H-O
(Ar)
R
H-O
b. 随C数↑,R在ROH中比例↑,而R一般是疏水的。
醇和酚的共性
8.1.6 醇的化学性质
1、似水性 醇有弱酸性,能与活泼金属反应,并放出氢气:
8章-醇酚醚

H2O + Na C2H5OH + Na
反应随R基团的增大而减慢
NaOH + 1/2 H2 C2H5ONa + 1/2 H2
HOH > CH3OH >1o醇 > 2o 醇 > 3o醇
2. 与氢卤酸的反应,断裂醇分子中的 C-OH 键
R-OH
A 活性
HX
RX + H2O
HI > HBr > HCl 这主要是依卤原子的原子半径所致,I 是最大,依次减小,
第八章 醇、 酚、 醚
1
醇 酚 醚可看成是水分子中的 H 被烷基,芳基取代的产物
如下图所示
R H O H Ar 2R
ROH ArOH ROR
醇 酚 醚
8.1
醇
醇的代表物,醇的分类及命名
醇的制备
醇的物理性质 醇的化学性质
硫醇(十二章部分内容)
3
一. 醇的代表物,分类及命名
CH3CH2OH
乙醇
CH3OH
OH OH OH
+ HO NO2 - 3 H2O HC H2C
H2SO4
三硝酸甘油酯是一种炸药,也是人药,治疗心肌病 从上面的例子中可以看出,醇出H,酸出OH。
例 2 烷基磷酸酯
HO ROH + HO P HO RO O HO P HO RO O + RO P HO RO O + RO P RO O
因此,实验室不能用氯化钙干燥醇类化合物。
四. 醇的化学性质
由于电负性的不同,如 O: 3.5; C: 2.5; H: 2.1
因而,在醇分子中,C-O 和 O-H 两种键均有极性,可发 生两种反应形式
第八章醇酚醚
己酮)氧化成酮,丙酮被还原成异丙醇,这一反应称为欧芬脑尔 (Oppenauer,R.V)氧化法,其逆反应称为麦尔外因-彭道夫(MeerweinPonndorf)还原。
O R2CHOH + CH3CCH3
Al(OCMe3)3 欧芬脑尔氧化法
麦尔外因-彭道夫还原
OH R2CH=O + CH3CHCH3
反应方向的控制
减压蒸餾
-H2SO4
CH3OSO2OCH3 硫酸二甲酯
C2H5OH NaOH
甲基化反应
C2H5OCH3 + CH3OSO3Na + H2O
2oROH , 3oROH在硫酸作用下消除。
五 氧化反应
ROH
氧化剂 反应条件
产物
氧化剂
氧化剂
RCH2OH
RCHO
RCOOH
O
氧化剂
R2CHOH
RC R
O
H+
氧化剂
反应机理
C OH C OH
OH
CO
OH
C O I O-
O
OH
HO HO
I
OH O-
O
-2H2O
I = +7
-H2O
C=O + C=O + IO3-
I = +5
邻二醇被高碘酸氧化的分析
OH OH
OH
OH OH
OH
OH OH
?
OH
(CH3)3C
OH
OH
OH
-羟基酸、 -二酮、 -氨基酮、1-氨基2-羟基化合物也能发生类似的反应。
100%
Br
3oROH 、大多数2oROH和空阻大 的 1oROH按SN1机理进行反应。
O R2CHOH + CH3CCH3
Al(OCMe3)3 欧芬脑尔氧化法
麦尔外因-彭道夫还原
OH R2CH=O + CH3CHCH3
反应方向的控制
减压蒸餾
-H2SO4
CH3OSO2OCH3 硫酸二甲酯
C2H5OH NaOH
甲基化反应
C2H5OCH3 + CH3OSO3Na + H2O
2oROH , 3oROH在硫酸作用下消除。
五 氧化反应
ROH
氧化剂 反应条件
产物
氧化剂
氧化剂
RCH2OH
RCHO
RCOOH
O
氧化剂
R2CHOH
RC R
O
H+
氧化剂
反应机理
C OH C OH
OH
CO
OH
C O I O-
O
OH
HO HO
I
OH O-
O
-2H2O
I = +7
-H2O
C=O + C=O + IO3-
I = +5
邻二醇被高碘酸氧化的分析
OH OH
OH
OH OH
OH
OH OH
?
OH
(CH3)3C
OH
OH
OH
-羟基酸、 -二酮、 -氨基酮、1-氨基2-羟基化合物也能发生类似的反应。
100%
Br
3oROH 、大多数2oROH和空阻大 的 1oROH按SN1机理进行反应。
【课件】第八章醇酚醚10-11学年1PPT
酸性序: H2O > R-OH > HC≡CH > NH3 > R-H 碱性序:OH- < RO- < HC≡C- < NH2- < R-
Li、K等碱金属和Mg、Ca、Ba等碱土金属也能和 C1 ~ C8的醇类反应,生成相应的醇的金属化合物
问题:比较CH3CH2CH2OH、
(CH3)2CHOH及(CH3)3COH与 Na反应的活性以及相应醇钠的 碱性大小
问题:氯化钙能用作干燥剂,是因为它能与水形成 CaCl2 ·6H2O。能否用氯化钙来干燥醇类?
某些醇具有特殊的
香味,多用来配制 香精。如苯乙醇具 有玫瑰香气
8.1.4 醇的化学性质
氧化反应
H CC H
形成氢键 形成金羊盐
酸性(被金属取代)
O
H
取代反应 脱水反应
1. 与活泼金属反应——似水
H—O-H + Na ——> Na OH + H2 (反应激烈) R—O-H + Na ——> RO Na + H2 (反应和缓)
2、由于醇分子与水分子之间能形成氢键,三个碳的醇和叔丁醇 能与水混溶。
从丁醇开始,在水中的溶解度随相对分子量的增加而减小。
R
O HH O
H
R
O HH O
H
R
O HH O
H
醇与水之间形成的氢键
3、醇合物 醇与水的另一相似之处:能形成象水合物那 样的醇合物,称为结晶醇。如:
MgCl2 ·6CH3OH
CaCl2 ·4CH3OH
或: Al2O3,250 ℃
+ H2O
Lewis酸如Al2O3,也能催化醇的脱水反应。
醇的脱水是质子化的醇作为脱水物的单分子消除反应(E1)。
Li、K等碱金属和Mg、Ca、Ba等碱土金属也能和 C1 ~ C8的醇类反应,生成相应的醇的金属化合物
问题:比较CH3CH2CH2OH、
(CH3)2CHOH及(CH3)3COH与 Na反应的活性以及相应醇钠的 碱性大小
问题:氯化钙能用作干燥剂,是因为它能与水形成 CaCl2 ·6H2O。能否用氯化钙来干燥醇类?
某些醇具有特殊的
香味,多用来配制 香精。如苯乙醇具 有玫瑰香气
8.1.4 醇的化学性质
氧化反应
H CC H
形成氢键 形成金羊盐
酸性(被金属取代)
O
H
取代反应 脱水反应
1. 与活泼金属反应——似水
H—O-H + Na ——> Na OH + H2 (反应激烈) R—O-H + Na ——> RO Na + H2 (反应和缓)
2、由于醇分子与水分子之间能形成氢键,三个碳的醇和叔丁醇 能与水混溶。
从丁醇开始,在水中的溶解度随相对分子量的增加而减小。
R
O HH O
H
R
O HH O
H
R
O HH O
H
醇与水之间形成的氢键
3、醇合物 醇与水的另一相似之处:能形成象水合物那 样的醇合物,称为结晶醇。如:
MgCl2 ·6CH3OH
CaCl2 ·4CH3OH
或: Al2O3,250 ℃
+ H2O
Lewis酸如Al2O3,也能催化醇的脱水反应。
醇的脱水是质子化的醇作为脱水物的单分子消除反应(E1)。
第八章醇酚醚
一. 醇
醇的分类
1、按烃基结构分为
饱和醇 CH3CH2CH2CH2OH 不饱和醇 CH2 脂环醇 芳香醇
OH
CH2OH
丁醇 CHCH2OH 烯丙醇 环戊醇 苯甲醇
2、按醇分子中所含羟基的数目分为
一元醇 二元醇
CH3 OH CH2 CH2
甲醇 乙二醇 丙三醇
多元醇 CH2 CH CH2
OH OH OH
OH OH CHO SO 3H COOH OH
对羟基苯磺酸
邻羟基苯甲醛
对羟基苯甲酸
三、酚的制备 1. 磺酸盐碱熔法
SO3Na
ONa
NaOH >300℃ (融 熔)
H+
OH
2. 氯苯水解法
O Na NaOH , 400℃
Cl
H+
OH
200atm
氯苯难以发生亲核取代,当卤原子的邻对 位有吸电子基团时,水解反应容易进行。
(二) 乙醇(CH3CH2OH) 俗称“酒精”
(三) 丙三醇(CH2OH—CHOH—CH2OH) 又称“甘油”
CH2 ONO2 CH CH2 ONO2 ONO2
阿尔弗里德.伯恩纳德 .诺贝尔(Alfred Bernhard Nobel) 诺贝尔的一生中 ,仅在英国申请 的发明专利就有 355项之多。
CH3CH3OH
Cu
250~350 ℃
CH3CHO + H2
CH3CCH3 + H2 O
CH3 CHCH3 OH
Cu
500 ℃ , 0.3 MPa
叔醇:分子中没有α-H,不发生脱氢反应。
三、几种重要的醇 (一) 甲醇(CH3OH)
又称“木醇”, 毒性大,误服10ml可致失明,误服30ml可致死亡 。
第八章醇、酚、醚消除反应
甲醇的分子结构
H
::
H H
C O
sp3
H
二、醇的物理性质和光学性质
1.物理性质 低级一元醇:C1-C4无色流动液体,比水轻。
C5-C11油状液体, C12以上无色蜡状固体。 甲醇、乙醇、丙醇都带有酒味. 丁醇开始到十一醇有不愉快的气味. 二元醇和多元醇:是具有甜味液体,故乙二醇俗
称甘醇,丙三醇俗称甘油.
[O]
[O]
1°ROH
RCHO
RCOOH
[O]
2°ROH
RCOR’
等。
3°ROH 因无 α - H,难以被氧化,若在强烈条件下氧化,碳链将断裂。
CH3CH2CH2CH2OH K2Cr2O7 / dil. H2SO4 CH3CH2CH2CHO (50%)
CH3CH(CH2)3CH3 OH
K2Cr2O7 / dil. H2SO4
结晶醇: 低级醇和一些无机盐类(MgCl2,CaCl2,CuSO4等) 形成结晶状的分子化合物, 如:MgCl2.6CH3OH,CaCl2.4C2H5OH等。 结晶醇不溶于有机溶剂而溶于水,可使醇与 其他有机物分开或从反应物中除去醇类 如:乙醚中的少量乙醇,加入 CaCl2便可除去.
2.光谱性质 IR:-OH未缔合的3640-3610cm-1有尖峰;
可用来区别一元醇和邻二醇或邻多醇ch2ohch2ohcuoh2ch2och2ocu可溶性洛合物降兰色h2o2与高碘酸或四乙酸铅反应二醇可被高碘酸四乙酸铅氧化生成相应的羰基化合物反应是定量的每分裂一组邻二醇结构消耗一个分子hio4因此根据hio4的消耗量可以推知分子中有几组邻二醇结构可用agno3来检测邻二羟基结构rchohrchohio4rchorchoiooohohrchorchoio3h2o白agio3io3agno3四乙酸铅作氧化剂rchchrch3coo4pbohohrchhcrch3coo2pbch3coohoo被hio4氧化断键除邻二醇外还有羰基醇
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
①、分子内脱水与Saytzeff规则: β-H断裂
CH3CH2OH
96%H2SO4
主要产物
H C H H C H H
170℃
CH2=CH2 + H2O
H H C CH C
CH3 H3C CH2 C OH CH3
H
66%H2SO4
H
H C C C CH3
H
100℃
H H H
CH2
E1机理
碳正离子中间体,是醇与氢卤酸反应的副产物
2ROH + 2Na RONa + H2O
2RONa + H2↑ ROH + NaOH
工业上制备乙醇钠是通过乙醇和固体NaOH作用,并常在反应中加 苯进行共沸蒸馏除去水,使反应向生成EtONa方向移动。 R的给电子能力越强,O-H的极性越弱,此离解作用越难进行。
反应的活性:甲醇 > 伯醇 > 仲醇 > 叔醇
注意
许多无机盐 不能作为醇 的干燥剂。
CaCl2 4C2H5OH
工业乙醚常杂有 少量乙醇,加入 CaCl2可使醇从 乙醚中沉淀下来。
结晶醇不溶于有机 溶剂而溶于水。利 用这一性质,可以 使醇和其它有机溶 剂分开,或从反应 物中除去醇类。
16
四、醇的化学性质:
b a Rc CH CH O H d H H
H C H H O
H H H
:
:
2、醇分子间的氢键:
R基团的性质与氢键的 形成有什么关系?
H O R
R O H O R
12
H
醇与水分子间也能形成氢键
..
H
..
化合物
沸点
乙醇
78.5
乙烷
-98
沸点
丙烷
-42
氯乙烷
12
100 50 0 -50 -100 乙醇 乙烷 丙烷 氯乙烷
13
沸点
三、醇的物理性质:
n-C12H25OSO3H
硫酸氢十二烷基酯
n-C12H25OSO3Na 十二烷基磺酸钠
(SDS)
乳化剂
23
②、与氢卤酸的反应:(C-O键的断裂)
反应式: ROH + HX Δ
H R3COH + H
+
RX + H2O
R R H C
+
亲核取代
R3 C O
+
R Cl-
机理:主要SN1
R3CCl
24
醇与HX作用机理的SN1 反应机理(叔醇仲醇、非直链伯醇):
CH2 CHCH2OH 烯丙醇 CH2OH 苄醇
CH CH CH2 OH OH OH 甘油(丙三醇)
ClCH2CH2OH 氯乙醇
7
②复杂的醇:采用系统命名法:
A、选择含羟基的最长碳链为主链。 B、从离羟基最近的一端开始编号。 C、根据主链所含的碳原子数目称为“n-某醇”。 D、标明各个取代基的位置和名称。 例1:
31
醇分子内脱水是制备烯烃的常用方法之一
活性:
R3COH>R2CHOH>RCH2OH 叔醇的脱水较常用,有时也用仲醇,伯 醇少用。
CH3CH2CH2CH2OH Al2O3 CH3CH3CH CH2 + H2O
32
②、分子间脱水
2 ROH
H+
R O R + H 2O 醚
96%H2SO4
亲核取代 Et-O-Et + H2O 低温有利
与浓盐酸作用必须有氯化锌存在并加热才能生成氯代烃。
29
醇的鉴别:
Lucas reagent (卢卡斯试剂)
CH3 H3C C OH CH3 ZnCl2/HCl r.t. CH3 H3C C
无水ZnCl2 和浓HCl
Cl
立即浑浊
H H5C2 C OH CH3
CH3
H CH3
几分钟变浑浊
ZnCl2/HCl room temperature
RCH2OH R2CHOH R3COH [O] RCHO (醛) RCOOH(羧酸) 氧化剂 R2CO(酮)
无反应。剧烈条件下, 发生键断裂生成低级羧酸 氧化剂:KMnO4、H2CrO4、K2Cr2O7/H2SO4、 Na2Cr2O7/H2SO4、CrO3/H2SO4
①、伯醇的氧化反应:
[O] RCH2OH RCHO -H2 随时蒸出 [O] RCOOH
IUPAC规定的次序大体上为:正离子(如铵盐)、羧酸、 磺酸、酸的衍生物(酯、酰卤、酰胺等)、腈、醛酮、 醇、酚、硫醇、胺、醚、过氧化物
6—氨基—2—己醇
OH CH3CHCH2CHO
3-羟基丁醛
11
二、醇的结构特征:
RH的H被OH取代后的产物,HOH中的H被R取代的产物 H C、O: sp3杂化 1、甲醇的结构:
*例2:
H3C
OH CH
3 4
CH3 OH CH3 CH2 CH HC HC2 OH
1 H2C OH
CHHC
5 6
7
CH3
4,6-二甲基-3-(2-羟基丙基)-1,2,5–庚三醇
10
④如果分子中除羟基外尚有其他官能团时,需 按规定的官能团次序选择最前面的一个官能团 作为这个化合物的类名。其他官能团则作为取 代基。
RCH2OH + HONO2
CH 2 O H CH O H CH 2 O H
+ 3 HNO3
浓硫酸
诺贝尔
意大利化学家索布雷罗l847年在报告他的研究成果时 说,用硝酸和硫酸处理甘油,得到一种黄色的油状透 明液体,即硝化甘油,“这种液体可因震动而爆炸, 22 将来能做何用途,只有将来的实验能告诉我们。”
14
状态:
• C1-C4一元醇,是无色流动液体,比水轻。 • C5-C11为油状液体, • C12以上高级一元醇是无色的蜡状固体。
气味:
甲醇、乙醇、丙醇都带有酒味, 丁醇开始到十一醇有不愉快的气味, 二元醇和多元醇都具有甜味,故乙二醇有 时称为甘醇(Glycol)。
15
醇化物(结晶醇)
低级醇与一些无机盐形成的结晶状分子化合物称 之为结晶醇,也称之为醇化物。 MgCl2 6CH3OH
C-O键极性——亲核取代 涉及β-H断裂——消除
H在离去基 团的位, 可消除
好离去基
H C C H
a碳有亲电 性,但难亲 核取代
H H+ O H C C H
a碳有亲电 性,可亲核 取代
18
OH2
基团不易离去
1、似水性
1)与活泼金属的反应(O-H的断裂):
RO H
+ R O + H
-
弱酸性 强碱,强亲 核试剂
CH3CH2-OH + HO-CH2CH3
140℃
主要副反应:分子内脱水成烯烃。不适于叔醇,Why? 机理:伯醇按SN2、仲醇按SN1
SN2:
CH3CH2
OH
H+
CH3CH2
OH2
CH3CH2OH C2H5OC2H5 + H+ CH3CH2OCH2CH3 H
33
1)氧化剂氧化: 4、氧化反应: α-H断裂
X- + R
O
H H
RX + H2O
28
醇与氢卤酸反应的活性比较:
苯甲型, 烯丙型 > 3oROH > 2oROH > 1oROH >CH3OH
HX的活性比较:
HI > HBr > HCl
当一级醇与47%氢碘酸一起加热就可生成碘代烃。
与氢溴酸(48%)作用是必须在H2SO4存在下加热才能生 成溴代烃。
第八章 醇、酚、醚
Alcohol, Phenol and Ether
1
醇、酚、醚: 烃的含氧衍生物。 醇与酚有相同的官能团:羟基(-OH)。 相同分子式的醇与醚互为同分异构体。
2
第一节: 醇(R-OH) 一、醇的分类与命名:
1、醇的分类:
①按羟基上所连接的碳原子种类分类:
醇 伯醇
H3CCH2CH2OH
羟基氧有亲核性(酯 化反应)和碱性
醇的结构及性质分析:
a. O-H键极性——酸性H反应与活泼金属反应 b. C-O键极性——亲核取代(OH被取代) c. 涉及β-H断裂——消除(消除OH和-H) d. 涉及 α-H断裂——氧化(脱OH-H 和α-H )
17
醇的化学性质
b. c.
位不能直 接消除
HO
ZnCl
好离去基
21
2、与无机酸的反应:
①、与无机含氧酸的反应(酯化反应):
--------------
醇羟基氧的亲核性
RCH2O NO2 + H2O 硝酸酯 CH 2 O N O 2 CH O N O 2 + H 2 O CH 2 O N O 2 甘油三硝酸酯 烈 性炸 药 (硝化甘油) 治疗心绞痛
6 5 4 3 2 1
5-甲基-3-己烯-1-醇 分子中含不饱和键 选主链时则选含不饱和键并连有羟基的最长碳链为主链,优 先羟基编号,主链碳原子数在烯中体现
9
③多元醇的命名:按系统命名法,选择含 有尽可能多羟基的碳链为主链。
例1:
5
OH
4 3
OH OH
2
H3C CH CH CH3
CH CH2
1
3-甲基-1,2,4-戊三醇
CH3 Step 1 H3C C O H + H CH3
快
CH3H H3C C O H CH3
CH3H Step 2 H3C C O H CH3
CH3 Step 3 H3C C CH3 +
