元素化学 稀有气体及氢化物
氢和稀有气体

这一发觉惊动了科学界,因为当初普遍以为空气已研究得够 清楚了,所以 Ramsay 旳工作具有划时代旳历史意义。
2 氙旳氟化合物旳生成 氙旳氟化物能够由两种单质直接化合生成,反应在一定旳温 度和压强下,在镍制旳容器中进行。为何在镍制容器中进行?
Xe ( g ) + F2 ( g ) ——— XeF2 ( g ) Xe 大过量,防止 XeF4 旳生成 ;
Xe ( g ) + 2 F2 ( g ) ——— XeF4 ( g ) F2 过量,但反应时间应短些,防止 XeF6 旳生成; Xe ( g ) + 3 F2 ( g ) ——— XeF6 ( g ) F2 大过量,反应时间长。 F2 和 Xe 旳混合气体在光照下,也能够直接化合成 XeF2 晶体 。
认识到 “ 惰气 ” 也不是绝对惰性旳。他旳工作为开拓 “ 惰气 ” 元 素化学Ba打rt下let了t 基曾础使。O2 同六氟化铂反应,而生成一种新旳化合物 O2+ [ PtF6 ]- 。他联想到 “惰气” 氙 Xe 旳第一电离能 ( 1171.5 kJ·mol-1 ) 同 O2 分子旳第一电离能 ( 1175.7 kJ·mol-1 ) 相近旳 事实,由此推测到 PtF6 氧化 Xe 旳可能性 。
杂化方式 sp3 不等性
杂化方式 sp3 等性
分子构型 三角锥
分子构型 正四面体
XeOF4 价层电子总数
对数 电子对构型
无机化学第13章_氢和稀有气体

⑤野外工作,用硅等两性金属与碱液反应
0.63kg Si可制取1m3H2 :
Si+2NaOH+H2O→Na2SiO3+2H2(g)
或 LiAlH4+4H2O→Al(OH)3+LiOH+4H2(g)
19
Light work with water, NATHAN S. LEWIS Nature 414, 589 - 590 (December 6, 2001) Direct splitting of water under visible light irradiation with an oxide semiconductor photocatalyst, ZHIGANG ZOU, JINHUA YE, KAZUHIRO SAYAMA & HIRONORI ARAKAWA Nature 414, 625 - 627 (December 6, 2001)
11
11/20/2020
性质: a. 溶解性 273K时1体积水仅能溶解0.02体积氢 b. 可燃性 燃料
c. 氢的化学性质:还原剂原料
冶金
加氢反应等
Vegetable oil to fat 植物油 氢化到 脂肪
人造黄油
肥料
12
检验反应:PdCl2(aq) + H2 → Pd(s) + 2HCl(aq)
11/20/2020
第13章 氢和稀有气体
“机遇号”重大发 现
1
11/20/2020
序言
从本章开始学习元素部分。HUMPHREYO说:“真正的化学 是叙述性化学,即元素化学。只有理论没有性质那就不是化 学。”F A COFTON说:“我们确信象其他教科书那样,没有 或几乎没有包含实际内容的无机化学,就好象没有乐器演奏 的一张乐谱。”因此,我们的学习就是要掌握重要元素及其 化合物的重要性质。
主族元素性质

XeF2 + H2O == Xe + ½ O2 + 2HF
精选版课件ppt
24
精选版课件ppt
25
O2 + PtF6 == O2+[PtF6]- (二氧基阳离子盐)
精选版课件ppt
26
氧族元素
BrO3F较 ClO3F更活泼且被碱所水解:
精选版课件ppt
13
11. 卤素互化物 卤素互化物:XX’n,n=1,3,5,7,X’的电负性更大
(1)一般为抗磁性 (2)空间构型与中心原子杂化方式(用价层电子对 互斥理论判断) (3)不稳定,熔沸点低,强氧化剂 (4)易水解:BrF3 + 2H2O=3HF + HBrO2
氯、溴和碘均应有四种类型的含氧酸:HXO、 HXO2、HXO3、HXO4,它们的结构见下图:
卤素原子和氧原子之间除有sp3杂化轨道参与成键外,还 有氧原子中充满电子的2p轨道与卤素原子空的d轨道间所成的 d-pπ 键。 特殊:ClO2(sp2),形成大键,35。
精选版课件ppt
氟原子没有可用 的d轨道因此不能 形成d-pπ 键。 7
④分子卤化物的水解得什么产物,应根据两种元素的电负性来确定。
NC l3 + 3H2O = NH3 + 3HOC l
当达到最大共价数时,像CCl4或SF6对水可以完全是惰性的,这仅是
动力学因素而不是热力学因素的结果。而SeF6和TeF6在常温下即水解, 这是由于中心原子半径大,空间上有利于水分子的进攻而实现的。
盐Ag5IO6的阴离子结构均精为选八版课面件p体pt 。
8
5. 卤化物的溶解性
IA族元素氟化物(除LiF外)和AgF、HgF2、SnF2易溶于水。 AgCl、CuCl、AuCl、TlCl和PbCl2难溶,PbCl2热的时候溶解度大。
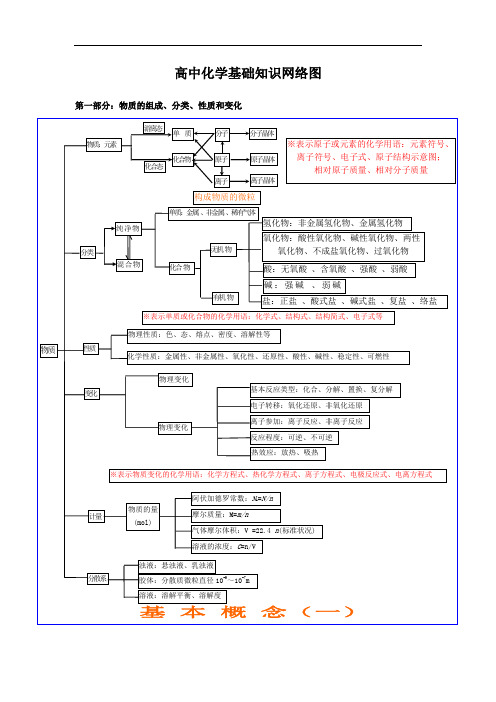
(完整)高中化学知识结构图
决 定
外 电 子
表 律 的排
结
周布
构
期周
离 子
性期 性
晶
体
横:周期 元素种类
起止序号
n=1
2
1~2
n=2
8
短周期
3~10
元素性质
n=3
8
11~18
周
原
n=4
18
19~36
n=5
18 长周期
37~54
期 表 位
子 结 构
n=6
32
55~86
置
n=7
21 不完全周期 87~111
纵:族
主族:ⅠA~ⅦA
副族:ⅢB~ⅦB、ⅠB ⅡB
原子晶体 石墨(混合晶体)
金属晶体 大多数盐
强 碱 离子晶体 碱性氧化物 部分过氧化物
物理性质 宏观
化学性质 纯净物
单质 化合物
非金属 稀有气体
组成
分类
性质
物质 分 子
变化
原 子 微观
离 子
无机物 氢化物
氧化物
有机物
金属氢化物
酸性
非金属氢化物
碱性
成盐氧化物
两性
特殊
不成盐氧化物
含氧酸、无氧酸
酸
强酸、弱酸
电离度平衡的移动
质离 ) 水的电离平衡 H2O H++OH-
水的离子积 KW=1×10-14(25℃) 溶液的酸碱性:PH=-log[H+]
装置
离子反应
实质
发生条件 表示方式-离子方程式
盐类的水解
常见类型
非氧化还原
复分解反应 水解反应 络合反应
类型 规律(酸碱性性判断) 影响因素
第四篇 元素化学(一) 非金属

三. 稀有气体
He
2.用途:
超低温冷却剂;填充气球;作惰性保护气用于核 反应堆热交换器;液氦在温度小于2.2K时,是一 种超流体,具有超导性和低粘性,对于研究和验 证量子理论有重要的意义。
Ne Ar
氖的导电性是空气的75倍,用于放电管中发射红光, • 也用于作金属焊接的保护气。
氩 氩的导热性很差,用于填充灯泡,也 用作焊接的保护气。
第十三章 氢和稀有气体
制作人 何晓燕
• [教学要求]
1.了解氢及氢化物的物理和化学性质。 2.了解稀有气体的发现简史,单质、化合 物的性质、结构及用途。
• [教学重点]
1.氢化物的化学性质。 2.稀有气体化合物的结构及性质。
• [教学难点]
VSEPR理论判断稀有气体化合物的结构。
[主要内容]
1.氢的存在,氢气的性质,氢 化物。 2.稀有气体的存在、性质、制 备和应用,稀有气体的化合物。
早在1785年,英国著名科学家Cavendish H.在研究空气 组成时,就发现在电火花作用下,用缄液吸收了氮和 氧化合生成的氧化氮后,仍然有近1%的残存气体,但 这并未引起重视,谁也没有想到,就在这少量气体里 竟藏着整整一个族的化学元素。
100多年后,英国物理学家瑞利(Rayleigh J.W.S.)在研究氮气时发现,从氮的化合物中 分离出来的氮气每升重1.2508g,而从空气中 分离出来的氮气在相同情况下每升重1.2572g, 瑞利无法解释,于是写信给《自然》,遍请 读者回答,但无复信。 1894年,他与Ramsay合作,把空气中的氮气 和氧气除去,用光谱分析鉴别剩余气体时发 现了氩。由于氩和许多试剂都不发生反应, 极不活泼,故命名为 Argon(在希腊文中是 “懒惰”的意思,中译为氩,元素符号是 Ar)
化学元素特性

一、物理性质1、有色气体:F2(淡黄绿色)、Cl2(黄绿色)、Br2(g)(红棕色)、I2(g)(紫红色)、NO2(红棕色)、O3(淡蓝色),其余均为无色气体。
其它物质的颜色见会考手册的颜色表。
2、有刺激性气味的气体:HF、HCl、HBr、HI、NH3、SO2、NO2、F2、Cl2、Br2(g);有臭鸡蛋气味的气体:H2S。
3、熔沸点、状态:①同族金属从上到下熔沸点减小,同族非金属从上到下熔沸点增大。
②同族非金属元素的氢化物熔沸点从上到下增大,含氢键的NH3、H2O、HF反常。
③常温下呈气态的有机物:碳原子数小于等于4的烃、一氯甲烷、甲醛。
④熔沸点比较规律:原子晶体>离子晶体>分子晶体,金属晶体不一定。
⑤原子晶体熔化只破坏共价键,离子晶体熔化只破坏离子键,分子晶体熔化只破坏分子间作用力。
⑥常温下呈液态的单质有Br2、Hg;呈气态的单质有H2、O2、O3、N2、F2、Cl2;常温呈液态的无机化合物主要有H2O、H2O2、硫酸、硝酸。
⑦同类有机物一般碳原子数越大,熔沸点越高,支链越多,熔沸点越低。
同分异构体之间:正>异>新,邻>间>对。
⑧比较熔沸点注意常温下状态,固态>液态>气态。
如:白磷>二硫化碳>干冰。
⑨易升华的物质:碘的单质、干冰,还有红磷也能升华(隔绝空气情况下),但冷却后变成白磷,氯化铝也可;三氯化铁在100度左右即可升华。
⑩易液化的气体:NH3、Cl2 ,NH3可用作致冷剂。
4、溶解性①常见气体溶解性由大到小:NH3、HCl、SO2、H2S、Cl2、CO2。
极易溶于水在空气中易形成白雾的气体,能做喷泉实验的气体:NH3、HF、HCl、HBr、HI;能溶于水的气体:CO2、SO2、Cl2、Br2(g)、H2S、NO2。
极易溶于水的气体尾气吸收时要用防倒吸装置。
②溶于水的有机物:低级醇、醛、酸、葡萄糖、果糖、蔗糖、淀粉、氨基酸。
苯酚微溶。
稀有气体元素与元素周期表
稀有气体元素与元素周期表在元素周期表中,稀有气体元素是一类非常特殊的元素。
它们的特殊性在于其化学性质的稳定性和低反应性。
稀有气体元素包括氦(He)、氖(Ne)、氩(Ar)、氪(Kr)、氙(Xe)和氡(Rn),它们都位于元素周期表的第18族。
稀有气体元素的特点让它们在日常生活中具有广泛的应用价值。
首先,由于稀有气体元素的稳定性,它们常被用作填充在灯泡中,以提供稳定的光源。
例如,氖气体可以产生红色光线,在霓虹灯中得到广泛应用。
氦气则常被用于气球和气体球囊中,因为它比空气更轻,可以使气球漂浮在空中。
其次,稀有气体元素在科学研究和工业生产中也扮演着重要的角色。
氦气被广泛用于超导体的制冷,在低温条件下可以显著降低电阻,提高电流的传导性能。
氩气常被用于保护气体焊接,可以有效防止焊缝受到氧气和水蒸气的污染。
氩气还用于光刻过程中,可以提高芯片的质量和生产效率。
此外,稀有气体元素在医学诊断和治疗中也具有重要作用。
氙气被广泛应用于核磁共振成像(MRI)中,可以提供高质量的图像和准确的诊断结果。
氡气则用于放射疗法,对于某些类型的癌症治疗具有疗效。
稀有气体元素的存在使得元素周期表更加完整。
它们作为第18族元素,拥有完整的外层电子壳,电子结构稳定。
这也解释了它们的低反应性和化学稳定性。
由于电子结构已满,稀有气体元素很少与其他元素形成化合物,并且很难被氧化或还原。
从元素周期表的排列结构来看,稀有气体元素位于表的最右侧,代表了元素周期表的完整性和稳定性。
在填满了各个能级的元素周期表中,稀有气体元素的存在提醒我们,化学元素的世界是如此多样和丰富。
它们以自己独特的特点和性质,为人类生活和科学研究提供了不可或缺的贡献。
总结起来,稀有气体元素作为元素周期表中的一类特殊元素,具有稳定性和低反应性的特点。
它们在日常生活、科学研究和工业生产中发挥着重要的作用。
稀有气体元素的存在丰富了元素周期表的多样性和完整性,也推动了人类社会的进步与发展。
化学《无机化学》三基要求
化学《无机化学》三基要求(总14页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--化学《无机化学》三基要求课程编码:5 6课程性质:学科专业必修课程教学对象:化学专业本科生学时学分:136学时 8学分编写单位:化学系编写人:王克诚审定人:刘欣编写时间:2006年11月前言为了更好地贯彻执行无机化学教学大纲的教学规范与要求,强化无机化学的“基础知识、基本理论和基本技能”的教学,提高教学质量,夯实学生的专业知识基础和能力基础,提高教学质量,特制定《无机化学》课程的三基要求。
第一章化学基本概念和定律基础知识:1、原子、分子、单质、化合物2、元素、核素、同位素3、物质的量、摩尔、摩尔质量4、相对原子质量、相对分子质量5、理想气体基本理论:1、理想气体状态方程2、混合气体分压定律3、气体扩散定律基本技能:1、理想气体状态方程的应用2、混合气体分压定律的应用3、气体扩散定律的应用第二章溶液基础知识:1、分散系2、溶液4、渗透压基本理论:1、拉乌尔定律2、稀溶液的依数性3、胶体理论基础基本技能:1、溶液浓度的表示、换算和计算2、利用拉乌尔定律和稀溶液的依数性进行相关计算3、胶体的结构、性质,制备和破坏第三章化学热力学基础基础知识:1、体系与环境2、热和功3、状态和状态函数4、热力学能、焓和焓变、熵和熵变、自由能和自由能变基本理论:1、热力学第一定律和数学表达式2、热化学、盖斯定律3、化学反应方向的判据4、吉布斯-亥姆霍兹公式5、化学反应等温式基本技能:1、运用盖斯定律进行热化学的计算2、运用热力学数据计算化学反应的ΔrH°、ΔrS°、ΔrG°3、用ΔrG判据判断化学反应的方向4、利用吉布斯-亥姆霍兹公式,分析温度对反应方向的影响和相关计算5、利用化学反应等温式求K°第四章化学动力学基础基础知识:1、化学反应速率及其表示方法2、反应速率方程、反应级数、速率常数、半衰期3、反应机理、活化能4、基元反应、复杂反应基本理论:1、反应速率理论——碰撞理论和过渡状态理论2、浓度对反应速率的影响——速率方程3、温度对反应速率的影响——阿仑尼乌斯公式4、质量作用定律5、催化理论基本技能:1、由实验建立速率方程2、利用速率方程进行相关计算,求反应级数、速率常数;一级反应半衰期的计算3、利用阿仑尼乌斯公式进行相关计算第五章化学平衡基础知识:1、可逆反应2、化学平衡3、化学平衡常数、转化率4、化学平衡的移动基本理论:1、化学平衡定律2、多重规则3、化学平衡移动原理基本技能:1、化学平衡的有关计算2、Kc、Kp与K°的计算3、利用ΔrG°计算K°4、多重平衡的应用5、浓度、压力、温度对化学平衡的影响及有关计算6、勒夏特里原理的应用第六章电离平衡基础知识:1、电离平衡、电离平衡常数、水的离子积常数、电离度2、酸和碱、酸度、pH值、酸碱指示剂3、同离子效应、盐效应4、缓冲溶液6、溶度积常数基本理论:1、酸碱理论——电离理论、质子理论、电子理论2、化学平衡之电离平衡和溶解平衡理论3、溶度积规则基本技能:1、根据计算酸碱质子理论判断酸、碱和两性物质2、运用Ka(Kb)计算弱酸(弱碱)溶液的pH值3、缓冲溶液的配制和pH值计算4、盐溶液的pH值计算5、溶度积规则的应用和溶解平衡体系中物质浓度的计算6、多重平衡体系中平衡常数和平衡浓度的计算第七章原子结构和元素周期系基础知识:1、原子的组成2、电子运动的特点——能量的量子化、波粒二象性3、核外电子运动状态的描述——波函数和原子轨道,四个量子数4、核外电子运动的统计解释——概率和概率密度、电子云5、核外电子的排布——屏蔽效应和钻穿效应,原子轨道的能级,电子排布三原则,原子的电子构型6、原子结构与元素周期表的关系7、元素的性质——原子半径、电离能、电子亲合能、电负性基本理论:1、玻尔理论2、薛定谔方程3、原子结构的量子力学理论4、电子排布三原则5、元素周期律6、元素的性质7、斯莱特规则基本技能:1、用四个量子数表示核外电子运动状态,根据n、l、m确定原子轨道、轨道的角度分布2、电子云的形状和表示4、熟悉原子结构与元素周期表的关系,能正确确定某元素在周期表的位置和结构5、元素的性质的变化与原子结构的关系第八章分子结构基础知识:1、化学键、键参数和分子的性质2、离子键、晶格能3、共价键、共价键的类型(σ键、π键)和性质,杂化和杂化轨道成键分子轨道、反键分子轨道、键级4、金属键5、分子间作用力和氢键基本理论:1、离子键理论2、共价键的现代价键理论、杂化轨道理论和价层电子对互斥理论;3、共价键的分子轨道理论4、金属键理论——自由电子理论和能带理论5、波恩—哈伯循环基本技能:1、用键参数判断共价键的强度、稳定性、分子的空间构型2、用热力学数据计算离子键形成过程中的能量变化,计算晶格能3、用共价键的现代价键理论、杂化轨道理论和价层电子对互斥理论,解释一般分子的成键情况、杂化方式、空间构型4、用共价键的分子轨道理论,说明某些简单双原子分子及相应离子的结构、键级和稳定性5、用金属键能带理论,说明导体、半导体、绝缘体的性质6、能分析分子间作用力的类型、存在范围、氢键的形成情况,能从分子间作用力的角度解释物质的物理性质第九章晶体结构基础知识:1、晶体的特征和晶胞参数2、离子晶体(离子半径、构型、配位数、晶格能),原子晶体,分子晶体,金属晶体基本理论:1、晶体结构理论基本技能:1、熟悉四种晶体的特征和质点间作用力的不同点,正确判断晶体类型2、掌握晶体类型与物质性质的关系3、用离子极化理论解释离子极化作用对键型和化合物性质的影响第十章氧化还原和电化学基础知识:1、氧化数、氧化还原反应、歧化反应2、原电池、电极、电极反应与电池反应3、电极电势、标准电极电势、电池电动势4、元素电势图、pH电势图5、电解基本理论:1、电化学理论2、电极电势的双电层理论;3、标准电极电势4、能斯特方程5、电解原理基本技能:1、正确完成氧化还原方程的配平2、明确氧化还原反应与电化学的关系,掌握原电池的符号表示,能根据原电池正确书写电池反应式3、用标准电极电势说明氧化剂或还原剂的相对强弱,计算标准电池电动势,计算平衡常数,判断反应方向4、利用能斯特方程计算非标准电极电势和非标准电池电动势5、掌握元素电势图、pH电势图的应用第十一章配位化合物基础知识:1、配合物的基本概念(配合物、中心离子、配位体、配位原子、配位数)2、配合物的命名、配合物的分类、单齿配体和多齿配体、螯合物3、高自旋配合物、低自旋配合物5、配位平衡、K稳和K不稳基本理论:1、配合物的价键理论3、配位平衡基本技能:1、掌握配合物的命名2、用配合物的价键理论,解释配合物的形成、中心原子的杂化类型及配合物的空间构型,说明配合物的稳定性3、掌握配位平衡的相关计算,计算配位平衡体系中离子的浓度,计算K稳,判断配合物的稳定性4、掌握配位平衡与溶解平衡,配位平衡与氧化还原平衡等综合平衡的计算问题,讨论难溶盐的溶解性,计算配离子电对的φ°值5、了解螯合物的特殊稳定性与结构的关系第十二章氢、稀有气体基础知识:1、氢气,氢气的性质、制法和用途2、氢化物3、稀有气体、稀有气体的性质与分离5、氙的重要化合物基本理论:1、共价键的现代价键理论2、杂化轨道理论和价层电子对互斥理论;基本技能:1、掌握氢气的性质、氢化物的类型,了解氢能源的优点2、了解稀有气体的发现史3、了解氙的重要化合物的制备与性质第十三章卤素基础知识:1、卤素的通性2、卤素单质的结构、性质及其变化规律3、卤化氢和氢卤酸、卤化物和卤素互化物5、卤素含氧化合物:氧化物、含氧酸及其盐4、拟卤素5、氟及其化合物的特殊性基本理论:1、热力学知识、原子结构理论、分子结构理论、杂化轨道理论3、卤素单质、次卤酸、次卤酸盐的歧化条件及其变化规律4、卤化氢的还原性、热稳定性和酸性的变化规律5、卤素含氧酸的氧化性、热稳定性和酸性的变化规律基本技能:1、掌握卤素单质及其重要化合物的结构、性质、制备和用途2、能解释,按HF-HCl-HBr-HI顺序,酸强度递增,稳定性递减、还原性递增的变化规律3、掌握卤素元素电势图的应用4、掌握卤素含氧酸性质的变化规律,解释含氧酸及其盐的氧化性、热稳定性和酸性的强弱5、根据X-还原性差别,掌握制取HX的不同方法。
氢元素
氢是一种化学元素,在元素周期表中位于第一位。
它的原子是所有原子中最小的。
氢通常的单质形态是氢气。
它是无色无味无臭,极易燃烧的由双原子分子组成的气体,氢气是最轻的气体。
中文名:氢外文名:H ydrogen 拼音:qīng 化学符号:H原子质量:1.00794u 原子序数:1【物质状态】:气态【元素在太阳中的含量(%)】:75 【地壳中含量】:(%)1.5【大气含量】:0.0001 %【质子质量】:1.673E-27 【质子相对质量】:1.00794 【所属周期】:1【所属族数】:IA【摩尔质量】:1g/mol【氢化物】:无【氧化物】:H₂O【最高价氧化物】:H₂O原子属性【外围电子排布】:1s1 【核外电子排布】:1【电子层】:K【原子量】:1.00794【熔化热】:0.05868 kJ/mol化学键键能(KJ/mol)H-H454H-F566H-Cl431 H-Br366符号质子数中子数原子质量单位(u)半衰期原子核自旋丰度丰度的变化率1H101.00782503207(10)稳定[>2.8×1023年]1/2+0.999885(70)0.999816-0.9999742H112.0141017778(4)稳定1+0.000115(70)0.000026-0.000184 3H12 3.0160492777(25)12.32(2) 年1/2+4H134.02781(11)1.39(10)×10-22 s [4.6(9) MeV]2-5H145.03531(11)>9.1×10-22 s(1/2+)6H156.04494(28)2.90(70)×10-22 s [1.6(4) MeV]2-#7H167.05275(108)#2.3(6)×10-23# s [20(5)# MeV]1/2+#备注:画上#号的数据代表没有经过实验的证明,只是理论推测而已,而用括号括起来的代表数据不确定性。
干货---最全的主族元素及其化合物的用途(每族一篇,共8篇,成系列)
化学干货-----各族元素及其化合物的用途(1)第IA族冯芳芳氢1.单质氢气的用途:氢气在工业上有许多重要应用:化学工业-合成氨;石油裂解加氢、煤炭的加氢液化、油脂加氢固化、塑料合成,无机有机精细化工合成等等;冶金工业-钢铁冶金,铁矿石直接氢还原制海绵铁,然后在氢氛中直接炼钢、钨钼等希有金属冶炼等。
以上这些应用大概用掉了世界氢产量的90%。
这些用途依赖于氢的独特物理和化学性质,是其他物质所不能替代的。
氢气还有一些其他少量用途,例如充装氢气球、无线电元件的烧氢、科学实验中的还原性载气或还原性保护气氛、原子核科研中作为靶核或核反应产物的检定介质等。
2. 氢在能源方面的应用:氢气属二级能源,需要用另一种有效能源从水中制取。
但由于它燃烧后生成水,不会污染环境,成为21世纪非常有前途的无污染能源之一。
它具有以下优点:l)原料来源于地球上贮量丰富的水,因而资源不受限制。
2)氢气燃烧时发热量很大,其燃烧热为同质量石油燃烧的三倍。
作为一种动力燃料,氢气在许多方面比汽油和柴油更优胜,用氢的发动机更易发动,特别是在寒冷的气候里。
3)氢气作为燃料的最大优点是它燃烧后生成物是水,不会污染环境。
4)有可能实现能源的贮存,也有可能实行经济、高效的输送。
锂1. 单质锂的用途:锂的用途越来越广泛,如锂和锂合金是一种理想的高能燃料。
锂电池是一种高能电池。
LiBH4是一种很好的贮氢材料。
锂在核动力技术中将起重要作用,它是较理想的反应堆传热介质,热容量大(接近水)、液态范围宽(453.5~1615K)、粘度小、比重小、蒸气压低。
63Li、73Li被中子轰击都可得到氚,63Li与氚可以进行热核反应,受控热核聚变反应堆可以用氚和锂作燃料。
锂合金也是良好的轻质结构材料。
在金属熔炼中常用Li作除气剂,除去溶解在熔融金属中的氮气和氧气。
2. 锂的化合物的用途:a. 铌(或钽)酸锂: 锂的铌酸盐和钽酸盐是著名的激光材料。
b. LiH: 在有机合成中作还原剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学性质
XeF4 + H 2 Xe + 4 HF ; →
130o C
3 3 XeF4 + 6 H 2O XeO3 + 2 Xe + O2 + 12 HF ; → 2 HF XeF4 + Pt → PtF4 + Xe; XeOF2 + H 2 Xe + 2 HF →
400o C
完全水解与不完全水解
• 其它反应: 其它反应:
XeF6 +SiO 2 → XeO F4 +SiF4 ↑ 2XeF6 +XO 3 → 3XeO F4
盛放 氟化 物的 容器? 容器?
5.结构: 结构: 结构 a.XeF2——sp3d杂化,直线形,孤对电子 杂化, 杂化 直线形, 3; ; b.XeF4——sp3d2杂化,平面正方形,孤对 杂化,平面正方形, 电子2; 电子 ; c.XeF6——sp3d3杂化,变形八面体,孤对 杂化,变形八面体, 电子1。 电子 。 *电离能小的稀有气体原子当与电负性很大 电离能小的稀有气体原子当与电负性很大 电离能小的 的原子接近时,5p电子跃迁到5d轨道上 电子跃迁到5d轨道上, 的原子接近时,5p电子跃迁到5d轨道上, 以单电子形成共价键。 以单电子形成共价键。
5、稀有气体的应用 、
• 光学:氦、氖激光器、氩离子激光器、霓 光学: 氖激光器、氩离子激光器、 虹灯; 虹灯; • 冶金:氩和氦焊接提供惰性气氛; 冶金:氩和氦焊接提供惰性气氛; • 医学:氙灯能放射紫外线,氪、氙、氡的 医学:氙灯能放射紫外线, 同位素被用来测量脑血流量; 同位素被用来测量脑血流量; • 核聚变原料; 核聚变原料; • 其它:代替氢气(氦气球),超低温技术 其它:代替氢气(氦气球), ),超低温技术
1、稀有气体的发现 、
• 第一发现的是氩; 第一发现的是氩; • 从地球之外发现的氦; 从地球之外发现的氦; • 经过多方努力,从空气的分馏物中又发现了氖, 经过多方努力,从空气的分馏物中又发现了氖, 意外地又发现了氪; 意外地又发现了氪; • 空气中分馏得到氙; 空气中分馏得到氙; • 从放射性矿物中发现了氡。 从放射性矿物中发现了氡。 *契而不舍的科学家 契而不舍的科学家——莱姆赛(He、Ar、Ne、 莱姆赛( 契而不舍的科学家 莱姆赛 He、Ar、Ne、 Ke、Xe的发现均与他有关 的发现均与他有关) Ke、Xe的发现均与他有关); *元素周期系的指导作用。 元素周期系的指导作用。
2、稀有气体的分布 、
• 在地壳(包括大气层、水层和岩石圈)、 在地壳(包括大气层、水层和岩石圈)、 太阳和其它星球上都有分布; 太阳和其它星球上都有分布; • 分布量极不均匀:地壳中含量极少;但就 分布量极不均匀:地壳中含量极少; 整个宇宙而言其含量居第二。 整个宇宙而言其含量居第二。
3、稀有气体的分离 、
1175kJ/mol
O2+PtF6-
• 等体积的 等体积的PtF6与Xe混合,得到一种红色的离子 混合, 混合 得到一种红色的离子 固体: 型固体:Xe+PtF6- ∆rHm0=-66.56kJ/mol
(1)氙的化学: )氙的化学: • 稀有气体原子中最活泼的一个; 稀有气体原子中最活泼的一个; • 最先合成出的稀有气体化合物: 最先合成出的稀有气体化合物:
• 利用稀有气体的沸点不同: 利用稀有气体的沸点不同: He:-268.9 ; Ne:-243.1; Ar:-185.9 ; : : ; : Ke:-153.4 ; Xe:-108.1 ; N2:-195.8; : : ; O2:-183.0 设计的分馏方案: Ar逸出(O2不逸出?) 逸出( 不逸出? 设计的分馏方案: 逸出
蒸馏 [O2、Xe、Ke、Ar](液态) 、 、 (液态) 、 空气液化 +Cu (?) [Ke、Xe、O2 ] 、 、 液化除氮 [N2、He、Ne](气态) 、 (气态) 、 (?) [He、Ne] 、 +Ca
• 用Cu脱氧:Cu+O2 CuO 脱氧: + 脱氧 T<500K(?),可以将稀有气体中的氧降 ( ),可以将稀有气体中的氧降 至ppm级; 级 • 用Ca脱氮:3Ca+N2 Ca3N2 脱氮: 脱氮 + T~700K,须先脱氧!(?) !(? ~ ,须先脱氧!(
第三章 稀有气体、氢 及其化合物
一、稀有气体的一般性质
• 最外层都有 个电子; 最外层都有8个电子 个电子; • 化学性质非常不活泼:高电离能、接近于 化学性质非常不活泼:高电离能、 零的电子亲合能(?); 零的电子亲合能 ; • 单原子分子的形式存在,彼此之间仅存微 单原子分子的形式存在, 弱的分子间力; 弱的分子间力; • 熔、沸点、蒸发热、水中的溶解度均低; 沸点、蒸发热、水中的溶解度均低; • 一般靠物理方法(分级蒸馏或选择性吸附) 一般靠物理方法(分级蒸馏或选择性吸附) 进行分离。 进行分离。
• 英国化学家卡的文什实验时发现残余气体。 英国化学家卡的文什实验时发现残余气体。 • 100年后,英国物理学家发现由空气得到的氮 年后, 年后 的密度和用氮化物制得的氮的密度不一样 前者1.2572g/L,后者 (前者 ,后者1.2507g/L)Ne,经光 经光 谱分析,才发现为一种新的元素Ke。 谱分析,才发现为一种新的元素 。 • 日全食观察中,在太阳光谱中发现的新元素 日全食观察中, He。
加拿大化学家巴特列发现: 加拿大化学家巴特列发现: • O2+PtF6 O2+PtF6• 极强的氧化剂 极强的氧化剂PtF6从O2中夺取了电子的结果; 中夺取了电子的结果;
直径 电离能I 电离能 1 晶格能
Xe
400pm
180kJ/mol
1170kJ/mol
XePtF6?
O2
400pm
180kJ/mol
化学性质
讨论
1.都具有氧化性,且随n值增大,氧化性增强: 都具有氧化性,且随 值增大 氧化性增强: 值增大, 都具有氧化性 • XeF2、XeF4、XeF6同H2反应的温度分别是 400、130、25°C ; 、 、 ° 同水反应生成XeO3,而XeF2不 • XeF4、XeF6同水反应生成 反应; 反应; 2.都是氟化剂:随n增大,氟化能力增大(同 都是氟化剂: 增大, 都是氟化剂 增大 氟化能力增大( 氧化能力); 氧化能力); 3.XeF6的化学性质最活泼:室温下 的化学性质最活泼:室温下XeF2、 XeF4不与 不与SiO2反应,而XeF6在室温下就反 反应, 应。
二、稀有气体元素的化合物
• 最初探究卤化物的形成 最初探究卤化物的形成——基本不成功; 基本不成功; 基本不成功 • 稀有气体的包合物: 稀有气体的包合物: 1。包合物:大分子(主体分子)包容着小分 。包合物:大分子(主体分子) 客体分子),靠分子间力结合; ),靠分子间力结合 子(客体分子),靠分子间力结合; 2。稀有气体的水包合物 。稀有气体的水包合物——稀有气体分子填 稀有气体分子填 充在氢键骨架之中; 充在氢键骨架之中; 3。稀有气体的氢醌包合物 。稀有气体的氢醌包合物——稀有气体分子 稀有气体分子 填充在氢醌组合形成的骨架中; 填充在氢醌组合形成的骨架中; • 复合氟化物 复合氟化物——开创了稀有气体化合物的合 开创了稀有气体化合物的合 成
8
8
*注意合成条件和不同的浓度配比: 注意合成条件和不同的浓度配比: 注意合成条件和不同的浓度配比 只能在密闭的镍反应器中加热进行。 只能在密闭的镍反应器中加热进行。
稀有气体元素的化合物为什么 首先合成出的是Xe的 首先合成出的是 的?
氟与氙的化合物: 氟与氙的化合物: • 催化剂对氙的氟化物的形成尤为重要, 催化剂对氙的氟化物的形成尤为重要, 特别是钴、 特别是钴、镍、钙的氟化物以及银和镍 的氧化物; 的氧化物; • 有些化合物还可以选择性的催化:如 有些化合物还可以选择性的催化: MgF2催化生成 催化生成XeF2,NiF2只催化生成 XeF6; • F与Xe体系只生成 体系只生成XeFn,n=2、4、6没 与 体系只生成 , = 、 、 没 有奇数的化合物。 有奇数的化合物。
的特点: (2)XeFn的特点: ) 的特点
• 制备以加热合成较有意义,控制不同的 制备以加热合成较有意义,控制不同的F 的平衡体系的特点; -Xe比,利用 -Xe的平衡体系的特点; 比 利用F- 的平衡体系的特点
物理性质
• 密度、熔点、键能、键长均随n值增大而减 密度、熔点、键能、键长均随 值增大而减 小; • 有时,某些性质呈现两头大中间小的趋势: 有时,某些性质呈现两头大中间小的趋势: 如在无水HF中的溶解度唯独 中的溶解度唯独XeF4不溶,其 不溶, 如在无水 中的溶解度唯独 它都溶; 它都溶;
Xe+F2 XeF2 → Xe+2F2 XeF4 → Xe+3F2 XeF6 →
573K,6.18×10 5Pa Xe:F2 =1:20 873K,6.18×10 5Pa Xe:F2 =1:5 637K,1.03×10 5Pa Xe:F2 =2:1
K=8.79 × 10 4 K=1.07 × 10 K=1.01× 10
区别于 氟化剂 是氟的 受体
注意氟桥键与一般氟氙键的区别! 注意氟桥键与一般氟氙键的区别!
• 与水反应: 与水反应:
1 XeF2 +H2O → Xe+2HF+ O2 2 6XeF4 +12H2O → 2XeO3 +4Xe+24HF+3O2 XeF6 +3H2O → XeO3 +6HF XeF6 +3H2O → XeOF4 +2HF
X eF6 + 3 H 2 X e + 6 H F ; → X eF6 + 6 H g X e + 3 H g 2 F 2 ; → X eF6 + H 2 O X eO F 4 + 2 H F ; → X eF6 + 3 H 2 O X eO 3 + 6 H F ; → 2 X eF6 + S iO 2 2 X eO F 4 + S iF 4 ; → 2 X eO F + S iO 2 2 X e 2 O 2 F 2 + S iF 4 ; → → 2 X e 2 O 2 F 2 + S iO 2 2 X eO 3 + S iF 4 ; → X eF6 + 6 H C l X e + 3 C l 2 + 6 H F ; → X eF6 + 8 N H 3 X e + N 2 + 6 N H 4 F
