第二节分子的立体构型(1,2,3课时)
人教版高中化学选修3 2.2分子的立体结构 课件精选课件

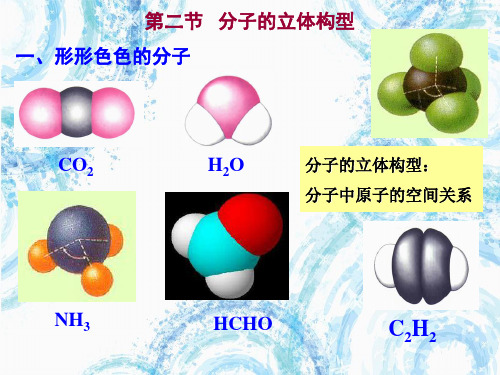
直线形
CO2、 BeCl2
3 0 平面三角形 平面三角形 BF3、CH2O
3
2 1 平面三角形 V形
NO2
4
0
四面体形
四面体形
CH4、SO42-、 NH4+、P4
4
3
1
四面体形
三角锥形
H3O+、NH3、 SO32-
2 2 四面体形
V形
H20、H2S、 NH2-
向你的美好的希冀和追求撒开网吧,九百九十九次落空了,还有一千次呢人若软弱就是自己最大的敌人游手好闲会使人心智生锈。故天将降大任于斯人也,必先苦其心 乏其身,行拂乱其所为,所以动心忍性,增益其所不能。让生活的句号圈住的人,是无法前时半步的。少一点预设的期待,那份对人的关怀会更自在。榕树因为扎根于 越长越茂盛。稗子享受着禾苗一样的待遇,结出的却不是谷穗。进取乾用汗水谱烈军属着奋斗和希望之歌。患难可以试验一个人的品格,非常的境遇方可以显出非常的 角度来看它。机会只对进取有为的人开放,庸人永远无法光顾。困苦能孕育灵魂和精神的力量骄傲,是断了引线的风筝,稍纵即逝;自卑,是剪了双翼的飞鸟,难上青 圆规的两只脚都动,永远也画不出一个圆。有困难是坏事也是好事,困难会逼着人想办法,困难环境能锻炼出人才来。只存在於蠢人的字典里。青,取之于蓝而青于蓝 然后知松柏之后凋也。积极的人在每一次忧患中都看到一个机会,而消极的人则在每个机会都看到某种忧患。一个能从别人的观念来看事情,能了解别人心灵活动的人 志当存高远。绳锯木断,水滴石穿让我们将事前的忧虑,换为事前的思考和计划吧!锲而舍之,朽木不折;锲而不舍,金石可镂。没有天生的信心,只有不断培养的信 下而求索天行健,君子以自强不息。会当凌绝顶,一览众山小。丈夫志四海,万里犹比邻。也,而不可夺赤。信言不美,美言不信。善者不辩,辩者不善。知者不博, 和其光,同其尘,是谓“玄同”。故不可得而亲,不可得而疏;不可得而利,不可得而害;不可得而贵,不可得而贱。故为天下贵。天下之至柔,驰骋天下之至坚。无 益。知者不言,言者不知。更多老子名言敬请关注习古堂国学网的相关文章。柔弱胜刚强。鱼不可脱於渊,国之利器不可以示人。善为士者,不武;善战者,不怒;善 之下。是谓不争之德,是谓用人之力,是谓配天古之极是以圣人后其身而身先,外其身而身存无为而无不为。取天下常以无事,及其有事,不足以取天下。合抱之木, 土;千里之行,始於足下。多言数穷,不如守中。天下莫柔弱於水,而攻坚强者莫之能胜,以其无以易之。天长地久。天地所以能长且久者,以其不自生,故能长生。 身而身存。非以其无故能成其私。譬道之在天下,犹川谷之於江海。江海之所以能为百谷王者,以其善下之,故能为百谷王。是以圣人欲上民,必以言下之;欲先民, 民不重,处前而民不害。是以天下乐推而不厌。以其不争,故天下莫能与之争。是以圣人抱一为天下式。不自见,故明;不自是,故彰;不自伐,故有功;不自矜,故 之争。故道大,天大,地大,人亦大。域中有四大,而人居其一焉修之於身,其德乃真;修之於家,其德乃余;修之於乡,其德乃长;修之於邦,其德乃丰;修之於天 以家观家,以乡观乡,以邦观邦,以天下观天下。吾何以知天下然哉?以此。慈故能勇;俭故能广;不敢为天下先,故能成器长。今舍慈且勇;舍俭且广;舍後且先; 将救之,以慈卫之。道生一,一生二,二生三,三生万物。知人者智,自知者明。胜人者有力,自胜者强。知足者富。强行者有志。一个实现梦想的人,就是一个成功 完全投入于权力和仇恨中,你怎么能期望他还有梦梦想无论怎样模糊,总潜伏在我们心底,使我们的心境永远得不到宁静,直到这些梦想成为事实。落叶——树叶撒下 腰拾起;与其肩负苦涩的回忆,不如走向明天,淋浴春雨梦想绝不是梦,两者之间的差别通常都有一段非常值得人们深思的距离。一个人要实现自己的梦想,最重要的 和行动。一个人如果已经把自己完全投入于权力和仇恨中,你怎么能期望他还有梦?如果一个人不知道他要驶向哪个码头,那么任何风都不会是顺风。最初的梦想紧握 让一切都��
高中化学 选修3 第二章 分子结构与性质第2节分子的立体构型第1课时价层电子对互斥理论学生使用

选修3 第一章原子结构与性质第2节分子的立体构型第1课时价层电子对互斥理论学习目标:1.认识共价分子结构的多样性和复杂性。
2.理解价层电子对互斥理论的含义。
3.能根据有关理论判断简单分子或离子的构型。
教学难点:1、理解价层电子对互斥理论的含义2、能根据有关理论判断简单分子或离子的构型教学重点:1、理解价层电子对互斥理论的含义2、能根据有关理论判断简单分子或离子的构型教学过程:知识回顾:1.分析下列化学式中画有横线的元素,选出符合要求的物质并填空。
A.NH3B.H2O C.HCl D.CH4E.C2H6F.N2(1)所有的价电子都参与形成共价键的是______;(2)只有一个价电子参与形成共价键的是______;(3)最外层有未参与成键的电子对的是______;(4)既有σ键,又有π键的是______;(5)既有极性键又有非极性键的是__________;(6)分子构型为正四面体的是____________。
【解析】A.NH3中N原子与3个H原子形成3个σ键,还有一对不成键电子;B.H2O中O原子与2个H原子形成2个σ键,还有两对不成键电子;C.HCl中Cl原子与1个H原子形成1个σ键,还有三对不成键电子;D.CH4中C原子与4个H原子形成4个σ键,所有价电子都参与成键,其分子构型为正四面体形;E.C2H6中C原子分别与3个H原子及另1个C原子形成4个σ键,所有价电子都参与成键;C—H为极性键,C—C为非极性键;F.N2中N原子与另1个N原子形成1个σ键,2个π键,还有一对不成键电子。
答案(1)DE (2)C (3)ABCF (4)F (5)E (6)D2.常见分子的立体构型通常有两种表示方法,一是比例模型,二是球棍模型。
请你用短线将下列几种分子的比例模型、球棍模型连接起来。
【解析】 本题主要考查常见分子的立体构型。
H 2O 分子为三原子分子呈V 形,应选E—c ;NH 3分子为四原子分子呈三角锥形,应选B—d ; CCl 4分子为五原子分子呈正四面体形,应选C—a ; CO 2分子为三原子分子呈直线形,应选A—b 。
分子的立体构型(VSEPR)

第二节 分子的立体结构
共价键
复习回顾
σ键 成键方式 “头碰头”,呈轴对称
π键 成键方式 “肩并肩”,呈镜像对称
键参数
键能
衡量化学键稳定性
键长 键角 描述分子的立体结构的重要因素
一、形形色色的分子
思考:在O2、HCl这样 的双原子分子中存在
分子的立体结构问题
吗?何谓“分子的立
三原子分子
分子 的立 四原子分子 体结
构
直线 形,如CO2 V 形,如H20
平面三角 形,如HCHO、BF3
三角锥 形,如NH3
五原子分子——— 最常见的是正四面体形,如CH4
同为三原子分子,CO2 和 H2O 分子的空间结 构却不同,什么原因?
直线形 V形
同为四原子分子,CH2O与 NH3 分子的的空 间结构也不同,什么原因?
体结构”?
O2
HCl
H2O
CO2
所谓“分子的立体结 构”指多原子构成的 共价分子中的原子的 空间关系问题。
C2H2
CH2O
COCl2
NH3
P4
CH4
CH3CH2OH CH3COOH
C6H6
C8H8
CH3OH
C60
C20
C40
C70
分子的立体结构是怎样测定的?
测分子体结构:红外光谱仪→吸收峰→分析。
型
分子的立体结 构模型
分子 的空
间构 型
CO2
20
2
直线形
直线形
SO2
21
3
SO3
30
3
PCl3
31
4
H2S
22
4
高中化学优质课第2章第2节分子的立体构型第1课时课件(30张)

⇓
⇓ 分子的立体构型——略去孤电子对在价层电子对互斥模型中占有的空间
活学活用 3.用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型, 有时也能用来推测键角大小。下列判断正确的是 A.SO2、CS2、HI都是直线形的分子 B.BF3键角为120°,SnBr2键角大于120°
√C.COCl2、BF3、SO3都是平面三角形的分子
范例 CO2、BeCl2
n=3
_平__面__三__角__形_
CH2O、BF3
n=4
正__四__面__体__形__
CH4、CCl4
n=5
三角双锥形
PCl5
n=6
正八面体形
SF6
(2)中心原子上有孤电子对(价电子中未参与形成共价键的电子对)的分 子的立体构型:中心原子上的 孤电子对 占据中心原子周围的空间,与 成键电子对互相排斥,使分子的立体构型发生变化,如: ①H2O为AB2型分子,氧原子上的两对孤电子对参与互相排斥,所以H2O
D.PCl3、NH3、PCl5都是三角锥形的分子
解析 答案
解析 SO2是V形分子,CS2、HI是直线形的分子,A错误; BF3键角为120°,是平面三角形结构,而Sn原子价电子数是4,在 SnBr2中两个价电子与Br形成共价键,还有一对孤对电子,对成键电子 有排斥作用,使键角小于120°,B错误; COCl2、BF3、SO3都是平面三角形的分子,键角是120°,C正确; PCl3、NH3都是三角锥形的分子,而PCl5是三角双锥形结构,D错误。
NH3
五原子分子 CH4
约120° 平__面__三__角__形__ 107° _三__角__锥__形__
109°28′ 正__四__面__体__形__
化学选修3第二章第二节分子的立体构型
3个sp2杂化轨 4个sp3杂化轨 道 道
1200 1090 28’
1800
空 间 构 型
实 例
直 线形
平面三角形
四面体形 CH4 , H2O
BeCl2 CO2 C2H2 BF3 , C2H4
杂化轨道只用于形成σ键或者用来容纳孤对电子,剩 余的p轨道可以形成π键
1、氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是 因为( C ) A.两种分子的中心原子杂化轨道类型不同,NH3为sp2杂化, 而CH4是sp3杂化 B.NH3分子中N原子形成3个杂化轨道,CH4分子中C原子形 成4个杂化轨道 C.NH3分子中有未成键的孤电子对,它对成键电子的排斥 作用较强 D.氨气分子中氮原子电负性强于甲烷分子中的碳原子 2、用价层电子对互斥理论预测H2S和BF3的立体结构,两个 结论都正确的是( D )
sp2杂化轨道的形成过程
120° z z z z
y x x
y x
y x
y
sp2杂化轨道由1个s轨道和2个p轨道杂化而得到三个sp2杂化轨道。 三个杂化轨道在空间分布是在同一平面上,互成120º 例如:C2H4
C2H4(sp2杂化)
sp杂化轨道的形成过程
z
z
180°
z
z
y x x
y x
y x
y
sp杂化轨道由1个s轨道和1个p轨道杂化而得到两个sp杂化轨道。 两个杂化轨道在空间分布呈直线型,互成180º 例如:C2H2
4、下列分子或离子中,不含有孤对电子的是( D ) A、H2O B、H3O+ C、NH3 D、NH4+
5、以下分子或离子的结构为正四面体,且键角为 109°28′ 的是( B ) ①CH4 ②NH4+ ③CH3Cl ④P4 ⑤SO42A、①②③ B、①②④ C、①②⑤ D、①④⑤
高二化学选修3第二章第二节分子的立体构型 杂化轨道理论

为了解决这一矛盾,鲍林提出了杂化轨道理论,
三、杂化轨道理论
1、理论要点
① 同一原子中能量相近的不同种原子轨道在成 键过程中重新组合,形成一系列能量相等的新轨 道的过程叫杂化。形成的新轨道叫杂化轨道,用 于形成σ键或容纳孤对电子 ② 杂化轨道数目等于各参与杂化的原子轨道数目 之和 ③ 杂化轨道成键能力强,有利于成键 ④ 杂化轨道成键时,满足化学键间最小排斥原 理,不同的杂化方式,键角大小不同 ⑤ 杂化轨道又分为等性杂化和不等性杂化两种
④ 其它杂化方式
dsp2杂化、sp3d杂化、sp3d2杂化、d2sp3杂化
例如:sp3d2杂化:SF6 构型:四棱双锥 正八面体
此类杂化一般是金属作为中心原子 用于形成配位化合物
小结:杂化轨道的类型与分子的空间构型 • 杂化轨道类型 sp
参加杂化的轨道 s+p 杂化轨道数 2
sp2
s+(2)p 3
+
构型 120° 正三角型
BF3的空间构型 为平面三角形
F
2p
F
激发 2s
B
B: 2s22p1
2s
2p
F
sp2杂化
sp2
③ sp3杂化
2p
2s
以C原子为例
2s 2p
激发
C
杂化
C
sp 杂 化
3
基态 激发态
1个s轨道和3个p轨道杂化形成4个sp3杂化轨道
构型 109°28′ 正四面体型 4个sp3杂化轨道可形成4个σ键 价层电子对数为4的中心原子 采用sp3杂化方式
CH4的空间构型为正四面体
C:2s22p2
2s
2p
激发 2s
2p
sp 杂化
《分子的立体构型》完整ppt课件
SP
直线形
CH2O
0
CH4 0
SO2
1
NH3
1
0+3=3 0+4=4 1+2=3 1+3=4
SP2
平面三角形
SP3
正四面体形
SP2
V形
碳的sp2杂化轨道 .
三、杂化轨道理论简介 ②sp2杂化 C2H4
.
三、杂化轨道理论简介
③sp杂化
sp杂化:夹角为180°的直线形杂化轨道。
.
三、杂化轨道理论简介 乙炔的成键
.
三、杂化轨道理论简介
③sp杂化 大π 键
C6H6
.
.
基态N的最外层电子构型为 2s22p3,在H影响下, N 的一个2s轨道和三个2p 轨道进行sp3 不等性杂化, 形成四个sp3 杂化轨道。其中三个sp3杂化轨道中各 有一个未成对电子,另一个sp3 杂化轨道被孤对电 子所占据。 N 用三个各含一个未成对电子的sp3 杂 化轨道分别与三个H 的1s 轨道重叠,形成三个 N―H键。由于孤对电子的电子云密集在N 的周围, 对三个N―H键的电子云有比较大的排斥作用,使 N―H键之间的键角被压缩到 107 o18',因此NH3 的空 间构型为三角锥形。 .
0
H
H
..
H2O H O. . H
O HH
2
2
.. ..
.. ..
..
NH3 H N. . H H N H
3
1
H
H
.
立体结构
应用反馈:
0 1 2
0
1 0
0
0
PO43-
0
2 2 2
3 3
【人教版】化学选修三分子的立体构型1
【人教版】化学选修三分子的立体构 型1优秀 课件( 实用教 材)
2.成键σ键电子对和未成键的孤电子对
价层电子对数 = σ键个数+中心原子上的孤电子对个数
σ键电子对数 = 与中心原子结合的原子数
中心原子上的孤电子对数 =½(a-xb) a: 微粒的价电子总数
原子:为中心原子的价Байду номын сангаас子数 阳离子:a为中心原子的价电子数减去离子的电荷数 阴离子:a为中心原子的价电子数加上离子的电荷数 x 为与中心原子结合的原子数 b 为与中心原子结合的原子最多能接受的电子数 (H为1,其他原子为“8-该原子的最外层电子数)
C6H6
CH3OH
【人教版】化学选修三分子的立体构 型1优秀 课件( 实用教 材)
资料卡片: 形形色色的分子
【人教版】化学选修三分子的立体构 型1优秀 课件( 实用教 材)
C60
C70
【人教版】化学选修三分子的立体构 型1优秀 课件( 实用教 材) 【人教版】化学选修三分子的立体构 型1优秀 课件( 实用教 材)
【人教版】化学选修三分子的立体构 型1优秀 课件( 实用教 材)
同为三原子分子,CO2 和 H2O 分子的空间结 构却不同,什么原因?
【人教版】化学选修三分子的立体构 型1优秀 课件( 实用教 材)
直线形 V形
【人教版】化学选修三分子的立体构 型1优秀 课件( 实用教 材)
同为四原子分子,CH2O与 NH3 分子的的空 间结构也不同,什么原因?
H2O H :O : H
2
2
2
4
NH3 H :N :H
3
H
H
CH4 H :C :H
4
:
:: :
人教版化学《分子的立体构型》完美课件
O2
HCl
活动:
2、利用几何知识分析一下,空间分布的三个点是否一 定在同一直线上? 迁移:三个原子构成的分子,将这3个原子看成三个点, 则它们在空间上可能构成几种形状?分别是什么?
在多原子构成的分子中,由于原子间排列的空间 位置不一样,使得分子有不同的结构,这就是所 谓的分子的立体构型。
科学视野—分子的立体结构是怎样测定的?
(指导阅读P39)
早年的科学家主要靠对物质的宏观性质进行系统总结得出规律后进 行推测,如今,科学家已经创造了许许多多测定分子结构的现代仪 器,红外光谱就是其中的一种。
分子中的原子不是固定不动的,而是不断地振动着的。所谓分子立 体结构其实只是分子中的原子处于平衡位置时的模型。当一束红外 线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红 外线,再记录到图谱上呈现吸收峰。通过计算机模拟,可以得知各 吸收峰是由哪一个化学键、哪种振动方式引起的,综合这些信息, 可分析出分子的立体结构。
一、形形色色的分子
1、三原子分子立体结构
CO2
直线形
180°
H2O
V形 105°
2、四原子分子立体结构
HCHO
平面三角形 120°
NH3
三角锥形 107°
人教版化学选修三第二章第二节分子 的立体 构型(第 1、2课 时)(共 62张PP T)
3、五原子分子立体结构
正四面体
人教版化学选修三第二章第二节分子 的立体 构型(第 1、2课 时)(共 62张PP T)
人教版化学选修三第二章第二节分子 的立体 构型(第 1、2课 时)(共 62张PP T)
人教版化学《分子的立体构型》课件完美版
人教版化学选修三第二章第二节分子 的立体 构型3课 时(共7 4张PPT )
同为三原子分子,CO2 和 H2O 分子的空间结构却不 同,什么原因?分析中心原子的价电子是否全部参加成 键?
同为四原子分子,CH2O与 NH3 分子的的空间结构 也不同,什么原因?
人教版化学选修三第二章第二节分子 的立体 构型3课 时(共7 4张PPT )
物
原子数
对
子对 子对数
: : :: : : : :
H2O H :O : H
2
2
2
4
NH3 H :N :H
3
HH
CH4 H :C :H
4
H
CO2 :O::C::O: 2
3
14
4
0
4
2
0
2
价层电子对数 =δ键个数+中心原子上的孤对电子对个数
δ键电子对数 = 与中心原子结合的原子数
人教版化学选修三第二章第二节分子 的立体 构型3课 时(共7 4张PPT )
人教版化学选修三第二章第二节分子 的立体 构型3课 时(共7 4张PPT )
人教版化学选修三第二章第二节分子 的立体 构型3课 时(共7 4张PPT )
孤电子对的计算
=½ (a-xb)
分子或 中心原 a
x
b
离子 子
H2O
O
6
2
1
SO2
S
6
2
2
NH4+
N
5-1=4
4
1
CO32- C
4+2=6 3
2
人教版化学选修三第二章第二节分子 的立体 构型3课 时(共7 4张PPT )
中心原子 上的孤电 子对数
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
y x
y x
y
sp 杂化:1个s 轨道与1个p 轨道进行的杂化,
形成2个sp杂化轨道。
每个sp杂化轨道的形状为一头大,一头小, 含有1/2 s 轨道和1/2 p 轨道的成分 两个轨道间的夹角为180°,呈直线型
例如:
Sp 杂化 —— BeCl2分子的形成
Cl
Be
180° sp
Cl
px 2 2 Be原子: Cl 1s 2s
O2
HCl
活动:
2、利用几何知识分析一下,空间分布的三个点 是否一定在同一直线上? 迁移:三个原子构成的分子,将这3个原子看成 三个点,则它们在空间上可能构成几种形状?分 别是什么?
在多原子构成的分子中,由于原子间排 列的空间顺序不一样,使得分子有不同 的结构,这就是所谓的分子的立体构型。
一、形形色色的分子
例3: CH4 1)孤电子对数为0, 价层电子对数为4
2)VSEPR 模型
3)实际的立体构型
价层电子对数 n与VSEPR模型的立体结构
分析下表中分子或离子的价层电子对数,并预测其结构
分子或离子 SO2
CO2 CO32SO32NH3
中心原子上 孤电子对数
σ键电子 对数
价层电子 VSEPR 实际的立 对数 模型的立 体结构 体结构
(2)杂化前后原子轨道数目不变:参加杂化的轨道数 目等于形成的杂化轨道数目;但杂化轨道改变了原子 轨道的形状方向,在成键时更有利于轨道间的重叠; (3)杂化前后原子轨道为使相互间排斥力最小,故 在空间取最大夹角分布,不同的杂化轨道伸展方向 不同;
sp杂化轨道的形成过程
z z 180° z z
y x x
直线 2 2 形
直线形
HgCl2
平面 3 3 三角 形 2
0
AB3
平面三角形
BF3
1
AB2
角形
PbCl2
价 层 电 子 对 数
价层 电子 对排 布
成键 电子 对数
孤对 电子 对数
分 子 类 型
电子对的排布 方式
分子构型
实 例
4 4 四面 体
0
AB4
正四面体
CH4
3
1
AB3
三角锥形
NH3
2
2
AB2
角形
px 没有单个电子, Cl
2s
2p
激发 2s
sp杂化
2p
sp
sp2杂化轨道的形成过程
120° z z z z
y x x
y x
y x
y
sp2杂化:1个s 轨道与2个p 轨道进行的杂化,
形成3个sp2 杂化轨道。 每个sp2杂化轨道的形状也为一头大,一头小, 含有 1/3 s 轨道和 2/3 p 轨道的成分
四个H原子分别以4个s轨道与C原子上的四个 sp3杂化轨道相互重叠后,就形成了四个性质、 能量和键角都完全相同的S-SP3σ键,从而构成一 个正四面体构型的分子。
三、杂化理论简介
1.概念:在形成分子时,在外界条件影响下若干不同 类型能量相近的原子轨道混合起来,重新组合成一组 新轨道的过程叫做原子轨道的杂化,所形成的新轨道 就称为杂化轨道。 2.要点:
第二课时——杂化理论
活动:请根据价层电子对互斥理论分析CH4 的立体构型
1.写出碳原子的核外电子排布图,思考为什么 碳原子与氢原子结合形成CH4,而不是CH2 ? C原子轨道排布图
2p2
2s2
H原子轨道排布图
1s2
1s1
C
C
按照我们已经学过的价键理论,甲烷的4个C — H单键 都应该是σ键,然而,碳原子的4个价层原子轨道是3 个相互垂直的2p 轨道和1个球形的2s轨道,用它们跟4 个氢原子的1s原子轨道重叠,不可能得到四面体构型 的甲烷分子
二、价层电子对互斥理论(VSEPR theory)
1、价层电子对互斥理论:
要点:对ABn型的分子或离子,中心原子A上价层电 子对之间存在排斥力,将使分子中的原子处于尽可 能远的相对位置上,以使彼此之间斥力最小,分子 体系能量最低。 1)分子的立体结构是“价层电子对”相互排斥的结 。 果 2)价层电子对指 分子中的中心原子上的电子对 , 包括 σ键电子对和中心原子上的孤电子对 。
3) σ键电子对数怎样确定?
4)中心原子上的孤对电子数的确定方法是什么?
5) a、x、b分别指什么?
中心原子上的孤电子对数=1 (a-xb) 2
a 指中心原子的价电子数、 x 指中心原子结合的原子 数、 b 为与中心原子结合的原子最多能接受的电子数
6)分子、阳离子和阴离子中a的计算方法 有什么不同?
1、双原子分子(直线型)
O2
2、三原子分子立体结构(有直线形和V形)
HCl
H2O
CO2
3、四原子分子立体结构(直线形、平面三 角形、三角锥形、正四面体) (平面三角形,三角锥形)
C2H2
CH2O
NH3
P4
4、五原子分子立体结构
最常见的是正四面体
CH4
5、其它分子立体结构
CH3CH2OH
C6H6
为了解决这一矛盾,鲍林提出了杂化轨道理论
C:2s22p2
2s
2p
激发 2s
sp 杂化
3
2p
sp3
由1个s轨道和3个p轨道混杂并重新组合成4个能量与 形状完全相同的轨道。我们把这种轨道称之为 sp3杂化 轨道。
为了四个杂化轨道在空间尽可能远离,使轨道间的排斥 最小,4个杂化轨道的伸展方向成什么立体构型?
例2: NH3
1)孤电子对数为1, 价层电子对数为4
2)VSEPR 模型 3)实际的立体 构型
1)先确定中心原子的价层电子对数 价层电子对数= σ键电子对数+中心原子上的孤电子对数 2)确定含孤电子对的VSEPR模型的立体结构 • 价层电子对数 n与VSEPR模型的立体结构的关系 • n=2 n=3 n=4 n=5 n=6 • 直线型 平面三角形 四面体 三角双锥体 八面体 3)略去VSEPR模型中心原子上的孤电子对,便得到了实际的 立体结构
分子 电子对的排 分子构型 类型 布方式
实 例
AB6
正八面体
SF6
6
八面体
5
1
AB5
四方锥形
IF5
4
2
AB4
平面正方 形
ICl 4
【小结】
分子类型
中心原子
空间构型
有孤对电子
AB2 无孤对电子 有孤对电子 AB3 无孤对电子 AB4 无孤对电子
V型
直线形 三角锥形 平面三角形 四面体形
第二节
分子的立体构型
第二节
分子的立体构型
第一课时 ——价层互斥理论
复习回顾
σ键 共价键
成键方式 “头碰头”,呈轴对 称 成键方式 “肩并肩”,呈镜面对 称 衡量化学键稳定性
π键
键能 键参数
键长
键角 描述分子的立体结构的重要因素
活动:
1、利用几何知识分析一下,空间分布的两个点 是否一定在同一直线? 迁移:两个原子构成的分子,将这2个原子看成两 个点,则它们在空间上可能构成几种形状?分别 是什么?
S
N
1 0 0 0 0
C
C
S
4
8
2
4
思考与交流
• 1、以S和P为例,说明如何根据主族元素 在周期表上的位置确定它的价电子数。 • 2、以N和Cl为例,说明如何根据主族元素在 周期表上的位置确定它最多能接受的电子 数。
思考:根据价层电子对互斥理论分析,为什么 水是V 型的结构?
中心原子上的孤对电子也要占据中心原子 周围的空间,并参与互相排斥。例如,H2O上 有2对孤对电子,跟中心原子周围的σ键加起来 都是4,它们相互排斥,形成四面体,因而H2O 分子呈V形。
每两个轨道间的夹角为120°,呈平面三角形
例如:
Sp2 杂化 —— BF3分子的形成
F
B
B: 1s22s22p1没有3个成单电子
F
F
2s
2p
激发
2s
sp2
2p
sp2杂化
sp3杂化轨道的形成过程
z z z 109°28′
y x x y x
z
y x
y
sp3杂化:1个s 轨道与3个p 轨道进行的杂化, 形成4个sp3 杂化轨道。 每个sp3杂化轨道的形状也为一头大,一头小, 含有 1/4 s 轨道和 3/4 p 轨道的成分 每两个轨道间的夹角为109.5°, 空间构型为正四面体型
VSEPR模型立体结构
H2O的立体结构
2、如何确定分子的立体结构?
1)先确定中心原子的价层电子对数 价层电子对数= σ键电子对数+中心原子上的孤电子对数 中心原子上的孤电子对数=1 (a-xb) 2 2)确定含孤电子对的VSEPR模型的立体结构 • 价层电子对数 n与VSEPR模型的立体结构的关系 • n=2 n=3 n=4 n=5 n=6 • 直线型 平面三角形 四面体 三角双锥体 八面体
分子中a 指中心原子的价电子数、阳离子中a 指中心 原子的价电子数减去离子的电荷数,阴离子中a 指中 心原子的价电子数加上离子的电荷数
分析下表中分子或离子的孤电子对数
分子或离子 中心 原子
a
6 4 6
x
2 4 3
b
2 1 2 2 2
中心原子 上的孤电 子对数
SO2
NH4+ CO32CO2 SO42-
3)略去VSEPR模型中心原子上的孤电子对,便得到了实际的 立体结构
1)先确定中心原子的价层电子对数 价层电子对数= σ键电子对数+中心原子上的孤电子对数 2)确定含孤电子对的VSEPR模型的立体结构 • 价层电子对数 n与VSEPR模型的立体结构的关系 • n=2 n=3 n=4 n=5 n=6 • 直线型 平面三角形 四面体 三角双锥体 八面体 3)略去VSEPR模型中心原子上的孤电子对,便得到了实际的 立体结构
