金属晶体2
金属晶体 离子晶体(精讲课件)-高二化学同步学习高效学讲练(人教版2019选择性必修2)

一.金属键与金属晶体
2.金属晶体 (1)在金属晶体中,原子间以金属键相结合。 (2)金属晶体的性质:优良的导电性、导热性和延展性。 延展性:当金属受到外力作用时,晶体中的各原子层就会发生回相对滑动, 但排列方式不变,而且弥漫在金属原子间的电子气可以起到类似轴承中滚珠 之间润滑剂的作用,所以金属有良好的延展性。
那么,金属键的本质是什么呢?
一.金属键与金属晶体
1.金属键 (1)概念: “电子气理论”把金属键描述为金属原子脱落下来的价电子形成遍布整块晶 体的“电子气”,被所有原子所共用,从而把所有的金属原子维系在一起。
金属晶体和共价晶体一 样,是一种“巨分子”
一.金属键与金属晶体
1.金属键 (2)成键粒子是金属阳离子和自由电子。 (3)金属键的强弱和对金属性质的影响 ①金属键的强弱主要决定于金属元素的原子半径和价电子数。 原子半径越大、价电子数越少,金属键越弱;反之,金属键越强。 ②金属键越强,金属的熔、沸点越高,硬度越大。 如:熔点最高的金属是钨,硬度最大的金属是铬。 金属键没有方向性和饱和性
【典例5】(2021·云南昭通·高二阶段练习)石墨晶体是层状结构 (如图)。下列有关石墨晶体的说法正确的是
A.石墨的熔点、沸点都比金刚石的低 B.石墨中的C原子均为sp3杂化 C.石墨晶体中存在的化学键有共价键、金属键和范德华力 D.每个六元环完全占有的碳原子数是2 【答案】D
本课结束
硬度
较小
很大
有的很大, 有的很小
较大
熔、沸点
较低
很高
有的很高, 有的很低
较高
溶解性
相似相溶
难溶于任何 溶剂
常见溶剂难溶
大多易溶于水 等极性溶剂
导电、传热性
一般不导电, 溶于水后有的
晶胞结构
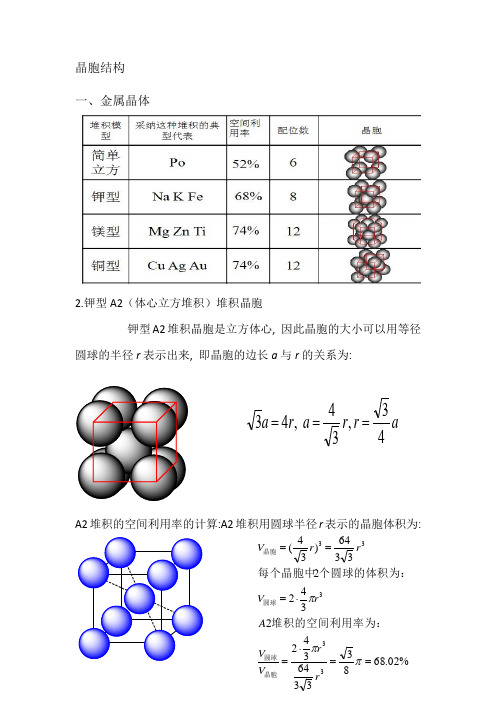
晶胞结构一、金属晶体2.钾型A2(体心立方堆积)堆积晶胞钾型A2堆积晶胞是立方体心, 因此晶胞的大小可以用等径圆球的半径r 表示出来, 即晶胞的边长a 与r 的关系为:A2堆积的空间利用率的计算:A2堆积用圆球半径r 表示的晶胞体积为:ar r a r a 43,34 ,43===%02.68833364342234223364)34(33333==⋅=⋅===πππr r V V A rV rr V 晶胞圆球圆球晶胞堆积的空间利用率为:个圆球的体积为:每个晶胞中3.六方最密堆积(4)A1(面心立方最密堆积)A1是ABCABCABC······型式的堆积,从这种堆积中可以抽出一个立方面心点阵,因此这种堆积型式的最小单位是一个立方面心晶胞。
A1堆积晶胞是立方面心, 因此晶胞的大小可以用等径圆球的半径r 表示出来, 即晶胞的边长a 与r 的关系为:A1堆积空间利用率的计算:A1堆积用圆球半径r 表示的晶胞体积为:(5)A4堆积形成晶胞A4堆积晶胞是立方面心点阵结构, 因此晶胞的大小可以用等径圆球的半径r 表示出来, 即晶胞的边长a 与r 的关系为:A4堆积的空间利用率的计算:A4堆积用圆球半径r 表示的晶胞体积为: ra r a 22 ,42==%05.742312163441344 4216)22(33333==⋅=⋅===πππr r V V A r V r r V 晶胞圆球圆球晶胞堆积的空间利用率为:个圆球的体积为:每个晶胞中ar r a r r a 83,38 ,8243===⨯=%01.34163335123484348 833512)38(33333==⋅=⋅===πππr r V V A r V r r V 晶胞圆球圆球晶胞堆积的空间利用率为:个圆球的体积为:每个晶胞中二、原子晶体1.金刚石立体网状结构,每个碳原子形成4个共价键,任意抽出2个共价键,每两个单键归两个六元环所有,而不是只归一个六元环所有(如图所示,红色的两个碳碳单键,可以构成蓝色和紫红色的两个六元环)。
化学金属晶体知识点总结

化学金属晶体知识点总结一、金属晶体的基本概念金属晶体是由金属原子以一定规律排列组成的固体结构。
金属晶体具有一些特点,如具有金属典型的电性能、热性能和光学性能,同时还具有良好的延展性、韧性和导电性。
二、金属晶体的结构金属晶体的结构是由金属原子通过化学键相互连接而形成的。
金属晶体的结构有多种类型,其中最常见的是面心立方晶体结构和体心立方晶体结构。
金属晶体的结构对金属的性能具有重要影响,比如面心立方晶体结构使得金属具有优良的导电性和导热性,而体心立方晶体结构使得金属具有良好的韧性和延展性。
三、金属晶体的性能1. 导电性:金属晶体中的自由电子能够在晶体结构中自由传导,因此金属具有良好的导电性能。
2. 导热性:金属晶体中的自由电子能够在晶体结构中迅速传递热量,因此金属具有良好的导热性能。
3. 延展性:金属晶体中的金属原子之间的化学键相对较弱,因此金属具有良好的延展性能,可以被拉伸成细丝或者铺展成薄片。
4. 韧性:金属晶体中的金属原子之间的化学键相对较强,因此金属具有良好的韧性能,可以经受一定的外力而不易断裂。
5. 耐腐蚀性:金属晶体中的化学键特点使得金属具有一定的抗腐蚀性能,可以抵御外界腐蚀物质的侵蚀。
四、金属晶体的制备金属晶体的制备方法有多种,常见的包括熔融法、沉淀法、溶胶-凝胶法等。
熔融法是通过将金属加热至熔点后冷却凝固成固体晶体;沉淀法是通过将金属盐溶液中加入适量还原剂使金属物质析出,然后经过洗涤、干燥等处理制备金属晶体;溶胶-凝胶法是通过将金属盐加入溶液中形成凝胶后再经过热处理的方法制备金属晶体。
五、金属晶体的应用金属晶体广泛应用于工业生产中,主要包括金属材料、金属合金、金属催化剂等。
金属材料广泛用于航空航天、汽车制造、机械加工等领域;金属合金具有优异的物理性能和化学性能,用于制备高强度、高耐热、高耐腐蚀的材料;金属催化剂广泛用于化工生产中的有机合成、空气净化等领域。
总的来说,金属晶体是由金属原子组成的固体结构,在工业生产和科研领域有重要应用。
nis2晶体结构

nis2晶体结构
Nis2晶体结构是一种常见的金属合金的晶体结构之一。
它是由镍和硫组成的,具有一定的独特性质,因此在工业生产中有着广泛的应用。
Nis2晶体结构是属于单斜晶系的,其空间群为P21/c。
它的晶格参数为a=b=6.53A,c=8.34A,角度为β=103.3°。
其晶体结构是由一层层的Ni和S原子交替排列而成的。
其中,Ni原子和S原子都是八面体配位的,即每个Ni原子和每个S原子周围都有六个相邻原子,分别处在一个正八面体的顶点位置上。
Nis2晶体结构具有很高的热稳定性,可以在高温下保持结构的稳定性和完整性。
它还具有很好的电导率和磁导率,可以应用于电子器件制造和磁性储存介质等领域。
此外,Nis2晶体结构还可以在催化反应中起到重要作用,例如它可以作为脱硫催化剂用于石油炼制中。
总的来说,Nis2晶体结构的特殊性质使其在许多领域发挥重要作用。
目前,对于其结构的理解和探索还有许多待发掘的地方,值得我们持续关注。
金属晶体__第2课时_导学案

高山不爬不能到顶,竞走不跑不能取胜,永恒的幸福不争取不能获得。
想成为一名成功者,先必须做一名奋斗者。
《选修三第三章第三节 金属晶体》导学案(第2课时)高二 班 第 组 姓名 组内评价 教师评价_______【课标要求】1、能列举金属晶体的基本堆积模型2、了解金属晶体性质的一般特点3、理解金属晶体的类型与性质的关系 【重点难点】1、金属晶体的堆积方式 【新课导学】 二、金属晶体 1、金属晶体:(1)定义: 和 通过 形成的晶体。
(2)构成微粒: 。
(3)微粒间相互作用: 。
2、金属晶体的原子堆积模型Ⅰ、概念 ①紧密堆积:微粒之间的作用力,使微粒间尽可能地相互接近,使它们占有最小的空间 ②空间利用率:空间被晶格质点占满的百分数。
用来表示紧密堆积的程度 ③配位数:在晶体中,与离子直接相连的带异电荷的离子数称为配位数 Ⅱ、金属晶体的原子堆积模型(1) 金属原子在二维平面里有两种方式为非密置层和密置层__层,配位数为 _______层,配位数为 (2)金属原子在三维空间里有四种堆积方式①简单立方体堆积,非密置层排列的金属原子,在空间内可能的排列。
这种堆积方式形成的晶胞是一个 ,每个晶胞含 个原子,被称为 堆积。
这种堆积方式的空间利用率 ,只有金属钋采取这种堆积方式。
②体心立方(A 2型)堆积----钾型如果是非密置层上层金属原子填入下层的金属原子形成的凹穴中,每层均照此堆积,如下图:这种堆积方式所得的晶胞是一个含 个原子的立方体,一个原子在立方体的 ,另一个在立方体的 ,称为体心立方堆积,这种堆积方式的空间利用率( )显然比简单立方堆积的 多了,许多金属是这种堆积方式,如碱金属,简称为钾型。
③六方最密堆积(A 3)型和面心立方(A 1型)最密堆积对于密置层的原子按钾型堆积方式堆积,会得到两种基本堆积方式---- 和 ,即:镁型和铜型。
六方最密堆积如下图左侧,按 的方式堆积; 面心立方最密堆积如图右侧,按 的方式堆积.这两种堆积方式都是金属晶体的 堆积,配位数均为 ,空间利用率均为 ,但所得的晶胞的形式不同。
1t′ mote2晶体结构

1t′ mote2晶体结构
T'Mote2晶体结构是一种典型的金属硫化物晶体结构,属于层状结构。
T'Mote2中的T、M和O分别代表不同的金属元素,通常是过渡金属元素。
这种晶体结构中,金属原子和硫原子以一定的比例排列组合在一起,形成多层结构。
每一层中,金属原子和硫原子以一定的方式相互连接,形成特定的晶体结构。
T'Mote2晶体结构的具体性质和结构参数取决于T、M和O所代表的具体元素,以及它们之间的相互作用。
从化学角度来看,T'Mote2晶体结构体现了金属和硫元素之间的化学键和排列规律。
金属原子通常以一定的配位数与硫原子形成化学键,而不同金属元素的配位数和电子结构会对晶体结构产生影响,从而影响材料的性质。
从物理角度来看,T'Mote2晶体结构的层状排列方式决定了其在空间中的排列规律和对称性,这些因素直接影响了T'Mote2材料的电学、光学、磁学等性质。
此外,T'Mote2晶体结构中的缺陷和畸变也会对材料的性能产生影响。
总的来说,T'Mote2晶体结构是一种重要的金属硫化物晶体结
构,具有丰富的化学和物理性质,对于研究其结构特征和性能具有重要意义。
希望以上回答能够全面回答你的问题。
机械工程材料 第二章 金属的晶体结构与结晶

均匀长大
树枝状长大
2-2
晶粒度
实际金属结晶后形成多晶体,晶粒的大小对力学性能影响很大。 晶粒细小金属强度、塑性、韧性好,且晶粒愈细小,性能愈好。
标准晶粒度共分八级, 一级最粗,八级最细。 通过100倍显微镜下的 晶粒大小与标准图对 照来评级。
2-2
• 影响晶粒度的因素
• (1)结晶过程中的形核速度N(形核率) • (2)长大速度G(长大率)
面心立方晶 格
912 °C α - Fe
体心立方晶 格
1600
温 度
1500 1400
1300
1200
1100
1000
900
800
700 600 500
1534℃ 1394℃
体心立方晶格
δ - Fe
γ - Fe
γ - Fe
912℃
纯铁的冷却曲线
α – Fe
体心立方晶 格
时间
由于纯铁具有同素异构转变的特性,因此,生产中才有可能通过 不同的热处理工艺来改变钢铁的组织和性能。
2-3
• 铁碳合金—碳钢+铸铁,是工业应用最广的合金。 含碳量为0.0218% ~2.11%的称钢 含碳量为 2.11%~ 6.69%的称铸铁。 Fe、C为组元,称为黑色金属。 Fe-C合金除Fe和C外,还含有少量Mn 、Si 、P 、 S 、 N 、O等元素,这些元素称为杂质。
2-3
• 铁和碳可形成一系列稳定化合物: Fe3C、 Fe2C、 FeC。 • 含碳量大于Fe3C成分(6.69%)时,合金太脆,已无实用价值。 • 实际所讨论的铁碳合金相图是Fe- Fe3C相图。
2-2
物质从液态到固态的转变过程称为凝固。 材料的凝固分为两种类型:
金属晶体与离子晶体(2)高二化学(人教版2019选择性必修2)

0 -200
SiF4
SiCl4 SiBr4 SiI4
根据所学和实验图像推测: TiF4是离子化合物,熔点较高 TiCl4 、 TiBr4、TiI4是共价化合物
知识梳理
推测是否正确?为什么由金属 元素和非金属元素组成的化合 物可能是共价化合物呢?
知识梳理
事实上,纯粹的典型晶体是不多的,大多数离子晶体中的化学键具有一定的共 价键成分。
晶体类型
石墨晶体中,既有共价键 ,又有ቤተ መጻሕፍቲ ባይዱ金属键 和范德华力,属于 混合型晶体。
混合型晶体
物理性质 导电性
知识梳理
导热性
润滑性
典例精讲
请同学们回顾所学内容,判断下列问题的对与错
问题1 问题2
问题3
问题4 问题5 问题6 问题7
纯粹的典型晶体是没有的( ) 离子键成分的百分数是依据电负性的差值计算出来的,差值越大,离子 键成分的百分数越小( ) 在共价晶体中可以认为共价键贯穿整个晶体,而在分子晶体中共价键仅 限于晶体微观空间的一个个分子中( ) 石墨的二维结构内,每个碳原子的配位数为3( ) 石墨的导电只能沿石墨平面的方向进行( ) 石墨晶体层与层之间距离较大,所以石墨的熔点不高( ) 四类晶体都有过渡型( )
800
NaI
600
400
200
0 -200
SiF4
SiCl4 SiBr4 SiI4
根据硅的卤化物(SiX4)的组成能判断其 的晶体类型吗?分子晶体?共价晶体?
分子晶体熔化时需克服分子间作用力或氢 键,熔点较低;共价晶体需克服共价键, 熔点较高;由图可知:SiX4为分子晶体。
知识梳理
过渡晶体
探究一
钠的卤化物(NaX)和硅的卤化物(SiX4)的熔点
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
三、金属晶体的原子堆积模型
1.几个概念
紧密堆积:微粒之间的作用力,使微粒间尽可能的 相互接近,使它们占有最小的空间。
空间利用率:空间被晶格质点占据的百分数。用来 表示紧密堆积的程度。
配位数:在密堆积中,一个原子或离子周围距离最 近且相等的原子或离子的数目。
堆积原理:
组成晶体的金属原子在没有其他因素 影响时,在空间的排列大都遵循紧密堆积 原理。这是因为金属键没有方向性,因此 都趋向于使金属原子吸引更多的其他原子 分布于周围,并以紧密堆积方式降低体系 的能量,使晶体变得比较稳定。
下图是镁型紧密堆积的前视图
A
12
6
3
B
54
A
B A
镁型
7 1 9
6
5
8 2
3 4
10
11
12
这种堆积晶胞空间利用率高(74%),属于 最密置层堆集,配位数为 12 ,许多金属(如 Mg、Zn、Ti等)采取这种堆积方式。
六方紧密堆积
1200
平行六面体
(4)面心立方堆积——铜型(密置)
12
6
3
54
子的半径大小也有关,金属阳离子的半径越
大,金属键越弱。据此判断下列金属熔点逐
渐升高的是
() B
A、Li Na K B、Na Mg Al
C、Li Be Mg D、Li Na Mg
回顾练习
4、下列有关金属晶体叙述正确的是(B)
A、常温下金属单质都以金属晶体形式存在 B、金属离子与自由电子之间的强烈作用, 在一定外力作用下,不因形变而消失 C、钙的熔、沸点低于钾 D、温度越高,金属的导电性越好
(2)体心立方堆积——钾型(非密置)
这种堆积晶胞是一个体心立方,
每个晶胞每个晶胞含 2 个原子,
空间利用率不高(68%),属于非
密置层堆积,配位数为 8 ,许
多金属(如Na、K、Fe等)采取这 种堆积方式。
思考:密置层的堆积方式有哪些?
第二层对第一层来讲最紧密的堆积方式是将球对准 1 ,3,5 位。 ( 或对准 2,4,6 位,其情形是一样的 )
BA 此种立方紧密堆积的前视A图
铜型
12
6
3
54
这种堆积晶胞空间利用率高(74%),属 于最密置层堆集,配位数为 12 ,许多 金属(如Cu、Ag、Au等)采取这种堆积 方式。
铜型
堆积方式及性质小结
堆积方式 晶胞类型 空间利 配位数 用率
实例
简单立 方堆积
简单立方
52%
6
Po
体心立方 密堆积
体心立方
C.延展性
D.锈蚀性
2.下列对各组物质性质的比较正确的是 (B )
A.熔点:Li<Na<K
B.导电性:Ag>Cu>Al>Fe
C.密度:Na>Mg>Al
D.空间利用率:体心立方堆积<六方最密堆积< 面心立方最密堆积
• 3.判断下列晶体类型。
• (1)SiI4:熔点120.5 ℃,沸点271.5 ℃,易水解 __________。
金属晶体
(第二课时)
回顾练习
1、下列生活中的问题,不能用金属键知
识解释的是
() D
A、用铁制品做炊具
B、用金属铝制成导线
C、用铂金做首饰
D、铁易生锈
回顾练习
2、下列物质中含有金属键的是 ( A) B
A、金属铝 B、合金
C、NaOH
D、NH4Cl
回顾练习
3、金属键的强弱与金属价电子数的多少有
关,价电子数越多金属键越强;与金属阳离
68%
Hale Waihona Puke 8Na、K、Fe六方最 密堆积
六方
74%
12 Mg、Zn、Ti
面心立方 最密堆积
面心立方
74%
12
Cu、Ag、Au
简 单 立 方 ( 六 方 最镁 密型 堆 积 )
(
体
心
立 方 密
钾 型
堆
积
)
( 六 方 最镁 密型 堆 积 )
练习:
1.不能用金属键理论解释的是 ( D )
A.导电性
B.导热性
• (4)金属晶体
12
6
3
54
第三层的另一种排列 方式,是将球对准第一层 的 2,4,6 位,不同于 AB 两层的位置,这是 C 层。
12
6
3
54
第下四图层是再排铜A型,于型是紧形密堆积的前视图
A
成 ABC ABC 三层一个周 期。 得到面心立方堆积。
AC
CB
12
BA
6
3
AC
54
CB
配位数 12 。 ( 同层 6, 上下层各 3 )
• (2)硼:熔点2 300 ℃,沸点2 550 ℃,硬度大 ___________。
• (3)硒:熔点217 ℃,沸点685 ℃,溶于氯仿 ____________。
• (4)锑:熔点630.74 ℃,沸点1 750 ℃,导电 ____________。
答案:(1)分子晶体 (2)原子晶体 (3)分子晶体
12
6
3
54
12
6
3
54
,
AB
关键是第三层,对第一、二层来说,第三层可以有两种最紧 密的堆积方式。
金属晶体的两种最密堆积方式──镁型和铜型
镁型
铜型
(3)六方最密堆积——镁型(密置)
12
6
3
54
12
6
3
54
12
6
3
54
第三层的另一种排列方式,是将球对准第一层每一
个球,于是每两层形成一个周期,即 AB AB 堆 积方式。
金属晶体中的原子可看成直径相等的小 球。
2、金属晶体的原子在二维平面堆积模型
I型
II 型
2
1
3
4
非密置层
配位数为4
2 1
6
3 4
5
密置层 配位数为6
3、金属晶体的原子在三维空间堆积模型
(1)简单立方堆积(非密置)
非最紧密堆积,空间利用率低(52%)
配位数是 6 个.
只有金属(Po)采取这种堆积方式
