第三章 烯烃和二烯烃
第三章烯烃(1)

H Br
Z-E命名法(熟练掌握)
将原子或基团按次序规则排序:
① 原子序数大者优先,同位素质量大者优先 如: I > Br > Cl > S > P > F > O > N > C > D > H ② 基团的第一个原子相同时,比较与其相连的下一个原子
H H C H H H
如:-CH2CH3 > -CH3 -CH2Cl > -CH2F -CH2OCH3 > -CH2OH -CH(CH3)2 > -CH2CH(CH3)2
本次课要求
了解并掌握烯烃的类型、结构和命名
掌握烯烃构型的表示方式(顺式和反式,E型和Z型) 掌握烯烃的化学性质,常见的化学反应(氧化反应、加成反 应、聚合反应) 掌握烯烃的氧化反应,产物类型。
课后作业:
p45 习题1:(1), (3), (5) 习题3:(3)
C H
>
C H
H
H C H
H C O H
H
Cl C
H
H
F
H>
>
C H
C H
O
H
H
③ 对不饱和基团,可认为与同一原子连接 2 或 3 次
CH CH2 CH CH2 C CH O C C N
N C N
C N C
如:
CH O O C
CH3
例:
比较
C
CH
与
C CH3
CH3
的优先顺序
C C CH C C
C C C H
vinyl propenyl, 1-propenyl
异丙烯基,isopropenyl,2-propenyl 烯丙基, allyl, 3-propenyl
第三章-烯烃、炔烃、二烯烃

以反式加成产物为主
Br
Br
CH2 CH2 + Br2 NaCl水溶液 CH2 CH2 + CH2 CH2
Br
Cl
亲电试剂:试剂带有正电荷,或者电子云密度较低,在
反应中进攻反应物上带部分负电荷的位置,这种试剂叫
做亲电试剂,例如X+(卤素)、R+、H +等。详见课本 P54-56。
亲电加成反应:由亲电试剂进攻而引起的加成反应。
1埃 = 0.1纳米(nm) = 10-10米(m)
1
键的特点: 1.成键原子不能绕两核连线自由旋转。
2.键比键易断裂。
3.电子云易极化。
PS:极化(polarization),指事物在一定条件下发生两极 分化,使其性质相对于原来状态有所偏离的现象
烯烃的同分异构
构造异构:碳链异构;官能团位置异构 构型异构:顺反异构 (几何异构or立体异构)
链终止 CH3CH· CH2Br +Br· CH3CHBrCH2Br
注:过氧化物只对HBr有影响,不影响HCl和HI。
诱导效应:受分子中电负性不同的原子或基团的影响,整个分 子中成键的电子云向着一个方向偏移,分子发生极化的效应。
δ+ δ- δ+ δH3C CH CH2 + HBr
CH3CHCH2 Br
电负性差别:O:3.5 Cl:3.1 O> Cl
由于次氯酸不稳定,反应中常用氯气和水代替次氯酸
Cl2 + H2O HOCl + HCl
H2C CH2 + Cl2 + H2O
CH2 CH2 OH Cl
(2) 臭氧化反应
O
CH3CH CH2 O3 CH3HC O
有机化学 第三章 烯烃、炔烃和二烯烃

第三章烯烃、炔烃和二烯烃第一节烯烃和炔烃单烯烃是指分子中含有一个C=C的不饱和开链烃,简称烯烃.通式为C n H2n。
炔烃是含有(triple bond) 的不饱和开链烃。
炔烃比碳原子数目相同的单烯烃少两个氢原子,通式CnH2n-2。
一、烯烃和炔烃的结构乙烯是最简单的烯烃, 乙炔是最简单的炔烃,现已乙烯和乙炔为例来讨论烯烃和炔烃的结构。
(一)乙烯的结构分子式为C2H4,构造式H2C=CH2,含有一个双键C=C,是由一个σ 键和一个π 键构成。
现代物理方法证明,乙烯分子的所有原子都在同一平面上,每个碳原子只和三个原子相连.杂化轨道理论根据这些事实,设想碳原子成键时,由一个s轨道和两个p轨道进行杂化,组成三个等同的sp2杂化轨道,sp2轨道对称轴在同一平面上, 彼此成1200角.此外,还剩下一个2p轨道,它的对称轴垂直于sp2轨道所在的平面。
乙烯:C-C σ键4C-H σ键在乙烯分子中,两个碳原子各以一个sp2轨道重叠形成一个C-Cσ键,又各以两个sp2轨道和四个氢原子的1s轨道重叠,形成四个C-Hσ键,五个σ键都在同一平面上。
每个碳原子剩下的一个py轨道,它们平行地侧面重叠,便组成新的分子轨道,称为π轨道。
其它烯烃的双键也都是由一个σ键和一个π键组成的。
双键一般用两条短线来表示,如:C=C,但两条短线含义不同,一条代表σ键,另一条代表π 键。
π键重叠程度比σ键小,不如σ键稳定,比较容易破裂。
(二)乙炔的结构乙炔的分子式是C2H2,构造式H-C≡C-C,碳原子为sp 杂化。
两个sp杂化轨道向碳原子核的两边伸展,它们的对称轴在一条直线上,互成180°。
在乙炔分子中,两个碳原子各以一个sp轨道互相重叠,形成一个C-Cσ键,每个碳原子又各以一个sp轨道分别与一个氢原子的1s轨道重叠形成C-Hσ键。
此外,每个碳原子还有两个互相垂直的未杂化的p轨道(px,py),它们与另一碳的两个p轨道两两相互侧面重叠形成两个互相垂直的π键。
3烯烃、炔烃、二烯烃

沸点:
3.7°C
0.88°C -105.6°C
熔点: -138.9°C
三、烯烃、炔烃的化学性质
双键的结构与性质分析
C C C C
键能: 键 ~347 kJ / mol 键 ~263 kJ / mol 键活性比 键大 不饱和,可加成至饱和
电子受原子核吸引较弱, 是电子供体,易受 亲电试剂进攻参与反应。 与亲电试剂结合 与氧化剂反应
乙烯分子中的σ键
乙烯分子中的π键
H H
·
·
H
C = C
C
C H
{
sp2-sp2 σ键 2p-2p π键
π键
σ键和π键比较
存在的情况 键的形成情 况 电子云的分 布情况
键
键
1、可以单独存在。 2、存在于任何共价键中。
1、必须与键共存。 2、仅存在于不饱和键中。
成键轨道沿轴向在直线上相 成键轨道对称轴平行,从侧 互重叠。 面重叠。 1、 电子云集中于两原子 核的连线上,呈圆柱形分布 2、 键有一个对称轴,轴 上电子云密度最大。 1、键能较大。 2、键的旋转:以 键连接 的两原子可相对的自由旋转 3、键的可极化度:较小。 1、 电子云分布在 键所 在平面的上下两方,呈块状
第三章
烯烃、炔烃、二烯烃
本章重点
不饱和烃的类型、结构和命名
烯烃构型的表示方式(顺式和反式,E型和Z型)
不饱和烃的亲电加成反应 Markovnilkov加成规则及理论解释 诱导效应及共轭效应 共轭二烯烃的1,4加成
第三章
烯烃、炔烃、二烯烃
本章难点 不饱和烃的亲电加成反应
Markovnilkov加成规则及理论解释
(3)命名:根据主链上的碳数和双、叁键的位次 编号m、n,称为m-某烯-n-炔
烯烃和二烯烃课件

1 2 3
数据记录
在实验过程中,需要及时、准确地记录实验数据 。包括温度、压力、时间、质量等参数的变化情 况。
数据处理
根据记录的数据,利用数学工具进行数据处理和 分析。如绘制图表、计算平均值、标准差等统计 指标。
结果解释
根据数据处理的结果,对实验现象和规律进行解 释。比较与理论预测是否一致,分析误差原因等 。
THANKS
感谢观看
还原反应
通过还原反应可以制备二烯烃。
共轭二烯烃
共轭二烯烃可以通过Diels-Alder 反应制备。
05
烯烃和二烯烃的应用
烯烃的应用
塑料和纤维
烯烃是许多塑料和纤维的主要成 分,广泛用于制造日常用品,如
包装材料、衣物等。
橡胶
烯烃制成的橡胶具有优异的弹性和 耐久性,可用于制造轮胎、鞋底等 。
清洁剂和溶剂
烯烃的制备方法
• 烯烃可以通过多种方法制备,其中最常用的方法是石油裂解 和有机合成。石油裂解是一种从石油中提取轻质烯烃的方法 ,主要是通过高温高压条件下的热裂解反应来实现。有机合 成是指通过一系列化学反应来制备特定结构的化合物,其中 烯烃的合成是重要的有机合成之一。合成方法包括Wittig反 应、Suzuki-Miyaura反应、Diels-Alder反应等。这些方法 可以根据需要合成不同结构的烯烃,为有机合成提供了重要 的手段。
相对密度
二烯烃的相对密度接近于 1。
熔点
熔点受相对分子质量、双 键位置和取代基的影响。
化学性质
Байду номын сангаас
加成反应
二烯烃可以与氢气、卤素 单质、卤化氢等发生加成 反应。
聚合反应
二烯烃在催化剂作用下可 发生聚合反应。
第三章 烯烃和二烯烃

(四) 烯烃的化学性质
(1) 加氢
在催化剂作用下,烯烃或炔烃与氢加成生成烷烃:
CH2=CH 2 + H 2
催化剂
(甲) 催化加氢
CH3-CH 3
Cat.:Pt、Pd、Rh、Ni等。 Raney Ni,又叫活性Ni、骨架Ni。特点是具有很大的表面 积,反应按下列机理进行:
H2
吸附 解吸
H
H
C2H4
(RCH2CH2)2BH
二烷基硼
(RCH2CH2)3B
三烷基硼
H2O2,OH-
RCH2CH2OH + B(OH)3
一级醇
H2O2的NaOH水溶液
19
烯烃硼氢化反应得醇,炔烃的硼氢化得醛. 其特点:反马、顺加、不重排!
例:
CH3(CH 2)7CH=CH 2
① B2H6 ,醚 ② H2O2/OH
-
CH3(CH 2)7CH2CH2OH
1 2 O2
。 250 C
Ag
CH2-CH 2 O
23
(5) 聚合反应
高压聚乙烯的制备属于自由基聚合反应:
n CH 2=CH 2
自由基引发剂
>100 C,>1000MPa
。
[ CH2 CH 2 ]n
高压聚乙烯
乙烯、丙烯等可在齐格勒-纳塔(1963年Nobel化学奖得主) 催化剂存在和低压条件下,经离子型定向聚合得到聚烯烃:
(Ⅰ)
Br -
CH3-CH-CH 3(主要产物) Br CH3CH2CH2Br(次要产物)
1°C+
CH3CH2CH2+
(Ⅱ)
Br -
14
结论:C的稳定性决定了烯烃加成主要产物的结构。 C的稳定性:
烯烃和二烯烃
CnH2n-2(n≧4)
烯烃的结构、同分异构体和命名
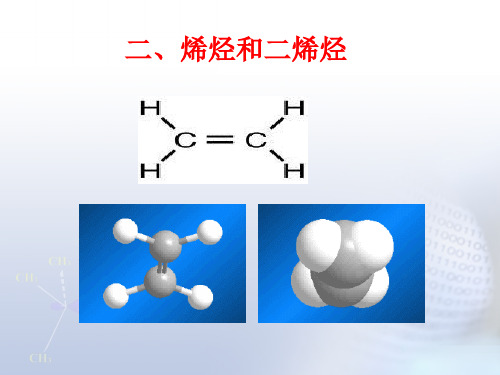
(一)、乙烯的结构
1.平面构型
118° 121°
说明:乙烯分子中的两个碳原子和四个氢原子都在同一
个平面上。它们彼此间的夹角约为120°,双键的键长比 单键的短,键能比单键的两倍小。所以化学性质活泼。
同系物:结构相似:都含有一个碳碳双键的链烃;
组成上相差一个或若干个“CH2”原子团。 如:丙烯,1-丁烯,1-己烯等等
C
3
C H 2
CH3
1
CH2 CH3
③
②
4-甲基-3-乙基-2-戊烯
【例题1】用系统命名法命名下列化合物
CH2 CH H3C H2C CH CH2 CH2 CH3 CH3CH2CH
C
CHCH3
CH3 CH3
3-乙基-1-己烯 3,4-二甲基-2-己烯
CH3 H3C H C CH3 C H C H C CH2 CH3
写出丙烯的分子式、电子式和结构简式
它们的化学性质与乙烯的相似;物理性质一般地 也随着碳原子数目的增加而递变,与烷烃类似。
(二)、烯烃的同分异构现象
1、碳链异构
2、双键位置异构
如:写出C4H8 属于烯烃的同分异构体
H2C CHCH2CH3
H2C C CH3 CH3
H3CHC CHCH3
烯烃同分异构体的推导方法:
加成反应、加聚反应、氧化反应
加成反应 1 ) 1,4-加成反应
H2C
①
H2C Br
②
C H
③
C H
④
CH2 Br
①
C H ②
C H ③
CH2
+ Br2
第三章 烯烃

3.1.2 烯烃的命名规则(系统命名):
(1)主链选择:选择含碳碳双键的最长碳链为主 链(母体),根据含碳数目称为某烯. (2)主链编号:从最靠近双键的一端开始给主碳 链编号. (3)双键位置:将双键位置标明在烯烃名称前面 (只标出位次较小双键碳原子位置). (4)其它同烷烃的命名规则.
Naming alkenes
B.碳正离子的结构和稳定性 ----马尔科夫尼科夫(Markovnikov,s rule)规律 CH3
2 C=CH2 CH3 2-甲基丙烯
CH3 CH3 + 2HCl C-CH3 + CH-CH2Cl CH3 Cl CH3
主要产物
马尔科夫尼科夫规律 --卤化氢与不对称烯烃加成时, 可以得到两种不同的产物,以H原子加到含氢较多的双 键C原子上,而卤素原子加到含氢较少或不含氢的双键 碳原子上的那种产物为主. Why?
>C=C< + Y-X -C-C( sp2) Y Z
(sp3)
例1: CH2=CH2 +Cl-Cl CH2Cl-CH2Cl H= -171kJ/mol 例2: CH2=CH2 +Br-Br CH2Br-CH2Br H= -69kJ/mol
• 加成反应往往是放热反应,往往需要较低的活化能. 所以烯烃容易发生加成反应是烯烃的一个特征反应.
在烯烃名称前加顺(cis-)或反(trans-)字表示,例如:
CH3 CH3 CH3 CH3
C=C
H H H
C=C
Cl
顺-2-丁烯
CH3 C=C H
顺-2-氯-2-丁烯
CH3CH2 C=C CH3
H
CH3
H
H
反-2-丁烯
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H H CH2=CH 2
H-CH 2-CH 2-H
中间形成一个Ni-H键(半氢化态)为过渡态。
10
(乙) 氢化热与烯烃的稳定性
氢化热——1mol不饱和烃氢化时所放出的能量称为氢化热 。 氢化热越高,说明原来的不饱和烃的内能越高,稳定性越差。 因此,可以利用氢化热获得不饱和烃的相对稳定性信息. ① 不同结构的烯烃催化加氢时反应热的大小顺序如下: CH2=CH2>RCH=CH2>RCH=CHR, R2C=CH2>R2C=CHR>R2C=CR2 顺-RCH=CHR>反-RCH=CHR ②烯烃的热力学稳定性次序为: R2C=CR2>R2C=CHR>RCH=CHR, R2C=CH2>RCH=CH2>CH2=CH2 反-RCH=CHR>顺-RCH=CHR
1 2 O2
。 250 C
Ag
CH2-CH 2 O
23
(5) 聚合反应
高压聚乙烯的制备属于自由基聚合反应:
n CH 2=CH 2
自由基引发剂
>100 C,>1000MPa
。
[ CH2 CH 2 ]n
高压聚乙烯
乙烯、丙烯等可在齐格勒-纳塔(1963年Nobel化学奖得主) 催化剂存在和低压条件下,经离子型定向聚合得到聚烯烃:
20
(4) 氧化反应
(甲) 高锰酸钾氧化
用稀KMnO4 的中性或碱性溶液,在较低温度下氧化烯 烃,产物是邻二醇:
C=C + KMnO 4
OH ,H 2O
-
OH OH C C
+ MnO 2
顺式氧化!
如果用浓度较大的 KMnO4 的酸性溶液,结果是得到双健断裂 产物:
R R' C=C R" KMnO 4 H R R' C=O + O=C
3 C
£ ¡ + 2 C
C+H3
15
(d) 过氧化物效应
一般情况下(遵马) : CH3-CH=CH 2 + HBr 但有过氧化物存在时:
CH3-CH-CH 3 Br (主)
CH3-CH=CH 2 + HBr
hor 过氧化物
CH3CH2CH2Br (反马)
只 能 是 HBr (HCl、 HI 都 不 反 马 )
n CH 2=CH 2 (C2H5)3Al-TiCl 4
3Al-TiCl 4 n CH 2=CH (C2H5)。 50 C,1MPa CH3
[ CH2-CH 2 ] n
(低压聚乙烯)
[ CH2-CH ]n (聚丙烯) 24 CH3
-
(6) α-氢原子的反应
α-氢受双键的影响,有特殊的活泼性。
(甲) α-氢原子的取代
Cl-CH 2-CH 2-OH
-氯乙醇
实际操作时,常用氯和水直接反应。例:
b CH3-CH=CH 2
Cl 2 -Cl
-
CH3- CH
a Cl
+
CH2
OH
H2O -H
+
OH CH2 Cl
CH3- CH Cl
CH2 + CH3- CH
2-氯-1-丙醇
1-氯-2-丙醇
烯烃与次卤酸加成也是亲电加成反应.
13
(b)
Markovnikov规则(马氏规则)
烯、炔加卤化氢时,氢原子总是加到含氢多的不饱和碳上。 (c) Markovnikov规则的理论解释 为什么烯烃和炔烃加卤化氢时遵循马氏规则? 由反应中间体正碳离子的稳定性所决定的
CH3-C H-CH 3 CH3-CH=CH 2 + H
+
2° C+ +
(C) (C) -C CH 可看作 -C C-H (C) (C)
(C) (C) -CH=CH 2 可看作 -C H C-H H
∴ -CCH > -CH=CH2 Z,E-命名法不能同顺反命名法混淆!
8
(三) 烯烃的物理性质
1.物态:C4以下的烯是气体,C5-C18为液体,C19以上是固体。 2 沸点:末端烯烃的沸点>同碳数烷烃; 相对分子质量↑,烯烃的沸点↑; 碳数相同时,正构烯的沸点>异构烯; 双键位置相同时,顺式烯烃的沸点>反式烯烃; 3.熔点:分子的对称性↑,烯的熔点↑。 内烯的熔点>末端烯烃; 反式烯烃的熔点>顺式烯烃。 4.相对密度:烯烃的相对密度>同碳数烷烃 5.折射率:烯烃分子中含有π 键,电子云易极化,它们的折射率> 同碳数烷烃。
(Ⅰ)
Br -
CH3-CH-CH 3(主要产物) Br CH3CH2CH2Br(次要产物)
1°C+
CH3CH2CH2+
(Ⅱ)
Br -
14
结论:C的稳定性决定了烯烃加成主要产物的结构。 C的稳定性:
CH3 CH3 C+ CH3 £ ¡ + CH3 CH3 C+H CH3 C+H2 £ ¡ + 1 C C+H3
① 产生自由基难易: HCl键能大,不易生成氯自由基; HI 键能小,易生成碘自由基,但活性太差;H-Br适中。 ② 光照、加热、过氧化物存在等条件下,HBr易产生自由基, 发生自由基反应; 16
(丙) 与硫酸加成
CH2=CH 2 + H OSO 2OH (浓 ) CH3-CH 2-OSO 2OH 硫酸氢乙酯 (酸式硫酸酯) H2O CH3CH2OH + H 2SO4 (稀)
(RCH2CH2)2BH
二烷基硼
(RCH2CH2)3B
三烷基硼
H2O2,OH-
RCH2CH2OH + B(OH)3
一级醇
H2O2的NaOH水溶液
19
烯烃硼氢化反应得醇,炔烃的硼氢化得醛. 其特点:反马、顺加、不重排!
例:
CH3(CH 2)7CH=CH 2
① B2H6 ,醚 ② H2O2/OH
-
CH3(CH 2)7CH2CH2OH
形成顺反异构的条件:
①必要条件:有双键或环平面
②充分条件:每个双键碳原子或环平面必须连接两个不同的原子 4 或原子团。
3.烯烃的命名
(1) 烯基 烯烃分子从形式上去掉一个氢原子后,剩下的基团 分别称为烯基;
CH2=CH乙烯基 CH3-CH=CHCH2=CH-CH2烯丙基
丙烯基
(2) 系统命名法 选择含有C=C的最长碳链为主链,从最距离双键最近的一端开 始编号,其它与烷烃的系统命名规则同(略)。
3
2.烯烃的同分异构
烯烃:C4以上的烯有碳链异构、官能团位置异构、顺反异构.
丁烯的四种异构体:
H3C H CH3 H H3C H H CH3
CH2=CH-CH 2-CH 3
1-丁-CH3
2-甲基丙烯 (异丁烯)
顺-2-丁烯
反-2-丁烯
I
I I(A)
I I(B)
I I I
以上反应相当于烯烃间接水合。
烯烃与H2SO4的加成反应也是亲电加成反应,遵循马氏规则。
意义:
① 工业上制备乙醇和其他仲醇、叔醇,但有环境污染和设 备腐蚀问题;
② 分离、提纯、鉴别烯烃。
17
(丁) 与次卤酸加成
次卤酸的酸性很弱,它与烯烃加成时,生成 β-氯代醇:
CH2=CH 2 + HO Cl
高温或光照下,烯烃的α-H可被卤素原子取代: 。 500 C CH2=CH-CH2Cl + HCl CH2=CH-CH3 + Cl2 氯丙烯
或 烯丙基氯
下列反应也属于自由基取代反应,可在较低温度下进行:
O CH3CH=CH2 +
O N-Br
h CCl4
H2 C C
H2 C C O
BrCH2CH=CH2 +
+ H 2O2
产物中有醛又有H2O2, 所以醛可能被氧化, 加入Zn粉可防止 醛被H2O2氧化。意义:从产物推出原来的烯烃的结构
H2O/Zn
R R'
R R'
C O
O O
C=O + O=C
(酮) (醛)
R" H R" OH
22
C
R" H
H2O2
R R'
C=O + O=C
(酮) (酸)
(丙) 环氧化反应
酮 醛
R" H O=C
酸
KMnO 4
R" OH
21 高锰酸钾与烯烃的氧化可用来检验双键是否存在,以及双键的位置。
(乙) 臭氧化
将含有O3的空气通入烯烃的溶液(如CCl4溶液)中:
R R' C=C R" H + O3 R R' C O O C O R" H
H2O
R R'
C=O + O=C
酮 醛
R" H
Ph-CH=CH-COOEt
CH 3CO 3H CH 3COOEt 。 80 C
Ph-CH--CH-COOEt O
CH3(CH 2)5CH=CH 2 + H 2O2
二氯甲烷 80%
CH3(CH 2)5- CH
1,2-环氧辛烷
CH2 O
工业上最常用的催化氧化,产物大都是重要的化工原料。
CH2=CH 2 +
18
(戊) 硼氢化反应
硼氢化反应是1979年Nobel化学奖得主Brown发现的。 烯烃 (π 电子 ) 首先与硼烷 ( 缺电子化合物 ) 反应生成三烷 基硼,后者在碱性条件下与过氧化氢反应得到醇:
空间效应
R-CH=CH2 + H BH2 CH2=CH-R
RCH2CH2BH2
一烷基硼
CH2=CH-R
H ¡ £ £ 121.7 ¡ C
