第八章醛、酮、醌详解
醛_酮_醌(j)

O || 稀HCl CH3CCH3 + NaCl + SO2 + H2O
五、化学性质—加成反应
④ 与R—OH加成:缩醛反应
O || R—C—H + R’—OH
R’—OH 无水HCl
无水HCl
OH | R—CH—OR’ (半缩醛)
OR’
|
R—CH—OR’ (缩醛)
+
H2O
* 同碳二元醚,胞二醚即缩醛。
—CHO O ||
—C—CH3
二、醛、酮的分类
2. 根据羰基的数目分:
一元醛(酮): CH3CHO C2H5COCH3 二元醛(酮):CH3COCH2COCH3 多元醛肪族醛酮采用系统命名法,选含有羰基的最
长碳链为母体;编号从醛基(或酮基最近端)
开始,酮的位次要标明。
四、醛、酮的结构
1. 醛、酮的性质:
亲核加成反应和α-H的反应是醛、酮的主要化学性质
醛基易于氧化
(R) H
δ+ δ-
CO
R CH2
亲核试剂进攻缺电子的碳,发生羰基的加成
α—H的反应(羟醛缩合;卤代)
五、化学性质—加成反应
1. 与HCN加成:
(增加一个碳)
C O + H—CN
OH | C—CN
α-羟基腈是很有用的中间体,它可转变为多种化合物
O || CH3—C—H + NaHSO3
OH | CH3—CH—SO3Na↓
乙醛—α—羟基磺酸钠
五、化学性质—加成反应
O || CH3—C—CH3 + N(饱aH和S)O3
OH | CH3—CH—CH3↓ | SO3Na
丙酮—α—羟基磺酸钠
第八章醛、酮、醌第一节醛和酮一、醛酮的结构和命名羰基碳原子SP2杂化
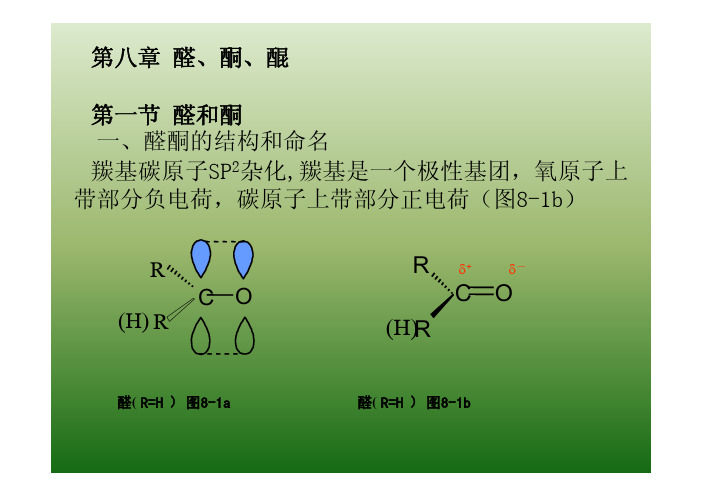
二、醛酮的物理性质羰基是极性基团,羰基中的氧原子可以与水形成氢键,醛酮的沸点比相应分子质量的烷烃高得多,而比相应分子质量的醇低得多。
三、醛酮的化学性质(一)羰基的加成羰基碳原子带部分正电荷,显正电性,易发生羰基的亲核加成反应醛、酮亲核加成反应的活泼性z空间效应考虑:醛羰基中有一个小的氢原子,酮羰基中有两个烃基,加成产物的中心碳原子周围较拥挤,反应平衡中产率较低z电子效应考虑:烃基是推电子的基团,醛只连有一个推电子的基团,而酮则连有两个推电子基团z直接连有吸电子基可使羰基碳原子正电性增高,更易于发生加成反应CCl3CHO>HCHO>RCHO>CH3COCH3>RCOCH3>ArCOCH3>ArCOAr常见醛酮的相对活泼性顺序为:(二)与氨的衍生物的加成—消除反应氨的衍生物通式H 2N-X 。
氨的衍生物氮原子上仍保留一对孤电子,容易与醛酮发生反应最常见的有:羟胺H 2N-OH 肼H 2N-NH 2;苯肼、H 2N-NHC 6H 52,4-二硝基苯肼H 2N-NHC 6H 5(NO 2)2 -2,4氨基脲H 2N-NHCONH 2醛类或酮类分子中的羰基被锌汞齐和浓盐酸还原为亚甲基:此法只适用于对酸稳定的化合物。
对酸不稳定而对碱稳定的化合物可用Wolff-Kishner-黄鸣龙反应还原。
反应机理本反应的反应机理较复杂,目前尚不很清楚。
参考文献[1]E. Clemensen, Ber.,1913, 46, 1837.[2]S. Yamamura, S. Ueda, Y. Hirata, Chem. Commun., 1967, 1049.[3]S. Yamamura, Y. Hirata, J.Chem. Soc.,C,1968, 2887.[4]S. Yamamura, Chem. Commun., 1968, 1494.[5]S. Yamamura,Tetrahedron Lett., 1967, 3361.[6]M. Toda, Y. Hirata, S.Yamamura,Chem. Commun., 1969, 919.。
有机化学第八章醛酮醌 PPT课件

O
Vit K2
O SO 3Na . 3 H2O O Vit K3
44
葡萄糖和果糖:
CHO H C OH HO C H H C OH H C OH CH2OH
CH2OH C O HO C H H C OH H C OH CH2OH
45
黄酮类化合物:
O O
O
O
46
例如:槲皮素
OH HO O OH OH OH O
RCHO + 2Cu
鉴别
2+
+ NaOH + H2O
△
RCOONa + Cu2O ↓ 砖红色
酮与弱氧化剂不反应
40
值得注意的是,苯甲醛与Fehling试剂不反
应。所以,可以用Fehling试剂区别芳香醛
和脂肪醛。 想一想
CHO
Fehling试剂
?
(—)
Cu2O(砖红)
CH2CHO
41
2、与希夫试剂的反应
47
醛和酮化学性质小结
-H的酸性
醇醛缩合 卤代反应 (碘仿反应)
O C C
氧化 还原
H
亲核加成
(与HCN、NaHSO3、ROH、H2N-G加成)
48
本章学习要求
1.掌握醛酮的结构和命名。 2.掌握醛酮的化学性质,熟悉醛和酮化学性质的异同 点: ⑴羰基的加成反应,(加氢氰酸、加亚硫酸氢钠、加 醇生成半缩醛和缩醛、加氨的衍生物等) ⑵α -活泼氢的反应:醇醛缩合反应、卤仿反应。 ⑶醛的特殊反应:氧化反应、与希夫试剂的反应。 ⑷还原反应:催化加氢、与金属氢化物反应。 3.了解醌的结构和性质,学习结构分析方法。
酮和醌的分子中都含有羰基ppt

O R C H + HO-R'
干燥 HCl
OH R C H OR'
半缩醛 半缩醛分子中有2个官能团, 半缩醛分子中有2个官能团,1个是醇 羟基,个是烃氧基,它既是醇又是醚。 羟基,个是烃氧基,它既是醇又是醚。 半缩醛分子中的羟基叫半缩醛羟基 半缩醛羟基。 半缩醛分子中的羟基叫半缩醛羟基。半 缩醛羟基与过量的醇作用,失去一分子 缩醛羟基与过量的醇作用, 水生成稳定的缩醛。 水生成稳定的缩醛。
OHHCN
O R C H(CH3) + CN
H+
H+ + CNH+ OH R C H(CH3) CN
OR C H(CH3) CN
上述加成反应是由负离子首先进 攻羰基中缺电子的碳原子, 攻羰基中缺电子的碳原子,因此是 亲核加成反应。HCN是亲核试剂 是亲核试剂。 亲核加成反应。HCN是亲核试剂。 所有的醛都可与HCN加成 加成, 所有的醛都可与HCN加成,酮的加 成较醛困难, 成较醛困难,脂肪族甲基酮及少于 8个碳的环酮才能反应,芳香族甲基 个碳的环酮才能反应 才能反应, 酮及其它酮难以发生反应。 酮及其它酮难以发生反应。
R H C O + H2 Pt R H C OH H
醛
R R C O + H2 Pt R
伯醇
R C OH H
酮
仲醇
(二) 醛的特殊反应 1. 与弱氧化剂的作用 醛和酮最明显的区别是对氧化 剂的敏感性。 剂的敏感性。醛非常容易被氧化 ,既使是弱氧化剂也可以把醛氧 化成含同数碳原子的羧酸, 化成含同数碳原子的羧酸,而酮 不能被弱氧化剂氧化。常用的弱 不能被弱氧化剂氧化。 氧化剂有托伦(Tollens)试剂和斐 氧化剂有托伦(Tollens)试剂和斐 (Fehling)试剂 试剂。 林(Fehling)试剂。
8 醛、酮、醌

醛羰基中的氢原子直接连在羰基碳上,它表现出 与其它碳氢键上氢原子不同的性质。在化学性质 上最大的区别是醛基氢原子非常容易被氧化,而 其它碳氢键上的氢原子较难被氧化。 醛酮C=O双键的化学反应,主要有: (1) 羰基上 的反应; (2) 羰基α-H的反应; (3) 醛基氢的 反应。
3.1 羰基上的加成反应
脂肪族亚胺不稳定,易分解为原料,而芳香族亚胺稳定 H+对反应有两种作用,①活化作用:与醛酮形成 RR’C=O+H,增大羰基碳的正电性,有利于含氮亲核试剂 进攻,且H+催化脱水。②钝化作用:H+与NH2-G形成 +NH -G,降低含氮亲核试剂的亲核性,不利于反应。因 3 此,反应体系需要有一个最适宜pH值。不同醛酮化合物 与不同含氮化合物的反应,所需的pH值不同。例如,由 丙酮制丙酮肟,pH=4.5最合适。 醛酮与氨衍生物的加成反应在有机分析中很有用,肟、苯 腙及缩氨脲绝大多数都是白色固体(与2,4-二硝基苯肼 生成的2,4-二硝基苯腙为金黄色固体),具有固定的结 晶形状和熔点,通过测定熔点就可确定原来的醛、酮;另 外,肟、腙、苯腙及缩氨脲在稀酸作用下,又能够水解为 原来的醛、酮,因而又可利用这种性质来分离和提纯醛酮。
CH 3CHO + 2C2H5OH 无水CaCl 2 CH 3CH(OC 2H5)2 + H2O
乙醛缩二乙醇
分子量大的醛与醇反应需要加苯蒸馏,把生成的 水带出,使平衡向右移动,提高缩醛产率。
酮与醇难形成类似的半缩酮或缩酮,但用乙二醇,丙三 醇或原甲酸三乙酯代替醇,可以形成缩酮。
C6H5CH2COCH 3 + HC(OC 2H5)3
缩醛和缩酮较稳定,不与碱反应,也不与RMgX 和金属氢化物反应,但在稀酸中加热,变为原来 的醛酮,缩醛 ( 酮 ) 这一性质在有机合成上很有 用。通过生成缩醛和缩酮,可使羰基在化学反应 中不被破坏而被保护起来。对于多官能团分子进 行某些反应,如果不需羰基发生反应,但羰基又 干扰反应进行,可先使之变为缩醛或缩酮,在反 应结束后,再酸性水解,恢复原来的羰基。
第八章 醛和酮

NO2
②消除
乙醛-2,4乙醛-2,4-二硝基苯腙 黄色结晶) (黄色结晶)
O C H
正丁醛
O CH3 C CH2CH3
异戊醛
苯甲醛
C O
二苯甲酮
甲基乙基(甲 酮 甲基乙基 甲)酮 甲乙酮
系统命名法:是选择含有羰基在内的最长碳链为主链, 系统命名法:是选择含有羰基在内的最长碳链为主链,称 为某醛或某酮。主链从离羰基较近的一端开始编号。 为某醛或某酮。主链从离羰基较近的一端开始编号。醛基 总是在碳链的一端。有取代基时,应标出其位置。例: 总是在碳链的一端。有取代基时,应标出其位置 CH3CHCH2CHO C2H5 3-甲基戊醛 甲基戊醛) (β-甲基戊醛) CH3-C=CH-CHO = - CH3 3-甲基-2-丁烯醛 甲基O - CH3-CH-C- CH2CH3 CH3 2-甲基-3-戊酮 甲基甲基- 戊酮) (α-甲基-3-戊酮)
水合三氯乙醛可用作安眠药和麻醉剂;水合茚三酮则用 水合三氯乙醛可用作安眠药和麻醉剂;水合茚三酮则用 可用作安眠药和麻醉剂 检验α 氨基酸色层分析指示剂。 于检验α-氨基酸色层分析指示剂。
(6)与氨的衍生物的加成反应 与氨的衍生物的加成反应 氨的衍生物(羰基试剂): 氨的衍生物(羰基试剂): NH2OH 羟胺 NH2-NH NH2-NH2 肼 NO2 NO2 NH2-NH 苯肼 O NH2-NH-C-NH2 氨基脲
② 反应历程
实验发现碱对上例加成反应有极显著的影响。例如: 实验发现碱对上例加成反应有极显著的影响。例如: 丙酮 + HCN 丙酮 + HCN 丙酮 + HCN HCN C=O OC CN + H+ + CN→ 在3-4小时内只有一半原料起反应 反应在2 反应在2分钟内完成 放置几星期也不反应 放置几星期也不反应 OC CN OH C CN
醛、酮和醌详解演示文稿
第50页,共69页。
强亲核试剂在 1,2位, 弱亲核试剂在 1,4位
第51页,共69页。
14.1.6 乙烯酮与卡宾
• 1. 乙烯酮
磷酸三乙酯
700℃
结构
非常不稳定,光照分解,易与有活泼氢的化合物加成
CH2
C
hν
O
..CH2 + CO
卡宾
第52页,共69页。
第53页,共69页。
• 2.卡宾
结构:
第43页,共69页。
Meerwein-Ponndorf 反应: Oppenauer反应的逆反应
醛酮
醇 (不饱和键不反应)
异丙醇,异丙醇铝催化
Clemmensen 还原:
酮羰基变成亚甲基
PhCOCH2CH2CH3
Zn-Hg,浓HCl 回流,88%
PhCH2CH2CH2CH3
第44页,共69页。
Wolff-Kishner 反应 : (醛酮)
慢
O
快
Br Br
CH3 C
O CH3 C CH2
CHBr + Br 2
注意酸碱催化时反应机理特点
第30页,共69页。
O
快
CH3 C CH3 + H+
+
OH CH3 C CH2
H
OH H+
CH3 C CH2
慢
OH CH3 C CH2
快
+ Br Br
OH
CH3
C
+
CH2 Br
+
OH CH3 C CH2Br + Br
单重态:无单电子,SP2杂化
三重态:两个单电子, SP 杂化,较稳定
有机化学——醛、酮、醌ppt课件
醛、酮对氢氰酸的加成反应活性次序
H H
O
O C O > CH3 C H> R
O C H>
O C
H
> CH3CCH3
O
O
>
> CH3
O C
R
>
O R C
R' &g;
C
适用范围:只有醛、脂肪族甲基酮、八 个碳原子以下的环酮才能与氢氰酸反应。
练习题
将下列化合物与HCN反应的活性按由大到
小顺序排列:
OH
慢
C
+
C N
快
-
OH C-CN
哪种占优,主要取决于各自中间体的相对稳定性 。
实验事实
(1) 丙酮和氢氰酸反应3-4小时,仅有一半原 料起作用。 (2)若在反应体系中加入一滴氢氧化钾溶液, 则反应可在几分钟内完成。 (3)若加入大量酸,则放置几周也不起反应 。
HCN
H +C N
+
-
实验事实说明羰基与氢氰酸的加成反应是亲核加成。
RC H S O N a 3 O H
(3)与格氏试剂加成
格氏试剂是较强的亲核试剂,非常容易与醛、酮 进行加成反应,加成的产物不必分离便可直接水解生 成相应的醇,是制备醇的最重要的方法之一。
M g X R C O
R H O 2 C O M g X+ + M g ( O H ) C X O H H
R
格氏试剂与甲醛作用,可得到比格氏试剂多一个碳 原子的伯醇;与其它醛作用,可得到仲醇;与酮作用, 可得到叔醇。
反应是可逆的,必须加入过量的饱和亚硫酸氢钠 溶液,以促使平衡向右移动。 适用范围:只有醛、脂肪族甲基酮、八个碳原子 以下的环酮才能与饱和亚硫酸氢钠溶液反应。
醛酮醌知识点总结思维导图
醛酮醌知识点总结思维导图一、醛酮醌的概念及分类1.1 醛酮醌的定义醛酮醌是一类具有羰基和酮基的有机化合物,其结构中含有羰基(一定是一个氧原子与一个碳原子形成的双键),也有酮基。
1.2 醛酮醌的分类醛酮醌根据其结构和特性可以分为醛、酮、醌三种类型。
其中醛和酮分别是通过氧原子与碳原子形成的双键连接,在结构上醛中羰基与氢原子相连,而酮中羰基与两个碳原子相连。
而醌则是通过两个羰基连接在一起。
二、醛酮醌的物理性质2.1 醛酮醌的溶解性醛酮醌在水中的溶解度一般较低,而在有机溶剂中的溶解度则较高。
2.2 醛酮醌的气味醛酮醌具有多种不同的气味,其中包括芳香、刺激性气味等。
2.3 醛酮醌的熔沸点醛酮醌的熔沸点一般在较高温度范围内,不同种类的醛酮醌具有不同的熔沸点。
三、醛酮醌的合成和制备3.1 醛酮醌的合成方法醛酮醌的合成方法有直接合成、氧化还原合成、亲核加成反应合成等多种方法。
3.2 醛酮醌的制备工艺醛酮醌的制备工艺中通常包括原料准备、反应操作、产物分离和提纯等多个步骤。
四、醛酮醌的化学性质4.1 醛酮醌的还原性醛酮醌在还原反应中常常失去氧原子,生成相应的羟基和醇类化合物。
4.2 醛酮醌的亲核加成反应醛酮醌在亲核加成反应中,酮中羰基上的氧原子可以成为亲核试剂攻击的位置,产生相应的产物。
4.3 醛酮醌的氧化反应醛酮醌在氧化反应中会通过氧化剂的作用产生相应的氧化产物。
五、醛酮醌的应用领域5.1 化工领域醛酮醌在化工领域中广泛应用,包括有机合成、催化剂和溶剂等方面。
5.2 医药领域醛酮醌在医药领域中用作药物合成中间体和抗氧化剂等。
5.3 日用品领域醛酮醌在日用品领域中用于生产香水、口红等化妆品,以及染料的生产。
六、醛酮醌的安全性及环境影响6.1 醛酮醌的安全性醛酮醌在使用和储存过程中需要注意防火、防爆、防毒等措施,以保证人员和设备的安全。
6.2 醛酮醌的环境影响醛酮醌可能对环境造成一定影响,需要在使用和废弃处理过程中注意环保措施。
第八章 醛、酮、醌
3,4-二甲基戊醛
CH3 H 2C C H C H C H 2C H O
4-甲基-3-己酮
O C H 3C H C H C H 2C C H 3
3-甲基-4-戊烯醛
CH3 CH3 CH2 CH
4-己烯-2-酮
CHO
三、醛和酮的物理性质
除甲醛是气体外,低级饱和醛、酮是液 体,高级醛、酮为固体。 2.沸点 沸点比分子量相当的烃及醚高。 3.溶解性 低级的醛酮可溶于水。 四、羰基的结构 1.状态
+
C H I3
氧化性
C H 3C H 2 O H I2 Na OH C H 3C H O
I2 Na OH C H I3
+
HC O ONa
C H3C H C H2C H3 OH
N a OI
C H3C C H2C H3 O
Na OI
C H I3
+ C H 3C H 2C O O N a
2.由甲基酮---→羧酸(少1C)
92%
2.羟醛(酮)缩合反应
O 2 CH3 C H 稀 OH
α,β -不饱和醛
C H 3C H CHCHO
反应机理:
O
O CH2 C H
1) O H
O
+
H CH2 C H
+
H 2O
O
碳负离子
C H3 C H C H2C H O O
2) C H 3 C H 3)
H 2O
+
CH2 C H
氧负离子
CH3 CH CHCH O OH H
H 2O
H
+
C H 2OH C H 2OH
在有机合成中利用这一性质来保护醛基
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第八章 醛、酮、醌 (5学时)【目的要求】⒈ 掌握醛、酮的结构、命名,了解它们的分类; ⒉ 掌握醛、酮的性质和制备方法; ⒊ 理解亲核加成反应的历程; 4.了解重要醛、酮的用途。
5.了解醌的结构与性质。
§8—1 醛、酮的结构、分类和命名 一、结构:⒈ 〉C=O⒉ 比较C=O 和C=C 双键C —O 单键键能: 360 KJ/mol ; C —C 单键键能:347 KJ/molC=O 双键键能: 醛 736 KJ/mol ; C=C 双键键能:611 KJ/mol酮 749 KJ/mo二、分类:⒈ 据分子中含羰基的数目可分为:一元醛、酮;二元醛、酮。
⒉ 据烃基的饱和程度可分为:饱和醛、酮;不饱和醛、酮。
⒊ 据烃基的不同可分为:脂肪醛、酮;芳香醛、酮; 脂环醛、酮。
⒋ 酮又可分为:单一酮和混合酮。
三、系统命名⒈ 选择含羰基的最长碳链作为主链。
⒉ 从靠近羰基一端开始编号,醛是从醛基碳原子开始编号。
⒊ 酮羰基(除丙酮、丁酮)要标明羰基碳的位置。
(编号还可用希腊字母表示,靠近羰基的碳原子为α碳)⒋ 环酮从羰基碳开始编号CH 3CH-C-CHCH 3Cl O Cl2,4-二氯戊酮(不要标明羰基位置)或α,α`-二氯戊酮C H =C H C OC H 34-苯基-3-丁烯-2-酮 (不饱和键也要注明位置)3-甲基环已酮 (羰基碳原子在环内的为环酮)OCH 3C O H H116.9°121.8°C OH 3CH 3C117.0°121.5°⒌芳香醛酮简单的:复杂的:可把芳基作为取代基,按系统命名法编号。
⒍混合酮:按系统命名法编号,标明羰基取代基的位置。
⒎既有醛基又有酮基的:一般将醛基作为母体,酮基作为取代基。
§8—2 醛、酮的性质一、物理性质醛、酮分子间不能形成氢键,但极性较强,分子间的引力大于烷烃、醚。
⒈极化度较大。
⒉沸点:比相应(分子量相近的)醇低,比相应的烷烃和醚高。
⒊低级醛、酮可溶于水。
醛、酮一般都能溶解于有机溶剂。
二、化学性质⒈加成反应:醛、酮中的C=O偶极矩约在2.3~2.9D说明羰基是极化的。
①与HCNa、可逆。
历程:·CN—进攻羰基是决定反应速度的步骤。
·实验事实:b、和HCN加成的难易·电子效应HCHO 〉RCHO 〉酮H CN H+CN+--δ-O OHCNR R CHCNOHR CR`O H CN+R CR`CNOHα—羟基腈CH3CCH3O+小时只有50%原料起反应。
C-CH3系统命名称苯乙酮 (也称苯甲酮)OC-CH2CH31-苯基-1-丙酮OCHO苯甲醛CO羰基的亲核加成反应和还原反应—H的反应(R)·空间效应HCHO 〉RCHO;RCHO 〉甲基酮〉R2C=O;c、范围:醛、脂肪族甲基酮和八个碳以下的环内酮可以进行反应。
d 、应用:·增长碳链的一种方法。
·产物羟基腈是一类活泼化合物,便于转化为其它化合物。
②与NaSO3Ha、可逆。
b、醛、脂肪族甲基酮、8个碳以下环酮。
C、应用。
可用于鉴别、分离、提纯醛和酮。
③与Grignard④与醇加成R'CHOR'C=ORCH2R-M gX增加一个C伯醇RCH2OHH2OR'CHOMgXRH2O R'CHOHR仲醇R'-C-OMgXR'RH2OR'-C-OHR'R叔醇+HH3COH3CH3COH3CCE tOH3CCM e2HCOH3CCM e3COE tE tO 89%56%36%12%6%2%Rδδ+-δδ+R C OMgXH2OR C OH+MgOHXCOHSO3NaOO+Na2SO3COSO H2ONaCl++++H2O+CH3CCH3OHCN CH3CCH3OHCNCH3OHH SOCH2=CCOOCH33α-甲基丙烯酸甲酯C=O+NaHSO C O NaSO3H+-C OHSO3Naα-羟基磺酸钠盐R CO+ROHH+R C OHHOR半缩醛H ROH,R C ORHOR缩醛R COHH++R COHH+R CHOHOEt半缩醛+R COHH+O EtH慢R COHOH HEt+H-Ha 、反应是可逆的。
b 、半缩醛是不稳定的,易分解为醛和醇。
c 、缩醛较稳定。
缩醛水解又转变为原来的醛和醇。
d 、应用。
·保护活泼的醛基。
e 、酮在同样的条件下,不发生半缩酮和缩酮的反应。
⒉ 与氨的衍生物加成缩合反应① 氨的衍生物 H 2—N —Z Z = —OH 羟氨 —NH 2 肼 —NHC 6H 5 苯肼 —NHCONH 2 氨基脲 —R' 胺 ② 反应实际反应一般属于加成——消除反应过程。
③ 特点:a . 由碳氧双键转变成碳氮双键。
b..常用来鉴别醛酮。
例:乙醛肟的熔点是:47 ℃ 。
环已酮肟的熔点是:90 ℃c. 分离提纯醛、酮 。
肟、腙、苯腙以及缩氨脲在稀酸作用下,能水解为原来的醛和酮。
3、醛酮 α—H 原子的反应α—H 由于受到羰基的影响,酸性增强。
C=O +H 2C —N-OH HC=O +H 2-N-NH 2H 2O -C=N-NH 2C=O +H 2-N-NHC 6H 5H 2O-C=N-NHC 6H 5C=O +H 2-N-NHCONH 2C=O +H 2-N-R`H 2O -C=N-R`(腙)(苯腙)(缩氨脲)(取代亚胺,不太稳定)HOEt R C OEt HOEt 缩醛R C EtO H H OEt+-H 2O R C H +H -R C H 2O H OEt++CH 3CH=CHCH=O CH 3CH=CHCH OEt OEt 稀KMO 4OEt OEt 3CH-CHCH OH OH H +3CH-CHCHOOHOH CCH C H H O (R )α—H例: CH 3 CH 3 PKa 42 ;CH 3CO CH 3 Pka 20 。
① 羟醛缩合:稀OH —作用下,两分子的醛或酮结合生成一分子β—羟基醛或β—羟基酮,称~。
酮发生羟醛缩合时,比醛要困难些。
主要是由于空间效应的影响。
a. 除乙醛外,其它醛所得在α—C 上带有支链的羟醛或烯醛。
b.无α—H 的醛酮不能发生羟醛缩合。
c. 但无α—H 的醛酮可和另一分子有α—H 的醛的负离子接受者而在不同的分子间发生“交叉”羟醛缩合反应。
d. 在合成上有重要的意义。
· 增长碳链,产生支链。
· 制备α、β不饱和醛、酮、醇及二醇 ②卤代反应及卤仿反应。
含α—H 的醛、酮可被卤素取代生成α—卤代醛、酮。
醛酮中的α—H 易被卤素取代,特别是在碱性溶液中,反应进行的很顺利。
反应历程:碘仿是黄色晶体,不溶于水,具有特殊的的气味,易于发觉。
所以碘仿反应常用来鉴定具有甲基的醛、酮和醇(甲基酮、乙醛、含甲基的醇)。
+CH 3CHO CH 3CHO CH 3CH-CH 2CHO OH-H 2O CH 3CH=CHCHOαβ+RCH 2CHO RCH-CHCHO OH -H 2ORCH=CCHO αβRCH 2CHO R △R+稀碱CH 2CHO -H 2O CH 3△CHO CH OH CHCHO CH 肉桂醛+H 2O CH 3CHO Cl 2ClCH 2CHO +HCl +O Br HBr O Br+3O2O +OH -H 2O +-2O +X-X -X -R-C-CH 2X O++2X O X 2NaOH R-C-CX 3O--R-C-CX O R-C-CX 3OHOH R-CO OH +CX 3R-C OO+-HCX 3⒋ 氧化还原反应: 醛、酮羰基既能氧化又能还原。
① 氧化反应a . Tollen 反应:Tollen 试剂的主要成份是银氨络离子。
酮一般不发生此反应,可以区别醛、酮。
b .Fehling 反应:Fehling 试剂由两部分组成:甲液——为硫酸铜溶液。
乙液——为洒石酸钠的氢氧化钠溶液。
甲醛还原性较强,常进一步将氧化亚铜还原成暗红色的金属铜或铜镜。
芳香醛和各种酮都不能起Fehling 反应。
因此可用于鉴别脂肪族醛。
另还不氧化双键,可用不饱和醛制备不饱和酸。
例:② 还原反应a. 还原成烃: Clemmensen 还原法:③.歧化反应——Cannizzaro 反应 :在同种分子间同时进行着两种性质相反的反应~。
没有 α—H 的醛与强碱共热时,则其中一分子作为 H 的供给者,另一分子作为H 的接受者,前者被氧化,后者被还原,发生了分子间的氧化还原反应,而生成等量的醇和酸。
5.醛的显色反应: schiff 试剂与醛类反应,显紫红色,反应灵敏是醛特有的检验方法。
6.α,β—不饱和羰基化合物的亲核加成O 浓HNO 3CH 2CH 2COOH CH 2CH 2COOHCH 3CH=CHCHO (巴豆醛)Tollen 试剂CH 3CH=CHCOOHCH 3(巴豆醛)CH 3CH=CHCH 2OH NaBH 4(巴豆醇)酮不显色醛显紫红色酮H 2SO 4浓甲醛紫红色不褪色其它醛紫红色褪去RCHO Ag(NH 3)2OH +△+Ag ↓NH 3++H 2O NH 4-+RCHO Cu +△+↓+H 2O +++-25-Cu 2O 3络离子砖红色醇醛、酮酸伯醇醛C OCH 223Zn-Hg HCl CH 2CH 2CH 3+2CH 2O HCOO Na CH 3OH +-++NaOH -+CHO COO Na CH 2OH +归纳鉴别醛、酮的方法:§8—3 醛、酮的制法一、 氧化与脱氢: 醇醛 、酮⒈ 醇的氧化与脱氢⑴ 伯醇氧化为醛 ⑵ 仲醇氧化为酮⑶ 催化脱氢⑷ 氧化脱水⒉ 烃的氧化RCH 2CH 2OH 27H SORCH 2CHO CH 3CH 2Cu 260~290℃CH 3CHO +H 2Cu260~290℃OH O +H 2CH 3OH HCHO +O 2250℃+H 2O烯臭氧还原水解醛、酮+臭氧H 3C C H 3C CHCH 3Zn/H 2O 3C C 3C O CH 3CHOCH 2=CH C O H CH 2=CH-CHOH R1,2加成1,4加成RCH 2CH 2CHOCH 2=CH COH CH 2=CH-CHOH CN1,2加成1,4加成HCN OH -NCCH 2CH 2CHO二、芳烃的酰基化三、炔烃的水化(库切洛夫反应)三、羟醛缩合(略)§8—4 重要的醛、酮一、甲醛⒈物性:⒉化性:⑴聚合⑵还原性⑶Cabbuzzari 反应⑷与NH3反应生成环六亚甲四胺⒊制备:⒋应用:主要用于合成原料。
二、乙醛⒈物性⒉特性:聚合。
⒊制备:三、丙酮⒈物性⒉应用:优良的有机溶剂。
