橙汁饮料中Vc含量的测定
果汁中维生素C含量的测定要点

2013届毕业项目摘要:果汁饮料的主要原料就是水果,其中的主要营养成分是维生素C。
维生素C又称为抗坏血酸,属于水溶性维生素,在水溶液中易被空气和其他氧化剂氧化,但在弱酸性条件下较稳定,所以本次用碘量法测定果汁中的维生素C的含量。
本次方法简单,可靠,准确度较高,在实验室得到广泛应用。
关键词:果汁饮料;维生素C;碘量法
2013届毕业项目
目录
1绪论 (1)
1.1果汁饮料的概念 (1)
1.2果汁饮料的发展 (1)
1.3对果汁饮料中维生素C测定意义 (1)
2.实验部分 (3)
2.1实验原理 (3)
2.2实验仪器与试剂 (3)
2.3实验步骤 (4)
2.4数据处理 (5)
3.结果与分析 (7)
3.1数据变动原因 (7)
3.2不同方法对比实验 (7)
3.3酸碱性对维生素C测定的影响.......................................................................
3.4含量影响因素...................................................................................................
4.结论........................................................................................................
参考文献 (11)
致谢 (12)
1。
橙汁饮料中Vc含量的测定
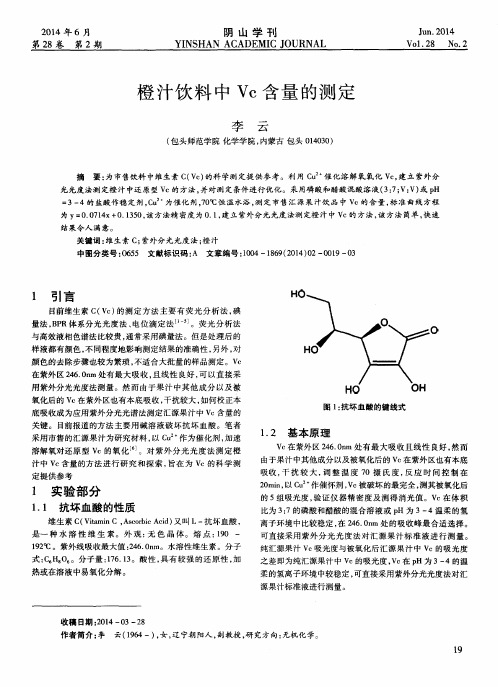
1 . 3 实验 用 品
仪器 : U V 3 0 1 0紫 外 分 光 光 度 计 (日本 日立 公 司 ) 、 F A 1 0 0 4电子天平 ( 上海 越平 科学 仪器 公 司 ) 、 S Y C一1 5 B超 级恒温水浴 ( 南京桑立电设备厂 ) 、 l O O m l 容 量瓶 2个 、 l O m l 量筒 2个 、 5 0 0 m l 容量瓶 1 个5 0 m l 容量瓶 5个 、 移 液管 5 0 ml
溶解 氧对 还原 型 V c的 氧化 J 。对 紫 外分 光光 度法 测 定橙 汁中 V c含量的方 法进行 研 究 和探 索 , 旨在 为 V c的科学 测
定 提 供 参 考
1 实 验部 分
1 . 1 抗坏血酸的性质
维 生素 C ( V i t a m i n C, A s c o r b i c A c i d ) 又叫 L一 抗坏 血酸 , 是一 种 水 溶 性 维 生 素。外 观 : 无 色 晶 体 。熔 点 : 1 9 0 — 1 9 2 ℃ 。紫外线吸收最大值 : 2 4 6 . 0 n m。水溶性维生素 。分子 式: C H。 0 。分子量 : 1 7 6 . 1 3 。酸性 , 具有 较强 的还 原性 , 加
的 5组 吸光度 , 验证 仪器 精密 度及测 得 消光值 。V c在体 积
比为 3 : 7的磷酸 和醋酸 的混 合溶液 或 p H为 3— 4温柔 的氢
离子环境 中比较稳定 , 在2 4 6 . 0 n m处 的吸 收峰最合适 选择 。
可直接采用紫外 分光 光 度法 对汇 源果 汁标 准液 进行 测量 。 纯 汇源果 汁 V c 吸光度与被氧化后 汇源果 汁 中 V c的吸光 度 之 差即为纯汇源果汁 中 V c的吸光度 , V c在 p H为 3— 4的温
测定果汁中维生素C含量

果汁中维生素C含量的测定与分析【实验日期】:年月日——月日【实验人员】:【实验地点】:【实验目的】:1.使用碘量法测定果汁中维生素C含量2.使用2,6-二氯靛酚钠测定果汁中维生素C含量3.将两个结果进行对比分析,并比较二者的优劣【实验原理】:维生素C具有还原性的烯二醇基,易被氧化性物质氧化为脱氢维生素C,据此采用氧化还原滴定法进行测定1,具体方案为:1.碘量法(间接碘量法)测定原理:+I2E(C6H6O6/C6H8O6)=0.18V E(I2/I-)=0.535V该反应在弱酸性环境下反应快速完全,同时弱酸环境降低了维生素C的还原性,有利于避免其他氧化性物质的干扰,弱酸环境也避免了I2的歧化反应。
2. 2,6-二氯靛酚法测定原理:1.“统一鲜橙多”成分中中含有部分D-异抗坏血酸钠,样品处理过程中被处理为异抗坏血酸,其也可被I2和2,6-二氯靛酚定量氧化,因此测定结果为二者总含量。
++2,6-二氯靛酚氧化型在酸性介质中为桃红色,碱性和中性介质中为蓝色,与维生素C反应后,生成无色的还原型酚亚胺,因此,在酸性条件下,用2,6-二氯靛酚滴定至浅红色15s不退色即为终点。
使用标准抗坏血酸钠标定2,6-二氯靛酚溶液,直接使用2,6-二氯靛酚溶液滴定样品。
【实验仪器】:50ml酸式滴定管,50ml碱式滴定管,250ml锥形瓶×3,250ml容量瓶×2,25ml移液管,10ml量筒,100ml量筒,玻璃棒,表面皿。
电子分析天平(0.0001g),真空循环水泵,抽滤瓶。
【实验试剂】:K2Cr2O7(基准试剂),KIO3(基准试剂),VC(基准试剂),Na2S2O3·5H2O(分析纯)、KI(分析纯)H2C2O4·2H2O(分析纯),淀粉溶液(5%)市售“统一鲜橙多”(瓶装2500ml)2【实验内容】:2.由于“统一鲜橙多”中维生素C的含量比较高(25mg/100ml),而其他饮料中维生素C的含量都是10mg/100ml以下,为了使实验现象更明显,故选用“统一鲜橙多”饮料,用来测定其维生素C的含量。
常见水果饮料Vc含量测定报告

常见水果饮料Vc 含量测定报告课题主要目的是研究并测定水果或饮料中Vc 的含量.通过对Vc 的认识,及其各种测定的方法,以小组为单位开展以实验为主的课题研究.以下是我高一(10)班研究小组的研究成果报告.维生素C (686O H C ).具有较强的还原性,加热或在溶液中易氧化分解,在碱性条件下更易被氧化.能够促进提高人体的免疫功能.可以说是人体必不可少的重要物质.测定Vc 有助于了解Vc 深入化学世界.在日常学习中知道碘单质具有氧化性Vc 可以被碘单质氧化.因此我们根据关键反应方程式进行了讨论.关键反应方程式:HI O H C I O H C 22662682+−→−+根据这个实验基本目的开始了实验.实验试剂:1.需测定的含有Vc 的溶液.(为了简单直接.我小组选用了学校出售的"鲜橙多"饮料.Vc 含量10-100mg/100ml)2.淀粉溶液.3.已经由指导老师配制好的含碘溶液(硫代硫酸钠.KI.氯水使 碘离子子不易流失)实验器材:酸氏滴定管.小烧杯.锥形瓶.移液管.铁架台等实验基本操作:由组内的实验员负责进行操作滴定.以下为实验过程把"鲜橙多"饮料打开倒足量到烧杯,用移液管移取其到锥形瓶里(溶液恰好到0刻度时开始移取).在移取好的溶液里加入2-3滴淀粉溶液震荡摇匀.放在避光处.向滴定管里倒入碘溶液,需倒在0刻度以上.(操作之前.滴定管活塞处于关闭状态).夹于铁架台上.用左手操作活塞(活塞开关在右手边)把滴定管内的多余气泡冲掉.并且把液面降至0刻度以下.不要降得太多了.我组先将液面降至2ml 处.把待测溶液的锥形瓶放于滴定管下.开始滴定.缓慢操作活塞让碘溶液一滴一滴地加入待测液.一边震荡锥形瓶使其均匀反应.待溶液呈现微兰色且不会褪色的时候表示实验结束且成功了.记录下目前数据.滴定管内液面约在3.95ml 处.即用去了1.95ml 碘溶液.重复以上实验方法.对新的待测液进行滴定.同样记录下数据.液面越在 6.00ml 处.即用去了2.05ml 碘溶液.实验完毕.把数据整理下.计算下.实验数据:两次用去的碘溶液体积是1.95ml 和2.05ml根据已知的公式计算的出结果:分别是11.84mg/100ml12.22mg/100ml将以上结果求平均值:12mg/100ml实验用的饮料瓶上标明Vc含量为10-100mg/100ml.比对下看看哦.实验的出的结果与之相类似.看来实验是成功了.那么就是.我组实验用的橙汁饮料中Vc含量为12mg/100ml,与标准数据相符合.小组对实验成功的分析:根据关键反应公式.维生素C与碘单质发生氧化还原反应.日常学习中所知碘单质遇到淀粉-KI溶液会变兰色.正是因为这样.在滴定的时候向有淀粉的待测液里加入碘单质溶液.与维生素C反应溶液不会变兰色.可是一旦维生素C反应完全了.那就碘单质过量.在碘单质过量的情况下溶液显微兰色.表明维生素C反应光了,没了.只要变成微兰色就可以了.一旦变成了偏棕红色就表示加入的碘溶液过量了.实验失败.需要重新去做一次.实验的关键在于.滴定操作的熟练程度.还好组内实验员能力值得信赖.才得以成功.本次课题的收获有通过亲自动手来进行Vc含量的测定不仅仅增广了我们的知识面.还提高了我们的动手能力.小组之间的合作能力.管理分工达到明确.对实验操作的熟练度训练.还有对某些时候实验连续失败的忍耐力.还有哦.不光知道这一种实验测定的方法.在查阅资料的时候还有如:间接碘量法,荧光法等.然则现今的我们不容易理解也不会去做.本次研究课课题对个人,对学习大有帮助.以上高一(10)班研究小组组员:高翔赵斌王宵驰评语:报告结构完整,数据真实、详细。
橙汁饮料中维生素C含量的测定

工业技术科技创新导报 Science and Technology Innovation Herald41维生素C是人体重要的维生素之一,其参与体内的氧化还原反应、多种羟化反应,有防止贫血的作用,可促进伤口愈合,维持牙齿、骨骼、血管和肌肉的正常功能。
人体不能自身制造维生素C,所以人体必须不断地从食物中摄入维生素C。
德国营养研究会建议,每人每天应摄取50~100 m g的维生素C。
而30 m g的维生素C是人体1 d摄取维生素C的最少值,如果低于30 m g,身体就会缺乏维生素C,使得部分机能无法正常运作,长期以往,甚至出现坏血症。
1 实验原理维生素C 分子式C 6H 8O 6,在空气中稳定,但在水溶液中易被空气和其他氧化剂氧化,生成脱氢抗坏血酸。
分子结构中的烯二醇基具有还原性,可被I 2定量地氧化成二酮基,抗坏血酸分子中的烯二醇基被I 2完全氧化后,则I 2与淀粉指示剂作用而使溶液变蓝,因而可用I 2标准溶液直接测定。
其滴定反应式如下:C 6H 8O 6+I 2=C 6H 6O 6+2H I。
所以当滴定的溶液出现蓝色时即为终点。
2 实验仪器与试剂2.1 仪器50 m L 滴定管、滴定管、250 m L锥形瓶、250 m L 容量瓶、25 m L移液管、500 m L烧杯、研钵、玻璃棒、电子分析天平等。
2.2 试剂2.2.1 K 2C 2O 7标准溶液(约为1/3的1.42×10-2 mol/L)准确称取0.35~0.36 g的K 2C 2O 7基准物质于小烧杯中,加入适量蒸馏水,待其全部溶解后转移至250 m L 容量瓶中,定容、摇匀、备用。
2.2.2 I 2溶液(约为1.42×10-2 mol/L)称取1.8I 2和3.5 g K I,置于研钵中加少量水,充分研磨。
待I 2全部溶解后,将溶液转入棕色试剂瓶,加水稀释至500 m L,摇匀,放置暗处保存。
2.2.3 Na 2S 2O 3标准溶液(约为2.90×10-2 mol/L)称取3.5 gNa 2S 2O 3·5H 2O置于500 m L烧杯中,加入新煮沸冷却的蒸馏水,使其全部溶解,再加入少量的Na 2CO 3,DOI:10.16660/ k i.1674-098X.2016.16.041橙汁饮料中维生素C含量的测定周卓娜(海南省高级技工学校化工部 海南海口 571000)摘 要:维生素C是一种己醛糖,广泛存在于植物组织中,有抗坏血酸的作用,又称抗坏血酸,是水溶性维生素。
鲜橙汁中维生素C的检测浅探解析

鲜橙汁中维生素C的检测浅探一、问题的提出伴随炎炎夏日的来临,各种新鲜水果、蔬菜纷纷上市。
其中富含的维生素C是人类营养中最重要的维生素之一,维生素C(简称V C)又名抗坏血酸,由于人体不能自身合成,必须由新鲜水果、蔬菜提供。
结合高中课程,我布置一项作业,希望同学们设计一套实验对鲜橙汁饮品中的V C进行检测,很快学生通过各种途径查到维生素C的基本情况如下:分子式C6H8O6、密度1.65,熔点192℃易溶于水,性质活泼,那么如何据其结构简式检测它的可能性质及测其含量呢?设计实验过程并用实验证明。
二、方案设计:学生表现兴趣很浓,很快用溴水,用新制Cu(OH)2、NaOH溶液水解……方法呼之即出,但对其如何测含量从课本上找不到方法,资料上查出其具有很强的还原性,能把单质碘溶液来滴定测量。
学生迅速拟定具体的实验方案。
方案如下:第一:用溴水验证其碳碳双键存在;第二:用新制Cu(OH)2验证其多羟基的性质;第三:观察其在NaOH溶液中情况;第四:用标准的碘溶液通过中和滴定测V C的含量。
三、师生互动:通过学生亲自动手实验,体会到下列问题:新制Cu(OH)2配制方法,酯的水解产物弱酸性证明,标准碘溶液的配制方法,滴定操作的关键要点,误差分析等。
其中水解产物的弱酸性证明,能否用石蕊、酚酞等,学生通过动手实验认识到先在NaOH 酚酞,再加入鲜橙汁,渐加热,发现其红色渐变浅,说明水解发生后有酸性物生成,这种方法可以用于其它弱酸的证明上。
再者标准碘溶液的配制,因为碘在水中溶解度较低(0.029g),所以配制标准碘溶液时,加较深的KI。
称取的1.9g碘与20gKI混合后溶于水配成1.75×10-3mol/L碘的标准溶液。
四、具体操作:维生素C浓度取平均值为C= 123=504.03mg/L3五、活动体会:让学生运用已有的化学知识和实验技能,通过实验研究解决与日常生活有密切关系的课题,不仅是活动课的内容,也应是课堂教学的延伸。
饮料中维生素C含量的测定

饮料中维生素C的测定实验设计方案【实验原理】1.维生素C又称抗坏血酸Vc,分子式C6H8O6。
Vc具有还原性,可被I2定量氧化,因而可用I2标准溶液直接测定。
其滴定反应式如下:C 6H8O6+I2= C6H6O6+2HI用淀粉溶液作指示剂,若溶液突变成蓝色,则滴定终点到达。
2.I2标准溶液的标定(间接碘量法)碘标准溶液可选用As2O3直接标定,由于As2O3是有毒性物质,本实验选用Na2S2O3标定碘。
而Na2S2O3不是基准物质,不能直接配制标准溶液,需用K2Cr2O7来标定。
故I 2标准溶液的标定方法为:先用K2Cr2O7标定Na2S2O3的浓度,再用Na2S2O3标定I2标准溶液的浓度。
①用K2Cr2O7做基准物质,间接碘量法标定Na2S2O3溶液的浓度。
其过程为:K2Cr2O7与KI先反应析出I2,析出的I2再用标准的Na2S2O3溶液滴定,从而求得Na2S2O3的浓度。
这个标定Na2S2O3的方法为间接碘量法。
标定Na2S2O3溶液时有:6I-+Cr2O72-+14H+ = 2Cr3++3I2+7H2O;2S2O32-+I2= S4O62-+2I-根据以上反应方程式可知Na2S2O3标定时的计量系数比为:K 2C2O7:Na2S2O3= 1:6。
②用标准的Na2S2O3溶液标定I2标准溶液的浓度,用淀粉溶液作指示剂,若溶液突变成蓝色,则滴定终点到达。
碘量法的基本反应式:2S2O32-+I2= S4O62-+2I-根据以上原理可知各物质的定量关系比为:Vc :I2:Na2S2O3:K2C2O7= 1 :1 :2 :1/3【实验内容】测定不同饮料(统一鲜橙多,汇源橙汁)中维生素C的含量。
【实验用品】1.实验试剂(1)市售“统一鲜橙多”“汇源橙汁”饮料溶液的配制依据:根据“统一鲜橙多”饮料包装上标明的维生素C的含量:25mg/100ml,换算成摩尔浓度约为1.42×10-3mol/L(汇源橙汁含量与其近似)。
橙汁中维生素C含量的测定

橙汁中维生素C含量的测定第5组成员:甘汉麟,李子宜指导教师:汤又文一、实验概述:目前维生素C(Vc)的测定方法有荧光分析法、碘量法、2,4-二硝基苯肼法、高效液相色谱法、铁(Ⅱ)-邻菲罗啉-BPR体系分光光度法、电位滴定法。
荧光分析法与高效液相色谱法的仪器比较昂贵,通常采用碘量法和2,6-二氯酚靛酚法。
但是一般样品处理后的样液都有颜色,不同程度地影响测定结果的准确性,另外,对颜色的去除步骤也较为繁琐,不适合大批量样品的测定。
二、实验原理:维生素C分子中含有还原性的烯二醇基,能被I2定量氧化为二酮基。
反应式如下:C6H8O6+I2=C6H6O6+2HIE (C6H6O6/ C6H8O6)=0.18V E(I2/I-)=0.535V该反应在弱酸性环境下反应快速完全,同时弱酸环境降低了维生素C的还原性,有利于避免其他氧化性物质的干扰,弱酸环境也避免了I2的歧化反应。
由于反应速率较快,可以直接用I2标准溶液滴定。
通过消耗I2溶液的体积及其浓度可以计算试样中维生素C的含量。
由于维生素C具有较强的还原性,在空气极易被氧化而变成黄色,尤其在碱性介质中更甚,测定时加入HAc使溶液呈弱酸性,减少维生素C 副反应。
由于I2的挥发性及对天平的腐蚀性,不宜在分析天平上称重,故应先配制一个近似浓度的溶液,然后再进行标定。
配制I2溶液时加入过量KI(I2与KI形成I3-使溶解度增加,挥发性大大降低)。
溶液保存在棕色瓶中放在暗处,避免见光而使浓度发生改变,还应避免与橡皮等有机物接触。
I2可以用已标定好的Na2S2O3标准溶液来标定I2溶液浓度。
淀粉指示剂要在接近终点时加入。
淀粉吸附大量I3-后,过早的形成蓝色化合物,由于较多的I2被淀粉的胶粒包住,影响其与Na2S2O3的反应,使终点拖长,且吸附后颜色变为深灰色,终点不好观察。
所以用Na2S2O3溶液滴定I2时应该在大部分的I2已被还原,溶液呈现淡黄色时才加入淀粉溶液。
+I2反应式如下:2Na2S2O3 + I2 = Na2S4O6 + 2NaINa2S2O3中一般含有S、NaCl等杂质,Na2S2O3不稳定,易分解,不能直接配制为标准溶液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
橙汁饮料中Vc含量的测定
2010级环境科学1班
古娟(201008011138)黄俊杰(201008041141)实验原理:
1.维生素C又称抗坏血酸,分子式为C
6H
8
O
6
,Vc呈酸性,具有较强的还原
性,加热或在溶液中易氧化分解,在碱性条件下更易被氧化。
在弱酸性条件下,能与碘单质发生氧化还原反应,反应式为:
C 6H
8
O
6
+I
2
=C
6
H
6
O
6
+2HI
可利用此性质滴定,以淀粉(遇碘变蓝)为指示剂。
2.Na
2S
2
O
3
见光易分解可用棕色瓶储于暗处,经8-14天后用K
2
Cr
2
O
7
做基准物
间接碘量法标定Na
2S
2
O
3
溶液的浓度,即称取一定量的K
2
Cr
2
O
7
,在弱酸性溶液中
与过量的KI作用析出一定量的I
2用K
2
Cr
2
O
7
滴定。
Cr2O72-+6I-+14H+==2Cr3++3I2+7H2O 此时应考虑K2Cr2O7基准物的反应条件:
1)合适的酸度。
溶液酸度高反应快,酸度太大,I-易被空气,且Na
2S
2
O
3
易
分解,故酸度一般在0.2〜0.4 mol•L-1为宜。
2)K
2Cr
2
O
7
与KI的反应速率慢,所以应在带塞的锥形瓶中暗处放置一段时
间,使两者反应完全。
3)所用 KI溶液不得含有I
2或K
2
Cr
2
O
7。
4) 滴定前需将溶液稀释。
若滴定到终点后,溶液迅速变蓝表示Cr
2O
7
2-离子反应不完全,可能是放置的
时间不够或溶液稀释过早。
3. I
2可以用已标定好的Na
2
S
2
O
3
进行标定,考虑到I
2
在强酸性中也易被氧
化,故一般选在PH为3-4的弱酸性溶液中进行滴定。
Na
2S
2
O
3
在弱酸性及KI存在条件下定量滴定I
2
:
I2+2S2O32-==2I-+S4O62-
实验试剂:
硫代硫酸钠(s) KI(s) HCl溶液(6 mol•L-1) HAc溶液
(2 mol•L-1) K
2Cr
2
O
7
标准溶液淀粉指示剂(5g/L) I
2
标准溶液
(0.005mol•L-1)橙子饮料样品(Vc含量约为25mg/100ml)。
实验步骤:
一、溶液的配制
1、硫代硫酸钠(0.01 mol•L-1):
称取1.3g Na
2S
2
O
3
•5H
2
O溶于500ml新煮沸的蒸馏水中,加入0.1g,保存于
棕色试剂瓶中,放置一周后进行标定
2、K
2Cr
2
O
7
标准溶液:
称取重铬酸钾固体0.5-0.6g,加水溶解后移入250 ml容量瓶中,用水稀释至刻度线处,摇匀。
3、KI(20%水溶液)
称2.5g KI固体溶于50 ml蒸馏水中。
4、I 2溶液(0.005mol •L -1)配制
称取I 2固体0.6-0.7g ,溶于浓KI 溶液中,溶解后移入500ml 棕色试剂瓶中,加水摇匀。
5、醋酸(0.2 mol •L -1)
量取17.4 mol •L -1的 34.4 ml 的冰醋酸稀释到300 ml 二、Na 2S 2O 3溶液的标定
准确移取25.00 ml 标准K 2Cr 2O 7 溶液于250 ml 碘量瓶中,加3 ml 6mol •L -1
的HCl ,5 mlKI ,盖上瓶塞,液封,摇匀后置于暗处5min ,使反应完全,加50 ml 蒸馏水稀释,以Na 2S 2O 3 滴定至黄绿色,加入2 ml 淀粉溶液,继续滴定至溶液呈亮绿色为终点,记录Na 2S 2O 3 的体积。
再重复标定两次,计算Na 2S 2O 3 的浓度。
25025
)O S V(Na )O Cr M(K 10006)O Cr m(K )O S c(Na 322722722322⨯
⨯⨯⨯=
三、I 2溶液的标定
准确移取25.00 ml 待标定的I 2 溶液于250 ml 的锥形瓶中,加50 ml 蒸馏
水,用Na 2S 2O 3 标准溶液滴定至溶液呈浅黄色,加3 ml 淀粉溶液,继续用
Na 2S 2O 3 溶液滴定至蓝色恰好消失,记录Na 2S 2O 3 的体积。
平行测定3份,计算I 2 的浓度。
四、Vc 含量的测定
用移液管移取100ml 橙汁样品于250ml 锥形瓶中,迅速向其中加入10ml 2mol/L 的HAc 溶液和2ml 淀粉溶液,用标准I 2溶液进行滴定,至溶液刚刚出现蓝色,30秒内不褪色,即为终点。
平行测定3份。
计算Vc 含量。
V )()(Vc 样品)
()(I )(I 22V c Vc M ⨯⨯=
ρ
五、实验数据表格 1、Na 2S 2O 3溶液的标定
1 2 3 V(Na 2S 2O 3)初/ml V(Na 2S 2O 3)终/ml V(Na 2S 2O 3)/ml
2。
