复习课:微粒构成物质(公开课)
初三化学《微粒构成物质复习课》教学设计

初三化学“微粒构成物质复习课”教学设计教学依据课标分析:1.课标要求:“微粒构成物质”是初中阶段形成微粒观的重要阶段。
微粒观的建立是化学学科中的一条重要思想,是课程标准中的“物质构成的奥秘”这一核心主题中的重要内容。
微粒观主要内容在教材中编排在第三单元,其余少部分穿插在其他单元。
初中阶段学生构建微粒观可以分为三个阶段:第一阶段,以分子、原子等基本粒子的概念的建立为标志,让学生认识物质是由这些肉眼看不到的微粒构成的;微粒在不断运动的;微粒间有一定的间隔;微粒间存在相互作用,这种相互作用使微粒聚集构成物质;物质的宏观状态、特性是由构成物质的微粒的种类、排列方式以及运动决定的;物质的变化是微粒之间相互作用的结果。
第二阶段,以化合价、质量守恒定律概念建立为标志,学习者要从宏观和微观相结合的视角定量的解释物质的化学变化。
第三阶段,学习者能自觉地应用为例观解释一些现象。
而本节课正是进入第一阶段后的一节复习课,在这一阶段学生要完成对微粒构成物质的比较全面的认识,不仅仅是知道两个名词,记忆两段概念那么简单。
在这一阶段学生要从习惯了的宏观视角走进微观视角,从全新的角度去观察物质、变化,还要从静态到动态、从定性到定量多角度的多层面的去体会、感知、描述,逐渐习惯运用微观与宏观相结合的思考方式和表达方式,学会运用“微粒模型图”这种表达微观特征的技术手段。
这些都将对他们后面两个阶段乃至于高中阶段的学习有着重要的影响。
2.本节课如何落实课标:在这节复习课上采用的大量时间让学生识图、画图,将自己对微观世界的认识描绘出来,就是希望学生能主动地把对“微粒构成物质”的主动认识调动出来,并能运用有效的方式表达出来,能将物质宏观层面的表面与微观粒子的特征形成对应,在这样的表达中活动深化对微观世界的认识。
学情分析1.学生已有的认识初三是化学的初始阶段,学生已经学习了对物质进行简单的分类,但这些分类还都是停留在宏观层面的。
学生见过并记忆了一些物质的化学式,但是为什么这样书写化学式,化学式与物质构成之间的关系学生并不清楚。
初三化学《构成物质的微粒》单元复习课课件ppt

三、离子
5、离子符号的意义:
表示一种离子 离子符号
表示一个离子
6、离子符号里的数字的意义:
2Mg2+
表示每个镁离子带2个 单位的正电荷
表示2个镁离子
三、离子
(1)离子的形成
原子: Na +11 2 8 1 失一个电子
离子: Na+ +11 2 8
Cl +17 2 8 7 得一个电子
第三单元 构成物质的微粒
单元复习课
知识网络
定义
组成
纯净物
物 构成
质
混合物
元素
存在 符号
意义
写法 常见元素的化合价
周期表简介
分子
构分
成裂
原子 结构
质子
原子核 中子
得得
失 电
失 电
核外电子 原子结构示意图
子 子 质量表示方法
相对原子质量
离子 阳离子
阴离子
一、物质的构成
构成
物质 组 成 元素
构
构
总
宏观概念
四、元素
1、定义:质子数(即核电荷数)相同的一类原子的 总称 注意事项: ①“一类原子”指的化学变化中不能再分的粒子
②原子的质子数(即核电荷数)决定元素种类
元素——是一类原子的总称,只能讲 ③ 种类,不能讲个数。
原子——是一种粒子,有种类、个数
四、元素
2、地壳中含量较多的几种元素 含量前五位:氧、硅、铝、铁、钙
四、元素
3、元素符号书写的要求: ①由一个字母表示的元素符号要大写; ②由两个字母表示的元素符号,第一个字母大写 ,第 二个字母小写
构成物质的微粒复习课(公开课)

元素是什么?
元素是由具有相同原子数的原子组成的纯物质。元素可以通过化学符号进行表示,如氧气(O2)和氢(H)。
元素周期表的意义
元素周期表按照原子的原子核结构和化学性质进行分类和排列。它提供了有关元素的重要信息,如原子序数、 原子量和化学性质。
原子的基本结构
原子由原子核和围绕核心运动的心的轨道上运动。
原子的质子和中子
质子带有正电荷,中子是电荷中性的。质子和中子都存在于原子核中,共同 组成了原子的质量。
原子的电子
电子带有负电荷,在原子的轨道上运动。电子确定了原子的化学性质和反应方式。
构成物质的微粒复习课 (公开课)
通过这个公开课,我们将回顾构成物质的微粒的基本知识,包括物质的组成 原理、元素和化学键等重要概念。
什么是物质?
物质是构成宇宙和我们周围一切物体的基本单位。无论是固体、液体还是气体,都是由微观的微粒构成的。
物质的构成原理
物质由不同的原子和分子组成。原子是物质的基本单位,而分子是由两个以 上原子组成的结构。
《构成物质的微粒》复习教学案(倪瑛泉)
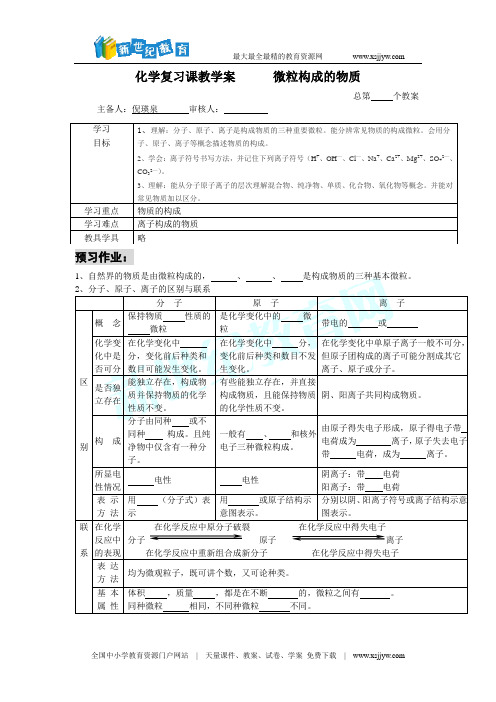
化学复习课教学案微粒构成的物质总第个教案主备人:倪瑛泉审核人:预习作业:1、自然界的物质是由微粒构成的,、、是构成物质的三种基本微粒。
3、物质的组成(构成) 单 质分 子 CO 2元 素 物 质 原 子 Hg化合物 离 子 NaCl4、原子的结构 ①每个质子相对原子质量约等于1,约等于一个 原子的质量。
质子 ②每个质子带一个单位的 电荷。
③决定 种类。
原子核 ①每个中子相对原子质量约等于1,约等于一个氢原子的质量。
原 中子 ② 电荷。
③决定同类元素中的不同种原子。
子 ①质量约等于 (或 )质量的1/1836。
②每个电子带一个单位的 电荷。
③核外电子分层排布, 最外层电子数决定 的性质。
原子中:核电荷数 = 数 = 数相对原子质量≈质子数 + 中子数。
(为什么?)阳离子:核电荷数=质子数>核外电子数阴离子:核电荷数=质子数<核外电子数5、 物质组成、构成的描述(1)、物质由元素 成:如:水是由氢元素和氧元素组成的。
(2)、物质由粒子(分子、原子、离子) 成。
例如:水是由水 构成的。
金是由金 构成的。
氯化钠是由 和 构成的。
(3)、分子是由原子 的:如:水分子是由氢原子和氧原子构成的;每个水分子是由二个氢 和一个氧 构成的。
例题精讲有A 、B 、C 三种粒子:已知A 带1个单位负电荷,其核外电子排布与氩原子相同;B 粒子的第一、第三两电子层的电子数相等;每个C 粒子中有3个原子核,其质子数总和为10。
(1) 写出A 、B 、C 的符号:A ,B ,C 。
(2) B 粒子的原子结构示意图是 ,A 粒子的核电荷数是 。
(3) 写出B 与稀硫酸反应的化学方程式: ;金属钠与C 反应的化学方程式: 。
练习巩固宏观组成 微观构成1、1994年12月科学家发现了一种新元素,它的原子核内有111个质子,161个中子,则该元素原子的核外电子数是( )A 、111B 、272C 、50D 、1612、一种原子的核内有6个质和6个中子,另一种原子的核内有6个质子和7个中子,则它们不同的是( )A 、核电荷数B 、核外电子数C 、原子的质量D 、元素的种类3、某元素R 原子的核电荷数为1~18之间,已知R 2- 的核外有x 个电子,则R 原子的核内质子数及与钠化合时的化学式分别是 ( )A . x 、Na 2RB . 2x 、NaRC . ( x -2)、Na 2RD . ( x +2)、Na 2R4、一种物质不能用化学方法再分成两种或多种更简单的物质,这种物质是( )A 、化合物B 、混合物C 、空气D 、单质5、画出下列微粒的结构示意图Mg 2+ Na S 2-Ar Al 3+ Cl -6、读下表完成填空①可形成XY 2型化合物的元素是 。
中考化学复习 主题一 物质的组成与结构第2讲 构成物质的微粒课件

A.水由分子构成,氯化钠也是由分子构成 B.分子、原子和中子都是不带电的微粒 C.铁块受热膨胀,是由于铁分子之间的间隔增大 D.原子的质量很小,主要集中在原子核上 (2)用化学符号表示下列意义:
N2
2H
2Fe3+
(3)根据以下几种粒子的结构示意图,回答下列问题(填字母):
ABCDEF
属于同种元素的粒子是 CE ;在化学反应中易失去电子的粒子是 D ;具有
(1)按“实验一”进行时,有明显现象的烧杯是 甲 (填“甲”“乙”或
“丙”),该现象说明 ②⑤ (填序号)。
①分子间有间隙
②分子在不断运动
③分子是由原子构成的 ④温度越高分子运动越快
⑤分子很小肉眼看不见 ⑥分子构成不同,化学性质不同
(2)将装置改进成“实验二”后,其优点有 A (填序号)。
稳定结构的是 ABE ;属于稀有气体元素的是 A ;化学性质相似的原子
是 CF 。
典例2:如图,U形管两侧盛有酚酞溶液。通过本实验不.能.得出的结论是( C )
A.同种分子化学性质相同 B.右侧比左侧先变红 C.分子间有间隔 D.分子在不断运动
考点1 构成物质的微粒及其特征 1.(2022·辽宁)一定质量的由分子构成的气体液化后,发生改变的是(
B)
考点2 原子的结构及其表示方法 3.(2021·贵港)“宏观辨识与微观探析”是化学的核心素养之一。
(1)核废水中含有大量具有放射性的氘,排放到海洋中会造成严重的污染。氘是氢
元素的一种原子,含有1个中子。如图1是氢元素在元素周期表中的部分信息和原子
结构示意图,氘的质子数是
,1氢元素位于元素周期表中的第
A.分子的数目 B.分子的间隔 C.分子的体积 D.分子的质量 2.(2022·临沂)从分子的角度分析,下列解释不.合.理.的是(
复习课:微粒构成物质

《微粒构成物质》复习课【教学目标】1、认识物质的微粒性,知道分子、原子、离子等都是构成物质的微粒;2、能用微粒的观点解释某些常见的现象;3、知道原子的构成,初步认识核外电子在化学反应中的作用;4、知道原子可以结合成分子,知道同一元素的原子和离子可以相互转化。
【教学重点】分子、原子、离子等都是构成物质的微粒【教学难点】知道同一元素的原子和离子可以相互转化【教学过程】环节一情境引入——钠与氯气的反应1、尝试写钠与氯气反应的方程式:______ ___。
环节二由钠(Na)引发的思考2、再写出几种由原子直接构成的金属:______ _ _ __。
3、在原子的构成中存在的等式是: ______ ___、______ ___。
钠原子的结构示意图:,钠离子的结构示意图:,钠原子的相对原子质量为23,则中子数为______。
4、原子最外层电子数与______ ___关心最密切。
环节三由氯气引发的思考5、再写出几种由分子构成的物质:______ _ _ __。
6、氯原子的结构示意图:,氯离子的结构示意图:。
环节四氯化钠的形成7、氯化钠由什么微粒构成:______ _ _ ;再写出几种由离子构成的物质______ _ ____ ___ _ _ 。
环节五微粒间的相互转化8、镁原子______,镁离子______;铝原子______,铝离子______。
环节六微观与宏观练习:18、27(课后完成)9、用分子、原子、离子、质子、中子、电子、原子核、物质等,编织成一个有意义、有结构的知识网络。
10、总结归纳:由分子构成的物质一般是:______ ___;由原子构成的物质一般是:______ ___;由离子构成的物质一般是:______ ___;。
教学设计 第三单元 微粒构成物质(复习课)

第三单元微粒构成物质(复习课)【学习目标】1.认识物质的微粒性,知道分子、原子、离子等都是构成物质的微粒。
2.能用微粒(分子)的观点解释某些常见的现象。
3.知道原子的构成,会分析原子结构示意图。
4.知道元素的简单分类,了解元素周期表。
【学习过程】活动一知识归纳请大家将:物质、元素、分子、原子、离子、质子、中子、电子、原子核、核外电子等概念建立相应的知识网络。
活动二基础知识1.从宏观角度分析,物质都是由元素组成的.例如氧气是由元素组成的,氧化铜是由元素组成的,水、二氧化碳、氧气中都含有元素.从微观角度分析,①物质都是由构成的,构成物质的粒子有、和。
如水是由构成的,汞是由构成的;氯化钠是由构成的。
②分子都是由构成的,如二氧化碳分子由构成的。
2.分子(微粒)的基本特征:(1);(2),且温度越高,;(3),气体分子间的间隔,容易被。
(4)分子是由构成的;同种分子相同;由分子构成的物质,3.构成原子的微粒有、、。
普通氢原子没有。
在原子中,核电荷数= = ,所以整个原子不显电性。
4.原子的质量主要集中在上;又由于构成原子的质子和中子的相对质量都约等于,所以相对原子质量= + 。
5.钠原子核内有11个质子,它的核电荷数是,钠原子核外有个电子;钠原子的相对原子质量为23,则钠原子核内有个中子。
核外电子在原子核外是排布的,可用原子结构示意图表示。
钠原子结构示意图为,它的最外层电子数为个,在化学反应中容易电子,带电,形成离子。
因此,元素的化学性质与的排布,特别是有密切关系。
6.当物质发生物理变化时,分子本身没有变,只改变了;当物质发生化学变化时,分子分解成,原子重新构成。
原子是化学变化中的。
在化学变化中,分子是的,原子是的。
分子是保持物质的最小粒子,由原子直接构成的物质,是保持物质化学性质的最小粒子。
7.元素是的总称;元素种类是由决定;元素的化学性质是由决定;地壳中含量前四名的元素是,地壳中含量最多的金属元素和非金属元素所形成的化合物为。
微粒构成物质专题复习的课件.

H氢
1-18号元素原子结构示意图
He 氦
Li 锂
Be 铍
B硼
C 碳
N 氮
O 氧
F 氟
Ne 氖
Na 钠
Mg 镁
Al 铝
Si 硅
P磷
S硫
Cl 氯
Ar 氩
4、分子、原子、离子的比较
分
概 念
子
化学性质
原
子
离
子
区
是保持物质—————— 的最小微粒
原子 是—————中 带电的________或 原子团 的最小粒子 _____
由原子得失电子形成, 质子 一般由_____、 负 电荷成 原子得电子带___ 中子 和核外 _____ 为阴 ___离子,原子失去电 电子三种微粒 正 电荷,成为阳 子带____ ___ 构成 离子
所显 不显 电性 别 电性 ______ 情况 表 化学式 示 用________ 方 表示 法
阴离子:带 负 电荷 _______电性 阳离子:带 正 电荷
九年级化学复习课
构成物质的微粒
分子、原子、离子
学习目标:
1.知道构成物质的三种微粒:分子、原子 、离子 2.知道分子,原子的定义,及二者的区别与联系 3.能用微观知识解决一些简单的化学问题
重点:
1.分子,原子的定义,及二者的区别与联系 1、用微粒的知识解释物理变化和化学变化
2.微观粒子的应用 2、用微粒的知识解释纯净物和混合 3、化学用语的书写 4、粒子结构示意图的应用
结论:
分子改变
物质发生物理变化,分子本身没有发生变化; 物质发生化学变化,分子本身发生了变化。
从电解水过程的模型你能说出多少相关的信息?
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
,新的分子(或原子)构成新的物质。
由原子构成的 加热
由分子构 成的
氧化汞分子 ( HgO )
分裂成汞原子 和氧原子
汞原子 (Hg)
氧分子 (O2)
知识点归纳一
分子、原子
1.分子与原子的比较
分 子 原 子 分子是保持物质 化学变化 原子是 ___________ 概 化学 性质的一种 _________ 念 中的最小粒子 粒子 小 ,彼此之间有 质量、体积都很________ 间隔 ,总在不停地__________ 运动 ,都能直 __________ 相同点 接构成物质,同种分子(或原子)化学性质相 同,不同种分子(或原子)化学性质不同 在化学变化中,分子_______ 再分, 可以 区别 不可 再分。 原子________ 分裂 联 分子 原子 结合 系
B
《构成物质的微粒》复习课
由Na引发的思考
1、金属钠由什么微粒构成?
Ne、Ar等
金属
稀有气体
金刚石
《构成物质的微粒》复习课
由Na引发的思考
2、钠原子的讨论
(1)钠原子的构成
原子核 原子
质子 中子
核外电子 (2)钠原子/钠离子的结构示意图
化学反应实质:
分子 分裂为________ 原子 , 原子 在化学变化中_________ ______重新组合成新的_______ 分子 (或_____ 原子 重新组合)
3.分布 O、Si、Al、Fe、Ca 。 (1)地壳中含量居前5位的元素为___________________
(2)人体中含量居前4位的元素是_________________ 。 O、C、H、N
(3)海水中除了水由________ H、O 两种元素组成外,含量较高 的元素是Na _______和 ________,即海水中含量最高的盐是 _____ Cl NaCl 。 4.元素与原子的比较 (1)区别:元素是宏观概念,描述物质的宏观组成,如: 氢元素 氧元素 水是由_________和_________组成的。原子是微观概念,描 金原子 氢原子 氧原子 述由原子直接构成的物质微观构成,如:金是由 _________ 构 (2)联系:元素是具有相同核电荷数的一类原子 成的;也描述分子的构成,如:水分子是由 _______和______ 构成的。
3、我国南海海底蕴藏着丰富的锰结核——含 有锰、铁、铜等金属的矿物。已知锰原子 的核内质子数为25,相对原子质量为55, 则锰原子的核外电子数为 ( A ) A.25 B.30 C.55 D.80 4、生活中常接触到“加碘食盐”、“高钙牛 奶”,其中的“碘”和“”应理解为( )
C
A.单质
B.分子
C.元素
知识归纳五:元素周期表 1、元素周期表共有 7 个横行,18 个纵行。 每一个横行叫做一个 周期,每一个纵行叫做一 个 族 (8,9,10三个纵行共同组成一个族)。
2、元素中期表中的信息 3、元素周期表的规律
(1)原子序数= 质子数 (2)同周期的原子 电子层 (3)同主族的原子
元素符号 元素名称 相对原子质量
1.下列粒子属于同种元素的是: A和D 2.化学性质相似的是:B C 与A EABC NhomakorabeaD
E
知识点2:原子结构示意图
原子核 第 2层 第 1层 第3层(最外层) 电子层
+ 15
原子核带正电
第 1电 子层 最多 排 2个 电子
2
第二 电子 层最 多排 8个 电子
8
5
该层上 的电子 数
核电荷数
最外 电子 层最 多排 8个 电子
的总称。原子和元素是个体与总体的关系。
你会描述吗?
1.二氧化碳是由 碳元素 和 氧元素 组成的, 共有 两 种元素; 2.二氧化碳分子是由 碳原子 和 氧原子 构成 的,共有 两 种原子;一个二氧化碳分子 中有 三 个原子。 3.过氧化氢(H2O2)是由 氢元素 和 氧元素 组 成的,1个过氧化氢分子中含有2个氢 原子 和 2个氧 原子 。
构成
NaCl等由金属元素和非金属元素 组成的化合物
2.表示分子、原子的微观示意图
用分子、原子解释纯净物和混合物(主要 是通过图的形式出现)如:纯净物只有一 种粒子,混合物有多种粒子,如图:
(“○”表示氧原子,“●”表示氢原子)
A
B
C
D
E
F
从微观的角度看,表示混合物有
BF
。
知识网络
构成物质的粒子: 分子、原子、离子
失电子 阴离子 得电子
原子
失电子 得电子
阳离子
知识归纳四
元
素
1.概念:具有相同___________ 核电荷数 (即_________) 质子数 的一类 原子的总称。元素是组成物质的基本成分,是宏观概念,只 讲种类不讲个数。 2.分类 金属元素:最外层电子数
<
4,如Na,Mg,Al
非金属元素:最外层电子数 ≥ 4,如S,O,C(H除外) 稀有气体元素:最外层电子数是 8 或 2 ,如He,Ne
Cl
知识归纳三:离子 强调离子符号的书写:在元素符号右上角标出电 1 、定义:离子是带电的 原子 或 原子团1时 。 荷数及电性,数字前正负号后,电荷数为 2省略不写。 、原子和离子的比较
原子
阳离子 电性
离子 阴离子
不带电
带正电
带负电
表示方 元素符号 (元素符号)n+ (元素符号)n+、Mg2+ -、S2如: Na 如: Cl 法 如:Na、O等 结构 质子数 =电子数 质子数 > 电子数 质子数 < 电子数 都能直接构成物质 相同点 联系
原子结构与元素性质的关系
金属 元素
非金属 元素 ≥4
<4
等于8 易失 电子
氦为2 易得 电子
稳定结构
※根据最外层电子数判断微粒的稳定性
《构成物质的微粒》复习课 NaCl的形成 1、NaCl由什么微粒构成?
知识归纳三:离子 1、定义:离子是带电的 原子 2、原子和离子的比较
或 原子团
。
Na
+ Na
《构成物质的微粒》复习课
由一粒“盐”引起的思考
《构成物质的微粒》复习课
Cl2与Na的反应
《构成物质的微粒》复习课
点燃
氯气+钠
氯化钠
+
Cl2 Na
NaCl
《构成物质的微粒》复习课 由Cl2引发的思考 1、氯气由什么微粒构成? 2、氯气分子由什么微粒构成?
3、氯原子、氯离子的结构示意 图?
《构成物质的微粒》复习课 由Cl2引发的思考 4、左图A、B说明什么问题? 5、打开盛氯气的集气瓶,有刺 激性气味说明什么? A
(-) 2、每个原子都含有质子和电子,不一定有中子
核外电子 最外层电子数决定元素化学性质 注意:1、质子数不一定等于中子数
该原子的质量 碳12原子的质量 ×1/12
= 相对原子质量≈质子数+中子数
注意:外层电子数相同,其化学性质不一定都 相同(如Mg、He最外层电子数都为2;He为稳定结构,
而Mg则易失电子不稳定)
D.原子
5、 下图是钠元素、氯元素在元素周期表中的信息及 有关粒子的结构示意图。请回答下列问题:
11 Na 钠 23.0
17 Cl 氯 35.5
A
B
C
D
E
F
11 ,氯离子的 (1)钠元素的原子序数为 F (填字母)。 结构示意图是 (2)钠元素与氯元素的本质区别是 质子数不同。
(3)D所表示的粒子的符号是 Na+
7 、
(1)元素化学性质与最外层电子数有 ,氯原子的最
密切关系。氯原子的原子结构示为
外层电子数为7 ______。下列图中微粒共表示 三 _____种元素,
D 其中与氯原子具有相似化学性质的是 _____(填序号)。
(2)某阳离子的结构示意图为
,则x的数值可能是
CD 。 下列中的________
A.9 B.10 C.11 D.12
。
6、随着日本福岛核电站放射性碘泄漏,碘这种元素被 人们所认知。下图是元素周期表中提供的碘元素的部 分信息及碘原子的结构示意图。下列说法错误的是 ( )
A
A.碘的相对原子质量为126.9g,原子核内质子数为53 B.碘原子核外共有53个电子,最外层有7个电子 C.碘元素属于非金属元素,碘原子在化学反应中容易 得到电子 D.碘盐中含有碘酸钾(KIO3),KIO3中含有3种元素。
= 核电荷数 = 核外电子数 。 相同。电子层数=周期数
最外层电子数 相同。
元素→ 非金属 元素
(4)每一周期的元素种类变化规律: 金属 → 稀有气体 元素
1.物质的构成
宏观物质是由微观粒子(分子、原子或离子)构成,微观粒子 可以描述种类,也可以描述个数。化学反应前后原子种类、数 目和质量不变,分子种类改变。
构 成 物 质 的 微 粒
构成 一些氧化物: H O CO 【活学活用】 2 2 分子 请你辨别这些物质分别由什么微粒构成? 有机物: 酒精 蔗糖 甲烷 分 构 气态非金属: O2 H2 N2 解 成 直接 原子 构成 金属:Cu、Ba、Zn
得 失 电 子
Na H2O2 P 固态非金属: C 、 P 、 S He 稀有气体: Na SO 2 4 He 、Ne、Ar 离子 C2H5OH
知识归纳二:原子的结构
决定元素种类:质子数(或核电荷数) 决定元素化学性质:最外层电子数 决定原子质量:质子数和中子数(原子核) 决定 知识点1 元素种类 质子 决定 原子核 (+) 原子质量 原 (+) 中子
重点: 三决定
子
(不带电)
(氢原子核中无中子) 核电荷数=质子数 =核外电子数=原子序数(原子)
