总铁结合力(TIBC)测定试剂盒(Ferene法)产品技术要求ldm
总铁结合力测定试剂盒(Ferene法)产品技术要求九州泰康

总铁结合力测定试剂盒(Ferene法) 适用范围:用于体外定量测定人血清中的总铁结合力。
1.1包装规格试剂Ⅰ(R1):60mL×3、试剂Ⅱ(R2):20mL×3、试剂Ⅲ(R1):60mL×3、试剂Ⅳ(R2):20mL×3;试剂Ⅰ(R1):60mL×2、试剂Ⅱ(R2):20mL×2、试剂Ⅲ(R1):60mL×2、试剂Ⅳ(R2):20mL×2;试剂Ⅰ(R1):60mL×1、试剂Ⅱ(R2):20mL×1、试剂Ⅲ(R1):60mL×1、试剂Ⅳ(R2):20mL×1;试剂Ⅰ(R1):45mL×1、试剂Ⅱ(R2):15mL×1、试剂Ⅲ(R1):45mL×1、试剂Ⅳ(R2):15mL×1;试剂Ⅰ(R1):90mL×1、试剂Ⅱ(R2):15mL×2、试剂Ⅲ(R1):90mL×1、试剂Ⅳ(R2):15mL×2。
1.2主要组成成分2.1 外观试剂盒外观应整洁,文字符号标识清晰;试剂均为澄清溶液,无未溶解物。
2.2 装量试剂瓶内试剂的净含量不少于标示值。
2.3 试剂空白吸光度在波长A600nm,记录吸光度值,试剂空白吸光度(R1+R2)不超过0.80A,试剂空白吸光度(R3+R4)不超过0.80A。
2.4 分析灵敏度Fe:测试浓度100µmol/L的样本,吸光度变化值不低于0.002A。
UIBC:测试浓度50µmol/L的样本,吸光度变化值不低于0.002A。
2.5 线性2.5.1铁离子:在[1,120]µmol/L范围内,线性回归的确定系数应不低于0.990;在[1,30)µmol/L范围内,线性绝对偏差不超过±3.0µmol/L;在[30,120]µmol/L范围内,线性相对偏差不超过±10%;2.5.2不饱和铁:在[1,80]µmol/L范围内,线性回归的确定系数应不低于0.990;在[1,30)µmol/L范围内,线性绝对偏差不超过±3.0µmol/L;在[30,80]µmol/L范围内,线性相对偏差不超过±10%。
不饱和铁结合力测定试剂盒(Ferene法)产品技术要求海丰

不饱和铁结合力测定试剂盒(Ferene法)适用范围:适用于体外定量测定人血清中不饱和铁结合力。
1.1 产品规格1.2 主要组成成分注:校准品具有批间、赋值特异性,具体值详见靶值单。
2.1 外观2.1.1 试剂盒标签标识清晰,外包装完整无破损;2.1.2 试剂1:无色到浅绿色液体,目测不得有任何沉淀及絮状悬浮物;2.1.3 试剂2:澄清黄绿色液体,目测不得有任何沉淀及絮状悬浮物;2.1.4 校准品:冻干粉,复溶后为无色或浅黄色,目测不得有任何沉淀及絮状悬浮物。
2.2 净含量净含量不低于标示值。
2.3 空白吸光度在主波长600nm、副波长700nm、37℃条件下,试剂空白吸光度A≤0.5。
2.4 线性范围(5,80)μmol/L范围内,r≥0.990;(5,30]μmol/L范围内,绝对偏差不超过±3μmol/L;(30,80)μmol/L范围内,相对偏差不超过±10.0%。
2.5 分析灵敏度在产品说明书规定参数设定条件下,测定50μmol/L样本,吸光变化△A ≥0.040。
2.6 精密度2.6.1 批内重复性CV≤10.0%。
2.6.2 批间差相对偏差R≤10.0%。
2.7 准确度与已上市产品比对:(5,80)μmol/L范围内,r≥0.990;(5,30]μmol/L 范围内,绝对偏差不超过±3μmol/L;(30,80)μmol/L范围内,相对偏差不超过±10.0%。
2.8 校准品2.8.1 均一性:CV≤5.0%;2.8.2 瓶间差:CV≤5.0%。
2.8.3 开瓶稳定性:开瓶后3天,相对偏差不超过±10.0%。
2.9 稳定性未开封试剂2℃~8℃储存,可稳定12个月。
取到效期后2个月内产品进行检测,检测结果应满足2.3、2.4、2.5、2.6.1、2.7的要求。
2.10 溯源性依据GB/T 21415—2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,校准品溯源至工作校准品,工作校准品经与北京利德曼生化股份有限公司的不饱和铁结合力测定试剂盒比对测量赋值。
血清总铁结合力(Total Iron Binding Capacity,TIBC)试剂盒说明书

货号:MS2811 规格:100管/96样血清总铁结合力(Total Iron Binding Capacity,TIBC)试剂盒说明书微量法注意:正式测定之前选择 2-3个预期差异大的样本做预测定。
测定意义:血清总铁结合能力指血清转铁蛋白可结合铁的能力,其含量高低与缺铁性贫血、急性肝炎等疾病的发生密切相关。
测定原理:Fe2+与菲洛嗪反应形成紫红色化合物,在562nm处有特征吸收峰。
碱性条件下,血清转铁蛋白可以与Fe3+结合,剩余未结合的Fe3+可以被还原成Fe2+,此时吸光度A1与未结合Fe3+数量正相关;酸化后,转铁蛋白结合的Fe3+释放,并且进一步被还原 Fe2+,此时吸光度A2与总Fe3+数量正相关。
A2减A1与TIBC浓度呈正比。
自备实验用品及仪器:天平、可见分光光度计/酶标仪、微量石英比色皿/96孔板、蒸馏水。
试剂组成和配制:试剂一:液体 30mL×1 瓶,4℃保存。
试剂二:液体 5mL×1 瓶,4℃避光保存。
试剂三:液体 5mL×1 瓶,4℃避光保存。
(临用前根据用量将A液和B液按1:1混合)试剂四:液体 7mL×1 瓶,4℃保存。
测定操作表:1、分光光度计/酶标仪预热30min,调节波长至562nm。
血清总铁结合力计算公式:总铁结合能力定义:37℃条件下,每升血清结合Fe3+的μmol数。
a. 用微量石英比色皿测定的计算公式如下标准曲线:y=0.5478x+0.0281,R2=0.9981总铁结合能力TIBC(μmol/L)=(ΔA-0.0281)÷0.5478×V反总÷V样=20.99×(ΔA-0.0281)b. 用 96 孔板测定的计算公式如下第1页,共2页标准曲线:y=0.2739x+0.0281,R2=0.9981总铁结合能力TIBC(μmol/L)=(ΔA-0.0281)÷0.2739×V反总÷V样=41.98×(ΔA-0.0281)V 反总:反应总体积,0.46mL;V 样:反应中样本体积,0.04mL注意事项:1. 吸光值大于0.8,样品适当稀释再测定,注意计算公式里乘以稀释倍数。
总铁结合力测定SOP_IBCT临床意义_检验科生化项目SOP

总铁结合力测定SOP_IBCT临床意义_检验科生化项目SOP总铁结合力(Total Iron Binding Capacity,TIBC)是一项常规的生化项目,用来评估机体铁代谢情况,对于诊断和监测铁代谢紊乱的疾病具有重要的临床意义。
以下是一份关于总铁结合力测定的检验科生化项目SOP。
1.目的:测定患者血液中总铁结合力的水平,评估机体铁代谢情况,辅助临床诊断和监测铁代谢紊乱的疾病。
2.原理:3.设备和试剂:-自动生化分析仪-TIBC测定试剂盒-完整的标本采集和处理设备4.标本采集和处理:-采集静脉全血样本,使用抗凝剂进行抗凝处理。
-分离血浆,避免血细胞污染。
-将血浆样本转移至干净的离心管中,离心10分钟以去除残留的血细胞和杂质。
-将清澈的上清液转移至新的离心管中,即可作为测定样本。
5.操作步骤:1)预热分析仪至设定的温度。
2)启动分析仪并选择TIBC测定程序。
3)将试剂盒中的试剂均匀摇匀。
4)在样本架上放置适量的样本和试剂。
5)启动测定程序,按照仪器操作提示进行操作。
6)测定完成后,记录结果并关闭分析仪。
6.结果解释:-总铁结合力的正常范围通常是250-400μg/dL。
-若总铁结合力偏低,可能表明机体铁储备不足或患有失血性贫血等疾病。
-若总铁结合力偏高,可能表明机体铁过载或患有贫血性疾病。
7.结果判读和临床意义:-总铁结合力低于正常范围可能与铁缺乏相关,可见于缺铁性贫血、慢性炎症性疾病等。
-总铁结合力高于正常范围可能与铁过载相关,可见于血色病、地中海贫血等。
-监测总铁结合力可用于评估治疗效果和指导铁剂的使用。
8.注意事项:-试剂和设备的存储和使用应遵守相关要求。
-标本采集和处理过程中要严格遵循无菌和避免污染的原则。
-操作过程中要注意个人安全和实验室生物安全。
-结果的解读需结合临床情况和其他检测结果。
以上是总铁结合力测定SOP_IBCT临床意义的检验科生化项目SOP,旨在指导实验室人员进行总铁结合力的测定,为临床提供准确的检查结果,辅助医生诊断和监测相关疾病。
不饱和铁结合力检测试剂盒 说明书

不饱和铁结合力检测试剂盒说明书如何正确使用不饱和铁结合力检测试剂盒随着慢性疲劳症状在现代社会中的增加,铁元素的吸收和利用已成为健康关注的焦点。
而不饱和铁结合力检测试剂盒则成为了诊断和治疗此类问题的重要工具之一。
本文将以全面、深度和广度兼具的角度来探讨如何正确使用不饱和铁结合力检测试剂盒,并对这一主题进行全面的评估和解析。
1. 什么是不饱和铁结合力检测试剂盒?不饱和铁结合力检测试剂盒是一种用于测量患者血液中铁元素的吸收和利用情况的医疗器械。
它通过测量铁与转铁蛋白的结合能力,帮助医生判断患者是否存在铁元素吸收不良的情况。
2. 如何正确使用不饱和铁结合力检测试剂盒?在使用不饱和铁结合力检测试剂盒时,首先需要准备患者的血液样本和相关试剂。
然后按照说明书上的步骤进行操作,将试剂和样本混合,并观察出现的颜色变化。
根据颜色变化的情况,可以判断患者的铁元素吸收和利用情况。
3. 如何解读不饱和铁结合力检测试剂盒的结果?根据不饱和铁结合力检测试剂盒的结果,可以判断出患者的铁元素吸收和利用情况。
如果结果显示不饱和铁结合力较高,说明患者可能存在铁元素吸收不良的情况,需要及时进行进一步的检查和治疗。
4. 个人观点和理解在日常临床工作中,正确使用不饱和铁结合力检测试剂盒对于判断患者的铁元素吸收和利用情况具有重要意义。
它能够帮助医生及时发现患者存在的健康问题,并指导后续的治疗方案。
我认为正确使用不饱和铁结合力检测试剂盒是十分必要的,也是对患者健康负责的表现。
总结回顾通过本文的全面评估和分析,我们对不饱和铁结合力检测试剂盒有了更深入的了解。
正确使用这一工具有助于及时发现患者存在的铁元素吸收问题,并采取相应的治疗措施。
我们在日常临床工作中应当重视对不饱和铁结合力检测试剂盒的正确使用,以更好地服务于患者的健康。
不饱和铁结合力检测试剂盒(TIBC)是用于评估人体血液中铁元素的吸收和利用情况的一种医疗工具。
它通过测量转铁蛋白与铁元素结合的能力来帮助医生判断患者是否存在铁元素吸收不良的情况。
总铁结合力(TIBC)检测试剂盒(亚铁嗪比色法)

自备材料: 1、离心管或试管 2、比色杯 3、分光光度计 操作步骤(仅供参考): 1、制备处理样品铁溶液和铁标准工作液:取适量铁标准(100μg/ml),按铁标准(100μg/ml):TIBC 铁标准稀释液=1:9 的比例配制铁标准(10μg/ml),作为处理样品铁溶液;同时按铁标准 (100μg/ml):TIBC 铁标准稀释液=1:49 的比例配制铁标准(2μg/ml),作为铁标准工作液。4℃避 光保存 3 个月有效。 2、制备样品:血浆、血清按照常规方法制备,可以直接用于本试剂盒的测定,-20℃冻存,用于 TIBC 的检测。选用经稀盐酸处理及去离子水清洁的干燥有塞子的试管或者一次性无菌聚乙烯有盖子的 离心管,加入血清或血浆 0.45ml、铁标准(10μg/ml)0.25ml、ddH2O 0.2ml,充分混匀,室温放置 10min。加入铁吸附剂 50mg,混匀,室温放置 10min,期间振荡 4 次,3000g 离心 10min,取上清 液,待用。 3、TIBC 检测:选用经稀盐酸处理及去离子水清洁的干燥的试管或者一次性无菌聚乙烯的离心管,按 下表操作。 加入物(ml) 空白管 标准管 测定管
ddH2O 铁标准(2μg/ml) 上清液
0.45 — —
— 0.45 —
— — 0.45
TIBC Assay buffer 1.2 1.2 1.2 混匀,于 562nm 处,以空白管调零,读取测定管吸光度 (即血清空白)。 0.05 0.05 0.05 4、混匀,室温静置 15min 或 37℃孵育 10min,分光光度计 562nm 处检测,以空白管调零,比色杯光 径 0.5cm,再次读取各管吸光度,1h 内比色完毕。 计算: 血浆、血清总铁结合力(TIBC)(μmol/L)={(A 测定−A 血清空白×0.97)/A 标准}×71.6 式中:A 测定=测定孔加入亚铁嗪显色液后测得的吸光度值 A 血清空白=测定孔未加入亚铁嗪显色液前测得的吸光度值 A 标准=标准孔的吸光度值 单位换算:铁标准(2μg/ml)=铁标准(35.8μmol/L) μg/dl=μmol/L/0.179 血浆、血清未饱和铁结合力(UIBC)(μmol/L)=TIBC 含量-血清铁含量 参考区间: 成年健康人血清总铁结合力: 男性:50~77μmol/L(280~430μg/dl) 女性:54~77μmol/L(300~430μg/dl) 注意事项: 1、溶血样本对检测有干扰,尽量避免采用溶血样本。 倍数。 3、实验过程中用到的水,不可用普通的蒸馏水,尽量采用高纯度的去离子水。 亚铁嗪显色液
不饱和铁结合力测定试剂盒(Ferene法)产品技术要求新产业
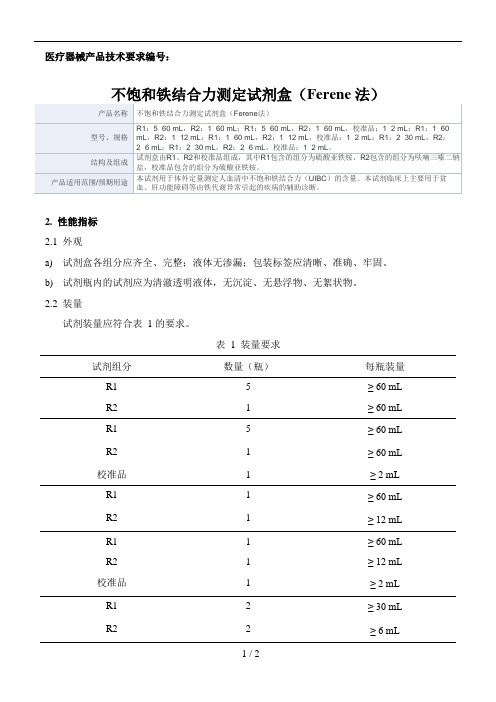
医疗器械产品技术要求编号:不饱和铁结合力测定试剂盒(Ferene 法)2.性能指标2.1外观a)试剂盒各组分应齐全、完整;液体无渗漏;包装标签应清晰、准确、牢固。
b)试剂瓶内的试剂应为清澈透明液体,无沉淀、无悬浮物、无絮状物。
2.2装量试剂装量应符合表 1 的要求。
表 1 装量要求试剂组分数量(瓶)每瓶装量R1 5 ≥ 60 mLR2 1 ≥ 60 mLR1 5 ≥ 60 mLR2 1 ≥ 60 mL校准品 1 ≥ 2 mLR1 1 ≥ 60 mLR2 1 ≥ 12 mLR1 1 ≥ 60 mLR2 1 ≥ 12 mL校准品 1 ≥ 2 mLR1 2 ≥ 30 mLR2 2 ≥ 6 mLR1 2 ≥ 30 mL R2 2 ≥ 6 mL 校准品 1 ≥ 2 mL2.3试剂空白吸光度在37℃、600 nm 主波长、700 nm 副波长、1 cm 光径条件下,用试剂盒测试纯化水,试剂空白吸光度≥0.20 Abs。
2.4分析灵敏度试剂盒测试50 μmol/L 的被测物时,吸光度变化的绝对值≥0.08 Abs。
2.5线性区间试剂盒线性在[3,100] μmol/L 区间内,应符合如下要求:a)线性相关系数(r)≥0.990;b)[3,20] μmol/L区间内,线性绝对偏差在±3 μmol/L范围内;(20,100] μmol/L区间内,线性相对偏差在±10% 范围内。
2.6精密度2.6.1重复性试剂盒测试浓度在(20±4) μmol/L 和(65±13) μmol/L 范围内的样本时,变异系数CV≤5%。
2.6.2批间差试剂盒测试浓度在(20±4) μmol/L 和(65±13) μmol/L 范围内的样本时,相对极差R≤10%。
2.7准确度平均回收率在90% ~110%范围内。
2.8校准品外观a)校准品的外观应整洁,标识应清晰、准确、牢固;b)瓶内液体清澈透明,无沉淀、无悬浮物、无絮状物。
铁测定试剂盒(Ferene法)产品技术要求senmeixikema

铁测定试剂盒(Ferene法)适用范围:用于体外定量测定人血清中铁的含量。
1.1规格a)试剂1:2×60ml,试剂2:2×12ml;b)试剂1:4×50ml,试剂2:1×40ml;c)试剂1:2×40ml,试剂2:1×16ml;d)试剂1:2×40ml,试剂2:2×8ml;e)试剂1:2×80ml,试剂2:2×16ml;f)试剂1:1×40ml,试剂2:1×8ml;g)试剂1:1×25ml,试剂2:1×5ml。
1.2 组成试剂主要组分见表1:表1 试剂主要组分2.1 净含量应不低于试剂瓶标示装量。
2.2 外观试剂1:无色或淡黄色透明溶液,试剂2:淡黄色透明溶液。
2.3 试剂空白在600nm处测定试剂空白吸光度,应不超过1.2。
2.4 分析灵敏度测试 100μmol/L的被测物时,吸光度变化(ΔA)应不低于0.05。
2.5 准确度用国家标准物质对试剂盒进行测试,测定值与标准物质标示值的相对偏差应不超过±15%。
2.6 重复性变异系数(CV)应不超过5%。
2.7 线性2.7.1在[2,120]μmol/L范围内,线性回归的相关系数应不低于0.990;2.7.2测试浓度(20,120]μmol/L的样品,相对偏差应不超过±15%;测试浓度[2,20]μmol/L的样品,绝对偏差应不超过±6μmol/L。
2.8 批间差相对极差应小于10%。
2.9 稳定性取在2℃~8℃条件下贮存达到18个月后的试剂进行检测,应符合本技术要求2.2、2.3、2.4、2.5、2.6、2.7之规定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
总铁结合力(TIBC)测定试剂盒(Ferene法)
适用范围:本产品用于体外定量测定人血清或血浆中总铁结合力的含量。
1.1规格
FE:试剂1(R1):1×40mL;试剂2(R2): 1×8ml;
UIBC:试剂3(R3):1×40mL;试剂4(R4): 1×8mL;
FE:试剂1(R1):2×80mL;试剂2(R2):2×16mL;
UIBC:试剂3(R3):2×80mL;试剂4(R4): 2×16mL;
FE:试剂1(R1):2×60mL;试剂2(R2): 2×12mL;
UIBC:试剂3(R3): 2×60mL;试剂4(R4): 2×12mL;
FE:试剂1(R1):1×20mL;试剂2(R2): 1×6mL。
1.2组成
1.2.1试剂组成
试剂1(R1)(以下简称R1),试剂2(R2)(以下简称R2),试剂3(R3)(以下简称R3),试剂4(R4)(以下简称R4),试剂的组成见表1:
表1 试剂组成
2.1 外观
液体四试剂 FE: R1:无色透明液体, R2:澄清黄绿色液体。
UIBC: R3:无色到浅绿色液体, R4: 澄清黄绿色液体。
2.2 净含量
液体试剂的净含量不得低于标示体积。
2.3 空白吸光度
(R1+ R2):在37℃、600 nm波长、1cm光径条件下,试剂空白吸光度应<0.3 ABS。
R4:在37℃、600 nm波长、1cm光径条件下,试剂空白吸光度应<0.15 ABS。
2.4 分析灵敏度
FE:浓度为102.9μmol/L时,吸光度变化范围在(0.17-0.36)之间。
UIBC:浓度为50μmol/L时,吸光度变化范围在(0.04-0.24)之间。
2.5 线性范围
R1+R2:在[2-120]μmol/L线性范围内,线性相关系数r2≥0.996。
在(50-120]μmol/L范围内的相对偏差≤10%;测定结果[2- 50]μmol/L时绝对偏差≤5.0μmol/L。
R3+R4:在[1- 80]μmol/L线性范围内,线性相关系数r2≥0.996。
在
(20 - 80]μmol/L,范围内的相对偏差≤10%;测定结果[1-20]μmol/L时绝对偏差≤2.0 μmol/L。
2.6 精密度
试剂盒测试项目精密度 CV< 6%。
2.7 批间差
不同批号之间测定结果的相对极差应< 6%。
2.8 准确度
相对偏差:用参考物质作为样本进行检测,测量结果与参考物质靶值的相对偏差应不超过±10%。
2.9稳定性
原包装试剂,在(2-8)℃下有效期为18个月,取失效期的试剂盒检测其试剂空白、分析灵敏度、线性范围、精密度、准确度应分别符合2.3、2.4、2.5、2.6、2.8的要求。
