血清蛋白质组样品处理方法的比较分析
四种蛋白质测定方法的比较研究
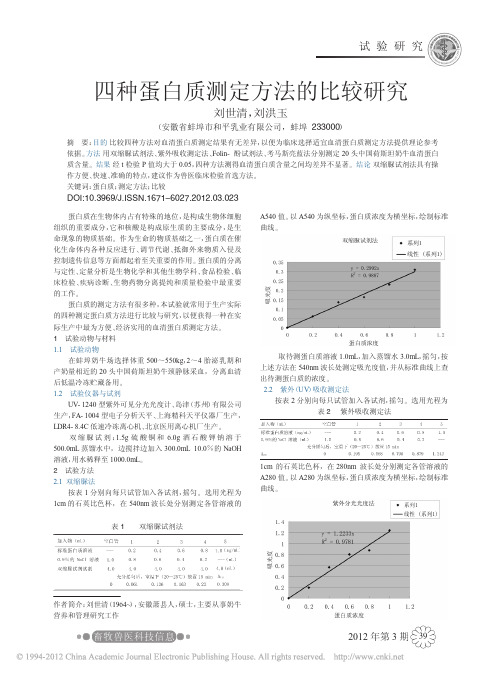
DOI:10.3969/J.ISSN.1671-6027.2012.03.023
蛋白质在生物体内占有特殊的地位,是构成生物体细胞 组织的重要成分,它和核酸是构成原生质的主要成分,是生 命现象的物质基础。作为生命的物质基础之一,蛋白质在催 化生命体内各种反应进行、调节代谢、抵御外来物质入侵及 控制遗传信息等方面都起着至关重要的作用。蛋白质的分离 与定性、定量分析是生物化学和其他生物学科、食品检验、临 床检验、疾病诊断、生物药物分离提纯和质量检验中最重要 的工作。
取普通试管 2 支,各加入待测溶液 1.0 mL,在分别加入 试剂甲 5.0 mL,混匀后放置 10 min,在各加入试剂乙 0.5 mL,迅速混匀,室温放置 30 min,于 750 nm 波长下测定吸 光度,并记录结果。
表 4 考马斯亮蓝 G-250 法
2.4 考马斯亮蓝 G- 250 法 按表 4 分别向每只试管加入各试剂,摇匀。选用光程为
按表 1 分别向每只试管加入各试剂,摇匀。选用光程为 1cm 的石英比色杯,在 540nm 波长处分别测定各管溶液的
A540 值。以 A540 为纵坐标,蛋白质浓度为横坐标,绘制标准 曲线。
取待测蛋白质溶液 1.0mL,加入蒸馏水 3.0mL,摇匀,按 上述方法在 540nm 波长处测定吸光度值,并从标准曲线上查 出待测蛋白质的浓度。 2.2 紫外(UV)吸收测定法
血清蛋白的分离

临床应用的合规性
血清蛋白的分离技术需要符合相关法规和标准,以确保其在临床 上的安全性和有效性。
生产规模的扩大
目前血清蛋白的分离技术主要停留在实验室阶段,需要进一步研 究和改进以适应大规模生产的需求。
成本与效益的平衡
在推广应用血清蛋白分离技术时,需要充分考虑其成本与效益的 平衡,以实现可持续发展。
前景展望
创新技术的研发
未来将不断涌现出新的血清蛋白分离技术,提高分离效率和纯度, 为相关领域的研究和应用提供有力支持。
应用领域的拓展
随着血清蛋白分离技术的不断成熟,其在生物医药、诊断、治疗等 领域的应用将得到进一步拓展。
产业化的推进
未来将有更多的企业和机构投入血清蛋白分离技术的研发和产业化, 推动相关产业的发展。
以确定蛋白质的种类和纯度。
04
血清蛋白分离的应用
生物医学研究
疾病机制研究
生物标志物发现
通过分离血清蛋白,可以深入了解疾 病发生、发展过程中蛋白质表达的变 化,为疾病机制研究提供重要线索。
血清蛋白分离可以帮助发现与特定疾 病相关的生物标志物,用于疾病的早 期诊断、病情监测和预后评估。
药物研发
分离血清中的靶向蛋白质,有助于发 现潜在的药物作用靶点,为新药研发 提供支持。
初步分离
利用离心、过滤或电泳等方法,将血清中的蛋白 质初步分离成不同的组分。
精细分离
01
02
03
04
凝胶电泳
利用凝胶电泳技术,根据蛋白 质的电荷和分子量大小进行分
离。
离子交换色谱
利用离子交换剂与蛋白质的电 荷相互作用,将其分离成不同
的组分。
疏水相互作用色谱
利用蛋白质的疏水性质,将其 分离成不同的组分。
四种检测法在乙腈沉淀法去除血清蛋白中的比较

四种检测法在乙腈沉淀法去除血清蛋白中的比较作者:胡洪华蒋婷宋海星胡瀚丹来源:《中国医药导报》2012年第23期[摘要] 目的比较四种方法在乙腈沉淀法去除血清蛋白中的检测效果,建立一种能快速检测去蛋白率的方法。
方法用乙腈沉淀法去除血清蛋白,分别应用四种不同的检测分析方法,方法Ⅰ通过真空冻干;方法Ⅱ通过真空干燥;方法Ⅲ通过设立对照调零;方法Ⅳ通过挥干乙腈,分析血清蛋白的去除率。
结果方法Ⅰ和方法Ⅱ耗时长、设备要求高;方法Ⅲ耗时最短、方法简便;方法Ⅳ耗时较短、但容易产生实验误差,方法Ⅰ、Ⅱ和Ⅲ的蛋白去除率结果比较,差异无统计学意义(P > 0.05),与方法Ⅳ比较,差异有统计学意义(P < 0.05)。
结论方法Ⅲ为最佳的分析测定分析方法,可用于快速方便了解乙腈的去蛋白率。
[关键词] 乙腈沉淀法;血清蛋白;去蛋白率[中图分类号] R446.1 [文献标识码] A [文章编号] 1673-7210(2012)08(b)-0085-02Comparison of four method for removing serum protein by acetonitrile precipitation HU Honghua1 JIANG Ting1 SONG Haixing2▲ HU Handan11.School of Laboratory Medicine, Chengdu Medical College, Sichuan Province, Chengdu 610083, China;2.Department of Biomedical Sciences, Chengdu Medical College, Sichuan Province, Chengdu 610083, China[Abstract] Objective To compare the test effect of serum protein removal rate by acetonitrile precipitation with four different methods, the aim is to establish a rapid test method to detect the serum protein removal rate. Methods The serum proteins were removed by acetonitrile precipitation experiments, and applied for four different detection methods, vacuum freeze-drying (method Ⅰ), vacuum drying (method Ⅱ), controlled through the establishment of zero (method Ⅲ), dryness acetonitrile (method Ⅳ) were detected the serum protein removal rate in respect. Results Method Ⅰand method Ⅱ were time-consuming and higher equipment requirements, while method Ⅲ was time-saving and simple, although method Ⅳ was time-saving, it was prone to experimental error, method Ⅰ, Ⅱ and Ⅲ proteins removal results revealed no significant difference (P > 0.05) compared with method Ⅳ, which had statistically significant difference (P < 0.05). Conclusion Method Ⅲ is the best analysis of measurement and analysis method, and can be used to understand the removal quickly and easily.[Key words] Acetonitrile precipitation; Serum proteins; Protein removal rate研究表明血清中有20多种高丰度蛋白质,占血清总蛋白的80%以上,而对疾病诊断有密切关系的蛋白含量甚微[1]。
血清蛋白、-球蛋白的分离纯化与鉴定

血清清蛋白.γ-球蛋白的分别纯化与判定(一)血清清蛋白.γ-球蛋白的分别与纯化【目标请求】1.懂得蛋白质分别提纯的总体思绪.2.控制盐析法.分子筛层析.离子交流层析等试验道理及操纵技巧.【试验道理】血清中含有清蛋白和各类球蛋白(α-β-γ-球蛋白等),因为它们所带电荷不合.相对分子质量不合,在高浓度盐溶液中的消融度不合,是以可运用它们在中性盐溶液中消融度的差别而进行沉淀分别,此法称为盐析法.本试验运用不合浓度硫酸铵分段盐析法可将血清中清蛋白.球蛋白初步分别.在半饱和硫酸铵溶液中,血清清蛋白不沉淀,球蛋白沉淀,离心后清蛋白重要在上清液中,沉淀的球蛋白加少量水可使其从新消融.用盐析法分别而得的蛋白质含有大量的硫酸铵,会妨害蛋白质的进一步纯化,是以必须去除,经常运用的有透析法.凝胶过滤法等.本试验采取凝胶过滤法,该法是运用蛋白质与无机盐类之间相对分子质量的差别除去粗成品中盐类.脱盐后的蛋白质溶液再经DEAE纤维素层析柱进一步纯化.DEAE纤维素为阴离子交流剂,在pH 6.5的前提下带有正电荷,能吸附带负电荷的α-球蛋白和β-球蛋白(pl分别为4.9.5.06和5.12),而γ-球蛋白(pl7.3)在此前提下带正电荷,不被吸附故直接从层析柱流出,此时收集的流出液即为纯化的γ-球蛋白.进步醋酸铵溶液的浓度到0.06 mol/L,DEAE纤维素层析柱上的ß-球蛋白及部分a-球蛋白可被洗脱下来.将醋酸铵溶液的浓度进步至,则清蛋白被洗脱下来,此时收集的流出液即为较纯的清蛋白.经DEAE纤维素阴离于交流柱纯化的清蛋白.γ-球蛋白液往往体积较大,样品德量分数较低.为便于判定,常需浓缩.浓缩的办法许多,本试验选用聚乙二醇透析浓缩的办法.血清清蛋白.γ-球蛋白分别纯化后,选用醋酸纤维薄膜电泳法判定其纯度.【试剂与器材】1.试剂.(1)饱和硫酸铵溶液:称取固体硫酸铵850g参加1000mL蒸馏水中,在70~80℃下搅拌促熔,室温中放置留宿,瓶底析出白色结晶,上清液即为饱和硫酸铵液.(2)醋酸铵缓冲液:称取醋酸铵23.12g,加蒸馏水800mL,用稀氨水或稀醋酸调pH至,定容至1000mL.(不得加热)(3)醋酸铵缓冲液:取上液用蒸馏水稀释5倍.(4)醋酸铵缓冲液:取上液用蒸馏水稀释3倍.(上述3种缓冲液要确保浓度和pH的精确性,稀释后要重调pH)(5)300g/L三氯乙酸(6)纳氏试剂(7)葡聚糖凝胶G-25(8)DEAE纤维素(9)新颖血清(10)聚乙二醇(11)双缩脲试剂2.器材离心计心情刻度离心管pH试纸抽滤瓶黑.白反响板透析袋铁架台×20cm)移液枪布氏漏斗造就皿【操纵办法】1. 硫酸铵盐析(1)取刻度离心管1支,参加mL新颖血清,边摇边迟缓滴入饱和硫酸铵液mL.混匀后室温下放置10min,4000r/min离心10min.用滴管当心吸出上清液置于试管中,即为粗清蛋白液.(2)离心管底部的沉淀参加0.8mL蒸馏水,振荡消融,即为粗球蛋白液.2.凝胶柱层析脱盐(1)凝胶的处理:量取30mLSephade G-25醋酸铵缓冲液,置于滚水浴中1h,并经常动摇负气泡逸出.掏出冷却,待凝胶下沉后,倾去含有细微悬浮物的上层液.×醋酸铵缓冲液,将上述处理过的凝胶粒悬液持续注入层析柱内,直至所需凝胶床高度距层析柱上口约3~4cm为止.装柱时应留意凝胶粒装填平均,凝胶床内不得有界面和蔼泡,凝胶床面应平整.打开下口夹,调节柱下端螺旋夹流速2mL/min,用2倍柱床体积的醋酸铵缓冲液均衡.封闭下口夹.(3)上样与洗脱:打开下口夹,使床面上的缓冲液流出,待液面降到凝胶床概况时,封闭出水口.用滴管汲取盐析所得清蛋白溶液,在距离床面1mm处沿管内壁轻轻迁移转变加进样品,切勿搅动床面.然后打开下口夹,使样品进入床内,直到与床面平齐为止.立刻醋酸铵缓冲液冲洗柱内壁,待缓冲液进入凝胶床后再加少量缓冲液.如斯反复2次,以洗净内壁上的样品溶液.然后再参加适量缓冲液于凝胶床上,调流速10滴/min,开端洗脱.用小试管收集流出的液体,每管收集20滴,收集10管后封闭出水口.(4)检测蛋白质与NH4+:取诟谇反响板各一块,按洗脱液的次序每管取1滴,分别滴入反响板中,在黑色反响板中加300g/L三氯乙酸溶液(或用双缩脲试剂检测)2滴,消失白色混浊或沉淀即示有蛋白质析出,并记载各管白色混浊程度.于白色反响板中加人奈氏试剂溶液l滴,不雅察NH4消失的情形.归并含有蛋白质的各管,即为已脱盐的清蛋白溶液,γ-球蛋白的收集同清蛋白的操纵.3.离子交流层析柱纯化(1)DEAE纤维素处理:量取 DEAE-纤维素20mL,加0.5mol/L HCl 溶液50mL,搅拌后放置20min,虹吸去除上清液(也可用布氏漏斗抽干),再用蒸馏水反复洗数次直至pH 4.0 为止.加等体积 0.5 mol/LNaOH 溶液,搅拌后放置20min,虹吸去除上清液,同上用蒸馏水反复洗至pH<7为止.醋酸铵缓冲液40mL 放置30min.待装柱.×醋酸铵缓冲液均衡.调流速20滴/min,将脱盐后的γ-球蛋白溶液上柱,办法与上述脱盐法雷同.同样用300g/L三氯乙酸溶液或双缩脲试剂检讨有无蛋白质流出.收集不被纤维素吸附的蛋白质即为纯化的γ-球蛋白溶液.DEAE纤维素层析柱不必再生,可直接用于血清蛋白.(3)清蛋白的纯化:将脱盐后的清蛋白溶液上柱后,用醋酸铵缓冲液洗脱,流出约6mL后.将柱上的缓冲液液面降至与纤维素床概况平齐.再改用醋酸铵缓冲液洗脱,并用300g/L三氯乙酸溶液或双缩脲试剂检讨流出液是否含有蛋白质.流出液中有蛋白质时,立刻收集,即为纯化的清蛋白液,留作纯度判定用.4.蛋白溶液浓缩将待浓缩的蛋白质溶液放入较细的透析袋中,置入造就皿内.透析袋四周撒上聚乙二醇.经由一准时光后即可不雅察到显著的浓缩现象.该浓缩样品留作纯度判定.以上物资在运用后可以经由过程加温及吹风而收受接管.【要点提醒】1.装柱时,不克不及有气泡和分层现象,凝胶悬液尽量一次加完.2.加样时,切莫将床面冲起,亦不要沿柱壁参加.不克不及搅动床面,不然分别带不整洁.3.流速不成太快,不然分子小的物资来不及集中,随分子大的物资一路被洗脱下来,达不到分别目标.4.在全部洗脱进程中,始终应保持层析柱床面上有一段蒸馏水,不得使凝胶干结.(二)血清清蛋白.γ-球蛋白的判定——醋酸纤维素薄膜电泳【试验目标】1.控制电泳的基起源基础理;2.熟习醋酸纤维素薄膜电泳的办法和运用.【试验道理】蛋白质是两性电解质,在统一pH情形下,混杂蛋白质中各类成分带电量不合.分子大小不合,在统一电场中泳动的速度不合,导致雷同的时光迁徙的距离不合而把它们离开.血清中含有多种蛋白质,用醋酸纤维素薄膜电泳可分为五个区带,γ-球蛋白的等电点为7.3,在pH8.6的巴比妥缓冲液中,带的负电荷起码,是以在电场中比其它蛋白质移动速度慢.而清蛋白等其它蛋白质的等电点均小于7.3(pl分别为4.9.5.06和5.12),是以在电场中比γ-球蛋白移动速度快.本试验分别全血清中各类蛋白质成分,同时判定前次试验清蛋白.γ-球蛋白的提纯成果.【试剂与器材】1.试剂(1)巴比妥缓冲液(pH8.6,离子强度0.06):称取巴比妥纳12.76g,巴比妥1.66g,蒸馏水消融并定容至1000mL.(2)染色液:氨基黑10B 0.25g,用甲醇50mL.冰醋酸10mL.水40mL消融.(3)漂洗液:甲醇或乙醇45mL,冰醋酸5mL,水50mL,混匀.2.器材电泳仪电泳槽醋酸纤维薄膜造就皿滤纸点样器吸量管竹镊子吹风机【操纵办法】1.取醋酸纤维薄膜3张,在薄膜的无光泽面的1.5cm处用铅笔轻轻整洁条线.2.将薄膜浸入pH8.6的巴比妥-巴比妥钠缓冲液中,浸泡约30min(膜上没有白色斑痕).3.将完整浸透的薄膜轻轻掏出,平铺在滤纸上,用滤纸吸去过剩的缓冲液.分别用点样器蘸取正常血清.清蛋白和γ-球蛋白溶液点在点样线上(光滑面).4.薄膜的无光泽面向下,两头紧贴在电泳槽支架上的滤纸条上(点样端在阴极).薄膜应位正,平直无曲折,加上槽盖均衡5分钟后通电电泳,调电流0.5mA/cm膜宽(几条薄膜就是通几毫安的电流,是按横向盘算的),通电时光约40~60min.5.电泳停止后,封闭电源,将薄膜浸于氨基黑10B染色液中染色5min,掏出后用漂洗液漂洗4~5次,每次约5min,待布景无色为止.【成果处理】依据脱色后薄膜上消失的黑点,对清蛋白.γ-球蛋白与正常血清比较,剖析样品的纯度.【思虑题】假如电泳成果证实γ球蛋白的分别后果不睬想,应从哪些方面剖析?。
血清免疫球蛋白的提取分离、纯化及鉴定-1

血清免疫球蛋白的提取分离、纯化及鉴定-1血液及组织样品的制备分析组织中某种物质的含量、探索物质代谢的过程和规律,经常使用动物的肝、肾、脑、粘膜和肌肉等组织,也选用全血、血浆、血清或者无蛋白血滤液等血液样品,有时也采用尿液、胃液等完成各种生化实验。
掌握以上各种实验样品的正确处理和制备方法是保证生化实验顺利进行的关键。
一、血液样品(一)采血测定用的血液,多由静脉采集。
一般在饲喂前空腹采取,因此时血液中化学成分含量比较稳定,采血时所用的针头、注射器,盛血容器要清洁干净;接血时应让血液沿着容器壁慢慢注入,以防溶血和产生泡沫。
(二)血清、全血及血浆的制备1.血清的制备血清是全血不加抗凝剂自然凝固后析出的淡黄清亮液体。
制备方法是:将刚采集的血液直接注入试管或离心管中。
将试管放成斜面,让其自然凝固,一般经3h 血块自然收缩而析出血清;也可将血样放入37 ℃恒温箱内,促使血块收缩,能较快约析出血清。
为了缩短时间,也可用离心机分离(未凝或凝固的均可离心),分离出的血青,用吸管吸出置于另一试管中,若不清亮或带有血细胞,应重离心,加盖冷藏备用。
2.全血及血浆的制备取清洁干燥的试管或其它容器,收集动物的新鲜血液,立即与适量的抗凝剂充分混合,所得到的抗凝血为全血。
每毫升血液中加入抗凝剂的种类可以根据实验的需要进行选择,但是用量不宜过大,否则将影响实验的结果。
将已抗凝的全二于 2,000r / min 离心10min ,沉降血细胞,取上层清液即为血浆。
血浆比血清分离得快而且量多:两者的差别,主要是血浆比血清多含一种纤维蛋白原,其它成分基本相同。
3.抗凝剂凡能够抑制血液凝固反应进行的化合物称为抗凝剂。
抗凝剂种类甚多,实验室常用的有如下几种,可根据情况选择使用。
(1)草酸钾(钠)优点是溶解度大,可迅速与血中钙离子结合,形成不溶性草酸钙,使血液不凝固。
每毫升血液用1-2mg 即可。
配制方法:配制10%草酸钾水溶液二吸取此液0.1ml 放入一试管中,慢慢转动试管,泛草酸钾尽量铺散在试管壁上,置80 ℃ 烘箱烤干(若超过150 ℃ 则分解),管壁即呈一薄层三色粉末,加塞备用。
双缩脲法测定血清蛋白质含量比色技术

双缩脲法测定血清蛋白质含量—比色技术
双缩脲法测定蛋白质的原理 蛋白质分子含有大量彼此相连的肽键(-
分光光度计的使用
分光光度计设计的原理
双缩脲法测定血清蛋白质含量—比色技术
分光光度计操作
• 打开电源开关,使仪器预热20分钟 • 用“波长设置”按钮将波长设置在您将要使用的分
析波长位置上 • 打开样品室盖,按“0%T”键调透射比零 • 盖好样品室盖,按“100%T”调100%透射比 • 按“方式键”(MODE)将测试方式设置为吸光度
实验开始!
双缩脲法测定血清蛋白质含量—比色技术
双缩脲法测定血清蛋白质含量—比色技术
➢ 原理:根据物质对于入射光的特征吸收,可应用于物 质溶液的定性检测
➢ 常用方法:
比较吸收光谱曲线:在相同的条件下,吸收光谱曲线 不同,表明物质的化学结构不同。
比较最大吸收波长:不同物质的最大吸收波长不同; 化学结构相似的物质最大吸收波长相同,吸收系数不 同。
比较吸光度的比值:多用于检测物质的纯度(DNA A260/A280=1.8 纯度鉴定)
I0
It
C
b
双缩脲法测定血清蛋白质含量—比色技术
✓ 透光率(Transmittance)T:透射光的强度It与入 射光强度I0之比。
T=
It Io
*100%
透光率愈大,溶液对光的吸收愈少;透光率愈小,溶液对 光的吸收愈多。
✓ 吸光度(Absorbance)A:透光率的负对数。
免疫透射比浊法及干化学法测定血清白蛋白方法学比较及偏倚评估

免疫透射比浊法及干化学法测定血清白蛋白方法学比较及偏倚评估【摘要】目的通过评估免疫透射比浊法与干化学法测定ALB的偏倚,探讨两种方法检测ALB结果间的偏差是否在允许的范围,保证检测结果的可比性。
方法依据NCCLS标准化文件EP9-A2 [1],每天取临床样本8份,分别用免疫透射比浊法与干化学法进行双份测定,共测定5 d,去除离群点,计算相关系数及预期偏差,以CLIA’88规定的室间质评(ALB+10%)允许误差的1/2作为方法比较结果系统误差的允许限值,进行偏倚的评估。
结果干化学法与免疫透射比浊法比较,r�2=0.934,在医学决定水平20 g/L,35 g/L,52 g/L时,干化学法的预期相对偏倚分别10.4%,6.8%,3.2%, 在Xc= 20 g/L及Xc=35 g/L时, 两种方法存在统计学差异。
结论以免疫透射比浊法作为比较方法,干化学法测定ALB的结果存在正偏差,测定结果的偏差随着ALB浓度的减低而增大,在低浓度时差异更显著,两者相关性差。
因此,实验室内使用不同分析方法检测同一分析物时,建议对各方法进行方法学比较及偏倚评估,明确方法间的差异,并建立各方法的参考范围,特别是建立不同方法在不同医学决定水平浓度的参考值,以保证检测结果的可比性。
【关键词】血清白蛋白;免疫透射比浊法;干化学; 偏倚Turbidimetric Immunoassay Method and Dry-slide Bromocresol Green Method in(ALB)Serum Albumin Determination:A Methodological Comparison and Bias AssessmentFENG Pin-ning,GAO Ling,YU Xiong-wen,et al.Laboratory Medicine Department of the First Affiliated Hospital of Sun Yat-sen University,Guangzhou 510080,China【Abstract】 Objective The article compares the bias assessments of turbidimetric immunoassay method and dry-slide bromocresol green method in ALB detection, and discusses whether the bias of the two detection results are within the range permitted, so as to ensure the comparability of the results.Method According to NCCLS standardization document EP9-A2 [1], firstly 8 clinical samples are daily taken and tested duplicates under each method, altogether five days. Next the outlier points are excluded and correlation coefficients and expected deviations are calculated. The value is restricted by 1/2 of the error thatexternal quality assessment allows(ALB+10%)by CLIA’88 as the method comparison result system error, and then it is bias assessed.Results The results of comparison between dry-slide bromocresol green method and turbidimetric immunoassay method are as follows: r�2=0.934,when medical decisions are 20 g/L,35 g/L and 52 g/L,the expected relative deviations of dry-slide bromocresol green method are 10.4%,6.8%,3.2% respectively. When Xc=20 g/L and Xc=35 g/L, there are significant differences between the results of two methods.Conclusion Turbidimetric immunoassay is regarded as the methodology in comparison. Dry-slide bromocresol green method, however, proves positive deviations in the results of ALB determination. Its value of bias increases with the decline of ALB concentration, and it is more apparent when the concentration turns low. These two methods have poor correlation. Therefore, when different analysis methods are utilized in the detection of the same object, it is suggested different methodological comparisons and bias assessments be used in each method to make clear the disparities among them and then establisheach reference range, especially the concentration reference values of different methods in different medical decisions, to insure the comparability of the detection results.【Key words】 (ALB)serum albumin; Turbidimetric immunoassay method; Dry-slide bromocresol green method;Bias作者单位:510080中山大学附属第一医院检验医学部血清白蛋白测定是医院常规的生化检验项目,可作为诊断某些疾病(肾病综合征,肝硬化等)和评估预后的指标,其值的高低也可作为血液透析,肾移植患者生存期等的预测指标[2]。
血清蛋白的分离、提纯与鉴定

血清清蛋白、γ-球蛋白的分离、提纯于鉴定一、实验目的:1、掌握盐析法分离蛋白质的原理和基本方法2、掌握凝胶层析法分离蛋白质的原理和基本方法3、掌握离子交换层析法分离蛋白质的原理和基本方法4、掌握醋酸纤维素薄膜电泳法的原理和基本方法5、了解柱层析技术二、实验原理:蛋白质的分离和纯化是研究蛋白质化学及其生物学功能的重要手段。
对于不同的蛋白质,其分子量、溶解度及等电点等都有所不同。
利用不同蛋白质在这些性质上的差别,利用相应的物理方法可分离纯化不同蛋白质。
A.盐析法:在蛋白质溶液中加入大量中性无机盐后,由于中性盐与水分子的亲和力大于蛋白质,致使蛋白质分子周围的水化膜减弱乃至消失。
同时,加盐后由于离子强度发生改变,蛋白质表面的电荷大量被中和,从而破坏了蛋白质的胶体性质,导致蛋白质溶解度降低,蛋白质分子之间易于聚集沉淀,进而使蛋白质从水溶液中沉淀析出。
B.凝胶层析:利用蛋白质与无机盐类之间分子量的差异。
当溶液通过SephadeG-25凝胶柱时,溶液中分子直径大的蛋白质不能进入凝胶颗粒网孔,而分子量小的无机盐能进入凝胶颗粒的网孔中,因此在洗脱过程中,小分子的盐会被阻滞而后洗脱出来,从而达到去盐的目的。
C.离子交换层析:离子交换层析是指流动相中的离子和固定相上的离子进行可逆的交换,利用化合物的电荷性质及电荷量不同进行分离。
D.纯度鉴定(醋酸纤维素薄膜电泳):血清中各种蛋白质的等电点不同,一般都低于pH7.4。
它们在pH8.6的缓冲液中均解离带负电荷,在电场中向正极移动。
由于血清中各种蛋白质分子大小、形状及所带的电荷量不同,因而在醋酸纤维素薄膜上电泳的速度也不同。
因此电泳时可将它们分离为清蛋白、α1-球蛋白、α2-球蛋白、β-球蛋白、γ-球蛋白5条区带。
三、材料与方法A材料样品:人混合血清试剂:葡聚糖凝胶(G-25)层析柱、DEAE纤维离子交换层析柱、饱和硫酸铵溶液、醋酸铵缓冲溶液、20%磺基水杨酸、1%BaCl溶液、氨基黑染色液、漂洗液、pH8.6巴比妥缓2冲溶液、电泳仪、电泳槽B实验步骤盐析(粗分离)→葡聚糖凝胶层析(脱盐)→DEAE纤维素离子交换层析(纯化)→醋酸纤维素薄膜电泳(纯度鉴定)具体操作流程示意:(一)盐析+凝胶柱层析除盐:(二)离子交换层析(纯化):(三)醋酸纤维素薄膜电泳:1、点样(如下图):-点样线尽量点得细窄而均匀,宁少勿多2、电泳:①薄膜粗面向下②点样端置阴极端③两端紧贴在滤纸盐桥上,膜应轻轻拉平电压:110V时间:50min3、染色和漂洗:电泳完毕后,关闭电源,将膜取出,直接浸于染色液中5min。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
作用[J ].解放军医学杂志,2004,29(8):703-706.
[3]李 毅,戚好文,刘颖格,等.氟伐他汀对大鼠气道平滑肌增生
的影响[J ].第四军医大学学报,2003,24(6):2089-2093.
[4]王文建,杨 莉,王西华,等.川芎嗪对大鼠支气管哮喘模型气
道重塑的影响及机制[J ].中华结核和呼吸杂志,2004,
27(12):833-836.
[5]B lack JL,Roth M ,Lee J,et al .Mechanis m s of air way re modeling:
A ir way s mooth muscle [J ].Am J Res p ir Crit Care Med,2001,164(10):63-66.
[6]葛守一,梅长林,徐成刚.羟甲基戊二酰辅酶A 还原酶抑制剂对
多囊肾病囊肿衬里上皮细胞增殖抑制及其机制的研究[J ].中华肾脏病杂志,2002,18(1):49-53.
[7]Cerez o 2Guisado M I,Garcia 2Marin LJ,Lorenz o MJ,et al .Lovastatin
inhibits the gr owth and survival pathway of phos phoinositide 32ki 2nase /p r otein kinase B in i m mortalized rat brain neur oblasts [J ].J Neur ochem,2005,94(5):1277-1287.
[8]Amm it AJ,Panettieri Jr .The circle of life:Cell cycle regulati on in
air way s mooth muscle [J ].J App l Physi ol,2001,91(3):
1431-1437.
编辑 杨湘华
・经验交流・ 文章编号:100022790(2007)0720640201血清蛋白质组样品处理方法的比较分析
刘希成,梁 恒,田 真,张 霖,陈 阳 (西安交通
大学生命科学与技术学院分离科学研究所,陕西西安
710049)
收稿日期:2006212212; 接受日期:2007202210基金项目:国家自然科学基金(90209016)
通讯作者:梁 恒.Tel:(029)82663992Email:lheng@mail .xjtu .edu .cn 作者简介:刘希成.博士生(导师梁 恒).Tel:(029)82663992
Email:xichengliu@mail .xjtu .edu .cn
【关键词】双向电泳;蛋白质组学;血清【中图号】Q51 【文献标识码】B
1 材料和方法 应用Affinity 2blue gel 和Pr otein A 分别去除
人血清中的白蛋白和I gG .将未做处理的血清以及去除白蛋
白和I gG 的血清各400μg 与水化液混合,参照G rg 等[1]
的方
法进行双向凝胶电泳(t w o 2di m ensi onal polyacryla m ide gel elec 2
tr ophoresis,22DE )检测,实验重复3次.扫描获取谱图,用P DQuest 分析软件进行图像分析,选取表达量差异2倍以上的
蛋白点进行质谱分析,获得其肽质量指纹图(P MF ),用Pr o 2
found P M F 数据库查询软件在NCB I nr 蛋白数据库中进行蛋白
的检索.
2 结果 P DQuest 软件对22DE 谱图进行匹配和统计分析,
发现未做处理血清、去除白蛋白及I gG 的血清的平均蛋白质点分别为(482±18)个和(523±29)个.从谱图中发现,去除白蛋白及I gG 后,M r =30000~70000区域内蛋白点的丰度明显提高,高丰度蛋白富集区的蛋白丰度明显下降,但其它区域的部分蛋白丰度也随之下降或者丢失.切取在去除白蛋白及
I gG 过程中丢失和新出现的9个蛋白点(Student πs 2t 检验差异
显著,P <0.05),胶内酶解后进行MALD I 2T OF 2MS 分析,成功鉴定了这些差异蛋白点为8种蛋白质.在这些鉴定的差异蛋白点中,出现在未做处理血清中的蛋白有5个,其中2个蛋白点鉴定为同一种蛋白,分别为维生素A 结合蛋白,可溶性尿激
酶血纤维蛋白溶酶原激活剂受体,蛋白激酶1抗原和血清白蛋白.出现在去除白蛋白和I gG 的血清中的蛋白有4个,分别为NADH 脱氢酶辅酶β,肌动蛋白结合蛋白M1,T 细胞活性受体β和血小板生长因子C .
3 讨论 应用Affinity 2blue gel 和Pr otein A 分别去除白蛋白
和I gG 已经成为血清蛋白质组学研究中一种常用的前处理方法[2].本研究应用蛋白质组学方法比较分析了人未做处理血清和去除白蛋白及I gG 的血清,鉴定了8种差异表达的蛋白质,其中7种为低丰度功能蛋白.蛋白功能分析发现,维生素
A 结合蛋白是一种与视觉感知和物质传递相关的胞外蛋白.
可溶性尿激酶血纤维蛋白溶酶原激活剂受体定位于质膜,具有血液凝聚、细胞表面信号转导的功能.蛋白激酶1抗原是由醛还原酶的C OVA1基因编码生成的,与细胞生长、电子传递和mRNA 拼接等功能相关[3].NADH 脱氢酶辅酶β由线粒体分泌到胞外,具有电子传递功能.T 细胞活性受体β与T 细胞信号通路和细胞防御等功能相关.血小板生长因子C 与血小板生长因子前体相关,定位于胞外,除与血小板受体信号通路相关,还与细胞增殖等其它生物功能相关[4].
我们的实验结果表明,去除高丰度蛋白时可以增强一些低丰度功能蛋白的检测,但由于非特异性吸附的存在,也会导致部分功能蛋白的丢失.因此,我们认为在分析具体病例的血清时,应采用不同的方法对样品进行处理后再分别进行实验,并将结果综合起来全面地加以分析.【参考文献】
[1]G rg A,W eissW ,Dunn MJ.Current t w o 2di m ensi onal electr ophore 2
sis technol ogy for p r oteom ics [J ].Pr oteom ics,2004,4(12):
3665-3685.
[2]Hu S,Loo JA,Wong DT .Human body fluid p r oteome analysis [J ].
Pr oteom ics,2006,6(23):6326-6353.
[3]庞月华,杨望平.丝裂原激活蛋白激酶磷酸酶21和p38在内膜
损伤后血管平滑肌细胞表型转化过程中的表达变化[J ].临床心血管病杂志,2006,22(9):36-40.
[4]Campbell JS,Hughes S D,Gilberts on DG,et al .Platelet 2derived
gr owth fact or C induces liver fibr osis,steat osis,and hepat ocellular carcinoma [J ].Pr oc Natl Acad Sci US A,2005,102(9):
3389-3394.
编辑 杨湘华
46第四军医大学学报(J Fourth M ilMed Univ )2007,28(7) htt p://j ournal .f mmu .edu .
cn。
