第三章 统计热力学基础.
热力学基础

绝 热 壁
Q T 恒温热源
Q 1 dQ
2
积分与过程有关
功与热量的异同
热量是过程量
(1)都是过程量:与过程有关; (2)等效性:都会使系统能量发生变化, (3)功与热量的物理本质不同 .
二、热力学第一定律
某一过程,系统从外界吸热 Q,对外界做 功A,系统内能从初始态 E1变为 E2,
Q E2 E1 A
P
1(P1 ,V1 ,T1)
绝 热 等温
dP P )T 等温曲线的斜率:( dV V dP P 绝热曲线的斜率: ( )Q dV V >1
2(P2 ,V2 ,T2)
O
V1
V
物理原因:
这表明:从同一状态出发,膨胀同一体积, 绝热过程比等温过程的压强下降得更多一些。 P 绝热曲线
Cm dT
定容摩尔热容CV,m 1mol气体,保持体积不变,吸(或放)热dQV,温度升 高(或降低)dT,则定容(定体)摩尔热容为 dQV CV , m M dT 1 M i i 热一: dQV 2 RdT pdV RdT 2 i CV , m R 2
CV , m
S
说明
O (1) 准静态过程是一个理想过程; (2) 除一些进行得极快的过程(如爆炸过程)外,大多数情 况下都可以把实际过程看成是准静态过程; (3) 准静态过程在状态图上可用一条曲线表示, 如图.
V
内能: 物体分子无规则运动的总和
M i RT 理想气体的内能 E 2
理想气体的内能是温度的单值函数。 内能是状态函数(state-dependent quantity)
2. 热力学平衡状态 (equilibrium state of thermodynamics)
热力学与统计物理第三章知识总结

§3.1 热动平衡判据当均匀系统与外界达到平衡时,系统的热力学参量必须满足一定的条件,称为系统的平衡条件。
这些条件可以利用一些热力学函数作为平衡判据而求出。
下面先介绍几种常用的平衡判据。
oisd一、平衡判据1、熵判据熵增加原理,表示当孤立系统达到平衡态时,它的熵增加到极大值,也就是说,如果一个孤立系统达到了熵极大的状态,系统就达到了平衡态。
于是,我们就能利用熵函数的这一性质来判定孤立系统是否处于平衡态,这称为熵判据。
孤立系统是完全隔绝的,与其他物体既没有热量的交换,也没有功的交换。
如果只有体积变化功,孤立系条件相当与体积不变和内能不变。
因此熵判据可以表述如下:一个系统在体积和内能不变的情形下,对于各种可能的虚变动,平衡态的熵最大。
在数学上这相当于在保持体积和内能不变的条件下通过对熵函数求微分而求熵的极大值。
如果将熵函数作泰勒展开,准确到二级有d因此孤立系统处在稳定平衡态的充分必要条件为既围绕某一状态发生的各种可能的虚变动引起的熵变,该状态的熵就具有极大值,是稳定的平衡状态。
如果熵函数有几个可能的极大值,则其中最大的极大相应于稳定平衡,其它较小的极大相应于亚稳平衡。
亚稳平衡是这样一种平衡,对于无穷小的变动是稳定是,对于有限大的变动是不稳定的。
如果对于某些变动,熵函数的数值不变,,这相当于中性平衡了。
熵判据是基本的平衡判据,它虽然只适用于孤立系统,但是要把参与变化的全部物体都包括在系统之内,原则上可以对各种热动平衡问题作出回答。
不过在实际应用上,对于某些经常遇到的物理条件,引入其它判据是方便的,以下将讨论其它判据。
2、自由能判据表示在等温等容条件下,系统的自由能永不增加。
这就是说,处在等温等容条件下的系统,如果达到了自由能为极小的状态,系统就达到了平衡态。
我们可以利用函数的这一性质来判定等温等容系统是否处于平衡态,其判据是:系统在等温等容条件下,对于各种可能的变动,平衡态的自由能最小。
这一判据称为自由能判据。
第三章 统计热力学基础 (2)

第三章统计热力学基础返回上一页1. 设有一个体系,由三个定位的单维简谐振子所组成,体系能量为11/2 hν,这三个振子在三个固定的位置上振动,试求体系全部的微观状态数。
2. 当热力学体系的熵函数S增加0.418 J/K时,则体系的微观状态数增加多少?用ΔΩ/Ω1表示。
3. 对于双原子分子,证明:U r=NkT U v=NkT设基态振动能为零,≈1+x 。
4.将N2气在电弧中加热,从光谱中观察到处于第一激发态的相对分子数N(v=1)/N(v=0)=0.26,式中ν为振动量子数N(v=0)为基态占有的分子数,N(v=1)为第一激发振动态占有的分子数,已知N2的振动频率ν= 6.99×,(1) 计算气体温度。
(2) 计算振动能量在总能量(包括平动,转动和振动)中所占的百分数。
5.设某理想气体A,其分子的最低能级是非简并的,取分子的基态作为能量零点,相邻能级的能量为ε,其简并度为2,忽略更高能级。
(1)写出A分子的总配分函数的表达式。
(2)设ε=kT,求出相邻两能级上最概然分子数之比n1/n0。
(3)设ε=kT,试计算1 摩尔该气体的平均能量是多少?6.某气体的第一电子激发态比基态能量高400 kJ/mol,试计算(1)在300 K时,第一激发态分子所占的百分数?(2)若要使激发态的分子数占10%,则需多少温度?7.零族元素氩(Ar)可看作理想气体,相对分子量为40,取分子的基态(设其简并度为1)作为能量零点,第一激发态(设其简并度为2)与基态能量差为ε,忽略其它高能级。
(1)写出氩分子的总的配分函数表达式。
(2)设ε=5kT,求在第一激发态上最可几分布的分子数占总分子数的百分数。
(3)计算1 mol Ar气在标准状态下的统计熵值。
设Ar 的核和电子的简并度均等于1。
8. Na原子气体(设为理想气体)凝聚成一表面膜(1)若Na原子在膜内可自由运动(即二维平动),试写出此凝聚过程的摩尔平动熵变的统计表达式。
热力学第二定律的统计解释
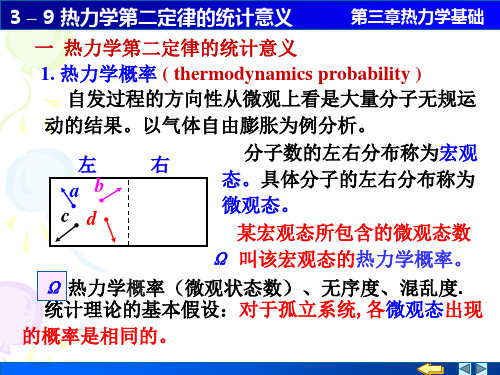
3 – 9 热力学第二定律的统计意义
第三章热力学基础
N1
2
4
N
Ω
(左)
2
22
24
2N
0
N个分子,Ωi
2 N。
若N=100, 则:
Ωi 2100 1030
而左右各半的平衡态及其附近宏观态的热力学概率则
占总微观状态数的绝大比例。 Ω(N左)
一般热力学系统 N的数量级约
N 很大
为1023,上述比例实际上是百分
概率小的状态
概率大的状态
讨论 N 个粒子在空间的分布问题
可分辨的粒子集中在 左空间的概率
N 1, 2
N 2, 4
3 – 9 热力学第二定律的统计意义
第三章热力学基础
b Aa
B
cd
ab
bc
c
a dcd
a bd
a bd
c
1 1264
A
bBa
cd
bd c
a
ab
c d
分子的分布
容器 A
的部
分B
设 S f(),求 f 的函数形式。
由 S 的可加性来分析:
1 S1, 1
1+2
S,
2 S2, 2 1、2彼此独立
∴ 应有: f( ) ln
3 – 9 热力学第二定律的统计意义
第三章热力学基础
S k ln
─ 玻耳兹曼熵公式
1877年玻耳兹曼提出了S ln 。
1900年普朗克引进了比例系数 k 。
ab cd
0
0a
b
c
d
bc ac ab a a d d d bc b
abbc cd d
统计热力学

统计热力学统计热力学是宏观热力学与量子化学相关联的桥梁。
通过系统粒子的微观性质(分子质量、分子几何构型、分子内及分子间作用力等),利用分子的配分函数计算系统的宏观性质。
由于热力学是对大量粒子组成的宏观系统而言,这决定统计热力学也是研究大量粒子组成的宏观系统,对这种大样本系统,最合适的研究方法就是统计平均方法。
微观运动状态有多种描述方法:经典力学方法是用粒子的空间位置(三维坐标)和表示能量的动量(三维动量)描述;量子力学用代表能量的能级和波函数描述。
由于统计热力学研究的是热力学平衡系统,不考虑粒子在空间的速率分布,只考虑粒子的能量分布。
这样,宏观状态和微观状态的关联就转化为一种能级分布(宏观状态)与多少微观状态相对应的问题,即几率问题。
Boltzmann 给出了宏观性质—熵(S )与微观性质—热力学几率(Ω)之间的定量关系:ln S k =Ω。
热力学平衡系统熵值最大,但是通过概率理论计算一个平衡系统的Ω无法做到,也没有必要。
因为在一个热力学平衡系统中,存在一个微观状态数最大的分布(最概然分布),摘取最大项法及其原理可以证明,最概然分布即是平衡分布,可以用最概然分布代替一切分布。
因此,有了数学上完全容许的ln Ω≈ln W D,max ,所以,S =k ln W D,max 。
这样,求所有分布的微观状态数—热力学几率的问题转化为求一种分布—最概然分布的微观状态数的问题。
波尔兹曼分布就是一种最概然分布,该分布公式中包含重要概念—配分函数。
用波尔兹曼分布求任何宏观状态函数时,最后都转化为宏观状态函数与配分函数之间的定量关系。
配分函数与分子的能量有关,而分子的能量又与分子运动形式有关。
因此,必须讨论分子运动形式及能量公式,各种运动形式的配分函数及分子的全配分函数的计算。
确定配分函数的计算方法后,最终建立各个宏观性质与配分函数之间的定量关系。
热力学:基础:三大定律研究对象:(大量粒子构成的)宏观平衡体系研究方法:状态函数法手段:利用可测量量p-T-V+C p,m和状态方程结果:求状态函数(U,H,S,G,等)的改变值,以确定变化过程所涉及的能量和方向。
傅献彩物理化学选择题———第一章 热力学第一定律及其应用 物化试卷(二)

目录(试卷均已上传至“百度文库”,请自己搜索)第一章热力学第一定律及其应用物化试卷(一)第一章热力学第一定律及其应用物化试卷(二)第二章热力学第二定律物化试卷(一)第二章热力学第二定律物化试卷(二)第三章统计热力学基础第四章溶液物化试卷(一)第四章溶液物化试卷(二)第五章相平衡物化试卷(一)第五章相平衡物化试卷(二)第六章化学平衡物化试卷(一)第六章化学平衡物化试卷(二)第七章电解质溶液物化试卷(一)第七章电解质溶液物化试卷(二)第八章可逆电池的电动势及其应用物化试卷(一)第八章可逆电池的电动势及其应用物化试卷(二)第九章电解与极化作用第十章化学动力学基础(一)物化试卷(一)第十章化学动力学基础(一)物化试卷(二)第十一章化学动力学基础(二) 物化试卷(一)第十一章化学动力学基础(二) 物化试卷(二)第十二章界面现象物化试卷(一)第十二章界面现象物化试卷(二)第十三章胶体与大分子溶液物化试卷(一)第十三章胶体与大分子溶液物化试卷(二)参考答案1.1mol 单原子分子理想气体从298 K,200.0 kPa 经历:①等温, ②绝热, ③等压三条途径可逆膨胀,使体积增加到原来的2倍,所作的功分别为W,W2,W3,三者的关系是: ( )1(A) |W1|>|W2|>|W3| (B) |W2|>|W1|>|W3|(C) |W3|>|W2|>|W1| (D) |W3|>|W1|>|W2|2. 下述说法哪一个是错误的? ( )(A)封闭体系的状态与其状态图上的点一一对应(B)封闭体系的状态即是其平衡态(C)封闭体系的任一变化与其状态图上的实线一一对应(D)封闭体系的任一可逆变化途径都可在其状态图上表示为实线3. 凡是在孤立体系中进行的变化,其ΔU和ΔH的值一定是: ( )(A) ΔU > 0 , ΔH > 0 (B) ΔU = 0 , ΔH = 0(C) ΔU < 0 , ΔH < 0 (D) ΔU = 0 , ΔH不确定4. " 封闭体系恒压过程中体系吸收的热量Q p等于其焓的增量ΔH ",这种说法:( )(A)正确(D) 需加可逆过程与无非体积功的条件(B) 需增加无非体积功的条件(C) 需加可逆过程的条件5. 非理想气体进行绝热自由膨胀时,下述答案中哪一个是错误的? ( )(A) Q=0 (B) W=0 (C) ΔU=0 (D) ΔH=06.当体系将热量传递给环境之后,体系的焓: ( )(A)必定减少(B) 必定增加(C)必定不变(D) 不一定改变7. 一定量的理想气体从同一始态出发,分别经(1)等温压缩,(2)绝热压缩到具有相同压力的终态,以H1,H2分别表示两个终态的焓值,则有:( )(A)H1> H2(B)H1= H2(C)H1< H2(D)H1>=H28. 下列诸过程可应用公式dU = (C p-nR)dT进行计算的是:( )(A)实际气体等压可逆冷却(C)理想气体绝热可逆膨胀(B)恒容搅拌某液体以升高温度(D)量热弹中的燃烧过程9. 1mol单原子分子理想气体,从273 K,202.65 kPa,经pT=常数的可逆途径压缩到405.3 kPa的终态,该气体的ΔU为: ( )(A)1702 J (B)-406.8 J (C)406.8 J (D)-1702 J10. 一定量的理想气体从同一初态分别经历等温可逆膨胀、绝热可逆膨胀到具有相同压力的终态,终态体积分别为V1,V2,则: ( )(A) V1> V2(B)V1< V2(C) V1= V2(D) 无法确定11.一容器的容积为V1=162.4 立方米,内有压力为94430 Pa,温度为288.65 K的空气。
统计热力学基础.ppt
N
qN
lnq
S kBln
N! NkBT (
T
)
V, N
(定位) (非定位)
G
kBTln q N
NkBTV
lnq ()
V T, N
G
kBTln
qN N!
NkBTV
lnq ()
V T, N
(定位) (非定位)
2020-6-17
谢谢阅读
18
U
NkBT
2 (lnq ) T V,
N
(定位或非定位)
H
NkBT
分布为最概然分布;
2020-6-17
谢谢阅读
7
通过摘取最大相原理可证明:在粒子数 N 很大 (N 1024)时,玻尔兹曼分布的微观状态数 (tmax) 几乎可以代表体系的全部微观状态数 ();
故玻尔兹曼分布即为宏观平衡分布。
在 A、B 两个能级上粒子数之比:
A / kBT
N g e A
A
量在第 i 个微态中的取值。
2020-6-17
谢谢阅读
6
七、玻尔兹曼分布
玻尔兹曼分布是自然界最重要的规律之一,其数 学表达为:
Ni
N
g ei / kBT i g ei / kBT i
i
(定位或非定位)
玻尔兹曼分布是微观状态数最多(由求 ti 极大值
得到)的一种分布;根据等概率原理,玻尔兹曼
可计算体系的熵。
2020-6-17
谢谢阅读
2
三、分布(构型、布居)
一种分布: 指 N 个粒子在许可能级上的一种分配;
每一种分布的微观状态数(ti)可用下列公式计算:
• 定位体系: ti N!
热力学中统计力学的数学基础
热力学中统计力学的数学基础热力学是研究物质内部微观粒子间相互作用引起的宏观性质和过程的一门科学。
而统计力学则是研究宏观物理规律与微观粒子运动规律之间的关系的一门科学。
在热力学中,统计力学起着至关重要的作用,提供了理解系统行为和推导宏观性质的数学基础。
微观与宏观在介绍统计力学的数学基础之前,我们先来从宏观和微观两个角度看待物理系统。
宏观角度下,我们研究物质的整体性质以及宏观现象,如温度、压强、体积等。
而微观角度下,我们关注的是物质内部微观粒子(原子、分子、离子)的运动状态和相互作用。
统计力学的目标就是通过建立微观粒子之间的统计关系来推导出宏观量的统计规律。
这种桥梁就是统计力学在热力学中的数学基础。
统计力学的数学基础1. 统计方法统计力学使用概率论和统计学的方法来处理物质内部微观粒子的运动和相互作用问题。
其中,概率论提供了描述微观粒子状态变化的工具,而统计学则用于将大量微观粒子系统的行为推断到整个系统层面。
其中一个关键概念是正则分布,即指明了能量分布在一定区域内服从某种规律。
这个概念在统计力学中被广泛应用于描述粒子处于某个能级上的概率,并进一步推导得到宏观量。
2. 状态与能级在统计力学中,系统的状态是由其微观粒子状态所决定的。
每个微观粒子都有一定数量的离散能级,而整个系统则包含了所有微观粒子共同构成的能级结构。
根据量子力学理论,每个能级都对应着具体的能量取值。
而不同能级上有不同数量的微观粒子,在某个时刻处于某个能级上的概率由正则分布给出。
3. 统计物理量在热力学中,我们通常关注与宏观状态有关的物理量,比如温度、压强、体积等。
这些物理量可以通过平均值来描述。
在统计力学中,根据概率分布函数求平均值可以得到系统各种物理量对时间平均之后得到系综平均值。
从而将微观数量转化为宏观数量来揭示系统规律。
4. 统计热力学统计热力学是建立在统计力学基础上研究热力学问题的一个分支。
它通过使用数列方法推导出经典热力学定律,并将其与实验结果进行对比以验证模型的正确性。
化工热力学Ⅱ(高等化工热力学)——第三章 流体的P—V—T关系
2! ( 3 2 )!
∈ 所以对于N个粒子分布在 ∈1 ,∈2 , …., , M ,共M个能级上,微观数 为: g N ! W = ∏ g = N !∏ n ! ∏ n! 定域子系统: (3-1) 离域子系统: (3-2) ( n i + g i 1 )!
分布方式 第一种方式 第二种方式
左边容器 abcd abc abd acd bcd ab ac ad bc bd cd a b c d 0
右边容器 0 d c b a cd bd bc ad ac ab bcd acd abd abc abcd
分布性质 四个粒子均在左边 三个粒子在左边 一个粒子在右边 共有4种方式 两个粒子在左边两个粒子 在右边共有6种方式
分布方 式
n左
n左 右
n右
0 10 1
1 9 10
2 8 45
3 7 120
4 6 210
5 5 252
6 4 210
7 3 120
8 2 45
9 1 10
10 0 1
微态数 WD
最可几分布 可见,当系统中所含粒子的量很大时,系统的宏观性质是由最可 几分布决定,其微态数为: N !
W
* D
=
N 2
例2 同例1,但能级有ξ1二个量子态(简并度g1=2),求此分布的微态数. 解:微态数为:
ε2 c
(g2=1)
c
c c a b
b
b
b a
b c a
a
a
a b
a c b
ε1
(g1=2)
ab -
ac -
bc -
ab b a
ac c
统计热力学基础
例2. 定域子系统中只有3个一维谐振子,它们分别在 A,B,C三个定点上振动,总能量为 9 hv,分析系统 2 可能有的能级分布及状态分布。 能级 能级分布 Ⅰ Ⅱ Ⅲ n0 n1 n2 n3
状态分布 0
3 0 0 WⅠ= 6 WⅡ = 3 WⅢ = 1 Ω = WⅠ+WⅡ+WⅢ=10
0=
1=
例如,某能级分布的微态数为WD,总微态数为Ω, 则该能级分布的数学概率 P 为:
WD 1 PD = Ω × WD = Ω
系统状态确定时,Ω为定值,微态数最大的分布 WD 最大,热力学概率也最大,称为最概然分布。
4、最概然分布与平衡分布 最概然分布虽然代表了系统微态数最多的一种 能级分布方式,但是它的数学概率是随着粒子数的 增多而减小的。 以粒子的空间分布为例来进行分析 例如,某一气体系统,粒子数为N,当系统达平 衡时,粒子在整个空间上的分布应是均匀的。 如果把整个空间分为大 小相等的两部分,则两部 分中所包含的粒子数应相 等,均为 N 。
2、等概率定理
对于U, V 和 N 确定的某一宏观系统,任何一 个可能出现的微观状态,都有相同的数学概率。 这个假设称为等概率定理。 例如,某宏观系统的总微态数为Ω ,则每一 种微观状态出现的数学概率 P 都相等,即:
1 P=Ω
3、最概然分布(最可几分布) 对于U, V 和 N 确定的宏观系统,微观上可能会 有多种能级分布方式,不同的能级分布所包含的状 态分布数不同,根据等概率定理,各微态出现的概 率相等,则各能级分布出现的概率不同。
§9.1
粒子各运动形式的能级及能级的简并度
根据前面的讨论及上述计算结果可以看出,各 种运动的能级间隔遵循如下关系:
Δn>Δe>Δv>Δr>Δt
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三章 统计热力学基础
思考题:
1.当系统的U ,V ,N 一定时,由于粒子可以处于不同的能级上,因而分布数不同所以系统总微观数不能确定,这句话是否正确?
2.由离域子系统和定域子系统熵与配分函数的关系可以看出,定域子系统熵比离域子系统的熵大S=klnN!,但是一般说来晶体总比同温度下气体的熵小,为什么?
3.分子能量零点的选择不同,所有热力学函数的值都要改变,对吗?
4.三维平动子第一激发态的简并度是多少?一维谐振子第一激发态的简并度是多少?
5.对于单原子理想气体在室温下的一般物理化学过程,若要通过配分函数来求过程热力学函数的变化值,只须知道g t 这一配分函数值就行了,对吗?
选择题:
1.1mol 双原子理想气体常温下热力学能为: (A)RT 23 (B) RT 25 (C) RT 2
7 (D) 无法确定
2.下列化合物中,298.15K 时标准摩尔熵ΔS 0最大的是:
(A) He (B) N 2 (C) CO (D) 一样大
3.在作N 、V 、U 有确定值的粒子体系的统计分布时,令∑n i = N ,∑n i εi = U ,这是因为所研究的体系是:
(A) 体系是封闭的,粒子是独立的
(B) 体系是孤立的,粒子是相依的
(C) 体系是孤立的,粒子是独立的
(D) 体系是封闭的,粒子是相依的
4.下列哪个体系不具有玻尔兹曼-麦克斯韦统计特点 :
(A) 每一个可能的微观状态以相同的几率出现
(B) 各能级的各量子态上分配的粒子数,受保里不相容原理的限制
(C) 体系由独立可别的粒子组成,U = ∑n i εi
(D) 宏观状态参量 N 、U 、V 为定值的封闭体系
5. HI 的转动特征温度Θr =9.0K ,300K 时HI 的摩尔转动熵为:
(A) 37.45J ·K -1·mol -1 (B) 31.70J ·K -1·mol -1
(C) 29.15J ·K -1·mol -1 (D) 都不正确
6. 对于单原子分子理想气体,当温度升高时,小于分子平均能量的能级上分布的粒子数:
(A) 不变 (B) 增多 (C) 减少 (D) 不能确定
7. O 2的转动惯量J = 19.3 × 10-47 kg ·m 2,则O 2的转动特征温度是:
(A) 10K (B) 5K (C) 2.07K (D) 8K
8. 各种运动形式的配分函数中与压力有关的是:
(A) 电子配分函数 ; (B) 平动配分函数 ;
(C) 转动配分函数 ; (D) 振动配分函数 。
9. 已知CO 和N 2分子的质量相同,转动特征温度基本相等,若电子均处于非简并的基态,且振动对熵的贡献可忽略,那么:
(A) S m (CO) < S m (N 2) ;
(B) S m (CO) 与S m (N 2) 大小无法比较 ;
(C) S m (CO) = S m (N 2) ;
(D) S m (CO) > S m (N 2) 。
10. 下面哪组热力学性质的配分函数表达式与体系中粒子的可别与否无关:
(A) S 、G 、F 、C V ; (B) U 、H 、P 、C V ;
(C) G 、F 、H 、U ; (D) S 、U 、H 、G 。
计算题:
1. O 2(g)分子的基态电子能级简并度为3 ,第一激发态简并度为2,与基态能级差为1.55× 10-9J ,求300K ,3000K 时第一激发态与基态上分子数之比。
2.已知H 2,CO ,CO 2,H 2O(g)在1000K 时的标准摩尔吉布斯自由能T U G T m 0
0,-分别为
-137.00,226.40,204.43,-197.00J ·K -1·mol -1,0K 时下列反应
H 2+CO 2=CO+ H 2O(g
的∆U 0=40.43kJ ·mol -1,求该反应1000K 的K 0。
答案:
思考题:
1. 不正确。
当 U ,V ,N 一定时,系统有多少种分布以及每一种分布的微观状态数是确定的。
2. 定域子系统中粒子的运动只有转动和振动,离域子系统中粒子的运动有平动,转动和振动。
常温下振动对熵的贡献极小,平动对熵的贡献最大。
且平动对熵中已考虑了N !对熵的贡献,所以晶体一般总比同温度下气体的熵小。
3. 不对。
S 、C V 与零点选择无关。
4. 3,1
5.对。
选择题:
1.(B) 2.(C) 3.(B) 4.(B) 5.(A) 6.(C) 7.(C) 8.(B) 9.(D) 10.(B)
计算题:
1.300K 时
173001038.1/)1055..1(/)(0121108.33
22301901-⨯⨯ε-⨯-ε-ε-⨯===--e e g g n n kT 3000K 时
230001038.1/)1055..1(/)(0121106.13
22301901-⨯⨯ε-⨯-ε-ε-⨯===--e e g g n n kT
2.T H T H G T G K R T m T m r r m 0,0,00)(ln ∆--∆=∆=
- 11,0,,0,,0,,0,,0,03.38)40.22612719743.204()()()()()(222--⋅⋅-=++--=-∆--∆--∆+-∆=-∆mol K kJ T
H G T H G T H G T H G T H G CO T m T m r H T
m T m r O H T m T m r CO T
m T m r T m T m r -8.314lnK 0=-38.04+40430/1000
K 0=0.75。
